江苏省南京市 盐城市2024-2025学年高三上学期期末调研测试(一模)化学试题(含答案)
文档属性
| 名称 | 江苏省南京市 盐城市2024-2025学年高三上学期期末调研测试(一模)化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-07 17:06:38 | ||
图片预览


文档简介
盐城市、南京市2024-2025一模测试
原子量:H-1 O-16 S-32 Cl-35.5 Cu-64 Zn-65
--、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.2024年中国“六五环境日”主题为“全面推进美丽中国建设”。下列做法不应提倡的是( )
A.大力发展火力发电 B.开发使用清洁能源
C.植树造林增加绿色植被 D.健全生态环境治理体系
2.将溶于浓盐酸能形成,存在平衡,下列说法正确的是( )
A.为非极性分子 B.含共价键
C.基态Co的价电子排布式为 D.结构示意图为
3.检验草木灰浸出液的性质,下列实验操作不正确的是( )
A.浸取草木灰 B.过滤草木灰浊液 C.测量浸出液 D.检验浸出液中
4.可用反应冶炼钾。下列说法正确的是( )
A.第一电离能: B.电负性:
C.离子半径: D.碱性:
阅读下列材料,完成5~7题:
地壳中的硫黄矿、硫铁矿和煤等都含有硫元素,这些矿物通过风化分解、燃烧、火山爆发等方式释放出等气体,这些气体有些进入大气,有些转化为亚硫酸盐、硫酸盐溶入河流或海洋,还有些则被土壤中的硫化细菌催化吸收。大气中的还可以被银杏、夹竹桃等植物吸收,而水体中的含硫化合物可被浮游植物吸收。
5.对于反应,下列说法不正确的是( )
A.上述反应的 B.上述反应的平衡常数
C.提高的值可增大的转化率 D.使用催化剂提高了反应的活化能
6.下列化学反应表示正确的是( )
A.单质硫与铜反应:
B.通入过量氨水:
C.溶液吸收
D.溶液被空气氧化:
7.下列描述正确的是( )
A.自然界硫元素在转化中都是被氧化 B.中S为杂化
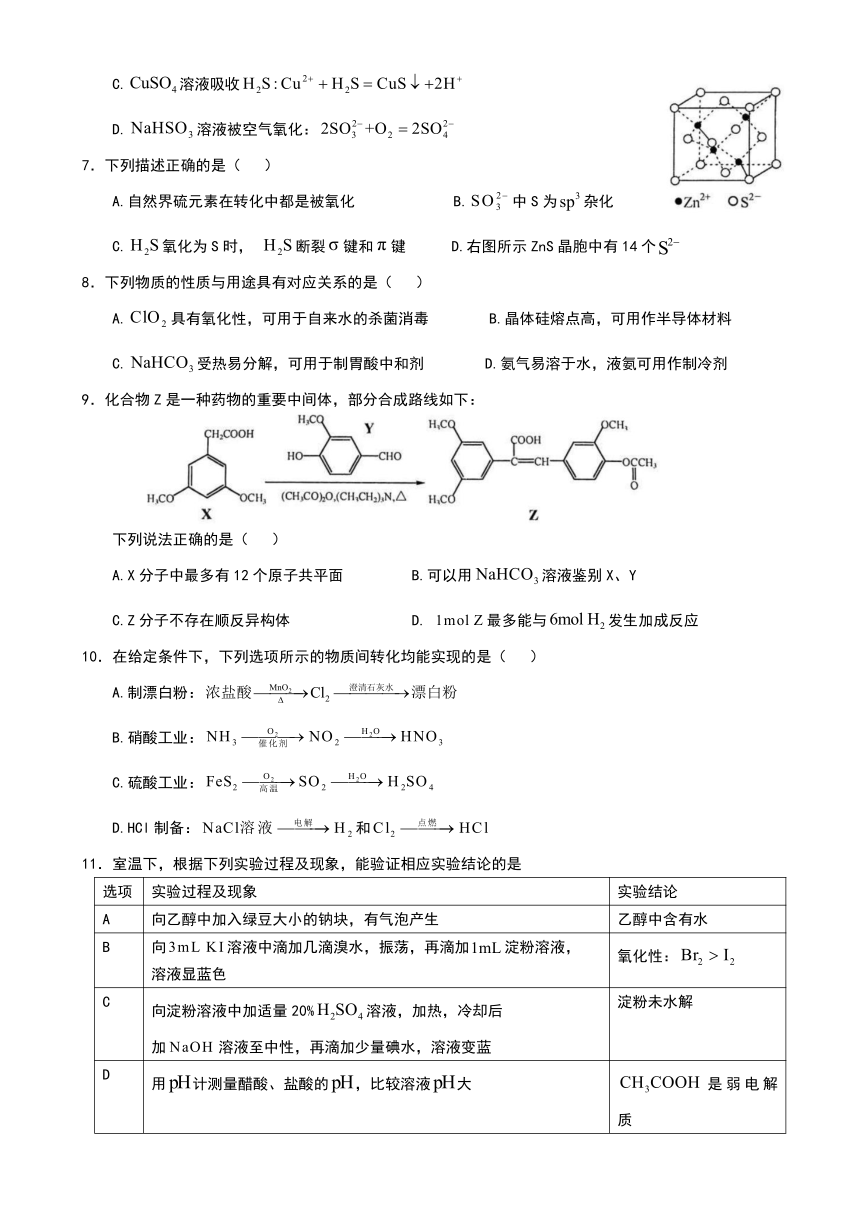
C.氧化为S时, 断裂键和键 D.右图所示ZnS晶胞中有14个
8.下列物质的性质与用途具有对应关系的是( )
A.具有氧化性,可用于自来水的杀菌消毒 B.晶体硅熔点高,可用作半导体材料
C.受热易分解,可用于制胃酸中和剂 D.氨气易溶于水,液氨可用作制冷剂
9.化合物Z是一种药物的重要中间体,部分合成路线如下:
下列说法正确的是( )
A.X分子中最多有12个原子共平面 B.可以用溶液鉴别X、Y
C.Z分子不存在顺反异构体 D. 最多能与发生加成反应
10.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.制漂白粉:
B.硝酸工业:
C.硫酸工业:
D.HCl制备:和
11.室温下,根据下列实验过程及现象,能验证相应实验结论的是
选项 实验过程及现象 实验结论
A 向乙醇中加入绿豆大小的钠块,有气泡产生 乙醇中含有水
B 向溶液中滴加几滴溴水,振荡,再滴加淀粉溶液, 溶液显蓝色 氧化性:
C 向淀粉溶液中加适量20%溶液,加热,冷却后 加溶液至中性,再滴加少量碘水,溶液变蓝 淀粉未水解
D 用计测量醋酸、盐酸的,比较溶液大 是弱电解质
12.已知:25℃时.室温下,通过下列实验探究溶液的性质。
实验1:向溶液中滴加酸性溶液,溶液的紫红色褪去
实验2:用计测得溶液为5.50
实验3:向0溶液中加入等浓度等体积的溶液,出现白色沉淀
实验4:向等浓度的混合溶液中滴加酚酞,溶液颜色无明显变化
下列说法正确的是( )
A.实验1证明溶液具有漂白性
B.实验2溶液中:
C.实验3可得到
D.实验4溶液中:
13.实现“碳中和”的一种路径是将和合成.其主要反应为:
反应I.
反应II.
反应II.
若仅考虑上述反应,在下,将的混合气体以一定流速通过装有催化剂的反应管,和的选择性及的转化率随温度的变化如图所示。的选择性
下列说法正确的是( )
A.一定温度下,使用高效催化剂可提高平衡产率
B.其他条件不变,260℃~280℃时,随温度升高生成的量增多
C.其他条件不变,260℃时,通入生成
D.温度高于260℃时,主要是因为反应III正向程度增大使的选择性降低
二、非选择题:共4题,共61分。
14.(15分)高铁锌焙烧矿渣主要含一种利用焙烧矿渣制备并生产黄铵铁矾的流程如下:
回答下列问题。
(1)“酸浸”前要将焙烧矿渣进行粉碎处理的原因是__________________。
(2)“酸浸”时,控制反应温度65℃、硫酸初始酸度,滤渣中锌元素的质量分数随时间变化的关系如图-1所示。当浸出时间超过后,滤渣中锌元素的质量分数反而升高的原因是___________。
(3)“沉矾”生成黄铵铁矾,需控制溶液、温度不超过85℃。
①生成黄铵铁矾的化学方程式为____________。
②控制溶液温度不能过高的原因是__________________。
③超过15,可发生反应.
其平衡常数K与的代数关系式为__________。
(4)加热晶体,测得加热过程中剩余固体的质量随温度的变化关系如图-2所示。A点物质为________________(填化学式)
15.(15分)药物氟普唑仑具有疗效良好的镇静催眠作用,其合成路线如下。
(1)A→B的反应类型为_____________。
(2)C中含氧官能团的名称为___________________。
(3)C→D的反应需经历C→X→D的过程,中间体X的分子式为,X的结构简式为___________。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式____________。
①含有苯环,能使溶液显色
②分子中含一个手性碳原子
③核磁共振氢谱有3组峰,峰的面积之比为2:2:1
(5)写出以飞为原料制备的合成路线流程图(无机试剂和流程中有机试剂任用,合成路线流程图示例见本题题干)。
16.(16分)生产印刷电路板所用的蚀刻液成分为等。
(1)蚀刻反应原理为。蚀刻过程中浓度下降,蚀刻能力降低。当通入空气后,即可恢复其蚀刻能力,反应的化学方程式为_____________。
(2)利用蚀刻废液可制备.取一定量蚀刻废液和稍过量的溶液加入如图所示实验装置的三颈瓶中,在搅拌下加热并通入空气,待产生大量沉淀时停止加热,冷却、过滤、洗涤,得到固体。
①向反应液中通入空气,除了使被氧化,另一个作用是_____________。
②图中装置X的作用是____________。
③检验固体是否洗净干净的实验操作是__________。
(3)利用铜精炼炉渣(含有及)制取该蚀刻液,请补充完整相应的实验方案:取一定量的铜精炼炉渣, ,得到蚀刻液。(实验中须选用的试剂:、浓氨水)
(4)利用蚀刻废液还可制备 (产品中会混有CuO)。测定产品中纯度的方法为:准确称取产品,加适量稀溶解,过滤、洗涤,滤液及洗涤液一并转移至碘量瓶中,加过量KI溶液,以淀粉溶液为指示剂,用标准溶液滴定至终点,消耗溶液。测定过程中发生下列反应:;:。
计算样品中的纯度_________(写出计算过程;保留小数点后2位有效数字)。
17.(15分)研究脱除烟气中的是环境保护、促进可持续发展的重要课题。
(1)催化脱硝。用催化脱除汽车尾气中的CO和NO。
①已知:,
CO的标准燃烧热。
则反应____。
②催化脱硝的反应机理如图-1所示。“过程①”部分转化成。
当氧化标准状况下时,生成的中_________。
(2)络合吸收脱硝。用混合液吸收烟气中NO,反应机理示意如下。
[NO络合]
[再生]反应i:
反应ⅱ:
反应ⅲ:……
①从结构上分析与NO成键络合的原理为________。
②反应ⅲ的离子方程式为_____________。
③探究烟气中对吸收液脱除NO的影响。将一定比例、NO和的混合气体匀速通过装有吸收液的反应器。NO去除率、吸收液中浓度随时间的变化如图-2所示。在前后,NO去除率先上升后下降的原因是________。
电解氧化脱硝。电解食盐水,利用生成的将废气中NO氧化为。电解溶液,NO去除率、溶液中浓度与电流强度的关系如题图-3所示。当电流强度大于4A时,随着电流强度的增大,NO去除率降低的可能原因是 。
原子量:H-1 O-16 S-32 Cl-35.5 Cu-64 Zn-65
--、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.2024年中国“六五环境日”主题为“全面推进美丽中国建设”。下列做法不应提倡的是( )
A.大力发展火力发电 B.开发使用清洁能源
C.植树造林增加绿色植被 D.健全生态环境治理体系
2.将溶于浓盐酸能形成,存在平衡,下列说法正确的是( )
A.为非极性分子 B.含共价键
C.基态Co的价电子排布式为 D.结构示意图为
3.检验草木灰浸出液的性质,下列实验操作不正确的是( )
A.浸取草木灰 B.过滤草木灰浊液 C.测量浸出液 D.检验浸出液中
4.可用反应冶炼钾。下列说法正确的是( )
A.第一电离能: B.电负性:
C.离子半径: D.碱性:
阅读下列材料,完成5~7题:
地壳中的硫黄矿、硫铁矿和煤等都含有硫元素,这些矿物通过风化分解、燃烧、火山爆发等方式释放出等气体,这些气体有些进入大气,有些转化为亚硫酸盐、硫酸盐溶入河流或海洋,还有些则被土壤中的硫化细菌催化吸收。大气中的还可以被银杏、夹竹桃等植物吸收,而水体中的含硫化合物可被浮游植物吸收。
5.对于反应,下列说法不正确的是( )
A.上述反应的 B.上述反应的平衡常数
C.提高的值可增大的转化率 D.使用催化剂提高了反应的活化能
6.下列化学反应表示正确的是( )
A.单质硫与铜反应:
B.通入过量氨水:
C.溶液吸收
D.溶液被空气氧化:
7.下列描述正确的是( )
A.自然界硫元素在转化中都是被氧化 B.中S为杂化
C.氧化为S时, 断裂键和键 D.右图所示ZnS晶胞中有14个
8.下列物质的性质与用途具有对应关系的是( )
A.具有氧化性,可用于自来水的杀菌消毒 B.晶体硅熔点高,可用作半导体材料
C.受热易分解,可用于制胃酸中和剂 D.氨气易溶于水,液氨可用作制冷剂
9.化合物Z是一种药物的重要中间体,部分合成路线如下:
下列说法正确的是( )
A.X分子中最多有12个原子共平面 B.可以用溶液鉴别X、Y
C.Z分子不存在顺反异构体 D. 最多能与发生加成反应
10.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.制漂白粉:
B.硝酸工业:
C.硫酸工业:
D.HCl制备:和
11.室温下,根据下列实验过程及现象,能验证相应实验结论的是
选项 实验过程及现象 实验结论
A 向乙醇中加入绿豆大小的钠块,有气泡产生 乙醇中含有水
B 向溶液中滴加几滴溴水,振荡,再滴加淀粉溶液, 溶液显蓝色 氧化性:
C 向淀粉溶液中加适量20%溶液,加热,冷却后 加溶液至中性,再滴加少量碘水,溶液变蓝 淀粉未水解
D 用计测量醋酸、盐酸的,比较溶液大 是弱电解质
12.已知:25℃时.室温下,通过下列实验探究溶液的性质。
实验1:向溶液中滴加酸性溶液,溶液的紫红色褪去
实验2:用计测得溶液为5.50
实验3:向0溶液中加入等浓度等体积的溶液,出现白色沉淀
实验4:向等浓度的混合溶液中滴加酚酞,溶液颜色无明显变化
下列说法正确的是( )
A.实验1证明溶液具有漂白性
B.实验2溶液中:
C.实验3可得到
D.实验4溶液中:
13.实现“碳中和”的一种路径是将和合成.其主要反应为:
反应I.
反应II.
反应II.
若仅考虑上述反应,在下,将的混合气体以一定流速通过装有催化剂的反应管,和的选择性及的转化率随温度的变化如图所示。的选择性
下列说法正确的是( )
A.一定温度下,使用高效催化剂可提高平衡产率
B.其他条件不变,260℃~280℃时,随温度升高生成的量增多
C.其他条件不变,260℃时,通入生成
D.温度高于260℃时,主要是因为反应III正向程度增大使的选择性降低
二、非选择题:共4题,共61分。
14.(15分)高铁锌焙烧矿渣主要含一种利用焙烧矿渣制备并生产黄铵铁矾的流程如下:
回答下列问题。
(1)“酸浸”前要将焙烧矿渣进行粉碎处理的原因是__________________。
(2)“酸浸”时,控制反应温度65℃、硫酸初始酸度,滤渣中锌元素的质量分数随时间变化的关系如图-1所示。当浸出时间超过后,滤渣中锌元素的质量分数反而升高的原因是___________。
(3)“沉矾”生成黄铵铁矾,需控制溶液、温度不超过85℃。
①生成黄铵铁矾的化学方程式为____________。
②控制溶液温度不能过高的原因是__________________。
③超过15,可发生反应.
其平衡常数K与的代数关系式为__________。
(4)加热晶体,测得加热过程中剩余固体的质量随温度的变化关系如图-2所示。A点物质为________________(填化学式)
15.(15分)药物氟普唑仑具有疗效良好的镇静催眠作用,其合成路线如下。
(1)A→B的反应类型为_____________。
(2)C中含氧官能团的名称为___________________。
(3)C→D的反应需经历C→X→D的过程,中间体X的分子式为,X的结构简式为___________。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式____________。
①含有苯环,能使溶液显色
②分子中含一个手性碳原子
③核磁共振氢谱有3组峰,峰的面积之比为2:2:1
(5)写出以飞为原料制备的合成路线流程图(无机试剂和流程中有机试剂任用,合成路线流程图示例见本题题干)。
16.(16分)生产印刷电路板所用的蚀刻液成分为等。
(1)蚀刻反应原理为。蚀刻过程中浓度下降,蚀刻能力降低。当通入空气后,即可恢复其蚀刻能力,反应的化学方程式为_____________。
(2)利用蚀刻废液可制备.取一定量蚀刻废液和稍过量的溶液加入如图所示实验装置的三颈瓶中,在搅拌下加热并通入空气,待产生大量沉淀时停止加热,冷却、过滤、洗涤,得到固体。
①向反应液中通入空气,除了使被氧化,另一个作用是_____________。
②图中装置X的作用是____________。
③检验固体是否洗净干净的实验操作是__________。
(3)利用铜精炼炉渣(含有及)制取该蚀刻液,请补充完整相应的实验方案:取一定量的铜精炼炉渣, ,得到蚀刻液。(实验中须选用的试剂:、浓氨水)
(4)利用蚀刻废液还可制备 (产品中会混有CuO)。测定产品中纯度的方法为:准确称取产品,加适量稀溶解,过滤、洗涤,滤液及洗涤液一并转移至碘量瓶中,加过量KI溶液,以淀粉溶液为指示剂,用标准溶液滴定至终点,消耗溶液。测定过程中发生下列反应:;:。
计算样品中的纯度_________(写出计算过程;保留小数点后2位有效数字)。
17.(15分)研究脱除烟气中的是环境保护、促进可持续发展的重要课题。
(1)催化脱硝。用催化脱除汽车尾气中的CO和NO。
①已知:,
CO的标准燃烧热。
则反应____。
②催化脱硝的反应机理如图-1所示。“过程①”部分转化成。
当氧化标准状况下时,生成的中_________。
(2)络合吸收脱硝。用混合液吸收烟气中NO,反应机理示意如下。
[NO络合]
[再生]反应i:
反应ⅱ:
反应ⅲ:……
①从结构上分析与NO成键络合的原理为________。
②反应ⅲ的离子方程式为_____________。
③探究烟气中对吸收液脱除NO的影响。将一定比例、NO和的混合气体匀速通过装有吸收液的反应器。NO去除率、吸收液中浓度随时间的变化如图-2所示。在前后,NO去除率先上升后下降的原因是________。
电解氧化脱硝。电解食盐水,利用生成的将废气中NO氧化为。电解溶液,NO去除率、溶液中浓度与电流强度的关系如题图-3所示。当电流强度大于4A时,随着电流强度的增大,NO去除率降低的可能原因是 。
同课章节目录
