第二章 烃 第二节 课时2 炔烃 课件(共54张PPT) 人教版(2019) 选择性必修3
文档属性
| 名称 | 第二章 烃 第二节 课时2 炔烃 课件(共54张PPT) 人教版(2019) 选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-08 21:31:54 | ||
图片预览








文档简介
(共54张PPT)
第二节 烯烃 炔烃
第二章 烃
课时 炔烃
2
1.认识炔烃的组成和结构特点。2.通过乙炔的学习,掌握炔烃的性质和变化规律。3.通过实验设计了解乙炔的实验室制备。
学习目标
一、炔烃的结构与性质
二、乙炔的实验室制备
目
录
CONTENTS
课后巩固训练
一、炔烃的结构与性质
对点训练
(一)知识梳理
1.炔烃
概念 分子中含有_________的烃称为炔烃。如乙炔(CH≡CH)、丙炔(CH3C≡CH)、2-丁炔(CH3C≡CCH3)等
官能团
通式 分子中只含有1个碳碳三键的链状炔烃的通式为______(n≥2)
物理 性质 随着碳原子数的递增,炔烃的沸点逐渐______,密度逐渐______,但都小于水的密度,一般都难溶于水
碳碳三键
碳碳三键(—C≡C—)
CnH2n-2
升高
增大
2.乙炔
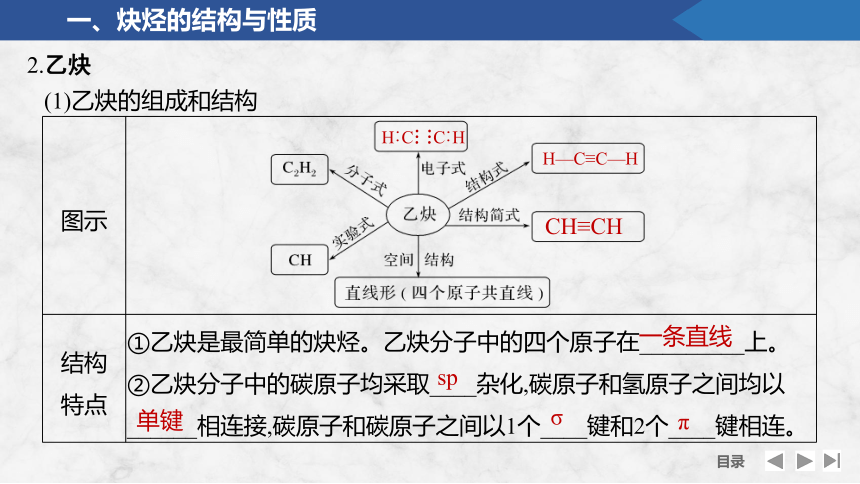
(1)乙炔的组成和结构
图示
结构 特点 ①乙炔是最简单的炔烃。乙炔分子中的四个原子在_________上。
②乙炔分子中的碳原子均采取____杂化,碳原子和氢原子之间均以______相连接,碳原子和碳原子之间以1个____键和2个____键相连。
H︰C C︰H
H—C≡C—H
CH≡CH
一条直线
sp
单键
σ
π
(2)物理性质
乙炔(俗称电石气)是_____色_____味的气体,密度比相同条件下的空气____,____溶于水,易溶于有机溶剂。
无
无
稍小
微
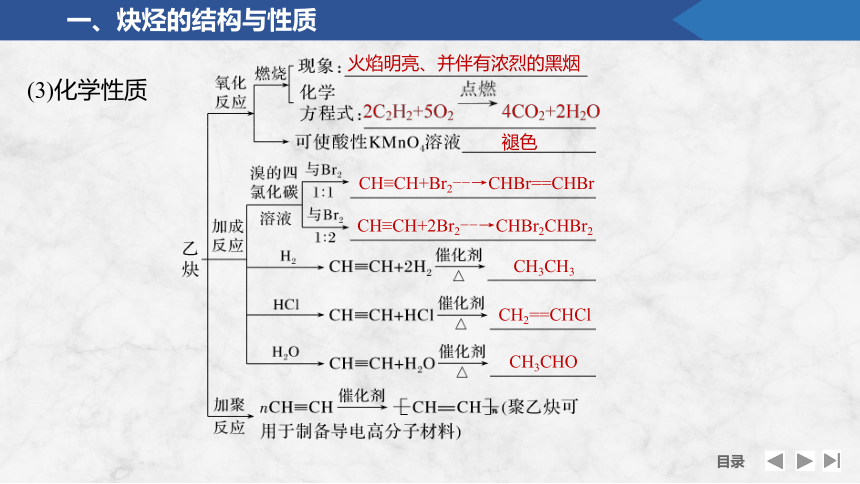
(3)化学性质
火焰明亮、并伴有浓烈的黑烟
褪色
CH≡CH+Br2--→CHBr==CHBr
CH≡CH+2Br2--→CHBr2CHBr2
CH3CH3
CH2==CHCl
CH3CHO
(二)问题探究
问题1 乙烯和乙炔都能使酸性高锰酸钾溶液褪色,聚乙烯和聚乙炔也都能使酸性高锰酸钾溶液褪色吗
提示 聚乙烯中没有碳碳双键,不能使酸性高锰酸钾溶液褪色,而聚乙炔中含有碳碳双键,能使酸性高锰酸钾溶液褪色。
问题2 由乙炔如何制取聚氯乙烯 请写出化学反应方程式。
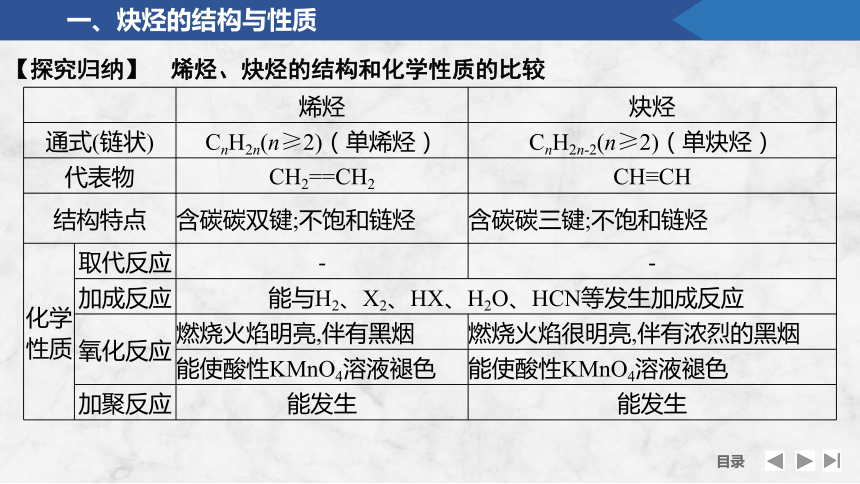
【探究归纳】 烯烃、炔烃的结构和化学性质的比较
烯烃 炔烃
通式(链状) CnH2n(n≥2)(单烯烃) CnH2n-2(n≥2)(单炔烃)
代表物 CH2==CH2 CH≡CH
结构特点 含碳碳双键;不饱和链烃 含碳碳三键;不饱和链烃
化学性质 取代反应 - -
加成反应 能与H2、X2、HX、H2O、HCN等发生加成反应 氧化反应 燃烧火焰明亮,伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
能使酸性KMnO4溶液褪色 能使酸性KMnO4溶液褪色
加聚反应 能发生 能发生
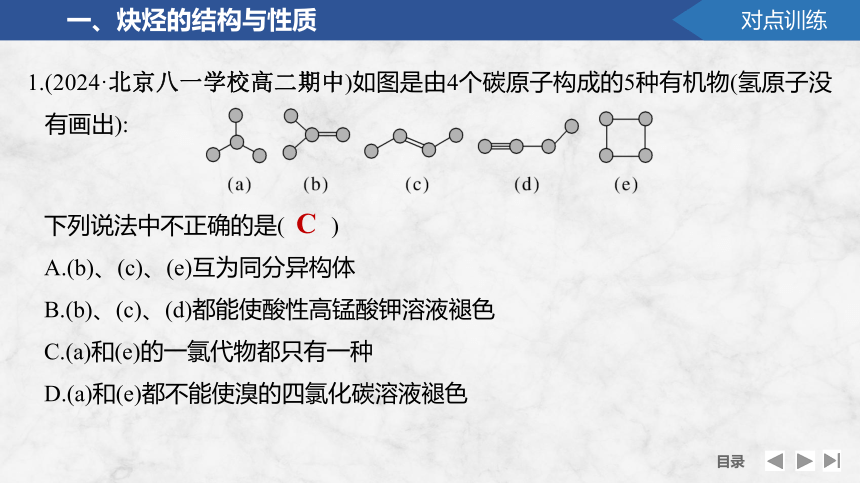
1.(2024·北京八一学校高二期中)如图是由4个碳原子构成的5种有机物(氢原子没有画出):
下列说法中不正确的是( )
A.(b)、(c)、(e)互为同分异构体
B.(b)、(c)、(d)都能使酸性高锰酸钾溶液褪色
C.(a)和(e)的一氯代物都只有一种
D.(a)和(e)都不能使溴的四氯化碳溶液褪色
C
解析 (b)、(c)、(e)化学式分别为C4H8、C4H8、C4H8,结构不同但分子式相同,三者互为同分异构体,A正确;(b)、(c)、(d)均含碳碳双键或碳碳三键,均能使酸性高锰酸钾褪色,B正确;(a)中有两种等效氢,一氯代物有两种。而(e)等效氢只有一种一氯代物只有一种,C错误;(a)、(e)中不含不饱和碳碳键无法与溴发生加成反应而褪色,D正确。
2.(2024·福建永安市第九中学高二月考)某气态烃0.5 mol能与1 mol HCl完全加成,加成后的产物分子上的氢原子又可被3 mol Cl2完全取代。则此气态烃可能是( )
A.HC≡CH B.CH2==CH2
C.HC≡C—CH3 D.CH2==C(CH3)CH3
解析 气态烃0.5 mol能与1 mol HCl加成,说明烃中含有1个C≡C键或2个C==C键,加成后产物分子上的氢原子又可被3 mol Cl2完全取代,说明0.5 mol氯代烃中含有3 mol H原子,则原0.5 mol烃中含有2 mol H原子,即1 mol烃含有4 mol H,并含有1个C≡C键或2个C==C键,则该烃为丙炔。
C
【题后归纳】 取代反应和加成反应中X2的用量关系
(1)每取代1 mol的氢原子,需要1 mol Cl2(或X2)。
(2)每1 mol碳碳双键加成,需要1 mol Cl2(或X2);每1 mol碳碳三键加成,需要2 mol Cl2(或X2)。
二、乙炔的实验室制备
对点训练
(一)知识梳理
1.反应原理
________________________________________。
CaC2+2H2O--→Ca(OH)2+CH≡CH↑
2.实验装置
使用“固+液--→气”的装置(如图所示)。
3.实验现象
序号 实验现象 解释或结论
① 反应迅速、有大量气泡生成 反应生成乙炔
② 有黑色沉淀产生 CuSO4+H2S===____________________
③ 溶液紫红色褪去 乙炔被酸性KMnO4氧化
④ 溶液橙色褪去 乙炔与溴发生了加成反应
⑤ 火焰明亮,并伴有浓烈的黑烟 乙炔可燃且含碳量高
CuS↓+H2SO4
4.收集方法
______集气法。
排水
(二)问题探究
问题1 实验室制取乙炔时用饱和食盐水代替蒸馏水的目的是什么 如何滴加饱和食盐水
提示 电石与水反应非常剧烈,为了减小其反应速率,可用饱和食盐水代替水作反应试剂,并用分液漏斗控制水流的速率,让食盐水逐滴慢慢地滴入。
问题2 实验室制备乙炔的反应特点是固体和液体反应,且不需要加热。那么该实验装置可以用启普发生器(图甲)或具有启普发生器原理的装置(图乙)代替吗 为什么
提示 不可以。原因有:碳化钙吸水性强,与水反应剧烈,不能随用、随停。反应过程中放出大量的热,易使启普发生器炸裂。生成的Ca(OH)2呈糊状易堵塞球形漏斗。
【探究归纳】 乙炔的实验室制法的注意事项
(1)实验装置在使用前要先检验气密性。
(2)由于CaC2和水反应剧烈,并产生泡沫,为防止产生的泡沫进入导管,最好在导气管口附近塞入少量棉花(不放也可以)。
(3)由电石制得的乙炔中往往含有H2S、PH3等杂质,使混合气体通过盛有CuSO4溶液的洗气瓶可将杂质除去。
(4)乙炔属于可燃性气体,点燃前要检验纯度,防止爆炸。
D
3.实验室制备C2H2并检验其性质,下列装置不能达到实验目的的是( )
解析 为了减缓反应速率,用电石与饱和食盐水反应制取乙炔,A正确;电石中含有其他成分,生成的乙炔气体中含有H2S等杂质,通过硫酸铜溶液可除去杂质,B正确;乙炔含有不饱和键,可以使溴的四氯化碳溶液褪色,C正确;乙炔密度比空气小,所以收集时导管应该短进长出,D错误。
4.(2024·山东泰安市高二期中)实验室用以下改进装置快速制备乙炔气体。
回答下列问题:
(1)电石(CaC2)的主要成分的电子式为
,与饱和食盐水发生反应的化学方程
式为 。
(2)若要使反应停止,应 (“向上”或“向下”)移动A管。
Ca2+[︰C C︰]2-
CaC2+2H2O--→Ca(OH)2+C2H2↑
向下
解析 (1)CaC2为离子化合物,其电子式为Ca2+[︰C C︰]2-,CaC2与饱和食盐水发生反应生成氢氧化钙和乙炔,化学方程式为CaC2+2H2O--→Ca(OH)2 +C2H2↑; (2)若要使反应停止,应向下移动A管,使得电石和饱和食盐水脱离接触,反应停止。
(3)制备的乙炔气体中往往混有少量的H2S,为除去该杂质气体,应使混合气体通过盛有足量 (填试剂名称)的洗气瓶。
(4)足量的乙炔通入含少量Br2的CCl4溶液中,观察到的现象是 ,此反应的有机产物 (填“能”或“不能”)发生加聚反应。
(5)聚氯乙烯是生产中常用的有机高分子材料,试写出由乙炔制备聚氯乙烯的化学方程式: ;
。
氢氧化钠溶液(或硫酸铜溶液)
溴水褪色
能
CH≡CH+HCl--→CH2==CHCl
课后巩固训练
A级 合格过关练
选择题只有1个选项符合题意
(一)炔烃的结构
1.(2024·江苏南通海安高级中学高二月考)乙炔俗称风煤或电石气,在室温下是一种无色、易燃的气体。乙炔气经净化处理后,在氮气氛中可催化聚合为聚乙炔,下列说法正确的是( )
D
2.(2024·河北尚义县第一中学高二月考)下列分子中所有碳原子不可能都处于同一平面上的是( )
A.CH2==CH2 B.CH2==CHCH3 C.C(CH3)4 D.CH2==CH—C≡CH
解析 CH2==CH2上6个原子共平面,A不符合题意;CH2==CHCH3上6个原子一定共平面,其中包含3个C原子,B不符合题意;C(CH3)4中碳原子均采用sp3杂化,4个甲基中只有2个碳原子与中心碳原子共平面,其余两个碳原子不可能与之共平面,C符合题意;CH2==CH—C≡CH中存在乙烯所在平面和乙炔所在直线,故分子中所有碳原子一定共面,D不符合题意。
C
(二)炔烃(乙炔)的性质
3.丙炔和氯化氢之间发生加成反应,产物不可能是( )
A.1-氯丙烷 B.1,2-二氯丙烷
C.1-氯丙烯 D.2-氯丙烯
解析 1个丙炔分子与2个HCl加成,则生成的产物中一定有2个Cl原子,不可能生成1-氯丙烷,A错误;1分子丙炔与2分子HCl发生加成反应,Cl原子分别连在不同的碳上,可生成1,2-二氯丙烷,B正确;1分子丙炔与1分子HCl发生加成反应,生成1-氯丙烯,C正确;1分子丙炔与1分子HCl发生加成反应,可生成2-氯丙烯,D正确。
A
4.下列说法正确的是( )
A.乙烯和乙炔都是直线形分子
B.乙烯和乙炔都能发生加成反应和加聚反应
C.除去乙烷中少量的乙烯:将混合气体通入酸性KMnO4溶液进行气液分离
D.乙炔与分子式为C4H6的烃一定互为同系物
解析 乙烯是平面形结构,所有原子不在一条直线上,乙炔是直线形分子,A错误;乙烯含有碳碳双键,乙炔含有碳碳三键,二者都能发生加成反应和加聚反应,B正确;酸性高锰酸钾溶液可以把乙烯氧化生成二氧化碳,又引入新的杂质,不正确,正确的做法是通入溴水中进行气液分离,C错误;乙炔与分子式为C4H6的烃不一定互为同系物,因为C4H6的烃不一定是炔烃,与乙炔的结构不一定相似,D错误。
B
5.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
解析 丙炔中有1个碳碳三键,相当于有两个不饱和度,1 mol丙炔最多能与2 mol Cl2发生加成反应,A正确;多碳原子的炔烃中碳原子不一定在一条直线上,如1-丁炔中的4个碳原子不在同一直线上,B错误;炔烃易发生加成反应,难发生取代反应,C错误;炔烃含有碳碳三键,既能使溴水褪色,又能使酸性KMnO4溶液褪色,D错误。
A
6.(2024·山东东营利津县高级中学高二月考)已知某炔烃与卤化氢按物质的量为1∶2发生加成反应后,生成的有机物至少需6 mol的卤素单质才能把其分子中的氢原子全部取代,则该炔烃可能是( )
A.丙炔 B.1-丁炔 C.3-己炔 D.2-庚炔
解析 某炔烃与卤素按物质的量为1∶2发生加成反应,则该炔烃中含有1个碳碳三键,根据“生成的有机物至少需6 mol的卤素单质才能把生成的有机物中的氢全部取代”可知,生成的有机物分子中含有6个氢原子,则原分子中含有6-2=4个氢原子,根据炔烃的通式CnH2n-2,则2n-2=4,解得:n=3,所以该炔烃中含有三个C,为丙炔。
A
7.(2024·北京育才学校高二期中)含有一个碳碳三键的炔烃,在一定条件下与足量氢气发生加成反应后,产物的结构简式如下:
此炔烃可能的结构有( )
A.1种 B.2种 C.3种 D.4种
B
8.某烃与氢气加成后得到2,2-二甲基丁烷,该烃的名称可能是( )
A.2,2-二甲基-3-丁炔 B.2,2-二甲基-2-丁烯
C.2,2-二甲基-1-丁烯 D.3,3-二甲基-1-丁烯
D
9.乙炔是重要的有机化工原料,其化学性质活泼。完成下列填空。
(1)乙炔能使溴水褪色,说明乙炔能发生 反应(填反应类型);乙炔能使酸性高锰酸钾褪色,说明乙炔容易被 。
(2)鉴别己烷和二乙烯基乙炔(CH2==CH—C≡C—CH==CH2)可用的试剂是 。
(3)乙炔聚合得到聚乙炔,聚乙炔 导电(选填“能”或“不能”)。
加成
氧化
酸性高锰酸钾溶液或溴水
能
d
(三)乙炔的实验室制备方法
10.某兴趣小组探究电石与溶液反应的速率并制备乙炔气体。下列说法错误的是( )
D
实验 电石质量/g 溶液 现象
1 m 稀食盐水 产气较快,有大量灰白色沉淀和泡沫
2 m 饱和食盐水 产气较慢,有较多灰白色沉淀和泡沫
3 m 稀盐酸
A.灰白色沉淀主要成分为Ca(OH)2
B.提高NaCl溶液的质量分数能减慢反应速率
C.不宜使用纯水作为反应试剂
D.推测实验3的现象为产气速度慢,无沉淀和泡沫
解析 电石制备乙炔气体的原理为CaC2+2H2O--→Ca(OH)2+C2H2↑。灰白色沉淀主要成分为Ca(OH)2,A正确;比较实验1和实验2可知,食盐水浓度越大,反应速率越慢,故提高NaCl溶液的质量分数能减慢反应速率,B正确;比较实验1和实验2可知,食盐水浓度越小,反应速率越快,纯水反应速率太快,不宜使用纯水作为反应试剂,C正确;由于反应生成的Ca(OH)2能与盐酸发生中和反应,故测实验3的现象为产气速度快,无沉淀,但有泡沫生成,D错误。
11.已知:制备乙炔的原理为CaC2+2H2O--→Ca(OH)2+C2H2↑,实验室用电石(含CaC2和少量CaS)制取乙炔时,下列对装置和试剂的分析错误的是( )
A.甲中用饱和食盐水可减缓电石与水的反应速率
B.乙中试剂X可选用CuSO4溶液净化乙炔
C.用丙收集气体时,应a口进气,b口导出气体
D.丁装置既可以处理尾气,又可以检验乙炔是否集满
C
解析 碳化钙与水的反应速率快,不宜控制,实验时用饱和食盐水可减缓电石与水的反应速率,获得平稳的乙炔气流,A正确;电石中的硫化钙能与水反应生成硫化氢气体,将电石与水反应获得的乙炔气体通过盛有硫酸铜溶液的洗气瓶可以除去乙炔气体中混有的硫化氢气体,获得纯净的乙炔,B正确;乙炔密度与同条件下空气密度接近,不能用向上排空气法收集乙炔,C错误;乙炔能与酸性高锰酸钾溶液发生氧化反应,所以盛有酸性高锰酸钾溶液的洗气瓶可以吸收乙炔,同时溶液颜色变浅也能说明乙炔已收集满,D正确。
BC
B
解析 由图可知,4→5为乙炔与吸附在催化剂AuCl上的HCl反应,化学方程式为CH≡CH+HCl/AuCl--→CH2==CHCl/AuCl,A正确;若保持体系中C2H2分压不变,HCl分压过高时,HCl的体积分数过高,催化剂吸附的较多,阻碍了乙炔与其接触,降低反应催化效率,B错误;反应过程中有H—Cl极性共价键和C—C非极性共价键断裂,C正确;反应物在催化剂表面经历1→2过程扩散,2→3过程HCl在AuCl上吸附(活性位点),4→5乙炔和HCl在催化剂表面反应,5→6生成产物氯乙烯从催化剂上脱附,D正确。
14.利用传统方式制备乙炔的过程中,存在一些问题难以解决,如反应速率过快、放热过多不易控制,生成的糊状物难以实现固液分离导致乙炔气流不平稳,甚至发生堵塞等问题。为解决上述问题,某校化学兴趣小组设计出一套乙炔制备、净化和收集实验的一体化实验装置。
(1)实验室常用电石与水反应的传统方法制取乙炔,写出反应的化学方程式:
。
CaC2+2H2O→Ca(OH)2+CH≡CH↑
解析 (1)电石的主要成分是CaC2,其与水反应的方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑。
(2)①仪器B的名称是 ;
②向A反应器中填装固体反应物时,电石放置位置为 (填“甲处”或“乙处”);反应器中装有7 mm玻璃珠,其作用为 ;
③B装置中可用次氯酸钠吸收混杂在乙炔中的H2S、PH3,反应中PH3被氧化为最高价氧化物对应的水化物,请写出次氯酸钠与PH3反应的离子方程式: 。
具支试管
甲处
形成空隙,促进固液分离,防堵塞
PH3+4ClO-===H3PO4+4Cl-
解析 (2)①该仪器名称为“具支试管”。②将电石放置于甲处时,产生的糊状物质由于重力作用沿着玻璃珠空隙流下,而电石则因固体无流动性而留在玻璃珠上方,由此实现固体与糊状物质的及时分离,并保持糊状物有足够的时间处于流动状态,不会因滞留导致堵塞,而放置于乙处则无法实现。③依题意,PH3被氧化为H3PO4,故离子反应方程式为PH3+4ClO-===H3PO4+4Cl-。
(3)兴趣小组在制备乙炔时对反应液进行了一系列筛选(如下图),依据图表选择最合适的反应液为 (填标号),原因是
。
a.饱和食盐水 b.2.5 mol·L-1醋酸
c.2 mol·L-1盐酸 d.饱和氯化铵溶液
d
饱和氯化铵溶液作反应液时,反应
温和可控,固液分离率适当
解析 (3)根据题意,醋酸和盐酸“反应速率过快、放热过多不易控制”,饱和食盐水“生成的糊状物难以实现固液分离”,故应选择反应速率和放热较为平稳、固液分离率适中的饱和氯化铵溶液。
(4)选取合适的反应液后,小组称取电石1.25 g(杂质的质量分数为4.0%)完成实验,除杂后测得乙炔气体体积为336 mL(标准状况下),计算该实验中乙炔的产率:
%(结果保留两位有效数字)。
80
解析 (4)理论产量为×22.4 L/mol=0.42 L,实际产量为0.336 L,故产率为×100%=80%。
Thanks!
本
讲
内
容
结
束
第二节 烯烃 炔烃
第二章 烃
课时 炔烃
2
1.认识炔烃的组成和结构特点。2.通过乙炔的学习,掌握炔烃的性质和变化规律。3.通过实验设计了解乙炔的实验室制备。
学习目标
一、炔烃的结构与性质
二、乙炔的实验室制备
目
录
CONTENTS
课后巩固训练
一、炔烃的结构与性质
对点训练
(一)知识梳理
1.炔烃
概念 分子中含有_________的烃称为炔烃。如乙炔(CH≡CH)、丙炔(CH3C≡CH)、2-丁炔(CH3C≡CCH3)等
官能团
通式 分子中只含有1个碳碳三键的链状炔烃的通式为______(n≥2)
物理 性质 随着碳原子数的递增,炔烃的沸点逐渐______,密度逐渐______,但都小于水的密度,一般都难溶于水
碳碳三键
碳碳三键(—C≡C—)
CnH2n-2
升高
增大
2.乙炔
(1)乙炔的组成和结构
图示
结构 特点 ①乙炔是最简单的炔烃。乙炔分子中的四个原子在_________上。
②乙炔分子中的碳原子均采取____杂化,碳原子和氢原子之间均以______相连接,碳原子和碳原子之间以1个____键和2个____键相连。
H︰C C︰H
H—C≡C—H
CH≡CH
一条直线
sp
单键
σ
π
(2)物理性质
乙炔(俗称电石气)是_____色_____味的气体,密度比相同条件下的空气____,____溶于水,易溶于有机溶剂。
无
无
稍小
微
(3)化学性质
火焰明亮、并伴有浓烈的黑烟
褪色
CH≡CH+Br2--→CHBr==CHBr
CH≡CH+2Br2--→CHBr2CHBr2
CH3CH3
CH2==CHCl
CH3CHO
(二)问题探究
问题1 乙烯和乙炔都能使酸性高锰酸钾溶液褪色,聚乙烯和聚乙炔也都能使酸性高锰酸钾溶液褪色吗
提示 聚乙烯中没有碳碳双键,不能使酸性高锰酸钾溶液褪色,而聚乙炔中含有碳碳双键,能使酸性高锰酸钾溶液褪色。
问题2 由乙炔如何制取聚氯乙烯 请写出化学反应方程式。
【探究归纳】 烯烃、炔烃的结构和化学性质的比较
烯烃 炔烃
通式(链状) CnH2n(n≥2)(单烯烃) CnH2n-2(n≥2)(单炔烃)
代表物 CH2==CH2 CH≡CH
结构特点 含碳碳双键;不饱和链烃 含碳碳三键;不饱和链烃
化学性质 取代反应 - -
加成反应 能与H2、X2、HX、H2O、HCN等发生加成反应 氧化反应 燃烧火焰明亮,伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
能使酸性KMnO4溶液褪色 能使酸性KMnO4溶液褪色
加聚反应 能发生 能发生
1.(2024·北京八一学校高二期中)如图是由4个碳原子构成的5种有机物(氢原子没有画出):
下列说法中不正确的是( )
A.(b)、(c)、(e)互为同分异构体
B.(b)、(c)、(d)都能使酸性高锰酸钾溶液褪色
C.(a)和(e)的一氯代物都只有一种
D.(a)和(e)都不能使溴的四氯化碳溶液褪色
C
解析 (b)、(c)、(e)化学式分别为C4H8、C4H8、C4H8,结构不同但分子式相同,三者互为同分异构体,A正确;(b)、(c)、(d)均含碳碳双键或碳碳三键,均能使酸性高锰酸钾褪色,B正确;(a)中有两种等效氢,一氯代物有两种。而(e)等效氢只有一种一氯代物只有一种,C错误;(a)、(e)中不含不饱和碳碳键无法与溴发生加成反应而褪色,D正确。
2.(2024·福建永安市第九中学高二月考)某气态烃0.5 mol能与1 mol HCl完全加成,加成后的产物分子上的氢原子又可被3 mol Cl2完全取代。则此气态烃可能是( )
A.HC≡CH B.CH2==CH2
C.HC≡C—CH3 D.CH2==C(CH3)CH3
解析 气态烃0.5 mol能与1 mol HCl加成,说明烃中含有1个C≡C键或2个C==C键,加成后产物分子上的氢原子又可被3 mol Cl2完全取代,说明0.5 mol氯代烃中含有3 mol H原子,则原0.5 mol烃中含有2 mol H原子,即1 mol烃含有4 mol H,并含有1个C≡C键或2个C==C键,则该烃为丙炔。
C
【题后归纳】 取代反应和加成反应中X2的用量关系
(1)每取代1 mol的氢原子,需要1 mol Cl2(或X2)。
(2)每1 mol碳碳双键加成,需要1 mol Cl2(或X2);每1 mol碳碳三键加成,需要2 mol Cl2(或X2)。
二、乙炔的实验室制备
对点训练
(一)知识梳理
1.反应原理
________________________________________。
CaC2+2H2O--→Ca(OH)2+CH≡CH↑
2.实验装置
使用“固+液--→气”的装置(如图所示)。
3.实验现象
序号 实验现象 解释或结论
① 反应迅速、有大量气泡生成 反应生成乙炔
② 有黑色沉淀产生 CuSO4+H2S===____________________
③ 溶液紫红色褪去 乙炔被酸性KMnO4氧化
④ 溶液橙色褪去 乙炔与溴发生了加成反应
⑤ 火焰明亮,并伴有浓烈的黑烟 乙炔可燃且含碳量高
CuS↓+H2SO4
4.收集方法
______集气法。
排水
(二)问题探究
问题1 实验室制取乙炔时用饱和食盐水代替蒸馏水的目的是什么 如何滴加饱和食盐水
提示 电石与水反应非常剧烈,为了减小其反应速率,可用饱和食盐水代替水作反应试剂,并用分液漏斗控制水流的速率,让食盐水逐滴慢慢地滴入。
问题2 实验室制备乙炔的反应特点是固体和液体反应,且不需要加热。那么该实验装置可以用启普发生器(图甲)或具有启普发生器原理的装置(图乙)代替吗 为什么
提示 不可以。原因有:碳化钙吸水性强,与水反应剧烈,不能随用、随停。反应过程中放出大量的热,易使启普发生器炸裂。生成的Ca(OH)2呈糊状易堵塞球形漏斗。
【探究归纳】 乙炔的实验室制法的注意事项
(1)实验装置在使用前要先检验气密性。
(2)由于CaC2和水反应剧烈,并产生泡沫,为防止产生的泡沫进入导管,最好在导气管口附近塞入少量棉花(不放也可以)。
(3)由电石制得的乙炔中往往含有H2S、PH3等杂质,使混合气体通过盛有CuSO4溶液的洗气瓶可将杂质除去。
(4)乙炔属于可燃性气体,点燃前要检验纯度,防止爆炸。
D
3.实验室制备C2H2并检验其性质,下列装置不能达到实验目的的是( )
解析 为了减缓反应速率,用电石与饱和食盐水反应制取乙炔,A正确;电石中含有其他成分,生成的乙炔气体中含有H2S等杂质,通过硫酸铜溶液可除去杂质,B正确;乙炔含有不饱和键,可以使溴的四氯化碳溶液褪色,C正确;乙炔密度比空气小,所以收集时导管应该短进长出,D错误。
4.(2024·山东泰安市高二期中)实验室用以下改进装置快速制备乙炔气体。
回答下列问题:
(1)电石(CaC2)的主要成分的电子式为
,与饱和食盐水发生反应的化学方程
式为 。
(2)若要使反应停止,应 (“向上”或“向下”)移动A管。
Ca2+[︰C C︰]2-
CaC2+2H2O--→Ca(OH)2+C2H2↑
向下
解析 (1)CaC2为离子化合物,其电子式为Ca2+[︰C C︰]2-,CaC2与饱和食盐水发生反应生成氢氧化钙和乙炔,化学方程式为CaC2+2H2O--→Ca(OH)2 +C2H2↑; (2)若要使反应停止,应向下移动A管,使得电石和饱和食盐水脱离接触,反应停止。
(3)制备的乙炔气体中往往混有少量的H2S,为除去该杂质气体,应使混合气体通过盛有足量 (填试剂名称)的洗气瓶。
(4)足量的乙炔通入含少量Br2的CCl4溶液中,观察到的现象是 ,此反应的有机产物 (填“能”或“不能”)发生加聚反应。
(5)聚氯乙烯是生产中常用的有机高分子材料,试写出由乙炔制备聚氯乙烯的化学方程式: ;
。
氢氧化钠溶液(或硫酸铜溶液)
溴水褪色
能
CH≡CH+HCl--→CH2==CHCl
课后巩固训练
A级 合格过关练
选择题只有1个选项符合题意
(一)炔烃的结构
1.(2024·江苏南通海安高级中学高二月考)乙炔俗称风煤或电石气,在室温下是一种无色、易燃的气体。乙炔气经净化处理后,在氮气氛中可催化聚合为聚乙炔,下列说法正确的是( )
D
2.(2024·河北尚义县第一中学高二月考)下列分子中所有碳原子不可能都处于同一平面上的是( )
A.CH2==CH2 B.CH2==CHCH3 C.C(CH3)4 D.CH2==CH—C≡CH
解析 CH2==CH2上6个原子共平面,A不符合题意;CH2==CHCH3上6个原子一定共平面,其中包含3个C原子,B不符合题意;C(CH3)4中碳原子均采用sp3杂化,4个甲基中只有2个碳原子与中心碳原子共平面,其余两个碳原子不可能与之共平面,C符合题意;CH2==CH—C≡CH中存在乙烯所在平面和乙炔所在直线,故分子中所有碳原子一定共面,D不符合题意。
C
(二)炔烃(乙炔)的性质
3.丙炔和氯化氢之间发生加成反应,产物不可能是( )
A.1-氯丙烷 B.1,2-二氯丙烷
C.1-氯丙烯 D.2-氯丙烯
解析 1个丙炔分子与2个HCl加成,则生成的产物中一定有2个Cl原子,不可能生成1-氯丙烷,A错误;1分子丙炔与2分子HCl发生加成反应,Cl原子分别连在不同的碳上,可生成1,2-二氯丙烷,B正确;1分子丙炔与1分子HCl发生加成反应,生成1-氯丙烯,C正确;1分子丙炔与1分子HCl发生加成反应,可生成2-氯丙烯,D正确。
A
4.下列说法正确的是( )
A.乙烯和乙炔都是直线形分子
B.乙烯和乙炔都能发生加成反应和加聚反应
C.除去乙烷中少量的乙烯:将混合气体通入酸性KMnO4溶液进行气液分离
D.乙炔与分子式为C4H6的烃一定互为同系物
解析 乙烯是平面形结构,所有原子不在一条直线上,乙炔是直线形分子,A错误;乙烯含有碳碳双键,乙炔含有碳碳三键,二者都能发生加成反应和加聚反应,B正确;酸性高锰酸钾溶液可以把乙烯氧化生成二氧化碳,又引入新的杂质,不正确,正确的做法是通入溴水中进行气液分离,C错误;乙炔与分子式为C4H6的烃不一定互为同系物,因为C4H6的烃不一定是炔烃,与乙炔的结构不一定相似,D错误。
B
5.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
解析 丙炔中有1个碳碳三键,相当于有两个不饱和度,1 mol丙炔最多能与2 mol Cl2发生加成反应,A正确;多碳原子的炔烃中碳原子不一定在一条直线上,如1-丁炔中的4个碳原子不在同一直线上,B错误;炔烃易发生加成反应,难发生取代反应,C错误;炔烃含有碳碳三键,既能使溴水褪色,又能使酸性KMnO4溶液褪色,D错误。
A
6.(2024·山东东营利津县高级中学高二月考)已知某炔烃与卤化氢按物质的量为1∶2发生加成反应后,生成的有机物至少需6 mol的卤素单质才能把其分子中的氢原子全部取代,则该炔烃可能是( )
A.丙炔 B.1-丁炔 C.3-己炔 D.2-庚炔
解析 某炔烃与卤素按物质的量为1∶2发生加成反应,则该炔烃中含有1个碳碳三键,根据“生成的有机物至少需6 mol的卤素单质才能把生成的有机物中的氢全部取代”可知,生成的有机物分子中含有6个氢原子,则原分子中含有6-2=4个氢原子,根据炔烃的通式CnH2n-2,则2n-2=4,解得:n=3,所以该炔烃中含有三个C,为丙炔。
A
7.(2024·北京育才学校高二期中)含有一个碳碳三键的炔烃,在一定条件下与足量氢气发生加成反应后,产物的结构简式如下:
此炔烃可能的结构有( )
A.1种 B.2种 C.3种 D.4种
B
8.某烃与氢气加成后得到2,2-二甲基丁烷,该烃的名称可能是( )
A.2,2-二甲基-3-丁炔 B.2,2-二甲基-2-丁烯
C.2,2-二甲基-1-丁烯 D.3,3-二甲基-1-丁烯
D
9.乙炔是重要的有机化工原料,其化学性质活泼。完成下列填空。
(1)乙炔能使溴水褪色,说明乙炔能发生 反应(填反应类型);乙炔能使酸性高锰酸钾褪色,说明乙炔容易被 。
(2)鉴别己烷和二乙烯基乙炔(CH2==CH—C≡C—CH==CH2)可用的试剂是 。
(3)乙炔聚合得到聚乙炔,聚乙炔 导电(选填“能”或“不能”)。
加成
氧化
酸性高锰酸钾溶液或溴水
能
d
(三)乙炔的实验室制备方法
10.某兴趣小组探究电石与溶液反应的速率并制备乙炔气体。下列说法错误的是( )
D
实验 电石质量/g 溶液 现象
1 m 稀食盐水 产气较快,有大量灰白色沉淀和泡沫
2 m 饱和食盐水 产气较慢,有较多灰白色沉淀和泡沫
3 m 稀盐酸
A.灰白色沉淀主要成分为Ca(OH)2
B.提高NaCl溶液的质量分数能减慢反应速率
C.不宜使用纯水作为反应试剂
D.推测实验3的现象为产气速度慢,无沉淀和泡沫
解析 电石制备乙炔气体的原理为CaC2+2H2O--→Ca(OH)2+C2H2↑。灰白色沉淀主要成分为Ca(OH)2,A正确;比较实验1和实验2可知,食盐水浓度越大,反应速率越慢,故提高NaCl溶液的质量分数能减慢反应速率,B正确;比较实验1和实验2可知,食盐水浓度越小,反应速率越快,纯水反应速率太快,不宜使用纯水作为反应试剂,C正确;由于反应生成的Ca(OH)2能与盐酸发生中和反应,故测实验3的现象为产气速度快,无沉淀,但有泡沫生成,D错误。
11.已知:制备乙炔的原理为CaC2+2H2O--→Ca(OH)2+C2H2↑,实验室用电石(含CaC2和少量CaS)制取乙炔时,下列对装置和试剂的分析错误的是( )
A.甲中用饱和食盐水可减缓电石与水的反应速率
B.乙中试剂X可选用CuSO4溶液净化乙炔
C.用丙收集气体时,应a口进气,b口导出气体
D.丁装置既可以处理尾气,又可以检验乙炔是否集满
C
解析 碳化钙与水的反应速率快,不宜控制,实验时用饱和食盐水可减缓电石与水的反应速率,获得平稳的乙炔气流,A正确;电石中的硫化钙能与水反应生成硫化氢气体,将电石与水反应获得的乙炔气体通过盛有硫酸铜溶液的洗气瓶可以除去乙炔气体中混有的硫化氢气体,获得纯净的乙炔,B正确;乙炔密度与同条件下空气密度接近,不能用向上排空气法收集乙炔,C错误;乙炔能与酸性高锰酸钾溶液发生氧化反应,所以盛有酸性高锰酸钾溶液的洗气瓶可以吸收乙炔,同时溶液颜色变浅也能说明乙炔已收集满,D正确。
BC
B
解析 由图可知,4→5为乙炔与吸附在催化剂AuCl上的HCl反应,化学方程式为CH≡CH+HCl/AuCl--→CH2==CHCl/AuCl,A正确;若保持体系中C2H2分压不变,HCl分压过高时,HCl的体积分数过高,催化剂吸附的较多,阻碍了乙炔与其接触,降低反应催化效率,B错误;反应过程中有H—Cl极性共价键和C—C非极性共价键断裂,C正确;反应物在催化剂表面经历1→2过程扩散,2→3过程HCl在AuCl上吸附(活性位点),4→5乙炔和HCl在催化剂表面反应,5→6生成产物氯乙烯从催化剂上脱附,D正确。
14.利用传统方式制备乙炔的过程中,存在一些问题难以解决,如反应速率过快、放热过多不易控制,生成的糊状物难以实现固液分离导致乙炔气流不平稳,甚至发生堵塞等问题。为解决上述问题,某校化学兴趣小组设计出一套乙炔制备、净化和收集实验的一体化实验装置。
(1)实验室常用电石与水反应的传统方法制取乙炔,写出反应的化学方程式:
。
CaC2+2H2O→Ca(OH)2+CH≡CH↑
解析 (1)电石的主要成分是CaC2,其与水反应的方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑。
(2)①仪器B的名称是 ;
②向A反应器中填装固体反应物时,电石放置位置为 (填“甲处”或“乙处”);反应器中装有7 mm玻璃珠,其作用为 ;
③B装置中可用次氯酸钠吸收混杂在乙炔中的H2S、PH3,反应中PH3被氧化为最高价氧化物对应的水化物,请写出次氯酸钠与PH3反应的离子方程式: 。
具支试管
甲处
形成空隙,促进固液分离,防堵塞
PH3+4ClO-===H3PO4+4Cl-
解析 (2)①该仪器名称为“具支试管”。②将电石放置于甲处时,产生的糊状物质由于重力作用沿着玻璃珠空隙流下,而电石则因固体无流动性而留在玻璃珠上方,由此实现固体与糊状物质的及时分离,并保持糊状物有足够的时间处于流动状态,不会因滞留导致堵塞,而放置于乙处则无法实现。③依题意,PH3被氧化为H3PO4,故离子反应方程式为PH3+4ClO-===H3PO4+4Cl-。
(3)兴趣小组在制备乙炔时对反应液进行了一系列筛选(如下图),依据图表选择最合适的反应液为 (填标号),原因是
。
a.饱和食盐水 b.2.5 mol·L-1醋酸
c.2 mol·L-1盐酸 d.饱和氯化铵溶液
d
饱和氯化铵溶液作反应液时,反应
温和可控,固液分离率适当
解析 (3)根据题意,醋酸和盐酸“反应速率过快、放热过多不易控制”,饱和食盐水“生成的糊状物难以实现固液分离”,故应选择反应速率和放热较为平稳、固液分离率适中的饱和氯化铵溶液。
(4)选取合适的反应液后,小组称取电石1.25 g(杂质的质量分数为4.0%)完成实验,除杂后测得乙炔气体体积为336 mL(标准状况下),计算该实验中乙炔的产率:
%(结果保留两位有效数字)。
80
解析 (4)理论产量为×22.4 L/mol=0.42 L,实际产量为0.336 L,故产率为×100%=80%。
Thanks!
本
讲
内
容
结
束
