3.3.2水解平衡的影响因素 课件 (共18张PPT) 人教版(2019) 选择性必修1
文档属性
| 名称 | 3.3.2水解平衡的影响因素 课件 (共18张PPT) 人教版(2019) 选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 219.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 10:58:01 | ||
图片预览




文档简介
(共18张PPT)
第三节 盐类的水解
第2课时 水解平衡的影响因素
第三章 水溶液中的离子反应与平衡
温故知新 · 盐类的水解
盐的水溶液中,“弱离子”会夺取H2O中的H+/OH-,生成对应的弱酸/弱碱
水解的特点:吸热、微弱、可逆
盐的水解存在平衡状态
平衡的特点:逆、等、动、定、变
平衡的影响因素:
内因:物质本身性质
外因:浓度、温度……
“越弱越水解”
勒·夏特列原理
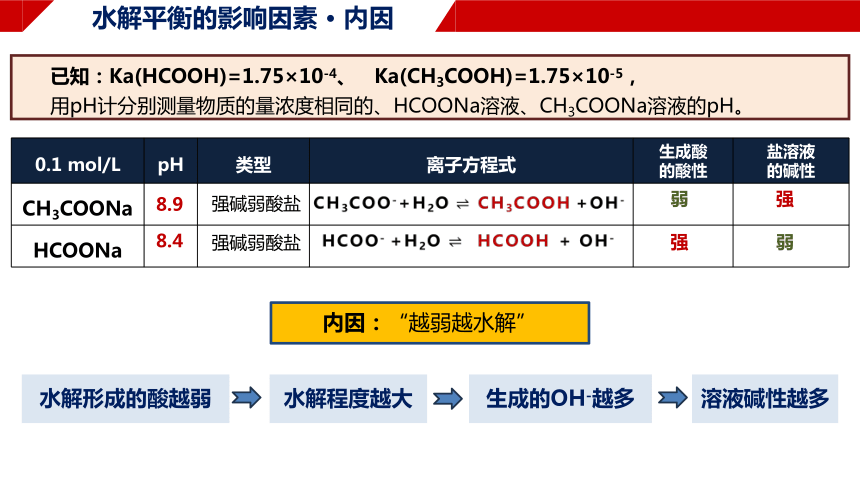
水解平衡的影响因素 · 内因
内因:“越弱越水解”
已知:Ka(HCOOH)=1.75×10-4、 Ka(CH3COOH)=1.75×10-5,
用pH计分别测量物质的量浓度相同的、HCOONa溶液、CH3COONa溶液的pH。
0.1 mol/L pH 类型 离子方程式 生成酸 的酸性 盐溶液
的碱性
CH3COONa
HCOONa
强碱弱酸盐
强碱弱酸盐
8.9
8.4
弱
强
CH3COO-+H2O CH3COOH +OH-
HCOO- +H2O HCOOH + OH-
强
弱
水解形成的酸越弱
水解程度越大
生成的OH-越多
溶液碱性越多
酸的电离
CH3COOH CH3COO - + H+
HCOOH HCOO - + H+
HCOO-+H2O HCOOH +OH-
CH3COO-+H2O CH3COOH +OH-
水解平衡的影响因素 · 内因
思考1
为什么酸越弱,其酸根离子水解程度越大?
酸根离子的水解
Ka(HCOOH)=1.75×10-4
Ka(CH3COOH)=1.75×10-5
①、酸的电离常数越小,在水溶液中越难电离出H+,酸性就越弱,
②、正向电离越难、意味着逆向结合越易 → 更弱的酸根离子更易结合H+ → 更易水解
③、酸根更易水解、结合的H+越多、生成的OH-越多、溶液的碱性越强
归纳分析
【练习1】、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A、HX、HZ、HY B、HX、HY、HZ
C、HZ、HY、HX D、HY、HZ、HX
水解平衡的影响因素 · 内因
思考2
已知: Na2SiO3 + H2O +CO2 = H2SiO3↓ + Na2CO3
预测:相同浓度的NaHCO3溶液与Na2SiO3溶液,谁的pH更大,写出水解方程并解释原因
B
外界条件 移动方向 溶液颜色 水解程度 溶液PH
加热
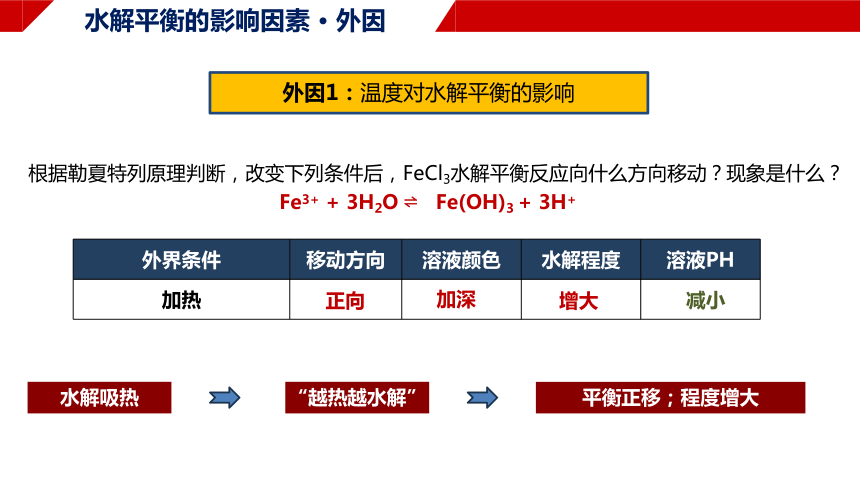
水解平衡的影响因素 · 外因
外因1:温度对水解平衡的影响
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
正向
Fe3+ + 3H2O Fe(OH)3 + 3H+
加深
增大
水解吸热
“越热越水解”
平衡正移;程度增大
减小
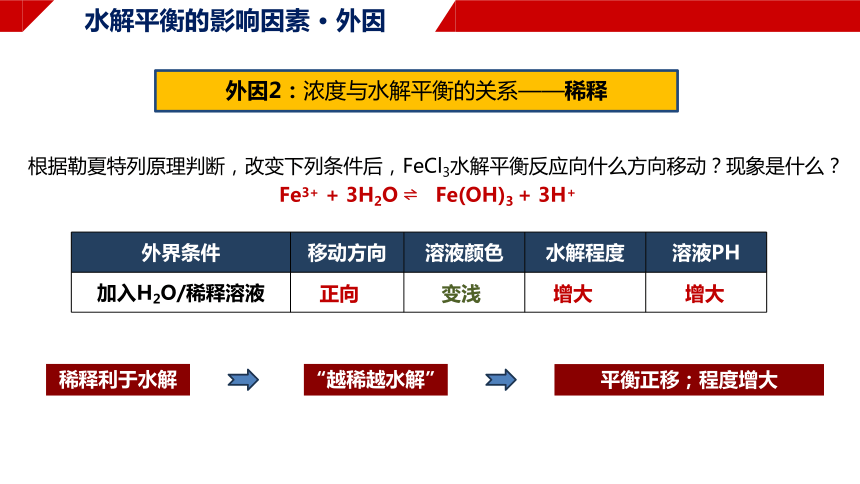
外界条件 移动方向 溶液颜色 水解程度 溶液PH
加入H2O/稀释溶液
水解平衡的影响因素 · 外因
外因2:浓度与水解平衡的关系——稀释
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
稀释利于水解
“越稀越水解”
平衡正移;程度增大
正向
变浅
增大
增大
水解平衡的影响因素 · 外因
为什么“稀释有利于水解“?尝试从平衡常数的角度进行分析
外因2:浓度与水解平衡的关系——稀释
思考3
c3 (H+)
Kh=
c (Fe3+)
水解
平衡常数
Fe3+ + 3H2O Fe(OH)3 + 3H+
若稀释
10倍
c3 (H+)
c (Fe3+)
(1/10)3
(1/10)
c3 (H+)
c (Fe3+)
(1/10)2
=
Q< Kh
Q=
平衡
正向移动
外界条件 移动方向 溶液颜色 水解程度 溶液PH
滴入浓盐酸
加入NaOH溶液
水解平衡的影响因素 · 外因
外因3:浓度与水解平衡的关系——加入酸/碱
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
加入酸/碱
“同性抑制,异性促进”
正向
逆向
红褐色沉淀
变浅
减小
增大
减小
增大
外界条件 所加盐的溶液酸碱性 移动方向 Fe3+的水解程度
加入NaHCO3固体
加入AlCl3固体
加入NaCl固体
水解平衡的影响因素 · 外因
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
逆向
正向
不移动
碱性
酸性
中性
增大
减小
不变
外因4:浓度与水解平衡的关系——加入其他盐
加入酸/碱
“同性抑制,异性促进”
外界条件 移动方向 水解程度 溶液PH
加入FeCl3晶体
水解平衡的影响因素 · 外因
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
平衡正移;但水解程度减小
正向
减小
减小
外因5:浓度与水解平衡的关系——加入待水解的盐
内因
2、温度:
3、浓度
加盐(本身):
稀释:
加酸、加碱、加盐:
平衡正移,水解程度增大
平衡正移,水解程度减小
总结:盐类水解平衡的影响因素
越弱越水解
外因
越热越水解
温度升高 — 平衡正移;水解程度增大
1、物质本身性质
(具体情况具体分析)
同性抑制;异性促进
越稀越水解
水解平衡的影响因素
改变条件 平衡移动 c(H+) pH 水解程度 现象
加热
加水
少量FeCl3(s)
盐酸
少量NaOH(s)
加NaHCO3
加NH4Cl
加Mg
正向
增大
减小
增大
正向
减小
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
减小
增大
增大
颜色变深
颜色变浅
颜色变深
红褐色↓无色↑
颜色变浅
红褐色↓
【检测】、在0.01mol/LFeCl3溶液中,Fe3++3H2O Fe(OH)3+3H+
逆向
减小
增大
减小
颜色变浅
正向
增大
减小
增大
红褐色↓无色↑
课堂练习
盐类水解平衡 · 应用
思考3
①、厨房重度油污可用烧碱祛除,利用了油脂在碱性条件下易水解的性质;
而一些轻度油污可用纯碱祛除,请写出对应的水解方程并解释原因
③、用小苏打能否起到去油污的作用?它的去油效果与纯碱相比哪一个更强?
②、用纯碱去油污式,通常需要加入热水,请利用盐类水解原理解释原因。
CO32- + H2O HCO3- + OH-
HCO3- + H2O H2CO3 + OH-
加热促进碳酸根电离,增强溶液的碱性,更利于油脂的水解
HCO3- + H2O H2CO3 + OH-
Na2CO3水解程度大于NaHCO3,所以溶液的碱性更强,去油效果更好
盐类水解平衡 · 应用
思考4
①、在配制FeCl3溶液时,若将FeCl3晶体直接溶于蒸馏水中,制得的液体会出现丁达尔效应,为什么?
②、如何配制澄清的FeCl3溶液?
Fe3+ + 3H2O Fe(OH)3 + 3H+
加入少量的盐酸,使溶液呈酸性,抑制铁离子的水解
【练习1】、在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A、加热 B、通入HCl
C、加入少量Na2SO4(s) D、加入NaCl溶液
D
课堂练习
【练习2】、向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A、减小、增大、减小 B、增大、减小、减小
C、减小、增大、增大 D、增大、减小、增大
A
课堂练习
种类 H2SO3 CH3COOH H2CO3 HClO
电离常数 Ka1=1.40×l0-2 Ka2=6.00×l0-8 1.75×10-5 Ka1=4.50×l0-7 Ka2=4.70×10-11 4.00×10-8
【练习3】、在相同温度下,比较0.1mol/L的NaHSO3、CH3COONa、Na2CO3、NaHCO3、NaClO溶液中pH值的大小。
课堂练习
第三节 盐类的水解
第2课时 水解平衡的影响因素
第三章 水溶液中的离子反应与平衡
温故知新 · 盐类的水解
盐的水溶液中,“弱离子”会夺取H2O中的H+/OH-,生成对应的弱酸/弱碱
水解的特点:吸热、微弱、可逆
盐的水解存在平衡状态
平衡的特点:逆、等、动、定、变
平衡的影响因素:
内因:物质本身性质
外因:浓度、温度……
“越弱越水解”
勒·夏特列原理
水解平衡的影响因素 · 内因
内因:“越弱越水解”
已知:Ka(HCOOH)=1.75×10-4、 Ka(CH3COOH)=1.75×10-5,
用pH计分别测量物质的量浓度相同的、HCOONa溶液、CH3COONa溶液的pH。
0.1 mol/L pH 类型 离子方程式 生成酸 的酸性 盐溶液
的碱性
CH3COONa
HCOONa
强碱弱酸盐
强碱弱酸盐
8.9
8.4
弱
强
CH3COO-+H2O CH3COOH +OH-
HCOO- +H2O HCOOH + OH-
强
弱
水解形成的酸越弱
水解程度越大
生成的OH-越多
溶液碱性越多
酸的电离
CH3COOH CH3COO - + H+
HCOOH HCOO - + H+
HCOO-+H2O HCOOH +OH-
CH3COO-+H2O CH3COOH +OH-
水解平衡的影响因素 · 内因
思考1
为什么酸越弱,其酸根离子水解程度越大?
酸根离子的水解
Ka(HCOOH)=1.75×10-4
Ka(CH3COOH)=1.75×10-5
①、酸的电离常数越小,在水溶液中越难电离出H+,酸性就越弱,
②、正向电离越难、意味着逆向结合越易 → 更弱的酸根离子更易结合H+ → 更易水解
③、酸根更易水解、结合的H+越多、生成的OH-越多、溶液的碱性越强
归纳分析
【练习1】、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A、HX、HZ、HY B、HX、HY、HZ
C、HZ、HY、HX D、HY、HZ、HX
水解平衡的影响因素 · 内因
思考2
已知: Na2SiO3 + H2O +CO2 = H2SiO3↓ + Na2CO3
预测:相同浓度的NaHCO3溶液与Na2SiO3溶液,谁的pH更大,写出水解方程并解释原因
B
外界条件 移动方向 溶液颜色 水解程度 溶液PH
加热
水解平衡的影响因素 · 外因
外因1:温度对水解平衡的影响
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
正向
Fe3+ + 3H2O Fe(OH)3 + 3H+
加深
增大
水解吸热
“越热越水解”
平衡正移;程度增大
减小
外界条件 移动方向 溶液颜色 水解程度 溶液PH
加入H2O/稀释溶液
水解平衡的影响因素 · 外因
外因2:浓度与水解平衡的关系——稀释
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
稀释利于水解
“越稀越水解”
平衡正移;程度增大
正向
变浅
增大
增大
水解平衡的影响因素 · 外因
为什么“稀释有利于水解“?尝试从平衡常数的角度进行分析
外因2:浓度与水解平衡的关系——稀释
思考3
c3 (H+)
Kh=
c (Fe3+)
水解
平衡常数
Fe3+ + 3H2O Fe(OH)3 + 3H+
若稀释
10倍
c3 (H+)
c (Fe3+)
(1/10)3
(1/10)
c3 (H+)
c (Fe3+)
(1/10)2
=
Q< Kh
Q=
平衡
正向移动
外界条件 移动方向 溶液颜色 水解程度 溶液PH
滴入浓盐酸
加入NaOH溶液
水解平衡的影响因素 · 外因
外因3:浓度与水解平衡的关系——加入酸/碱
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
加入酸/碱
“同性抑制,异性促进”
正向
逆向
红褐色沉淀
变浅
减小
增大
减小
增大
外界条件 所加盐的溶液酸碱性 移动方向 Fe3+的水解程度
加入NaHCO3固体
加入AlCl3固体
加入NaCl固体
水解平衡的影响因素 · 外因
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
逆向
正向
不移动
碱性
酸性
中性
增大
减小
不变
外因4:浓度与水解平衡的关系——加入其他盐
加入酸/碱
“同性抑制,异性促进”
外界条件 移动方向 水解程度 溶液PH
加入FeCl3晶体
水解平衡的影响因素 · 外因
根据勒夏特列原理判断,改变下列条件后,FeCl3水解平衡反应向什么方向移动?现象是什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
平衡正移;但水解程度减小
正向
减小
减小
外因5:浓度与水解平衡的关系——加入待水解的盐
内因
2、温度:
3、浓度
加盐(本身):
稀释:
加酸、加碱、加盐:
平衡正移,水解程度增大
平衡正移,水解程度减小
总结:盐类水解平衡的影响因素
越弱越水解
外因
越热越水解
温度升高 — 平衡正移;水解程度增大
1、物质本身性质
(具体情况具体分析)
同性抑制;异性促进
越稀越水解
水解平衡的影响因素
改变条件 平衡移动 c(H+) pH 水解程度 现象
加热
加水
少量FeCl3(s)
盐酸
少量NaOH(s)
加NaHCO3
加NH4Cl
加Mg
正向
增大
减小
增大
正向
减小
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
减小
增大
增大
颜色变深
颜色变浅
颜色变深
红褐色↓无色↑
颜色变浅
红褐色↓
【检测】、在0.01mol/LFeCl3溶液中,Fe3++3H2O Fe(OH)3+3H+
逆向
减小
增大
减小
颜色变浅
正向
增大
减小
增大
红褐色↓无色↑
课堂练习
盐类水解平衡 · 应用
思考3
①、厨房重度油污可用烧碱祛除,利用了油脂在碱性条件下易水解的性质;
而一些轻度油污可用纯碱祛除,请写出对应的水解方程并解释原因
③、用小苏打能否起到去油污的作用?它的去油效果与纯碱相比哪一个更强?
②、用纯碱去油污式,通常需要加入热水,请利用盐类水解原理解释原因。
CO32- + H2O HCO3- + OH-
HCO3- + H2O H2CO3 + OH-
加热促进碳酸根电离,增强溶液的碱性,更利于油脂的水解
HCO3- + H2O H2CO3 + OH-
Na2CO3水解程度大于NaHCO3,所以溶液的碱性更强,去油效果更好
盐类水解平衡 · 应用
思考4
①、在配制FeCl3溶液时,若将FeCl3晶体直接溶于蒸馏水中,制得的液体会出现丁达尔效应,为什么?
②、如何配制澄清的FeCl3溶液?
Fe3+ + 3H2O Fe(OH)3 + 3H+
加入少量的盐酸,使溶液呈酸性,抑制铁离子的水解
【练习1】、在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A、加热 B、通入HCl
C、加入少量Na2SO4(s) D、加入NaCl溶液
D
课堂练习
【练习2】、向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A、减小、增大、减小 B、增大、减小、减小
C、减小、增大、增大 D、增大、减小、增大
A
课堂练习
种类 H2SO3 CH3COOH H2CO3 HClO
电离常数 Ka1=1.40×l0-2 Ka2=6.00×l0-8 1.75×10-5 Ka1=4.50×l0-7 Ka2=4.70×10-11 4.00×10-8
【练习3】、在相同温度下,比较0.1mol/L的NaHSO3、CH3COONa、Na2CO3、NaHCO3、NaClO溶液中pH值的大小。
课堂练习
