3.3.4水解平衡常数的应用 课件 (共18张PPT) 人教版(2019) 选择性必修1
文档属性
| 名称 | 3.3.4水解平衡常数的应用 课件 (共18张PPT) 人教版(2019) 选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 321.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
第三节 盐类的水解
第4课时 水解平衡常数
第三章 水溶液中的离子反应与平衡
模块一
水解平衡常数表达式
水解平衡常数
基本概念
1、定义:盐的水解反应的平衡常数,用Kh 表示。
2、表达式:书写方法与其他平衡常数一致,固体、H2O不参与
【例1】:氯化铵水解:
NH4+ + H2O NH3 · H2O + H+
Kh=
c(NH3 · H2O ) ·c(H+)
c(NH4+ )
3、意义:
Kh越大,水解程度越大。
4、影响因素:
只受温度影响,升温,Kh增大
【例1】、书写下列水解平衡常数的表达式。
①、Fe3++3H2O Fe(OH)3+3H+
③、S2-+H2O HS-+OH-
④、HS-+H2O H2S+OH-
②、Cu2++2H2O Cu(OH)2+2H+
固体和溶剂水不出现
水解平衡常数
c3 (H+)
Kh=
c (Fe3+)
c2 (H+)
Kh=
c (Cu2+)
Kh1=
c(HS-) ·c(OH )
c(S2-)
Kh2=
c(H2S) ·c(OH )
c(HS-)
水解常数与电离常数
思考1
弱酸根离子的水解平衡常数(Kh),与弱酸的电离平衡常数(Ka)之间有什么关系?
【例2】以CH3COONa溶液为例:
溶液中同时存在着CH3COO-离子的水解平衡,与CH3COOH的电离平衡
①、分别写出CH3COO- 水解方程与CH3COOH的电离方程
②、分别写出溶液中Kh表达式与Ka表达式
CH3COO- 水解:
CH3COO- + H2O CH3COOH + OH-
Kh=
c(CH3COOH) ·c(OH )
c(CH3COO- )
CH3COOH 电离:
CH3COOH CH3COO- + H+
Ka=
c(CH3COO-) · c(H+)
c(CH3COOH)
③、将水解方程与电离方程相加,你有什么发现?
④、写出Kh、Ka与Kw之间的关系
Kw= Kh · Ka
方程相加
H2O H++OH-
平衡常数相乘
水解常数与电离常数
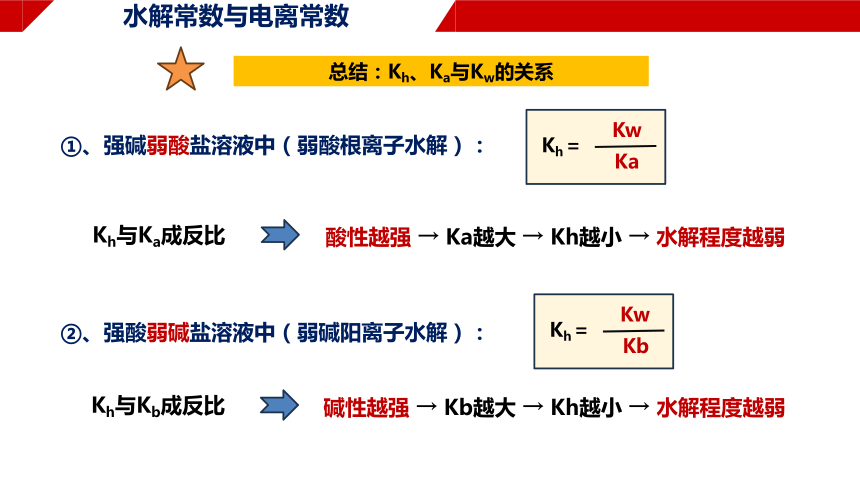
总结:Kh、Ka与Kw的关系
①、强碱弱酸盐溶液中(弱酸根离子水解):
Kh=
Kw
Ka
Kh与Ka成反比
酸性越强 → Ka越大 → Kh越小 → 水解程度越弱
②、强酸弱碱盐溶液中(弱碱阳离子水解):
Kh=
Kw
Kb
Kh与Kb成反比
碱性越强 → Kb越大 → Kh越小 → 水解程度越弱
水解常数与电离常数
思考2
二元弱酸的Kh与Ka之间有什么关系?
【例3】已知:水的离子积常数为Kw,
二元弱酸H2CO3的两步电离常数为Ka1、Ka2 ; CO32-的两步水解常数为Kh1、Kh2
①、分别写出H2CO3的两步电离方程与CO32-的两步水解方程
CO32- + H2O HCO3-+ OH-
HCO3- + H2O H2CO3+ OH-
Kh1
Kh2
H2CO3 HCO3- + H+
HCO3- CO32- + H+
Ka1
Ka2
电离
水解
水解常数与电离常数
CO32- + H2O HCO3-+ OH-
HCO3- + H2O H2CO3+ OH-
Kh1
Kh2
H2CO3 HCO3- + H+
HCO3- CO32- + H+
Ka1
Ka2
电离
水解
Kw= Ka1 · Kh2
Kw= Ka2 · Kh1
Kh1=
Kw
Ka2
Kh2=
Kw
Ka1
水解常数与电离常数
模块二
水解平衡常数的应用
水解常数 · 课堂练习
(2)25 ℃时,等浓度的碳酸钠溶液和碳酸氢钠溶液谁的碱性强?
CO32- + H2O HCO3-+ OH-
HCO3- + H2O H2CO3+ OH-
Kh2=
Kw
Ka1
=
1×10-14
4.5×10-7
≈ 2× 10-8
Kh1 >> Kh2
水解程度
CO32- >> HCO3-
Na2CO3溶液
碱性强
【练习1】、已知:25 ℃时,碳酸的电离常数为Ka1=4.5×10-7,Ka2=4.7×10-11。
(1)请写出碳酸钠水解的离子方程式,并计算其水解常数(Kh1、Kh2)。
Kh1=
Kw
Ka2
=
1×10-14
4.7×10-11
≈ 2 × 10-4
应用1:已知Ka求Kh
【练习1-2】、已知某温度时,Kw=1.0×10-12,Na2CO3溶液的水解常数Kh1=2.0×10-3,则当溶液中c(HCO3-)∶c(CO32-)=2∶1时,试求该溶液的pH=_________。
9
=2 × 10-3
Kh1=
c(HCO3-) c(OH-)
c(CO32-)
c(OH-)=1 × 10-3 mol/L
c(H+)=1 × 10-9 mol/L
CO32- + H2O HCO3-+ OH-
水解常数 · 课堂练习
变式应用1:已知Kh求解PH
【练习1-3】、在室温下,0.175 mol/L 醋酸钠溶液的pH约为__________
[已知Ka(CH3COOH)=1.75×10-5]。
9
Kh=
c(CH3COOH) c(OH-)
c(CH3COO-)
Kh=
Kw
Ka
1 × 10-14
1.75×10-5
=
c(OH-)=
Kh c(CH3COO-)
CH3COO-+H2O CH3COOH +OH-
变式应用1:已知Kh求解PH
水解常数 · 课堂练习
c(OH-) = c(CH3COOH)
c(CH3COO-)≈ 0.175mol/L(水解微弱)
c(OH-)
=10-5 mol·L-1
【练习2】、已知常温下Ka(CH3COOH)>Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),则同浓度的下列四种溶液的pH由大到小的顺序为______________________。
①Na2CO3溶液 ②NaHCO3溶液 ③NaClO溶液 ④CH3COONa溶液
①>③>②>④
水解常数 · 课堂练习
应用2:已知Ka,比较盐溶液PH
水解常数 · 课堂练习
应用3:酸式盐溶液酸碱性判断
【练习3-1】已知:25 ℃时,H2SO3的电离常数为Ka1=1.4×10-2,Ka2=6.0×10-8。请问NaHSO3溶液显酸性还是碱性?
NaHSO3 = Na+ + HSO3-
HSO3-
HSO3- + H2O H2SO3+ OH-
HSO3- H++ SO32-
电离:
水解:
溶液最终呈酸性或碱性取决于
HSO3- 电离程度与水解程度谁更大
比较Ka和Kh
Ka2=6.0×10-11
Kh2=
Kw
Ka1
=
1×10-14
1.4×10-2
≈ 7×10-13
Ka2 > Kh2
电离>水解
NaHSO3
溶液显酸性
水解常数 · 课堂练习
【练习3-2】已知:25 ℃时,H2S的电离常数为Ka1=1.1×10-7、Ka2=1.3×10-13。请问NaHS溶液显酸性还是碱性?
HS- + H2O H2S+ OH-
Kh2=
Kw
Ka1
=
1×10-14
1.1×10-7
≈ 1×10-7
HS- H++ S2-
Ka2=1.3×10-13
电离:
水解:
HS-
Kh2 > Ka2
水解>电离
NaHS溶液显碱性
应用3:酸式盐溶液酸碱性判断
【练习4】、在一定条件下,Na2CO3溶液中存在下列平衡:CO32- + H2O HCO3-+ OH- 。下列说法不正确的是( )
A、稀释溶液, 增大
B、通入CO2,溶液pH减小
C、升高温度,平衡常数增大
D、加入NaOH固体, 减小
A
c(CO32- )
c(HCO3-) ·c(OH-)
c(CO32- )
c(HCO3-)
水解常数 · 课堂练习
应用4:Kh的影响因素
【练习5】、常温下,三种酸的电离常数如下表所示。
酸 HX HY HZ
Ka 9×10-7 9×10-6 1×10-2
回答下列问题:
(1)同浓度的NaX、NaY、NaZ溶液,pH最大的是_______。
(2)同pH的NaX、NaY、NaZ溶液,浓度最大的是________。
(3)等物质的量浓度的HX和NaX混合溶液显_____性,
原因是_____________________________________________________________________________________。
NaX
NaZ
酸
HX的电离常数Ka=
9×10-7,NaX的水解常数Kh=
1×10-14
9×10-7
<Ka,混合溶液显酸性
水解常数 · 课堂练习
综合应用练习
第三节 盐类的水解
第4课时 水解平衡常数
第三章 水溶液中的离子反应与平衡
模块一
水解平衡常数表达式
水解平衡常数
基本概念
1、定义:盐的水解反应的平衡常数,用Kh 表示。
2、表达式:书写方法与其他平衡常数一致,固体、H2O不参与
【例1】:氯化铵水解:
NH4+ + H2O NH3 · H2O + H+
Kh=
c(NH3 · H2O ) ·c(H+)
c(NH4+ )
3、意义:
Kh越大,水解程度越大。
4、影响因素:
只受温度影响,升温,Kh增大
【例1】、书写下列水解平衡常数的表达式。
①、Fe3++3H2O Fe(OH)3+3H+
③、S2-+H2O HS-+OH-
④、HS-+H2O H2S+OH-
②、Cu2++2H2O Cu(OH)2+2H+
固体和溶剂水不出现
水解平衡常数
c3 (H+)
Kh=
c (Fe3+)
c2 (H+)
Kh=
c (Cu2+)
Kh1=
c(HS-) ·c(OH )
c(S2-)
Kh2=
c(H2S) ·c(OH )
c(HS-)
水解常数与电离常数
思考1
弱酸根离子的水解平衡常数(Kh),与弱酸的电离平衡常数(Ka)之间有什么关系?
【例2】以CH3COONa溶液为例:
溶液中同时存在着CH3COO-离子的水解平衡,与CH3COOH的电离平衡
①、分别写出CH3COO- 水解方程与CH3COOH的电离方程
②、分别写出溶液中Kh表达式与Ka表达式
CH3COO- 水解:
CH3COO- + H2O CH3COOH + OH-
Kh=
c(CH3COOH) ·c(OH )
c(CH3COO- )
CH3COOH 电离:
CH3COOH CH3COO- + H+
Ka=
c(CH3COO-) · c(H+)
c(CH3COOH)
③、将水解方程与电离方程相加,你有什么发现?
④、写出Kh、Ka与Kw之间的关系
Kw= Kh · Ka
方程相加
H2O H++OH-
平衡常数相乘
水解常数与电离常数
总结:Kh、Ka与Kw的关系
①、强碱弱酸盐溶液中(弱酸根离子水解):
Kh=
Kw
Ka
Kh与Ka成反比
酸性越强 → Ka越大 → Kh越小 → 水解程度越弱
②、强酸弱碱盐溶液中(弱碱阳离子水解):
Kh=
Kw
Kb
Kh与Kb成反比
碱性越强 → Kb越大 → Kh越小 → 水解程度越弱
水解常数与电离常数
思考2
二元弱酸的Kh与Ka之间有什么关系?
【例3】已知:水的离子积常数为Kw,
二元弱酸H2CO3的两步电离常数为Ka1、Ka2 ; CO32-的两步水解常数为Kh1、Kh2
①、分别写出H2CO3的两步电离方程与CO32-的两步水解方程
CO32- + H2O HCO3-+ OH-
HCO3- + H2O H2CO3+ OH-
Kh1
Kh2
H2CO3 HCO3- + H+
HCO3- CO32- + H+
Ka1
Ka2
电离
水解
水解常数与电离常数
CO32- + H2O HCO3-+ OH-
HCO3- + H2O H2CO3+ OH-
Kh1
Kh2
H2CO3 HCO3- + H+
HCO3- CO32- + H+
Ka1
Ka2
电离
水解
Kw= Ka1 · Kh2
Kw= Ka2 · Kh1
Kh1=
Kw
Ka2
Kh2=
Kw
Ka1
水解常数与电离常数
模块二
水解平衡常数的应用
水解常数 · 课堂练习
(2)25 ℃时,等浓度的碳酸钠溶液和碳酸氢钠溶液谁的碱性强?
CO32- + H2O HCO3-+ OH-
HCO3- + H2O H2CO3+ OH-
Kh2=
Kw
Ka1
=
1×10-14
4.5×10-7
≈ 2× 10-8
Kh1 >> Kh2
水解程度
CO32- >> HCO3-
Na2CO3溶液
碱性强
【练习1】、已知:25 ℃时,碳酸的电离常数为Ka1=4.5×10-7,Ka2=4.7×10-11。
(1)请写出碳酸钠水解的离子方程式,并计算其水解常数(Kh1、Kh2)。
Kh1=
Kw
Ka2
=
1×10-14
4.7×10-11
≈ 2 × 10-4
应用1:已知Ka求Kh
【练习1-2】、已知某温度时,Kw=1.0×10-12,Na2CO3溶液的水解常数Kh1=2.0×10-3,则当溶液中c(HCO3-)∶c(CO32-)=2∶1时,试求该溶液的pH=_________。
9
=2 × 10-3
Kh1=
c(HCO3-) c(OH-)
c(CO32-)
c(OH-)=1 × 10-3 mol/L
c(H+)=1 × 10-9 mol/L
CO32- + H2O HCO3-+ OH-
水解常数 · 课堂练习
变式应用1:已知Kh求解PH
【练习1-3】、在室温下,0.175 mol/L 醋酸钠溶液的pH约为__________
[已知Ka(CH3COOH)=1.75×10-5]。
9
Kh=
c(CH3COOH) c(OH-)
c(CH3COO-)
Kh=
Kw
Ka
1 × 10-14
1.75×10-5
=
c(OH-)=
Kh c(CH3COO-)
CH3COO-+H2O CH3COOH +OH-
变式应用1:已知Kh求解PH
水解常数 · 课堂练习
c(OH-) = c(CH3COOH)
c(CH3COO-)≈ 0.175mol/L(水解微弱)
c(OH-)
=10-5 mol·L-1
【练习2】、已知常温下Ka(CH3COOH)>Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),则同浓度的下列四种溶液的pH由大到小的顺序为______________________。
①Na2CO3溶液 ②NaHCO3溶液 ③NaClO溶液 ④CH3COONa溶液
①>③>②>④
水解常数 · 课堂练习
应用2:已知Ka,比较盐溶液PH
水解常数 · 课堂练习
应用3:酸式盐溶液酸碱性判断
【练习3-1】已知:25 ℃时,H2SO3的电离常数为Ka1=1.4×10-2,Ka2=6.0×10-8。请问NaHSO3溶液显酸性还是碱性?
NaHSO3 = Na+ + HSO3-
HSO3-
HSO3- + H2O H2SO3+ OH-
HSO3- H++ SO32-
电离:
水解:
溶液最终呈酸性或碱性取决于
HSO3- 电离程度与水解程度谁更大
比较Ka和Kh
Ka2=6.0×10-11
Kh2=
Kw
Ka1
=
1×10-14
1.4×10-2
≈ 7×10-13
Ka2 > Kh2
电离>水解
NaHSO3
溶液显酸性
水解常数 · 课堂练习
【练习3-2】已知:25 ℃时,H2S的电离常数为Ka1=1.1×10-7、Ka2=1.3×10-13。请问NaHS溶液显酸性还是碱性?
HS- + H2O H2S+ OH-
Kh2=
Kw
Ka1
=
1×10-14
1.1×10-7
≈ 1×10-7
HS- H++ S2-
Ka2=1.3×10-13
电离:
水解:
HS-
Kh2 > Ka2
水解>电离
NaHS溶液显碱性
应用3:酸式盐溶液酸碱性判断
【练习4】、在一定条件下,Na2CO3溶液中存在下列平衡:CO32- + H2O HCO3-+ OH- 。下列说法不正确的是( )
A、稀释溶液, 增大
B、通入CO2,溶液pH减小
C、升高温度,平衡常数增大
D、加入NaOH固体, 减小
A
c(CO32- )
c(HCO3-) ·c(OH-)
c(CO32- )
c(HCO3-)
水解常数 · 课堂练习
应用4:Kh的影响因素
【练习5】、常温下,三种酸的电离常数如下表所示。
酸 HX HY HZ
Ka 9×10-7 9×10-6 1×10-2
回答下列问题:
(1)同浓度的NaX、NaY、NaZ溶液,pH最大的是_______。
(2)同pH的NaX、NaY、NaZ溶液,浓度最大的是________。
(3)等物质的量浓度的HX和NaX混合溶液显_____性,
原因是_____________________________________________________________________________________。
NaX
NaZ
酸
HX的电离常数Ka=
9×10-7,NaX的水解常数Kh=
1×10-14
9×10-7
<Ka,混合溶液显酸性
水解常数 · 课堂练习
综合应用练习
