3.3.3盐类水解的应用 课件 (共16张PPT) 人教版(2019) 选择性必修1
文档属性
| 名称 | 3.3.3盐类水解的应用 课件 (共16张PPT) 人教版(2019) 选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 28.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 10:44:51 | ||
图片预览




文档简介
(共16张PPT)
第三节 盐类的水解
第3课时 盐类水解的应用
第三章 水溶液中的离子反应与平衡
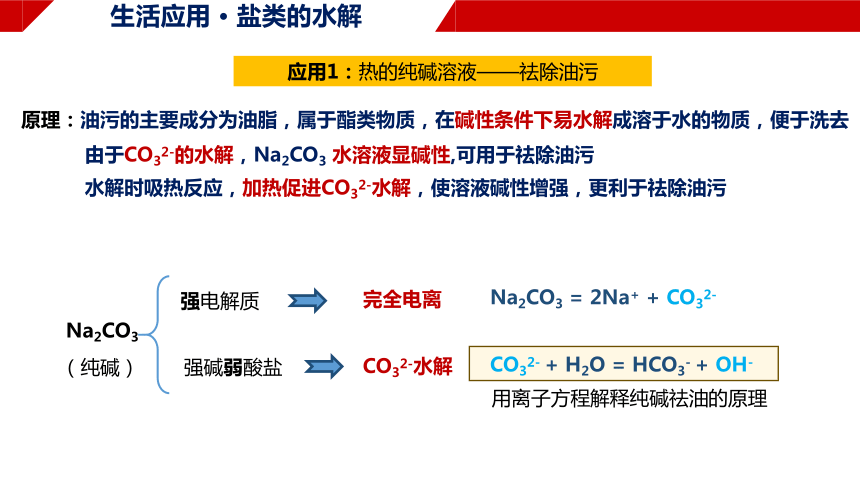
生活应用 · 盐类的水解
应用1:热的纯碱溶液——祛除油污
原理:油污的主要成分为油脂,属于酯类物质,在碱性条件下易水解成溶于水的物质,便于洗去
Na2CO3
(纯碱)
强电解质
强碱弱酸盐
完全电离
CO32-水解
Na2CO3 = 2Na+ + CO32-
CO32- + H2O = HCO3- + OH-
由于CO32-的水解,Na2CO3 水溶液显碱性,可用于祛除油污
水解时吸热反应,加热促进CO32-水解,使溶液碱性增强,更利于祛除油污
用离子方程解释纯碱祛油的原理
生活应用 · 盐类的水解
迁移应用1:肥皂祛油污
已知:
①、肥皂主要成分为:硬脂酸钠(C17H35COONa);②、硬脂酸(C17H35COOH)是一元弱酸。
(1)、写出方程并简述肥皂的去污原理
(2)、使用肥皂时,冷水和温水哪一个效果更佳?简述原因
思考1
C17H35COO- + H2O = C17H35COOH + OH-
热水促进硬脂酸根水解,增强祛油效果
生活应用 · 盐类的水解
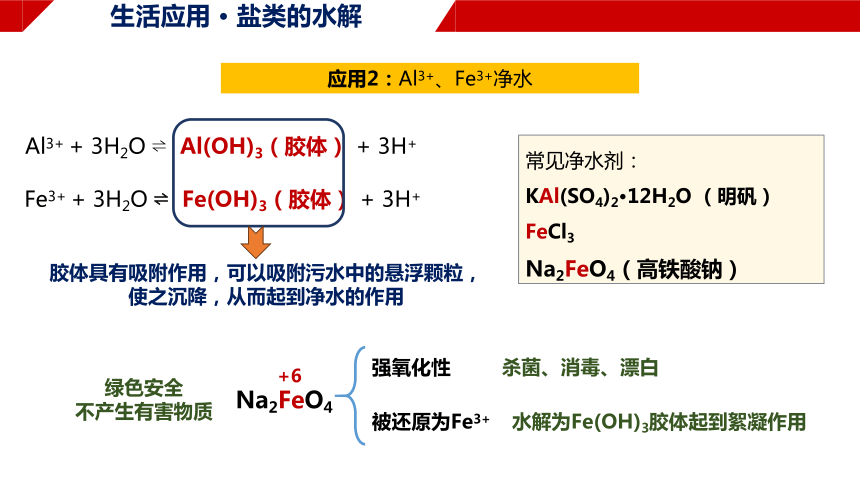
应用2:Al3+、Fe3+净水
生活应用 · 盐类的水解
应用2:Al3+、Fe3+净水
Al3+ + 3H2O Al(OH)3(胶体) + 3H+
Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+
胶体具有吸附作用,可以吸附污水中的悬浮颗粒,
使之沉降,从而起到净水的作用
常见净水剂:
KAl(SO4)2·12H2O (明矾)
FeCl3
Na2FeO4(高铁酸钠)
Na2FeO4
+6
强氧化性
被还原为Fe3+
杀菌、消毒、漂白
水解为Fe(OH)3胶体起到絮凝作用
绿色安全
不产生有害物质
生活应用 · 盐类的水解
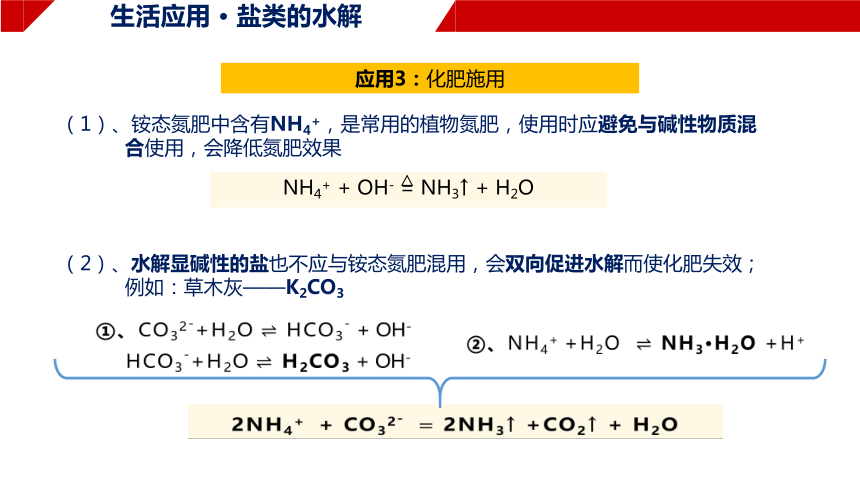
应用3:化肥施用
(1)、铵态氮肥中含有NH4+,是常用的植物氮肥,使用时应避免与碱性物质混 合使用,会降低氮肥效果
(2)、水解显碱性的盐也不应与铵态氮肥混用,会双向促进水解而使化肥失效;
例如:草木灰——K2CO3
①、CO32-+H2O HCO3- + OH-
②、NH4+ +H2O NH3·H2O +H+
2NH4+ + CO32- 2NH3↑ +CO2↑ + H2O
HCO3-+H2O H2CO3 + OH-
NH4+ + OH- = NH3↑ + H2O
△
【例1】、《礼记·内则》记载:“冠带垢,和灰清漱;衣裳垢,和灰清浣”。古人洗涤衣裳冠带,用的就是浸泡过草木灰的溶液。下列说法错误的是 ( )
A、草木灰的主要成分是K2CO3
B、浸泡过草木灰的溶液呈碱性
C、加热浸泡过草木灰的溶液可增强其去油污能力
D、草木灰作肥料时可与铵态氮肥混合施用
D
生活应用 · 盐类的水解
生活应用 · 盐类的水解
应用4:泡沫灭火器的原理
1、灭火器内填装物质
Al2(SO4)3溶液、 NaHCO3溶液
Al3+ + 3H2O Al(OH)3+3H+
混合前:
HCO3-+H2O H2CO3+ OH-
混合后:OH-与H+中和,促进水解,水解平衡向右移动,
以致生成大量的CO2, CO2将胶状Al(OH)3吹出可形成泡沫。
Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑
混合后:
生活应用 · 盐类的水解
应用5:工业除锈剂
①、铁锈的主要成分为:Fe2O3,工业上常用NH4Cl、ZnCl2等溶液做焊接时的除锈剂,请写出离子方程,并简述原因
思考3
Fe2O3 + 6H+ = 2Fe3+ + H2O
NH4++H2O NH3 H2O + H+
Zn2++2H2O Zn(OH) 2 + 2H+
②、为什么不直接用HCl、H2SO4等酸做除锈剂?
酸不仅能与铁锈反应而且与铁反应;
NH4Cl、ZnCl2溶液酸性很弱,只与铁锈反应,不与铁反应。
实验应用 · 盐类的水解
应用6:胶体的制备
实验应用 · 盐类的水解
应用6:胶体的制备
1、制备步骤:
向沸水中滴入5 6滴饱和FeCl3溶液,继续加热至溶液呈红褐色,然后停止加热。
用激光笔垂直照射所制得的液体,可看到光亮的通路
2、制备原理
FeCl3+3H2O = Fe(OH)3(胶体) + 3HCl
△
Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+
(1)、若将饱和FeCl3溶液滴入NaOH中,能否制得胶体?
(2)、会有何现象?简述现象产生的原因
思考2
实验应用 · 盐类的水解
应用7:盐溶液的配制
①、在配制FeCl3溶液时,若将FeCl3晶体直接溶于蒸馏水中,制得的液体会出现丁达尔效应,请写出离子方程,并简述原因
思考4
Fe3+ + 3H2O Fe(OH)3 (胶体)+ 3H+
②、如何配制澄清的FeCl3溶液?
核心:抑制水解
方法:先将FeCl3固体溶于浓盐酸中,再加蒸馏水稀释到所需浓度。
③、如何配置FeCl2溶液,需要注意哪些问题?
核心:抑制水解、防止氧化
方法:加入少量HCl(抑制水解)、 放入Fe钉/片/丝/粉(防止氧化)
原理:Fe2+ + 2H2O Fe(OH)2 + 2H+ 2Fe3+ + Fe = 3Fe2+
迁移应用7:盐溶液的配制
实验应用 · 盐类的水解
思考5
①、如何配置FeSO4溶液
方法:加入少量H2SO4、放入Fe钉
②、如何配置CuSO4溶液
方法:加入少量H2SO4
③、如何配置Na2S溶液?
方法:先将Na2S固体溶于NaOH中,再加蒸馏水稀释到所需浓度。
S2- + H2O HS-+ 2OH- HS- + H2O H2S+ 2OH-
剧毒
应用8:盐溶液的保存
实验应用 · 盐类的水解
①、保存NH4F溶液:铅容器或塑料瓶,不能存放在玻璃瓶中,根据水解原理,解释原因
思考6
②、Na2CO3溶液、 Na3PO4溶液、 Na2SiO3等溶液储存时,使用玻璃塞还是橡胶塞?
③、Na2CO3溶液、 Na3PO4溶液、 Na2SiO3等溶液滴定时使用什么滴定管?
F-水解产生HF,会腐蚀玻璃
以上盐溶液因水解而显碱性,会与磨口处玻璃反应,生成硅酸钠而发生粘连
碱式滴定管
应用9:盐溶液的蒸发产物
实验应用 · 盐类的水解
①、FeCl3溶液蒸干灼烧后,会得到何种固体产物?
思考7
FeCl3 + 3H2O Fe(OH)3 + 3HCl
2Fe(OH)3 = Fe2O3 + 3H2O
高温
升高温度,HCl挥发,促进FeCl3水解平衡正移,
最终完全生成Fe(OH)3固体,灼烧分解生成Fe2O3
②、AlCl3溶液蒸干灼烧后,会得到何种固体产物?简述原因
Al2O3
③、如何通过蒸发FeCl3溶液得到FeCl3固体?
核心:抑制水解
方法:在HCl的气流中蒸发,可以得到该氯化盐的无水晶体
迁移应用9:盐溶液的蒸发产物
实验应用 · 盐类的水解
思考8
①、蒸干灼烧Al2(SO4)3溶液,最终得到什么物质?
Al2(SO4)3 水解:
Al2(SO4)3 + 6H2O 2Al(OH)3 + 3H2SO4
H2SO4难挥发,平衡不移动。
最终产物: Al2(SO4)3
【例2】下列叙述正确的是( )
A、用图1装置制取无水MgCl2
B、利用图2装置将分液后的水层蒸干获得无水FeCl3
C、KAl(SO4)2·12H2O溶于NaOH溶液可形成Al(OH)3胶体
D、向滴有酚酞的Na2CO3溶液中加入足量CaCl2溶液,溶液红色褪去
第三节 盐类的水解
第3课时 盐类水解的应用
第三章 水溶液中的离子反应与平衡
生活应用 · 盐类的水解
应用1:热的纯碱溶液——祛除油污
原理:油污的主要成分为油脂,属于酯类物质,在碱性条件下易水解成溶于水的物质,便于洗去
Na2CO3
(纯碱)
强电解质
强碱弱酸盐
完全电离
CO32-水解
Na2CO3 = 2Na+ + CO32-
CO32- + H2O = HCO3- + OH-
由于CO32-的水解,Na2CO3 水溶液显碱性,可用于祛除油污
水解时吸热反应,加热促进CO32-水解,使溶液碱性增强,更利于祛除油污
用离子方程解释纯碱祛油的原理
生活应用 · 盐类的水解
迁移应用1:肥皂祛油污
已知:
①、肥皂主要成分为:硬脂酸钠(C17H35COONa);②、硬脂酸(C17H35COOH)是一元弱酸。
(1)、写出方程并简述肥皂的去污原理
(2)、使用肥皂时,冷水和温水哪一个效果更佳?简述原因
思考1
C17H35COO- + H2O = C17H35COOH + OH-
热水促进硬脂酸根水解,增强祛油效果
生活应用 · 盐类的水解
应用2:Al3+、Fe3+净水
生活应用 · 盐类的水解
应用2:Al3+、Fe3+净水
Al3+ + 3H2O Al(OH)3(胶体) + 3H+
Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+
胶体具有吸附作用,可以吸附污水中的悬浮颗粒,
使之沉降,从而起到净水的作用
常见净水剂:
KAl(SO4)2·12H2O (明矾)
FeCl3
Na2FeO4(高铁酸钠)
Na2FeO4
+6
强氧化性
被还原为Fe3+
杀菌、消毒、漂白
水解为Fe(OH)3胶体起到絮凝作用
绿色安全
不产生有害物质
生活应用 · 盐类的水解
应用3:化肥施用
(1)、铵态氮肥中含有NH4+,是常用的植物氮肥,使用时应避免与碱性物质混 合使用,会降低氮肥效果
(2)、水解显碱性的盐也不应与铵态氮肥混用,会双向促进水解而使化肥失效;
例如:草木灰——K2CO3
①、CO32-+H2O HCO3- + OH-
②、NH4+ +H2O NH3·H2O +H+
2NH4+ + CO32- 2NH3↑ +CO2↑ + H2O
HCO3-+H2O H2CO3 + OH-
NH4+ + OH- = NH3↑ + H2O
△
【例1】、《礼记·内则》记载:“冠带垢,和灰清漱;衣裳垢,和灰清浣”。古人洗涤衣裳冠带,用的就是浸泡过草木灰的溶液。下列说法错误的是 ( )
A、草木灰的主要成分是K2CO3
B、浸泡过草木灰的溶液呈碱性
C、加热浸泡过草木灰的溶液可增强其去油污能力
D、草木灰作肥料时可与铵态氮肥混合施用
D
生活应用 · 盐类的水解
生活应用 · 盐类的水解
应用4:泡沫灭火器的原理
1、灭火器内填装物质
Al2(SO4)3溶液、 NaHCO3溶液
Al3+ + 3H2O Al(OH)3+3H+
混合前:
HCO3-+H2O H2CO3+ OH-
混合后:OH-与H+中和,促进水解,水解平衡向右移动,
以致生成大量的CO2, CO2将胶状Al(OH)3吹出可形成泡沫。
Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑
混合后:
生活应用 · 盐类的水解
应用5:工业除锈剂
①、铁锈的主要成分为:Fe2O3,工业上常用NH4Cl、ZnCl2等溶液做焊接时的除锈剂,请写出离子方程,并简述原因
思考3
Fe2O3 + 6H+ = 2Fe3+ + H2O
NH4++H2O NH3 H2O + H+
Zn2++2H2O Zn(OH) 2 + 2H+
②、为什么不直接用HCl、H2SO4等酸做除锈剂?
酸不仅能与铁锈反应而且与铁反应;
NH4Cl、ZnCl2溶液酸性很弱,只与铁锈反应,不与铁反应。
实验应用 · 盐类的水解
应用6:胶体的制备
实验应用 · 盐类的水解
应用6:胶体的制备
1、制备步骤:
向沸水中滴入5 6滴饱和FeCl3溶液,继续加热至溶液呈红褐色,然后停止加热。
用激光笔垂直照射所制得的液体,可看到光亮的通路
2、制备原理
FeCl3+3H2O = Fe(OH)3(胶体) + 3HCl
△
Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+
(1)、若将饱和FeCl3溶液滴入NaOH中,能否制得胶体?
(2)、会有何现象?简述现象产生的原因
思考2
实验应用 · 盐类的水解
应用7:盐溶液的配制
①、在配制FeCl3溶液时,若将FeCl3晶体直接溶于蒸馏水中,制得的液体会出现丁达尔效应,请写出离子方程,并简述原因
思考4
Fe3+ + 3H2O Fe(OH)3 (胶体)+ 3H+
②、如何配制澄清的FeCl3溶液?
核心:抑制水解
方法:先将FeCl3固体溶于浓盐酸中,再加蒸馏水稀释到所需浓度。
③、如何配置FeCl2溶液,需要注意哪些问题?
核心:抑制水解、防止氧化
方法:加入少量HCl(抑制水解)、 放入Fe钉/片/丝/粉(防止氧化)
原理:Fe2+ + 2H2O Fe(OH)2 + 2H+ 2Fe3+ + Fe = 3Fe2+
迁移应用7:盐溶液的配制
实验应用 · 盐类的水解
思考5
①、如何配置FeSO4溶液
方法:加入少量H2SO4、放入Fe钉
②、如何配置CuSO4溶液
方法:加入少量H2SO4
③、如何配置Na2S溶液?
方法:先将Na2S固体溶于NaOH中,再加蒸馏水稀释到所需浓度。
S2- + H2O HS-+ 2OH- HS- + H2O H2S+ 2OH-
剧毒
应用8:盐溶液的保存
实验应用 · 盐类的水解
①、保存NH4F溶液:铅容器或塑料瓶,不能存放在玻璃瓶中,根据水解原理,解释原因
思考6
②、Na2CO3溶液、 Na3PO4溶液、 Na2SiO3等溶液储存时,使用玻璃塞还是橡胶塞?
③、Na2CO3溶液、 Na3PO4溶液、 Na2SiO3等溶液滴定时使用什么滴定管?
F-水解产生HF,会腐蚀玻璃
以上盐溶液因水解而显碱性,会与磨口处玻璃反应,生成硅酸钠而发生粘连
碱式滴定管
应用9:盐溶液的蒸发产物
实验应用 · 盐类的水解
①、FeCl3溶液蒸干灼烧后,会得到何种固体产物?
思考7
FeCl3 + 3H2O Fe(OH)3 + 3HCl
2Fe(OH)3 = Fe2O3 + 3H2O
高温
升高温度,HCl挥发,促进FeCl3水解平衡正移,
最终完全生成Fe(OH)3固体,灼烧分解生成Fe2O3
②、AlCl3溶液蒸干灼烧后,会得到何种固体产物?简述原因
Al2O3
③、如何通过蒸发FeCl3溶液得到FeCl3固体?
核心:抑制水解
方法:在HCl的气流中蒸发,可以得到该氯化盐的无水晶体
迁移应用9:盐溶液的蒸发产物
实验应用 · 盐类的水解
思考8
①、蒸干灼烧Al2(SO4)3溶液,最终得到什么物质?
Al2(SO4)3 水解:
Al2(SO4)3 + 6H2O 2Al(OH)3 + 3H2SO4
H2SO4难挥发,平衡不移动。
最终产物: Al2(SO4)3
【例2】下列叙述正确的是( )
A、用图1装置制取无水MgCl2
B、利用图2装置将分液后的水层蒸干获得无水FeCl3
C、KAl(SO4)2·12H2O溶于NaOH溶液可形成Al(OH)3胶体
D、向滴有酚酞的Na2CO3溶液中加入足量CaCl2溶液,溶液红色褪去
