4.1.1 原电池的工作原理 课件 (共27张PPT) 人教版(2019) 选择性必修1
文档属性
| 名称 | 4.1.1 原电池的工作原理 课件 (共27张PPT) 人教版(2019) 选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 10:46:42 | ||
图片预览


文档简介
(共27张PPT)
第一节 原电池
第1课时 原电池工作原理
第四章 化学反应与电能
模块一
单液、双液原电池工作原理
重难点:理解原电池中电子移动的动力——电位差
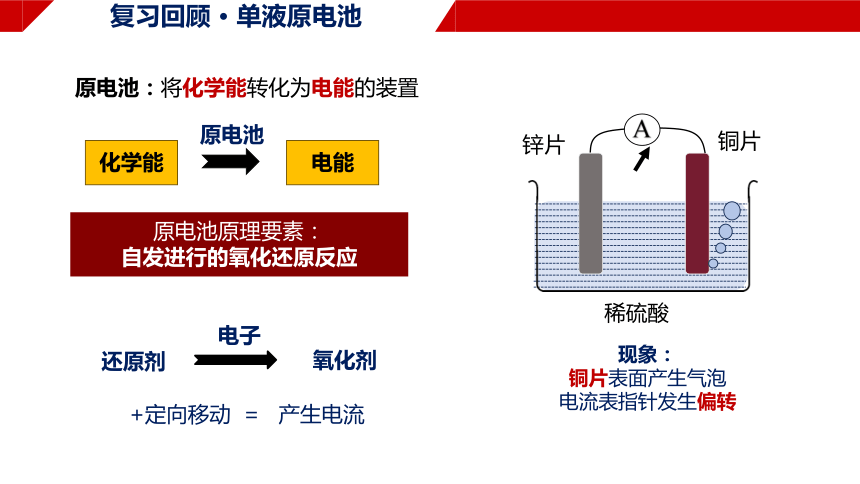
复习回顾 · 单液原电池
锌片
铜片
稀硫酸
A
现象:
铜片表面产生气泡
电流表指针发生偏转
原电池
化学能
电能
原电池:将化学能转化为电能的装置
原电池原理要素:
自发进行的氧化还原反应
还原剂
氧化剂
电子
+定向移动 = 产生电流
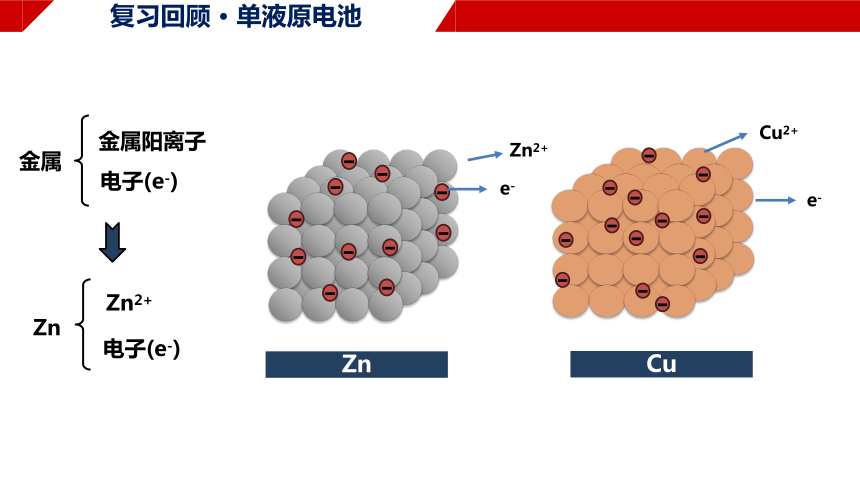
复习回顾 · 单液原电池
Zn
Zn2+
电子(e-)
金属
金属阳离子
电子(e-)
Zn2+
e-
Cu
Cu2+
e-
Zn
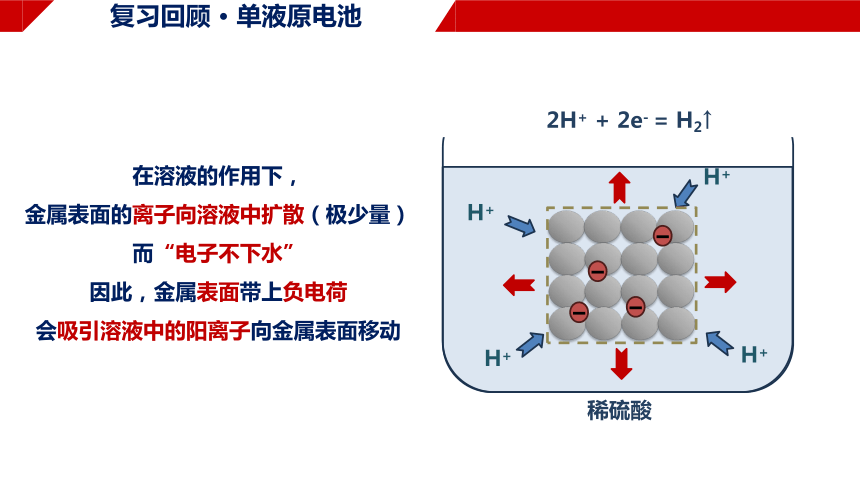
复习回顾 · 单液原电池
H+
H+
H+
H+
稀硫酸
2H+ + 2e- = H2↑
在溶液的作用下,
金属表面的离子向溶液中扩散(极少量)
而“电子不下水”
因此,金属表面带上负电荷
会吸引溶液中的阳离子向金属表面移动
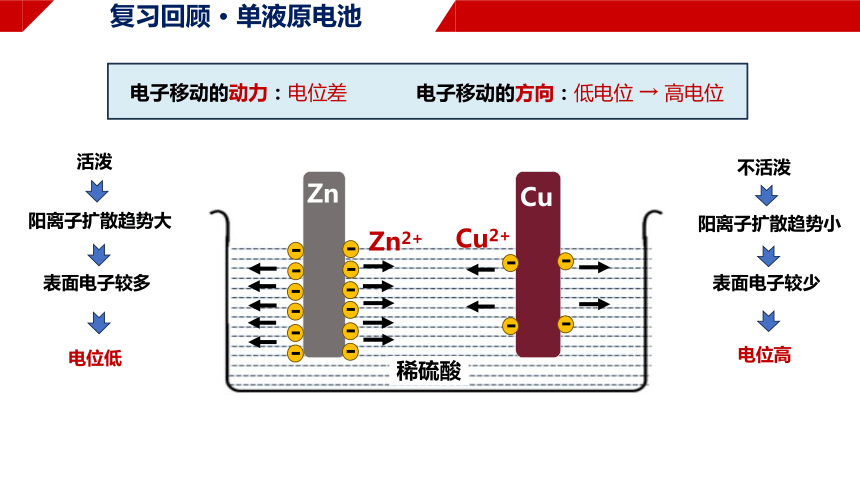
复习回顾 · 单液原电池
Zn
Cu
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
不活泼
电位高
表面电子较少
阳离子扩散趋势小
电子移动的动力:电位差
电子移动的方向:低电位 → 高电位
活泼
电位低
表面电子较多
阳离子扩散趋势大
Zn2+
Cu2+
稀硫酸
复习回顾 · 单液原电池
Zn
Cu
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
电子导体
负极
正极
e-
I
外电路
失去电子的一极
得到电子的一极
原电池中,活泼、易失电子的金属常做负极材料
低电位
高电位
稀硫酸
复习回顾 · 单液原电池
Zn
Cu
-
-
-
-
-
-
-
负极
正极
e-
-
-
-
-
H+
H+
SO42-
Zn2+
H2
内电路
阳离子向正极移动;阴离子向负极移动
【注意】
离子导体必须
为电解质溶液,
乙醇等非电解质
不能连通电路
2H+ + 2e- = H2↑
稀硫酸
离子导体
离子导体的作用:依靠阴阳离子向正负电极移动,来平衡两极电荷
原电池构成要素
负极
正极
电子导体
离子导体
失电子
氧化反应
得电子
还原反应
e-
阳离子向正极移动
阴离子向负极移动
总结
电流
氧化反应在负极发生(失电子)、还原反应在正极发生(得电子)
在电位差的影响下,电子沿电子导体从负极流向正极,产生电流
自发进行的氧化还原反应
外电路
内电路
复习回顾 · 单液原电池
复习回顾 · 单液原电池
【练1】某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
【练2】下列叙述中,正确的是( )
①原电池是把化学能转变成电能的一种装置
②原电池的正极发生氧化反应,负极发生还原反应
③不能自发进行的氧化还原反应通过原电池的装置可以实现
④碳棒能用来做原电池的正极
⑤反应Cu+2Ag+=Cu2++2Ag可以设计成原电池
A.①③⑤ B.①④⑤ C.②③④ D.②⑤
B
B
复习回顾 · 单液原电池
【练3】①、在以下原电池中标出正极、负极、电子方向、电流方向
②、写出正极反应式、负极反应式、电池总反应方程
③、预测一段时间后,锌片、铜片的质量变化
负:Zn – 2e- = Zn2+
正:Cu2+ + 2e- = Cu
总:Zn + Cu2+ = Zn2+ + Cu
原理 · 双液原电池
【“铜锌-硫酸铜”单液原电池 数字实验探究结果】
①、电流表指针偏转。
②、锌片和铜片上均有红色固体生成。
③、溶液温度升高。
④、一段时间后,电流会逐渐减小。
【实验现象】
原理 · 双液原电池
思考1
单液原电池存在哪些缺点?为什么会出现这些问题?
①、锌与CuSO4溶液直接接触,发生置换反应,导致部分化学能转为热能,
造成能量损耗。
②、工作时,锌片上也有铜析出,原电池的电动势很快降低,电压不稳定
思考2
如何避免以上问题?
将锌与CuSO4溶液分开放置,避免直接接触
原理 · 双液原电池
思考3
该装置能否成功发电?
不能发电,未构成闭合回路
若离子导体不连通,随着电子向正极移动
负极:Zn附近堆积大量Zn2+
正电荷浓度升高
正极:Cu附近堆积大量SO42-
负电荷浓度升高
离子导体无法通过离子移动平衡两极电荷,
电子移动速度极快,因此电位差瞬间消失
无法持续产生电流。
ZnSO4溶液
CuSO4溶液
A
负极
正极
-
-
-
Zn2+
SO42-
Zn2+
Zn2+
SO42-
Cu2+
-
-
-
e-
e-
Zn
Cu
原理 · 双液原电池
思考4
如何使该装置成功发电?
ZnSO4溶液
CuSO4溶液
A
负极
正极
SO42-
Zn2+
Cu2+
SO42-
e-
e-
核心思路:联通离子导体
K+
CI-
盐桥:装有含KCl饱和溶液的琼胶,
K+和Cl-可在其中自由移动。
原理 · 双液原电池
盐桥的作用
①、 联通内电路,形成闭合回路;
②、 平衡电荷,使溶液保持电中性,
使电流持续传导。
盐桥中的离子移动
“阳正阴负”
思考5
写出该原电池的正极反应式、负极反应式、电池总反应式
负:Zn – 2e- = Zn2+
正:Cu2+ + 2e- = Cu
总:Zn + Cu2+ = Zn2+ + Cu
原理 · 双液原电池
思考6
分析:以下原电池中各部分的作用是什么?
Cu片
Zn片
CuSO4溶液
ZnSO4溶液
盐桥
导线
电极材料
电极反应物 电极材料
电极反应物 离子导体
离子导体
离子导体
电子导体
注意:
①、电极材料的作用是为氧化、还原反应提供反应场所
②、电极材料不一定是电极反应物
③、电极材料、离子导体均有可能作为电极反应物
模块二
原电池原理的应用
重难点:设计原电池、区分电极材料与电极反应物
应用 · 双液原电池
根据原电池工作原理,将下列氧化还原反应设计成双液原电池
2Fe3+ + 2I- 2Fe2+ + I2
思考7
得2e-,化合价降低,发生还原反应
失2e-,化合价升高,发生氧化反应
第一步
找电极反应物
负极
(氧化反应)
2I- - 2e- = I2
正极
(还原反应)
2Fe3+ + 2e- = 2Fe2+
第二步
找电极材料/离子导体
负极电解液:KI
正极电解液:FeCl3
电极材料:均可用C棒
第三步
画出原电池图
双液电池
注意补加盐桥
应用 · 双液原电池
e-
e-
负极
正极
CI-
K+
2I- + 2e- I2
氧化反应
2Fe3+ + 2e- 2Fe2+
还原反应
2Fe3+ + 2I- 2Fe2+ + I2
应用 · 双液原电池
电池设计技巧总结
①、如何确定原电池的正负极反应式:
若负极反应中,失电子的物质为金属单质,则用该金属单质做负极;
若正极反应中,得电子后生成金属单质,则可用该金属单质做正极
例如:
Zn-Cu双液电池
若正负极反应物均为离子,也不生成金属单质,
则可用碳棒(石墨棒)、Pt棒等作为正负极材料
例如:
Fe3+ - I-双液电池
根据电池总反应,拆分对应的氧化反应(负极)、还原反应(正极)
②、如何确定电极材料:
应用 · 双液原电池
电池设计技巧总结
③、如何确定双液原电池的离子导体:
核心思路:离子导体不宜与电极材料反应
若正负极反应物均为离子:则用含有该离子的可溶电解质溶液作为离子导体
若电极反应物为金属单质(电极材料):则可用任意不与电极材料反应的电解质溶液作离子导体
④、如何检查原电池装置是否完整:
两极两导一盐桥,构成闭合回路
应用 · 双液原电池
【练习】利用反应Zn+2FeCl3 ══ ZnCl2+2FeCl2设计一个双液原电池。
注明正负极、写出电极反应、画出实验装置图,并注明电极材料。
Zn + 2e- = Zn2+
2Fe3+ + 2e- = 2Fe2+
负极
正极
应用 · 双液原电池
思考8
在双液原电池装置中,由于盐桥中离子的运动距离长、离子运动通道窄、离子容量小,产生的电流一般不大。请思考:如何使增大电流?
缩短盐桥的长度
增大盐桥的横截面积
用一张隔膜(离子交换膜)
代替盐桥
阳离子交换膜:只允许阳离子通过
阴离子交换膜:只允许阴离子通过
质 子 交 换 膜:只允许H+通过
【练习4】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是 ( )
C
A、铜电极上发生氧化反应
B、电池工作一段时间后,甲池的c (SO42-)减小
C、电池工作一段时间后,乙池溶液的总质量增加
D、阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
课堂练习
课堂练习
【练习5】正误判断。
(1)原电池是把化学能转化为电能的一种装置。 ( )
(2)原电池正极发生氧化反应,负极发生还原反应。 ( )
(3)不能自发进行的氧化还原反应,通过原电池装置可以实现。 ( )
(4)碳棒不能用来作原电池的电极。 ( )
(5)反应Cu+2Ag+═══2Ag+Cu2+能以原电池的形式来实现。 ( )
课堂练习
【练习6】有A、B、C、D四种金属。
将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀。
将A、D分别投入等浓度盐酸中,D比A反应剧烈。
将铜浸入B的盐溶液里,无明显变化。
如果把铜浸入C的盐溶液里,有金属C析出。
据此判断它们的活动性由强到弱的顺序是 ( )
B
A、 D > C > A > B
B、 D > A > B > C
C、 D > B > A > C
D、 B > A > D > C
第一节 原电池
第1课时 原电池工作原理
第四章 化学反应与电能
模块一
单液、双液原电池工作原理
重难点:理解原电池中电子移动的动力——电位差
复习回顾 · 单液原电池
锌片
铜片
稀硫酸
A
现象:
铜片表面产生气泡
电流表指针发生偏转
原电池
化学能
电能
原电池:将化学能转化为电能的装置
原电池原理要素:
自发进行的氧化还原反应
还原剂
氧化剂
电子
+定向移动 = 产生电流
复习回顾 · 单液原电池
Zn
Zn2+
电子(e-)
金属
金属阳离子
电子(e-)
Zn2+
e-
Cu
Cu2+
e-
Zn
复习回顾 · 单液原电池
H+
H+
H+
H+
稀硫酸
2H+ + 2e- = H2↑
在溶液的作用下,
金属表面的离子向溶液中扩散(极少量)
而“电子不下水”
因此,金属表面带上负电荷
会吸引溶液中的阳离子向金属表面移动
复习回顾 · 单液原电池
Zn
Cu
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
不活泼
电位高
表面电子较少
阳离子扩散趋势小
电子移动的动力:电位差
电子移动的方向:低电位 → 高电位
活泼
电位低
表面电子较多
阳离子扩散趋势大
Zn2+
Cu2+
稀硫酸
复习回顾 · 单液原电池
Zn
Cu
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
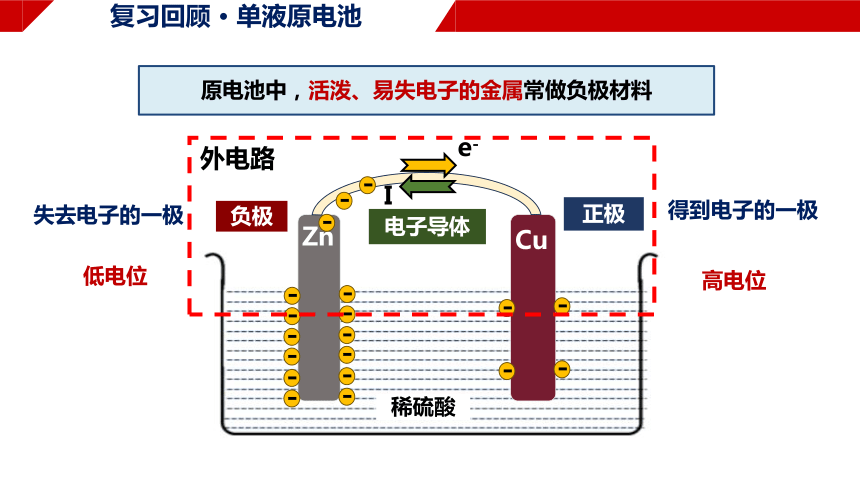
电子导体
负极
正极
e-
I
外电路
失去电子的一极
得到电子的一极
原电池中,活泼、易失电子的金属常做负极材料
低电位
高电位
稀硫酸
复习回顾 · 单液原电池
Zn
Cu
-
-
-
-
-
-
-
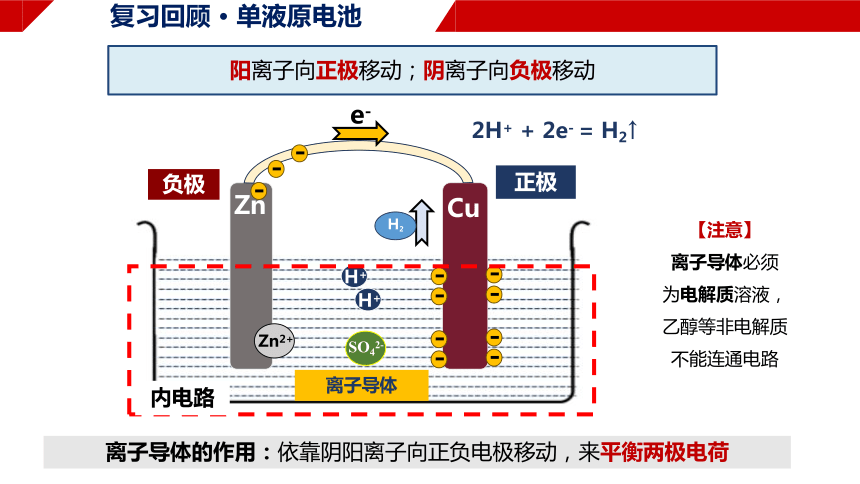
负极
正极
e-
-
-
-
-
H+
H+
SO42-
Zn2+
H2
内电路
阳离子向正极移动;阴离子向负极移动
【注意】
离子导体必须
为电解质溶液,
乙醇等非电解质
不能连通电路
2H+ + 2e- = H2↑
稀硫酸
离子导体
离子导体的作用:依靠阴阳离子向正负电极移动,来平衡两极电荷
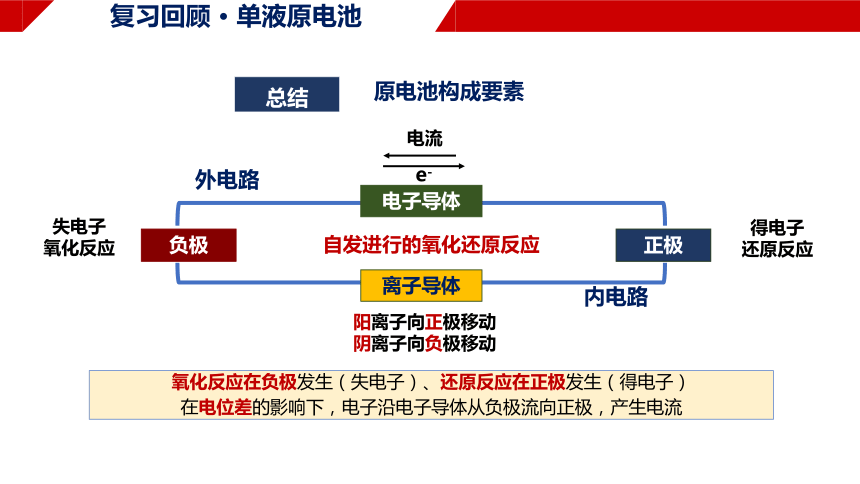
原电池构成要素
负极
正极
电子导体
离子导体
失电子
氧化反应
得电子
还原反应
e-
阳离子向正极移动
阴离子向负极移动
总结
电流
氧化反应在负极发生(失电子)、还原反应在正极发生(得电子)
在电位差的影响下,电子沿电子导体从负极流向正极,产生电流
自发进行的氧化还原反应
外电路
内电路
复习回顾 · 单液原电池
复习回顾 · 单液原电池
【练1】某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
【练2】下列叙述中,正确的是( )
①原电池是把化学能转变成电能的一种装置
②原电池的正极发生氧化反应,负极发生还原反应
③不能自发进行的氧化还原反应通过原电池的装置可以实现
④碳棒能用来做原电池的正极
⑤反应Cu+2Ag+=Cu2++2Ag可以设计成原电池
A.①③⑤ B.①④⑤ C.②③④ D.②⑤
B
B
复习回顾 · 单液原电池
【练3】①、在以下原电池中标出正极、负极、电子方向、电流方向
②、写出正极反应式、负极反应式、电池总反应方程
③、预测一段时间后,锌片、铜片的质量变化
负:Zn – 2e- = Zn2+
正:Cu2+ + 2e- = Cu
总:Zn + Cu2+ = Zn2+ + Cu
原理 · 双液原电池
【“铜锌-硫酸铜”单液原电池 数字实验探究结果】
①、电流表指针偏转。
②、锌片和铜片上均有红色固体生成。
③、溶液温度升高。
④、一段时间后,电流会逐渐减小。
【实验现象】
原理 · 双液原电池
思考1
单液原电池存在哪些缺点?为什么会出现这些问题?
①、锌与CuSO4溶液直接接触,发生置换反应,导致部分化学能转为热能,
造成能量损耗。
②、工作时,锌片上也有铜析出,原电池的电动势很快降低,电压不稳定
思考2
如何避免以上问题?
将锌与CuSO4溶液分开放置,避免直接接触
原理 · 双液原电池
思考3
该装置能否成功发电?
不能发电,未构成闭合回路
若离子导体不连通,随着电子向正极移动
负极:Zn附近堆积大量Zn2+
正电荷浓度升高
正极:Cu附近堆积大量SO42-
负电荷浓度升高
离子导体无法通过离子移动平衡两极电荷,
电子移动速度极快,因此电位差瞬间消失
无法持续产生电流。
ZnSO4溶液
CuSO4溶液
A
负极
正极
-
-
-
Zn2+
SO42-
Zn2+
Zn2+
SO42-
Cu2+
-
-
-
e-
e-
Zn
Cu
原理 · 双液原电池
思考4
如何使该装置成功发电?
ZnSO4溶液
CuSO4溶液
A
负极
正极
SO42-
Zn2+
Cu2+
SO42-
e-
e-
核心思路:联通离子导体
K+
CI-
盐桥:装有含KCl饱和溶液的琼胶,
K+和Cl-可在其中自由移动。
原理 · 双液原电池
盐桥的作用
①、 联通内电路,形成闭合回路;
②、 平衡电荷,使溶液保持电中性,
使电流持续传导。
盐桥中的离子移动
“阳正阴负”
思考5
写出该原电池的正极反应式、负极反应式、电池总反应式
负:Zn – 2e- = Zn2+
正:Cu2+ + 2e- = Cu
总:Zn + Cu2+ = Zn2+ + Cu
原理 · 双液原电池
思考6
分析:以下原电池中各部分的作用是什么?
Cu片
Zn片
CuSO4溶液
ZnSO4溶液
盐桥
导线
电极材料
电极反应物 电极材料
电极反应物 离子导体
离子导体
离子导体
电子导体
注意:
①、电极材料的作用是为氧化、还原反应提供反应场所
②、电极材料不一定是电极反应物
③、电极材料、离子导体均有可能作为电极反应物
模块二
原电池原理的应用
重难点:设计原电池、区分电极材料与电极反应物
应用 · 双液原电池
根据原电池工作原理,将下列氧化还原反应设计成双液原电池
2Fe3+ + 2I- 2Fe2+ + I2
思考7
得2e-,化合价降低,发生还原反应
失2e-,化合价升高,发生氧化反应
第一步
找电极反应物
负极
(氧化反应)
2I- - 2e- = I2
正极
(还原反应)
2Fe3+ + 2e- = 2Fe2+
第二步
找电极材料/离子导体
负极电解液:KI
正极电解液:FeCl3
电极材料:均可用C棒
第三步
画出原电池图
双液电池
注意补加盐桥
应用 · 双液原电池
e-
e-
负极
正极
CI-
K+
2I- + 2e- I2
氧化反应
2Fe3+ + 2e- 2Fe2+
还原反应
2Fe3+ + 2I- 2Fe2+ + I2
应用 · 双液原电池
电池设计技巧总结
①、如何确定原电池的正负极反应式:
若负极反应中,失电子的物质为金属单质,则用该金属单质做负极;
若正极反应中,得电子后生成金属单质,则可用该金属单质做正极
例如:
Zn-Cu双液电池
若正负极反应物均为离子,也不生成金属单质,
则可用碳棒(石墨棒)、Pt棒等作为正负极材料
例如:
Fe3+ - I-双液电池
根据电池总反应,拆分对应的氧化反应(负极)、还原反应(正极)
②、如何确定电极材料:
应用 · 双液原电池
电池设计技巧总结
③、如何确定双液原电池的离子导体:
核心思路:离子导体不宜与电极材料反应
若正负极反应物均为离子:则用含有该离子的可溶电解质溶液作为离子导体
若电极反应物为金属单质(电极材料):则可用任意不与电极材料反应的电解质溶液作离子导体
④、如何检查原电池装置是否完整:
两极两导一盐桥,构成闭合回路
应用 · 双液原电池
【练习】利用反应Zn+2FeCl3 ══ ZnCl2+2FeCl2设计一个双液原电池。
注明正负极、写出电极反应、画出实验装置图,并注明电极材料。
Zn + 2e- = Zn2+
2Fe3+ + 2e- = 2Fe2+
负极
正极
应用 · 双液原电池
思考8
在双液原电池装置中,由于盐桥中离子的运动距离长、离子运动通道窄、离子容量小,产生的电流一般不大。请思考:如何使增大电流?
缩短盐桥的长度
增大盐桥的横截面积
用一张隔膜(离子交换膜)
代替盐桥
阳离子交换膜:只允许阳离子通过
阴离子交换膜:只允许阴离子通过
质 子 交 换 膜:只允许H+通过
【练习4】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是 ( )
C
A、铜电极上发生氧化反应
B、电池工作一段时间后,甲池的c (SO42-)减小
C、电池工作一段时间后,乙池溶液的总质量增加
D、阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
课堂练习
课堂练习
【练习5】正误判断。
(1)原电池是把化学能转化为电能的一种装置。 ( )
(2)原电池正极发生氧化反应,负极发生还原反应。 ( )
(3)不能自发进行的氧化还原反应,通过原电池装置可以实现。 ( )
(4)碳棒不能用来作原电池的电极。 ( )
(5)反应Cu+2Ag+═══2Ag+Cu2+能以原电池的形式来实现。 ( )
课堂练习
【练习6】有A、B、C、D四种金属。
将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀。
将A、D分别投入等浓度盐酸中,D比A反应剧烈。
将铜浸入B的盐溶液里,无明显变化。
如果把铜浸入C的盐溶液里,有金属C析出。
据此判断它们的活动性由强到弱的顺序是 ( )
B
A、 D > C > A > B
B、 D > A > B > C
C、 D > B > A > C
D、 B > A > D > C
