第一节 原子结构(1-4课时综合) 课件 (共43张PPT) 人教版(2019) >选择性必修2
文档属性
| 名称 | 第一节 原子结构(1-4课时综合) 课件 (共43张PPT) 人教版(2019) >选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 11:09:54 | ||
图片预览







文档简介
(共43张PPT)
第一节 原子结构
第1课时 原子结构(基本概念)
第一章 原子结构与性质
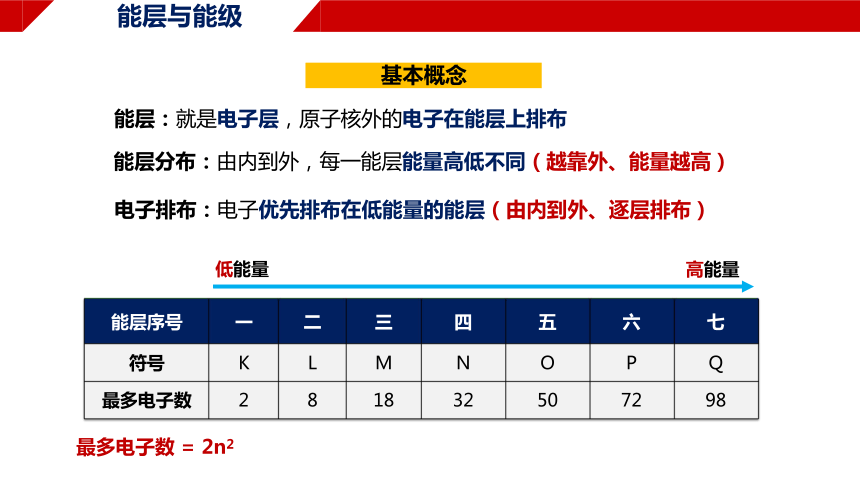
能层与能级
能层序号 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
能层:就是电子层,原子核外的电子在能层上排布
基本概念
能层分布:由内到外,每一能层能量高低不同(越靠外、能量越高)
电子排布:电子优先排布在低能量的能层(由内到外、逐层排布)
最多电子数 = 2n2
低能量
高能量
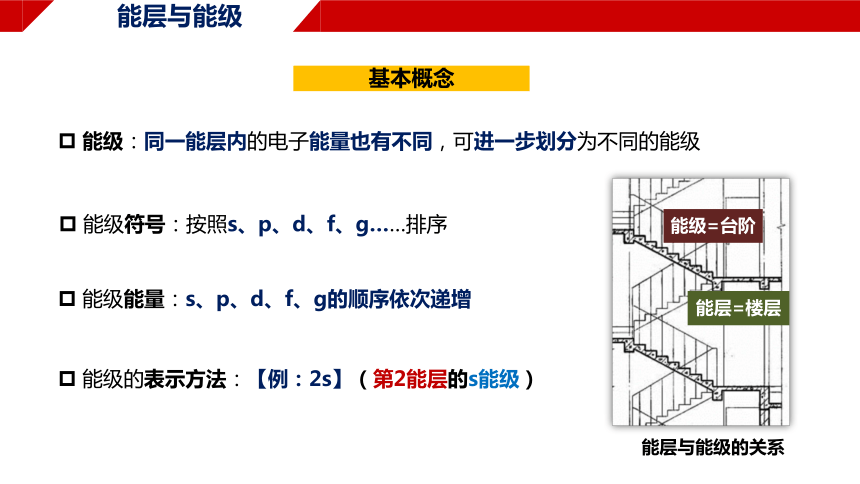
能层与能级
能级:同一能层内的电子能量也有不同,可进一步划分为不同的能级
基本概念
能级符号:按照s、p、d、f、g……排序
能层与能级的关系
能层=楼层
能级=台阶
能级能量:s、p、d、f、g的顺序依次递增
能级的表示方法:【例:2s】(第2能层的s能级)
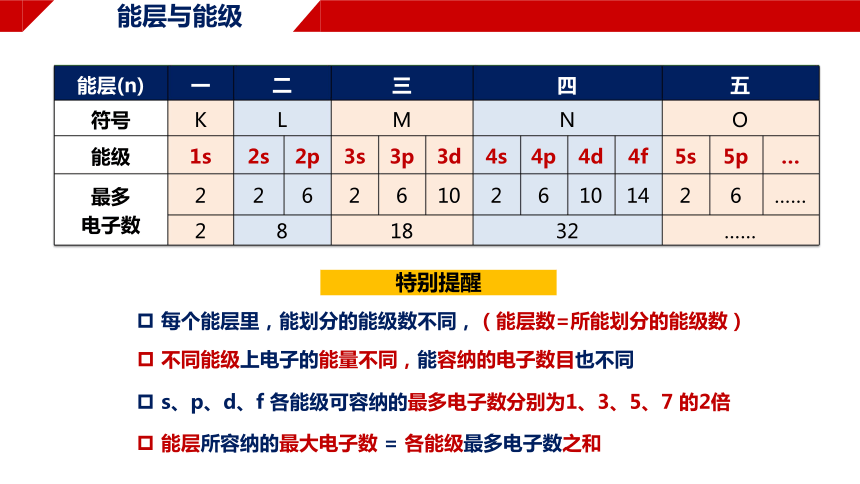
能层与能级
特别提醒
能层(n) 一 二 三 四 五
符号 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多 电子数 2 2 6 2 6 10 2 6 10 14 2 6 ……
2 8 18 32 ……
每个能层里,能划分的能级数不同,(能层数=所能划分的能级数)
s、p、d、f 各能级可容纳的最多电子数分别为1、3、5、7 的2倍
不同能级上电子的能量不同,能容纳的电子数目也不同
能层所容纳的最大电子数 = 各能级最多电子数之和
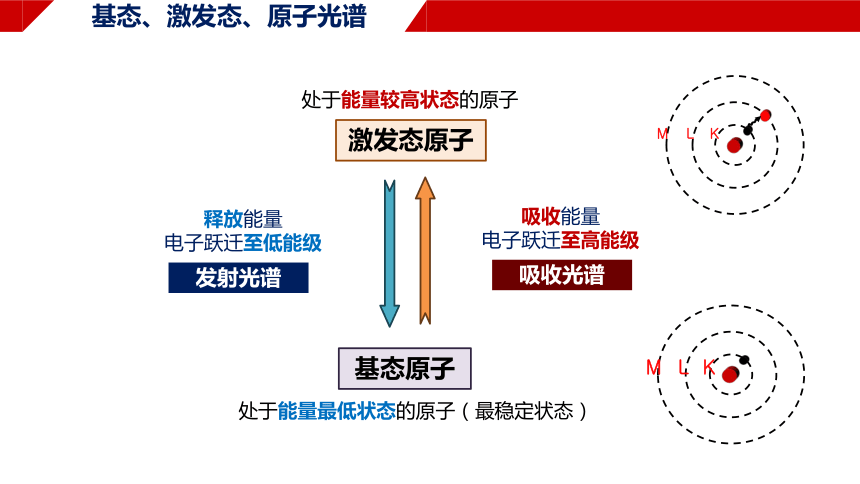
基态、激发态、原子光谱
基态原子
处于能量最低状态的原子(最稳定状态)
激发态原子
处于能量较高状态的原子
吸收能量
电子跃迁至高能级
释放能量
电子跃迁至低能级
K
L
M
K
L
M
发射光谱
吸收光谱
基态、激发态、原子光谱
焰火
霓虹灯光
激光
荧光
LED灯光
生活中与电子跃迁有关的现象
光是电子跃迁释放能量的重要形式之一
基态、激发态、原子光谱
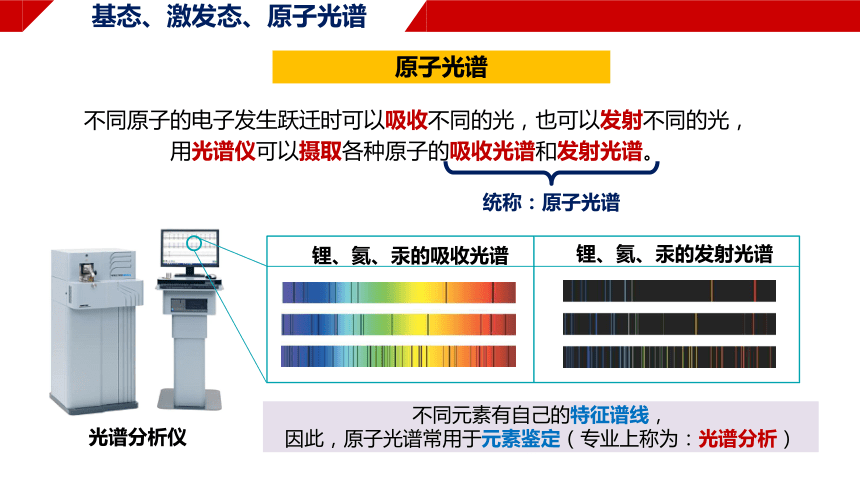
光谱分析仪
不同原子的电子发生跃迁时可以吸收不同的光,也可以发射不同的光,
用光谱仪可以摄取各种原子的吸收光谱和发射光谱。
锂、氦、汞的发射光谱
锂、氦、汞的吸收光谱
原子光谱
统称:原子光谱
不同元素有自己的特征谱线,
因此,原子光谱常用于元素鉴定(专业上称为:光谱分析)
课堂练习
【例1】、若以E表示某能级的能量,下列能量大小顺序中正确的是
A.E(3s)>E(2s)>E(1s)
B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(4d)
D.E(5s)>E(4s)>E(5f)
A
【例2】、以下能级符号正确的是
① 6s ② 2d ③ 3f ④ 7p
A.①② B.②③ C.③④ D.①④
D
课堂练习
【例3】、下列关于能层和能级的说法正确的是
A.原子核外每能层最多可容纳的电子数为n2
B.能层序数较大的能级,能量不一定较高
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能容纳的电子数逐渐增多
课堂练习
B
第一节 原子结构
第2课时 构造原理与电子排布式
第一章 原子结构与性质
构造原理
①、构造原理(核外电子填充规律)
以光谱学事实为基础,
从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理
连线方向即为电子填入顺序
注意:存在能级交错现象
3d>4s ;4d>5p
能层序数大,但能级的能量不一定高
构造原理
①、构造原理(核外电子填充规律)
1s - 2s - 2p - 3s - 3p - 4s - 3d - 4p - 5s - 4d - 5p - 6s
电子填充规律:电子填满较低能级后再填入下一能级,直至核外电子全部填充
能级顺序:
特别注意:由于能级交错现象,电子并不总是填满一个能层后
再开始填入下一个能层的。(例如K的核外电子排布)
局限性:作为一个理论模型,构造原理具有一定的局限性。
对于个别特殊的过渡元素核外电子的排布并不适用。
电子排布式
②、电子排布式
用能级、各能级上的电子数来表示,并按照能层从左到右的顺序排列的式子
6
C
碳
14.01
1s2 2s2 2p2
适用范围:基态原子、简单离子
电子排布式
【例1】:根据构造原理,试比较下列能级的能量高低(填“>”或“<”)。
①4s____3d;②6s____4f____5d。
【例2】:根据构造原理,写出下列基态原子的核外电子排布式
① 8O:_______________;
②14Si:______________________;
③19K:_________________________;
④21Sc:____________________________;
⑤26Fe:_________________________。
<
< <
1s22s22p4
1s22s22p63s23p2
1s22s22p63s23p64s1
1s22s22p63s23p63d14s2
1s22s22p63s23p63d64s2
注意
Cr、Cu特殊
Cr:
1s22s22p63s23p63d54s1
Cu:
1s22s22p63s23p63d104s1
电子排布式
【例3】:根据构造原理,写出下列离子的核外电子排布式
①O2-:_______________;
②Cl-:______________________;
③K+:_________________________;
④Fe3+:____________________________;
⑤Fe2+:_________________________。
1s22s22p6
1s22s22p63s23p6
1s22s22p63s23p6
1s22s22p63s23p63d5
1s22s22p63s23p63d6
电子排布式
③、简化电子排布式
写法:稀有气体(前一层)+ 外层电子
电子排布式:1s22s22p6 3s1
Na:
简化电子排布式:[Ne] 3s1
Ne
原子实
价层电子
(决定元素化学性质)
电子排布式
【例4】:根据构造原理试写出下列基态原子的电子排布式和简化电子排布式
①24Cr:
___________________________________,__________________。
②29Cu:
____________________________________,___________________。
③33As:
______________________________________,_____________________。
④35Br:
______________________________________,______________________。
1s22s22p63s23p63d54s1 [Ar]3d54s1
1s22s22p63s23p63d104s1 [Ar]3d104s1
1s22s22p63s23p63d104s24p3 [Ar]3d104s24p3
1s22s22p63s23p63d104s24p5 [Ar]3d104s24p5
电子排布式
④、价层电子排布式
写法:只写价层电子
Na:
价层电子排布式:3s1
【例5】:写出下列基态原子的价层电子排布式
Al:___________
Ge:___________
Se: ___________
3s23p1
4s24p2
4s24p4
规律总结
①、主族、零族元素:价层电子 = 最外层电子。
②、副族和第VIII族元素:价层电子 = 最外层电子 + (可能包括次外层)
Cr: ___________
3d54s1
电子排布式
总结:电子排布式的各种写法
电子排布式:1s22s22p6 3s1
Na:
简化电子排布式:[Ne] 3s1
价层电子排布式:3s1
按构造原理排布所有电子;
特殊:Cr、Cu
[稀有气体]价层电子
注意:价层电子不一定是最外层电子
课堂练习
【练习1】下 列电子排布式中,原子处于激发状态的是
A.1s22s22p5
B.1s22s22p43s2
C.1s22s22p63s23p63d54s2
D.1s22s22p63s23p63d34s2
B
第一节 原子结构
第3课时 电子云与原子轨道
第一章 原子结构与性质
电子云与原子轨道
玻尔模型
【认为电子在线性轨道上绕行】
电子云模型
【电子在各处均可出现,但概率不同】
量子力学
推翻了玻尔模型
电子云与原子轨道
原子轨道:电子在原子核外的一个空间运动状态
基本概念
电子云:处于一定空间运动状态的电子
在原子核外空间的概率密度分布的形象化描述
电子云的含义:
用黑点的疏密表示电子在原子核外出现概率大小(黑点越密、概率越大)
黑点仅表示电子出现的概率,并不代表实际的电子
电子云的形状:
不同能级(s、p、d、f……)拥有的原子轨道数不同,电子云形状也不同
电子云与原子轨道
电子云轮廓绘制
氢原子1s电子的概率密度分布图
小点是1s电子
在原子核外出现的
概率密度的形象描述
将出现概率90%的空间圈出来
电子云与原子轨道
1s
2s
3s
4s
同一原子的 s电子 的电子云轮廓图
1. s 能级只有1个原子轨道,形状为球形
s能级 — 1个轨道 — 球形
2. 不同能层的s电子云形状一致
3. 能层越高,s电子的电子云半径越大。
同一原子的 p电子 的电子云轮廓图
电子云与原子轨道
p能级有3个原子轨道,在直角坐标系中的延申方向不同
p电子云形状为:哑铃形
p能级 — 3个轨道 — 哑铃形
电子云与原子轨道
同一原子的 d电子 的电子云轮廓图
d能级 — 5个轨道 — 花瓣形
电子云与原子轨道
能级符号 ns np nd nf
轨道数目
每个轨道容纳电子数
该能级可容纳电子数
1
3
5
7
2
2
2
2
2
6
10
14
“能级-轨道-电子数“的关系
s、p、d、f 能级的轨道数为1、3、5、7 ; 每个轨道容纳2个电子
各能级所能容纳的最大电子数 = 1、3、5、7的倍数
电子云与原子轨道
能层 能级 原子 轨道数 原子 轨道符号 电子云轮廓图
形状 取向
K 1s
L 2s
2p
M 3s
3p
3d
在第几层
就有几个能级
s:1个轨道
p:3个轨道
d:5个轨道
s:球形
p:哑铃形
d:花瓣形
1
1
3
1
3
5
1s
2s
2px、2py、2pz
3s
3px、3py、3pz
——
球形
球形
哑铃形
球形
哑铃形
花瓣形
——
——
相互垂直
——
相互垂直
——
【练习1】、下列说法正确的是( )
A.p电子云是平面“8”字形的
B.3p2表示3p能级中有两个原子轨道
C.2d能级包含5个原子轨道,最多容纳10个电子
D.处于最低能量的原子叫基态原子
D
课堂练习
【练习2】、基态Si原子中,电子占据的最高能层符号为____________,
该能层具有的原子轨道数为_______、电子数为_______。
M
9
4
【练习3】、图1和图2分别是1s电子的概率密度分布图和电子云轮廓图。下列有关说法正确的是
A.图1中的每个小黑点都表示1个电子
B.图1中的小黑点表示电子在核外所处的位置
C.图2表明1s轨道呈球形,有无数对称轴
D.图2表示1s电子只能在球体内出现
C
课堂练习
【练习4】、下列说法中,正确的是
A.1s电子云轮廓图呈球形,处在该轨道上的电子只能在球壳内运动
B.电子云轮廓图中的小黑点密度大,说明该原子核外空间电子数目多
C.ns能级的原子轨道的电子云轮廓图如图所示
D.3d6表示3d能级有6个原子轨道
C
课堂练习
第一节 原子结构
第4课时 泡利原理与洪特规则
第一章 原子结构与性质
泡利原理
①、泡利原理
在一个原子轨道里最多容纳2个电子,且它们的自旋方向相反
自旋:电子除了绕核的空间运动状态外,还存在一种运动状态叫自旋
方向:自旋分为“顺时针”、“逆时针”两种取向
表达:可以用方向相反的两个箭头( “↑”“↓” )表示自旋相反的两电子
例如:He
电子排布式:1s2
电子排布图:
↑↓
1s
洪特规则
②、洪特规则
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行
简并轨道:能量相同的轨道
(例如:p能级有3个轨道—Px、Py、Pz,这三个轨道能量相同,为简并轨道)
自旋平行:自旋方向相同( “↑” “↑” )
洪特规则
②、洪特规则
例如:C
电子排布式:1s22s22p2
电子排布图:
↑↓
1s
↑
2p
↑
↑↓
2s
简并轨道
满足泡利原理
不符合洪特规则
的错误填法:
正确填法:
“先同向铺满,再反向补全”
洪特规则
③、能量最低原理
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,
使整个原子的能量最低。
洪特规则的例外:在简并轨道上的电子排布处于全充满、半满和全空状态时,
具有较低的能量和较大的稳定性。(符合能量最低原理)
Cu:
1s22s22p63s23p63d104s1
Cr:
1s22s22p63s23p63d54s1
电子排布的表示方法
④、电子排布的轨道表示式(电子排布图)
书写规则:
(1)、用方框表示原子轨道,在方框的下方用能级符号表示轨道所属能级
(2)、每个方框(轨道)中最多容纳两个电子
(3)、每个轨道中容纳的两个电子“自旋方向”必须相反,用2个方向相反的箭头表
(泡利原理)
(4)、p、d等多轨道的能级存在简并轨道,电子排布时“先同向铺满,再反向补全”(洪特规则)
电子排布的表示方法
【例2】书写Cr原子(基态)的电子排布式,并画出电子排布图/轨道表示式
电子排布式:1s22s22p4
电子排布图:
↑↓
1s
2p
↑↓
2s
↑
↑
↑↓
【例1】书写O原子(基态)的电子排布式,并画出电子排布图/轨道表示式
电子排布式:
1s22s22p63s23p63d54s1
电子排布图:
2s
3p
3s
↑↓
1s
2p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
↑
3d
↑
4s
电子排布的表示方法
【练习1】书写Cl原子、Mn原子、Cu原子、Fe2+的电子排布式,
并画出电子排布图/轨道表示式
Mn原子:
有_______个能层、有_________个能级、有_________个轨道;
有_______个电子对、有_________个单电子、
4
7
15
10
5
有_________种 空间运动状态、有_________种 运动状态;
15
25
= 轨道数
= 电子数
课堂练习
【练习1】若将基态6C的电子排布式写成ls22s22p2x,它违背了
A.能量守恒原理 B.泡利原理
C.能量最低原理 D.洪特规则
D
【练习2】下列基态原子的电子排布图中,违反了泡利原理的是
A. B.
C. D.
B
【练习3】在d轨道中电子排布成 ,
而不排布成 ,最直接的根据是
A.能量最低原理 B.泡利不相容原理
C.杂化轨道理论 D.洪特规则
D
课堂练习
第一节 原子结构
第1课时 原子结构(基本概念)
第一章 原子结构与性质
能层与能级
能层序号 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
能层:就是电子层,原子核外的电子在能层上排布
基本概念
能层分布:由内到外,每一能层能量高低不同(越靠外、能量越高)
电子排布:电子优先排布在低能量的能层(由内到外、逐层排布)
最多电子数 = 2n2
低能量
高能量
能层与能级
能级:同一能层内的电子能量也有不同,可进一步划分为不同的能级
基本概念
能级符号:按照s、p、d、f、g……排序
能层与能级的关系
能层=楼层
能级=台阶
能级能量:s、p、d、f、g的顺序依次递增
能级的表示方法:【例:2s】(第2能层的s能级)
能层与能级
特别提醒
能层(n) 一 二 三 四 五
符号 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多 电子数 2 2 6 2 6 10 2 6 10 14 2 6 ……
2 8 18 32 ……
每个能层里,能划分的能级数不同,(能层数=所能划分的能级数)
s、p、d、f 各能级可容纳的最多电子数分别为1、3、5、7 的2倍
不同能级上电子的能量不同,能容纳的电子数目也不同
能层所容纳的最大电子数 = 各能级最多电子数之和
基态、激发态、原子光谱
基态原子
处于能量最低状态的原子(最稳定状态)
激发态原子
处于能量较高状态的原子
吸收能量
电子跃迁至高能级
释放能量
电子跃迁至低能级
K
L
M
K
L
M
发射光谱
吸收光谱
基态、激发态、原子光谱
焰火
霓虹灯光
激光
荧光
LED灯光
生活中与电子跃迁有关的现象
光是电子跃迁释放能量的重要形式之一
基态、激发态、原子光谱
光谱分析仪
不同原子的电子发生跃迁时可以吸收不同的光,也可以发射不同的光,
用光谱仪可以摄取各种原子的吸收光谱和发射光谱。
锂、氦、汞的发射光谱
锂、氦、汞的吸收光谱
原子光谱
统称:原子光谱
不同元素有自己的特征谱线,
因此,原子光谱常用于元素鉴定(专业上称为:光谱分析)
课堂练习
【例1】、若以E表示某能级的能量,下列能量大小顺序中正确的是
A.E(3s)>E(2s)>E(1s)
B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(4d)
D.E(5s)>E(4s)>E(5f)
A
【例2】、以下能级符号正确的是
① 6s ② 2d ③ 3f ④ 7p
A.①② B.②③ C.③④ D.①④
D
课堂练习
【例3】、下列关于能层和能级的说法正确的是
A.原子核外每能层最多可容纳的电子数为n2
B.能层序数较大的能级,能量不一定较高
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能容纳的电子数逐渐增多
课堂练习
B
第一节 原子结构
第2课时 构造原理与电子排布式
第一章 原子结构与性质
构造原理
①、构造原理(核外电子填充规律)
以光谱学事实为基础,
从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理
连线方向即为电子填入顺序
注意:存在能级交错现象
3d>4s ;4d>5p
能层序数大,但能级的能量不一定高
构造原理
①、构造原理(核外电子填充规律)
1s - 2s - 2p - 3s - 3p - 4s - 3d - 4p - 5s - 4d - 5p - 6s
电子填充规律:电子填满较低能级后再填入下一能级,直至核外电子全部填充
能级顺序:
特别注意:由于能级交错现象,电子并不总是填满一个能层后
再开始填入下一个能层的。(例如K的核外电子排布)
局限性:作为一个理论模型,构造原理具有一定的局限性。
对于个别特殊的过渡元素核外电子的排布并不适用。
电子排布式
②、电子排布式
用能级、各能级上的电子数来表示,并按照能层从左到右的顺序排列的式子
6
C
碳
14.01
1s2 2s2 2p2
适用范围:基态原子、简单离子
电子排布式
【例1】:根据构造原理,试比较下列能级的能量高低(填“>”或“<”)。
①4s____3d;②6s____4f____5d。
【例2】:根据构造原理,写出下列基态原子的核外电子排布式
① 8O:_______________;
②14Si:______________________;
③19K:_________________________;
④21Sc:____________________________;
⑤26Fe:_________________________。
<
< <
1s22s22p4
1s22s22p63s23p2
1s22s22p63s23p64s1
1s22s22p63s23p63d14s2
1s22s22p63s23p63d64s2
注意
Cr、Cu特殊
Cr:
1s22s22p63s23p63d54s1
Cu:
1s22s22p63s23p63d104s1
电子排布式
【例3】:根据构造原理,写出下列离子的核外电子排布式
①O2-:_______________;
②Cl-:______________________;
③K+:_________________________;
④Fe3+:____________________________;
⑤Fe2+:_________________________。
1s22s22p6
1s22s22p63s23p6
1s22s22p63s23p6
1s22s22p63s23p63d5
1s22s22p63s23p63d6
电子排布式
③、简化电子排布式
写法:稀有气体(前一层)+ 外层电子
电子排布式:1s22s22p6 3s1
Na:
简化电子排布式:[Ne] 3s1
Ne
原子实
价层电子
(决定元素化学性质)
电子排布式
【例4】:根据构造原理试写出下列基态原子的电子排布式和简化电子排布式
①24Cr:
___________________________________,__________________。
②29Cu:
____________________________________,___________________。
③33As:
______________________________________,_____________________。
④35Br:
______________________________________,______________________。
1s22s22p63s23p63d54s1 [Ar]3d54s1
1s22s22p63s23p63d104s1 [Ar]3d104s1
1s22s22p63s23p63d104s24p3 [Ar]3d104s24p3
1s22s22p63s23p63d104s24p5 [Ar]3d104s24p5
电子排布式
④、价层电子排布式
写法:只写价层电子
Na:
价层电子排布式:3s1
【例5】:写出下列基态原子的价层电子排布式
Al:___________
Ge:___________
Se: ___________
3s23p1
4s24p2
4s24p4
规律总结
①、主族、零族元素:价层电子 = 最外层电子。
②、副族和第VIII族元素:价层电子 = 最外层电子 + (可能包括次外层)
Cr: ___________
3d54s1
电子排布式
总结:电子排布式的各种写法
电子排布式:1s22s22p6 3s1
Na:
简化电子排布式:[Ne] 3s1
价层电子排布式:3s1
按构造原理排布所有电子;
特殊:Cr、Cu
[稀有气体]价层电子
注意:价层电子不一定是最外层电子
课堂练习
【练习1】下 列电子排布式中,原子处于激发状态的是
A.1s22s22p5
B.1s22s22p43s2
C.1s22s22p63s23p63d54s2
D.1s22s22p63s23p63d34s2
B
第一节 原子结构
第3课时 电子云与原子轨道
第一章 原子结构与性质
电子云与原子轨道
玻尔模型
【认为电子在线性轨道上绕行】
电子云模型
【电子在各处均可出现,但概率不同】
量子力学
推翻了玻尔模型
电子云与原子轨道
原子轨道:电子在原子核外的一个空间运动状态
基本概念
电子云:处于一定空间运动状态的电子
在原子核外空间的概率密度分布的形象化描述
电子云的含义:
用黑点的疏密表示电子在原子核外出现概率大小(黑点越密、概率越大)
黑点仅表示电子出现的概率,并不代表实际的电子
电子云的形状:
不同能级(s、p、d、f……)拥有的原子轨道数不同,电子云形状也不同
电子云与原子轨道
电子云轮廓绘制
氢原子1s电子的概率密度分布图
小点是1s电子
在原子核外出现的
概率密度的形象描述
将出现概率90%的空间圈出来
电子云与原子轨道
1s
2s
3s
4s
同一原子的 s电子 的电子云轮廓图
1. s 能级只有1个原子轨道,形状为球形
s能级 — 1个轨道 — 球形
2. 不同能层的s电子云形状一致
3. 能层越高,s电子的电子云半径越大。
同一原子的 p电子 的电子云轮廓图
电子云与原子轨道
p能级有3个原子轨道,在直角坐标系中的延申方向不同
p电子云形状为:哑铃形
p能级 — 3个轨道 — 哑铃形
电子云与原子轨道
同一原子的 d电子 的电子云轮廓图
d能级 — 5个轨道 — 花瓣形
电子云与原子轨道
能级符号 ns np nd nf
轨道数目
每个轨道容纳电子数
该能级可容纳电子数
1
3
5
7
2
2
2
2
2
6
10
14
“能级-轨道-电子数“的关系
s、p、d、f 能级的轨道数为1、3、5、7 ; 每个轨道容纳2个电子
各能级所能容纳的最大电子数 = 1、3、5、7的倍数
电子云与原子轨道
能层 能级 原子 轨道数 原子 轨道符号 电子云轮廓图
形状 取向
K 1s
L 2s
2p
M 3s
3p
3d
在第几层
就有几个能级
s:1个轨道
p:3个轨道
d:5个轨道
s:球形
p:哑铃形
d:花瓣形
1
1
3
1
3
5
1s
2s
2px、2py、2pz
3s
3px、3py、3pz
——
球形
球形
哑铃形
球形
哑铃形
花瓣形
——
——
相互垂直
——
相互垂直
——
【练习1】、下列说法正确的是( )
A.p电子云是平面“8”字形的
B.3p2表示3p能级中有两个原子轨道
C.2d能级包含5个原子轨道,最多容纳10个电子
D.处于最低能量的原子叫基态原子
D
课堂练习
【练习2】、基态Si原子中,电子占据的最高能层符号为____________,
该能层具有的原子轨道数为_______、电子数为_______。
M
9
4
【练习3】、图1和图2分别是1s电子的概率密度分布图和电子云轮廓图。下列有关说法正确的是
A.图1中的每个小黑点都表示1个电子
B.图1中的小黑点表示电子在核外所处的位置
C.图2表明1s轨道呈球形,有无数对称轴
D.图2表示1s电子只能在球体内出现
C
课堂练习
【练习4】、下列说法中,正确的是
A.1s电子云轮廓图呈球形,处在该轨道上的电子只能在球壳内运动
B.电子云轮廓图中的小黑点密度大,说明该原子核外空间电子数目多
C.ns能级的原子轨道的电子云轮廓图如图所示
D.3d6表示3d能级有6个原子轨道
C
课堂练习
第一节 原子结构
第4课时 泡利原理与洪特规则
第一章 原子结构与性质
泡利原理
①、泡利原理
在一个原子轨道里最多容纳2个电子,且它们的自旋方向相反
自旋:电子除了绕核的空间运动状态外,还存在一种运动状态叫自旋
方向:自旋分为“顺时针”、“逆时针”两种取向
表达:可以用方向相反的两个箭头( “↑”“↓” )表示自旋相反的两电子
例如:He
电子排布式:1s2
电子排布图:
↑↓
1s
洪特规则
②、洪特规则
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行
简并轨道:能量相同的轨道
(例如:p能级有3个轨道—Px、Py、Pz,这三个轨道能量相同,为简并轨道)
自旋平行:自旋方向相同( “↑” “↑” )
洪特规则
②、洪特规则
例如:C
电子排布式:1s22s22p2
电子排布图:
↑↓
1s
↑
2p
↑
↑↓
2s
简并轨道
满足泡利原理
不符合洪特规则
的错误填法:
正确填法:
“先同向铺满,再反向补全”
洪特规则
③、能量最低原理
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,
使整个原子的能量最低。
洪特规则的例外:在简并轨道上的电子排布处于全充满、半满和全空状态时,
具有较低的能量和较大的稳定性。(符合能量最低原理)
Cu:
1s22s22p63s23p63d104s1
Cr:
1s22s22p63s23p63d54s1
电子排布的表示方法
④、电子排布的轨道表示式(电子排布图)
书写规则:
(1)、用方框表示原子轨道,在方框的下方用能级符号表示轨道所属能级
(2)、每个方框(轨道)中最多容纳两个电子
(3)、每个轨道中容纳的两个电子“自旋方向”必须相反,用2个方向相反的箭头表
(泡利原理)
(4)、p、d等多轨道的能级存在简并轨道,电子排布时“先同向铺满,再反向补全”(洪特规则)
电子排布的表示方法
【例2】书写Cr原子(基态)的电子排布式,并画出电子排布图/轨道表示式
电子排布式:1s22s22p4
电子排布图:
↑↓
1s
2p
↑↓
2s
↑
↑
↑↓
【例1】书写O原子(基态)的电子排布式,并画出电子排布图/轨道表示式
电子排布式:
1s22s22p63s23p63d54s1
电子排布图:
2s
3p
3s
↑↓
1s
2p
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
↑
3d
↑
4s
电子排布的表示方法
【练习1】书写Cl原子、Mn原子、Cu原子、Fe2+的电子排布式,
并画出电子排布图/轨道表示式
Mn原子:
有_______个能层、有_________个能级、有_________个轨道;
有_______个电子对、有_________个单电子、
4
7
15
10
5
有_________种 空间运动状态、有_________种 运动状态;
15
25
= 轨道数
= 电子数
课堂练习
【练习1】若将基态6C的电子排布式写成ls22s22p2x,它违背了
A.能量守恒原理 B.泡利原理
C.能量最低原理 D.洪特规则
D
【练习2】下列基态原子的电子排布图中,违反了泡利原理的是
A. B.
C. D.
B
【练习3】在d轨道中电子排布成 ,
而不排布成 ,最直接的根据是
A.能量最低原理 B.泡利不相容原理
C.杂化轨道理论 D.洪特规则
D
课堂练习
