3.4.1难溶电解质的沉淀溶解平衡 课件 (共20张PPT) 人教版(2019) 选择性必修1
文档属性
| 名称 | 3.4.1难溶电解质的沉淀溶解平衡 课件 (共20张PPT) 人教版(2019) 选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 64.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 00:00:00 | ||
图片预览






文档简介
(共20张PPT)
第四节 难溶电解质的沉淀溶解平衡
第1课时 沉淀溶解平衡与溶度积
第三章 水溶液中的离子反应与平衡
第一模块
沉淀溶解平衡的建立与移动
理解 · 难溶电解质
溶解度(S):
一定温度下,某物质在100克溶剂(通常是水)里达到饱和状态 时所溶解的质量
10
易溶
可溶
1
微溶
0.01
难溶
S /g
溶解度与溶解性的关系(20℃)
难溶电解质
溶解度小于0.01g的电解质
难溶电解质不是绝对不溶解
理解 · 难溶电解质
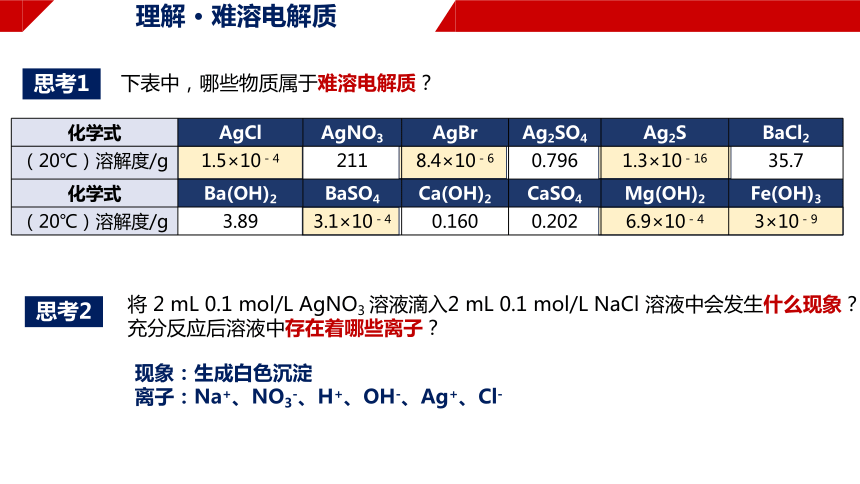
化学式 AgCl AgNO3 AgBr Ag2SO4 Ag2S BaCl2
(20℃)溶解度/g 1.5×10-4 211 8.4×10-6 0.796 1.3×10-16 35.7
化学式 Ba(OH)2 BaSO4 Ca(OH)2 CaSO4 Mg(OH)2 Fe(OH)3
(20℃)溶解度/g 3.89 3.1×10-4 0.160 0.202 6.9×10-4 3×10-9
将 2 mL 0.1 mol/L AgNO3 溶液滴入2 mL 0.1 mol/L NaCl 溶液中会发生什么现象?充分反应后溶液中存在着哪些离子?
思考2
下表中,哪些物质属于难溶电解质?
思考1
现象:生成白色沉淀
离子:Na+、NO3-、H+、OH-、Ag+、Cl-
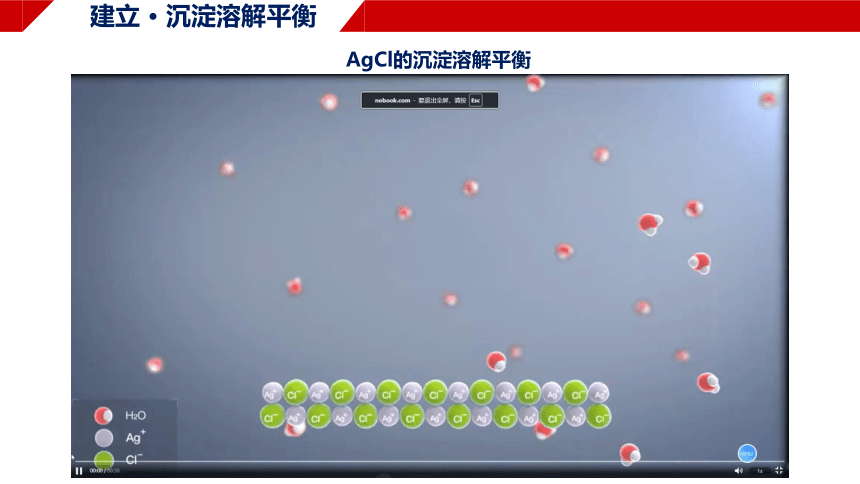
建立 · 沉淀溶解平衡
AgCl的沉淀溶解平衡
建立 · 沉淀溶解平衡
+
-
+
-
+
-
+
-
+
-
+
-
+
-
H2O
+
-
Ag+
Cl-
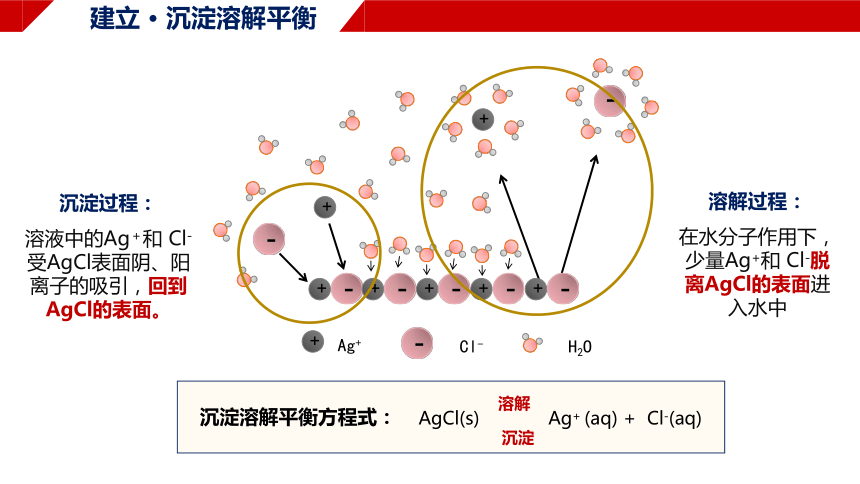
溶解过程:
在水分子作用下,少量Ag+和 Cl-脱离AgCl的表面进入水中
沉淀过程:
溶液中的Ag+和 Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面。
AgCl(s) Ag+ (aq) + Cl-(aq)
沉淀
溶解
沉淀溶解平衡方程式:
1、沉淀溶解平衡(v-t图像)
v
0
t
v(溶解)
v(沉淀)
v(溶解)=v(沉淀)
建立 · 沉淀溶解平衡
在一定温度下,当沉淀和溶解的速率相等时,
得到AgCl的饱和溶液,即达到 “沉淀溶解平衡”
此时,溶液中的离子浓度保持不变
2、沉淀溶解平衡方程书写
【例】CaCO3(s) Ca2+(aq) + CO32- (aq)
难溶电解质标 “s”;离子标“aq”
用“ ” 连接,
上不写“溶解、沉淀”
3、沉淀完全的判断
当溶液中某离子剩余的浓度
小于1×10-5 mol·L-1时,
就认为该离子已沉淀完全。
建立 · 沉淀溶解平衡
请写出BaSO4、Al2(CO3)3、Ag2S、CuS、Mg(OH)2的沉淀溶解平衡方程
练习1
BaSO4(s) Ba2+(aq) + SO42-(aq)
Al2(CO3)3(s) 2Al3+(aq) + 3CO32-(aq)
Ag2S(s) 2Ag+(aq) +S2-(aq)
CuS(s) Cu2+(aq) + S2-(aq)
Mg(OH)2(s) Mg 2+(aq) + 2OH-(aq)
沉淀溶解平衡 · 移动
影响沉淀溶解平衡的因素有哪些?
思考3
内因:电解质本身的性质
外因:温度、浓度(符合勒·夏特列原理)
在电解质的溶液中,不管是易溶的(如NaCl),微溶的,难溶的电解质都存在着溶解平衡
只要是饱和溶液都存在溶解平衡
特别提醒
①、稀释有利于溶解
②、温度升高,多数平衡向溶解方向移动(原因:溶解吸热);
但少数向沉淀方向移动 (例:Ca(OH)2)
沉淀溶解平衡 · 移动
思考4
已知反应:AgCl(S) Ag+(aq) + Cl-(aq) 若改变条件,对其有何影响(溶液始终饱和)
改变条件 移动方向 平衡时c(Ag+ ) 平衡时c(Cl-)
升温
加水
加AgCl(s)
加NaCl(s)
加AgNO3(s)
加Na2S(s)
→
增大
增大
→
不变
不变
溶液始终饱和,
温度不变→溶解度不变
因此离子的量增大
但是浓度不变
不移动
不变
不变
溶液已经饱和,
AgCl固体溶不进去
→
→
增大
增大
减小
减小
→
减小
增大
S2-结合Ag+生成Ag2S沉淀
Ag2S是比Ag2Cl更难溶的沉淀
Ag+减小,平衡正移
第二模块
溶度积(Ksp)的意义与应用
溶度积 · Ksp
1、定义:难溶电解质的沉淀溶解平衡的平衡常数,称为溶度积常数,简称溶度积,符号为Ksp
2、表达式:固体不写入表达式
【例1】 AgCl(S) Ag+(aq) + Cl-(aq)
【例2】Ag2S(S) 2Ag+(aq) + S2-(aq)
Ksp = c(Ag+) · c(Cl-)
3、意义:Ksp反映了难溶电解质在水中的溶解能力。
对于同类型的物质:Ksp越小,越难溶。
4、Ksp的影响因素:
内因:电解质本身的性质
外因:温度
越难溶 → Ksp越小
通常情况:T升Ksp升
例外:Ca(OH)2
Ksp = c2(Ag+) · c(S2-)
溶度积 · Ksp
溶度积(Ksp)与溶解度的关系
难溶物 Ksp(25 oC) 溶解度(S) 难溶物 Ksp(25 oC) 溶解度(S)
AgCl 1.8×10-10 1.5×10-4 BaSO4 1.1×10-10 2.4×10-4
AgBr 5.4×10-13 8.4×10-6 Mg(OH)2 5.6×10-12 6.9×10-4
AgI 8.5×10-17 2.1×10-7 Fe(OH)3 2.6×10-39 3.0×10-9
同种类型物质
(阴阳离子比一致)
Ksp与溶解度呈正比
溶度积:Ksp(AgCl) > Ksp(AgBr) > Ksp(AgI)
溶解度:S(AgCl) > S(AgBr) > S(AgI)
不同类型物质
Ksp不能直接用于比较溶解度
对不同类型物质,
Ksp差距不大时不能作为比较依据。
【例如:AgCl和Ag2CrO4】
溶度积 · Ksp
溶度积的应用:①、判断沉淀情况
溶度积( Ksp):平衡时离子浓度乘积
离子积(Q):任意时刻离子浓度乘积
Q > Ksp,溶液中有沉淀析出(溶液过饱和) → 向着沉淀的方向
Q = Ksp,沉淀与溶解处于平衡状态(溶液饱和,处于沉淀溶解平衡)
Q < Ksp,溶液中无沉淀析出(溶液不饱和) → 向着溶解的方向
溶度积 · Ksp
溶度积的应用:①、判断沉淀情况
【例1】下列情况下,有无CaCO3沉淀生成? (CaCO3的Ksp =4.96×10-9)
(1)往盛有1.0 L 纯水中加入0.1 mL浓度为0.01 mol /L 的CaCl2和Na2CO3
[Ca2+]×[CO32-] = 10-4 mol /L
Qc = [Ca2+]×[CO32-] = 10-8 >Ksp(CaCO3)
因此有CaCO3沉淀生成。
[Ca2+] = [CO32-] = 0.1 10-3 0.01/1.0 = 10-6 mol /L
Qc = [Ca2+]×[CO32-] = 10-12 < Ksp(CaCO3)
因此无 CaCO3沉淀生成。
(2)改变CaCl2和Na2CO3的浓度为1.0 mol /L 呢?
溶度积 · Ksp
溶度积的应用:②、判断沉淀生成的顺序
越难溶,越易沉
【是否难溶取决于溶解度(S) , Ksp能否作为参考取决于物质是否属于同一类型】
【例2】已知AgCl、AgI 的 Ksp分别为1.8×10-10、8.5×10-17
如在 0.01 mol·L-1 I- 和 0.01 mol·L-1 Cl- 混合溶液中,滴加AgNO3溶液,哪一离子先沉淀?
由Ksp数值可知,溶解能力:AgCl>AgI,
AgI沉淀更易生成,因此I-先沉淀
【例2-2】已知某温度下: AgCl(s) Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Mg(OH)2(s) Mg2+(aq)+2OH-(aq) Ksp=5.6×10-12
能否认为Mg(OH)2比AgCl更难溶。
不能,因为二者阴阳离子数目比不一致,不能用Ksp比较物质的溶解度
溶度积 · Ksp
溶度积的应用:③、已知Ksp计算离子浓度
【例3】1 mL 0.012 mol/L NaCl溶液与1 mL 0.010 mol/L AgNO3溶液充分反应,
求剩余Ag+的浓度(忽略溶液体积变化)【 AgCl的 Ksp为1.8×10-10】
AgCl(S) Ag+(aq) + Cl-(aq)
c(Cl-) =
1 mL×0.012 mol/L - 1 mL×0.010 mol/L
1 mL+1 mL
=
0.001 mol/L
c(Ag+) =
Ksp
c(Cl-)
=
=
0.001
1.8×10-10
根据:
Ksp = c(Ag+) · c(Cl-) = 1.8×10-10
1.8×10-7 mol/L
溶度积 · Ksp
溶度积的应用:③、已知Ksp计算离子浓度
【练习3】( 25 ℃时 )用Na2S溶液沉淀AgNO3溶液中的Ag+,充分反应后,
测得剩余溶液中的S2- 的浓度为1.0×10-4 mol/L,此时剩余溶液中Ag+的浓度为多少?
【 Ag2S的Ksp为6.3×10-50】
Ag2S(s) 2Ag+(aq) + S2-(aq)
Ksp = c2(Ag+) · c(S2-)
Ksp
c 2(Ag+) =
c(S2-)
=
6.3×10-50
1.0×10-4
=
6.3×10-46
c(Ag+)≈
2.5×10-23 mol/L
溶度积 · Ksp
溶度积的综合应用
【练习4】(25℃)若某溶液中Fe3+和Mg2+的浓度均为0.10 mol/L, 使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么
已知:Ksp [Fe(OH)3]= 4×10-39 Ksp [Mg(OH)2]= 1.8×10-11
Fe(OH)3 Fe3+ + 3OH-
Fe3+ 沉淀完全时的c(OH-)为:
pH = -lg c(H+) = 3.2
Mg2+开始沉淀的pH值为:
pH = -lg c(H+) = 9.1
Ksp (Mg(OH)2)= 1.8×10-11
因此, 只要控制pH值在3.2 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀
【任务二】定量描述难溶电解质的溶解程度
t ℃时,AgBr在水中的沉淀溶解平衡曲线
溶度积 · Ksp
沉淀溶解平衡曲线
曲线的点表示达到溶解与沉淀平衡——此时为饱和溶液;
曲线上方的点表示:
此时为过饱和溶液
离子过多,
向着结合析出沉淀的方向移动
曲线下方的点表示:
此时为不饱和溶液
离子过少,
向着沉淀溶解的方向移动
第四节 难溶电解质的沉淀溶解平衡
第1课时 沉淀溶解平衡与溶度积
第三章 水溶液中的离子反应与平衡
第一模块
沉淀溶解平衡的建立与移动
理解 · 难溶电解质
溶解度(S):
一定温度下,某物质在100克溶剂(通常是水)里达到饱和状态 时所溶解的质量
10
易溶
可溶
1
微溶
0.01
难溶
S /g
溶解度与溶解性的关系(20℃)
难溶电解质
溶解度小于0.01g的电解质
难溶电解质不是绝对不溶解
理解 · 难溶电解质
化学式 AgCl AgNO3 AgBr Ag2SO4 Ag2S BaCl2
(20℃)溶解度/g 1.5×10-4 211 8.4×10-6 0.796 1.3×10-16 35.7
化学式 Ba(OH)2 BaSO4 Ca(OH)2 CaSO4 Mg(OH)2 Fe(OH)3
(20℃)溶解度/g 3.89 3.1×10-4 0.160 0.202 6.9×10-4 3×10-9
将 2 mL 0.1 mol/L AgNO3 溶液滴入2 mL 0.1 mol/L NaCl 溶液中会发生什么现象?充分反应后溶液中存在着哪些离子?
思考2
下表中,哪些物质属于难溶电解质?
思考1
现象:生成白色沉淀
离子:Na+、NO3-、H+、OH-、Ag+、Cl-
建立 · 沉淀溶解平衡
AgCl的沉淀溶解平衡
建立 · 沉淀溶解平衡
+
-
+
-
+
-
+
-
+
-
+
-
+
-
H2O
+
-
Ag+
Cl-
溶解过程:
在水分子作用下,少量Ag+和 Cl-脱离AgCl的表面进入水中
沉淀过程:
溶液中的Ag+和 Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面。
AgCl(s) Ag+ (aq) + Cl-(aq)
沉淀
溶解
沉淀溶解平衡方程式:
1、沉淀溶解平衡(v-t图像)
v
0
t
v(溶解)
v(沉淀)
v(溶解)=v(沉淀)
建立 · 沉淀溶解平衡
在一定温度下,当沉淀和溶解的速率相等时,
得到AgCl的饱和溶液,即达到 “沉淀溶解平衡”
此时,溶液中的离子浓度保持不变
2、沉淀溶解平衡方程书写
【例】CaCO3(s) Ca2+(aq) + CO32- (aq)
难溶电解质标 “s”;离子标“aq”
用“ ” 连接,
上不写“溶解、沉淀”
3、沉淀完全的判断
当溶液中某离子剩余的浓度
小于1×10-5 mol·L-1时,
就认为该离子已沉淀完全。
建立 · 沉淀溶解平衡
请写出BaSO4、Al2(CO3)3、Ag2S、CuS、Mg(OH)2的沉淀溶解平衡方程
练习1
BaSO4(s) Ba2+(aq) + SO42-(aq)
Al2(CO3)3(s) 2Al3+(aq) + 3CO32-(aq)
Ag2S(s) 2Ag+(aq) +S2-(aq)
CuS(s) Cu2+(aq) + S2-(aq)
Mg(OH)2(s) Mg 2+(aq) + 2OH-(aq)
沉淀溶解平衡 · 移动
影响沉淀溶解平衡的因素有哪些?
思考3
内因:电解质本身的性质
外因:温度、浓度(符合勒·夏特列原理)
在电解质的溶液中,不管是易溶的(如NaCl),微溶的,难溶的电解质都存在着溶解平衡
只要是饱和溶液都存在溶解平衡
特别提醒
①、稀释有利于溶解
②、温度升高,多数平衡向溶解方向移动(原因:溶解吸热);
但少数向沉淀方向移动 (例:Ca(OH)2)
沉淀溶解平衡 · 移动
思考4
已知反应:AgCl(S) Ag+(aq) + Cl-(aq) 若改变条件,对其有何影响(溶液始终饱和)
改变条件 移动方向 平衡时c(Ag+ ) 平衡时c(Cl-)
升温
加水
加AgCl(s)
加NaCl(s)
加AgNO3(s)
加Na2S(s)
→
增大
增大
→
不变
不变
溶液始终饱和,
温度不变→溶解度不变
因此离子的量增大
但是浓度不变
不移动
不变
不变
溶液已经饱和,
AgCl固体溶不进去
→
→
增大
增大
减小
减小
→
减小
增大
S2-结合Ag+生成Ag2S沉淀
Ag2S是比Ag2Cl更难溶的沉淀
Ag+减小,平衡正移
第二模块
溶度积(Ksp)的意义与应用
溶度积 · Ksp
1、定义:难溶电解质的沉淀溶解平衡的平衡常数,称为溶度积常数,简称溶度积,符号为Ksp
2、表达式:固体不写入表达式
【例1】 AgCl(S) Ag+(aq) + Cl-(aq)
【例2】Ag2S(S) 2Ag+(aq) + S2-(aq)
Ksp = c(Ag+) · c(Cl-)
3、意义:Ksp反映了难溶电解质在水中的溶解能力。
对于同类型的物质:Ksp越小,越难溶。
4、Ksp的影响因素:
内因:电解质本身的性质
外因:温度
越难溶 → Ksp越小
通常情况:T升Ksp升
例外:Ca(OH)2
Ksp = c2(Ag+) · c(S2-)
溶度积 · Ksp
溶度积(Ksp)与溶解度的关系
难溶物 Ksp(25 oC) 溶解度(S) 难溶物 Ksp(25 oC) 溶解度(S)
AgCl 1.8×10-10 1.5×10-4 BaSO4 1.1×10-10 2.4×10-4
AgBr 5.4×10-13 8.4×10-6 Mg(OH)2 5.6×10-12 6.9×10-4
AgI 8.5×10-17 2.1×10-7 Fe(OH)3 2.6×10-39 3.0×10-9
同种类型物质
(阴阳离子比一致)
Ksp与溶解度呈正比
溶度积:Ksp(AgCl) > Ksp(AgBr) > Ksp(AgI)
溶解度:S(AgCl) > S(AgBr) > S(AgI)
不同类型物质
Ksp不能直接用于比较溶解度
对不同类型物质,
Ksp差距不大时不能作为比较依据。
【例如:AgCl和Ag2CrO4】
溶度积 · Ksp
溶度积的应用:①、判断沉淀情况
溶度积( Ksp):平衡时离子浓度乘积
离子积(Q):任意时刻离子浓度乘积
Q > Ksp,溶液中有沉淀析出(溶液过饱和) → 向着沉淀的方向
Q = Ksp,沉淀与溶解处于平衡状态(溶液饱和,处于沉淀溶解平衡)
Q < Ksp,溶液中无沉淀析出(溶液不饱和) → 向着溶解的方向
溶度积 · Ksp
溶度积的应用:①、判断沉淀情况
【例1】下列情况下,有无CaCO3沉淀生成? (CaCO3的Ksp =4.96×10-9)
(1)往盛有1.0 L 纯水中加入0.1 mL浓度为0.01 mol /L 的CaCl2和Na2CO3
[Ca2+]×[CO32-] = 10-4 mol /L
Qc = [Ca2+]×[CO32-] = 10-8 >Ksp(CaCO3)
因此有CaCO3沉淀生成。
[Ca2+] = [CO32-] = 0.1 10-3 0.01/1.0 = 10-6 mol /L
Qc = [Ca2+]×[CO32-] = 10-12 < Ksp(CaCO3)
因此无 CaCO3沉淀生成。
(2)改变CaCl2和Na2CO3的浓度为1.0 mol /L 呢?
溶度积 · Ksp
溶度积的应用:②、判断沉淀生成的顺序
越难溶,越易沉
【是否难溶取决于溶解度(S) , Ksp能否作为参考取决于物质是否属于同一类型】
【例2】已知AgCl、AgI 的 Ksp分别为1.8×10-10、8.5×10-17
如在 0.01 mol·L-1 I- 和 0.01 mol·L-1 Cl- 混合溶液中,滴加AgNO3溶液,哪一离子先沉淀?
由Ksp数值可知,溶解能力:AgCl>AgI,
AgI沉淀更易生成,因此I-先沉淀
【例2-2】已知某温度下: AgCl(s) Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Mg(OH)2(s) Mg2+(aq)+2OH-(aq) Ksp=5.6×10-12
能否认为Mg(OH)2比AgCl更难溶。
不能,因为二者阴阳离子数目比不一致,不能用Ksp比较物质的溶解度
溶度积 · Ksp
溶度积的应用:③、已知Ksp计算离子浓度
【例3】1 mL 0.012 mol/L NaCl溶液与1 mL 0.010 mol/L AgNO3溶液充分反应,
求剩余Ag+的浓度(忽略溶液体积变化)【 AgCl的 Ksp为1.8×10-10】
AgCl(S) Ag+(aq) + Cl-(aq)
c(Cl-) =
1 mL×0.012 mol/L - 1 mL×0.010 mol/L
1 mL+1 mL
=
0.001 mol/L
c(Ag+) =
Ksp
c(Cl-)
=
=
0.001
1.8×10-10
根据:
Ksp = c(Ag+) · c(Cl-) = 1.8×10-10
1.8×10-7 mol/L
溶度积 · Ksp
溶度积的应用:③、已知Ksp计算离子浓度
【练习3】( 25 ℃时 )用Na2S溶液沉淀AgNO3溶液中的Ag+,充分反应后,
测得剩余溶液中的S2- 的浓度为1.0×10-4 mol/L,此时剩余溶液中Ag+的浓度为多少?
【 Ag2S的Ksp为6.3×10-50】
Ag2S(s) 2Ag+(aq) + S2-(aq)
Ksp = c2(Ag+) · c(S2-)
Ksp
c 2(Ag+) =
c(S2-)
=
6.3×10-50
1.0×10-4
=
6.3×10-46
c(Ag+)≈
2.5×10-23 mol/L
溶度积 · Ksp
溶度积的综合应用
【练习4】(25℃)若某溶液中Fe3+和Mg2+的浓度均为0.10 mol/L, 使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么
已知:Ksp [Fe(OH)3]= 4×10-39 Ksp [Mg(OH)2]= 1.8×10-11
Fe(OH)3 Fe3+ + 3OH-
Fe3+ 沉淀完全时的c(OH-)为:
pH = -lg c(H+) = 3.2
Mg2+开始沉淀的pH值为:
pH = -lg c(H+) = 9.1
Ksp (Mg(OH)2)= 1.8×10-11
因此, 只要控制pH值在3.2 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀
【任务二】定量描述难溶电解质的溶解程度
t ℃时,AgBr在水中的沉淀溶解平衡曲线
溶度积 · Ksp
沉淀溶解平衡曲线
曲线的点表示达到溶解与沉淀平衡——此时为饱和溶液;
曲线上方的点表示:
此时为过饱和溶液
离子过多,
向着结合析出沉淀的方向移动
曲线下方的点表示:
此时为不饱和溶液
离子过少,
向着沉淀溶解的方向移动
