1.1原子结构 (共38张PPT)2024-2025学年人教版(2019)高中化学选择性必修2
文档属性
| 名称 | 1.1原子结构 (共38张PPT)2024-2025学年人教版(2019)高中化学选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 19:45:16 | ||
图片预览





文档简介
(共38张PPT)
走进奇妙的化学世界
选择性必修2
第一章
原子结构与性质
第一节
原子结构
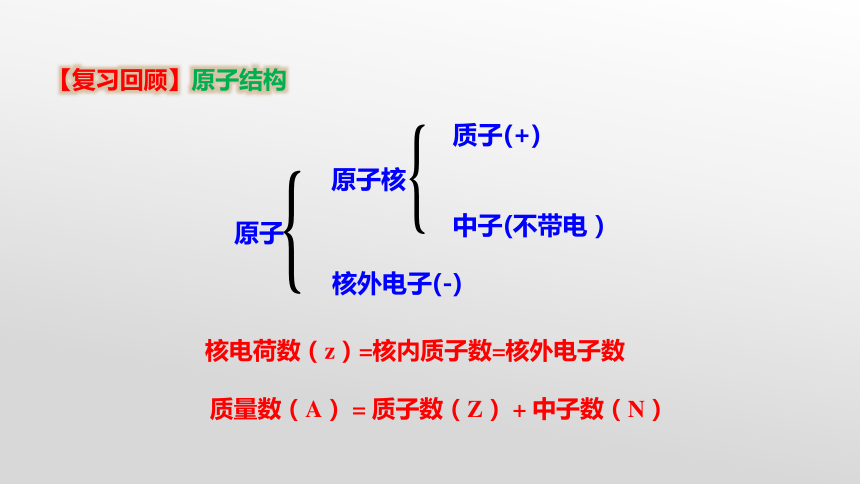
【复习回顾】原子结构
原子
原子核
核外电子(-)
质子(+)
中子(不带电)
核电荷数(z)=核内质子数=核外电子数
质量数(A) = 质子数(Z) + 中子数(N)
学习
目标
PART
01
知道电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
PART
03
了解核外电子的运动状态,知道原子核外电子的能层分布、能级分布及其能量的关系。(重点)
PART
02
PART
02
了解原子核外电子排布的构造原理,能写出1~36号元素基态原子的电子排布式(重难点)。
导3min
学7min+助8min
1.阅读教材对能层定义、能层的符号、排列顺序、能层与电子层、电子能量的关系?(自主)
2.理解能级的概念,完成课本P7的思考与讨论(合作+展示)
3.阅读课本理解基态原子、激发态原子的定义,两者的关系?电子跃迁是物理变化还是化学变化?(合作+展示)
4.阅读课本第8页图1-5,理解何为构造原理?每一横行,每一个小圆圈代表什么?电子填充顺序是怎样的?为何要按这个顺序填充(能级能量角度考虑)?试比较2S与4S;4S与 3d能级的能量大小。(自主)
5.阅读课本第9页理解基态原子电子排布式如何按照构造原理书写?尝试书写Cl,O,Al,26Fe,Cu基态原子电子排布式。(合作+展示)
6.按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?Cl,O,Al,26Fe,Cu基态原子电子排布式能否进行简化?(合作+展示)
7.尝试根据26Fe基态原子电子排布式写出铁原子结构示意图。(合作+展示)
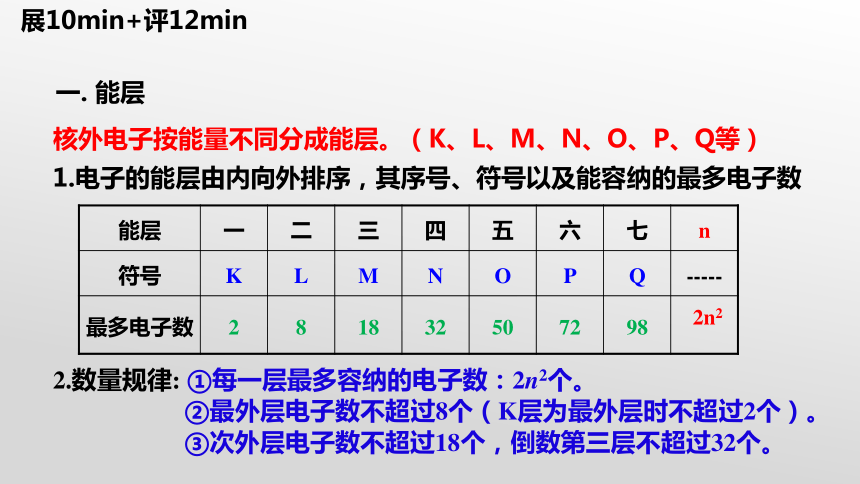
核外电子按能量不同分成能层。(K、L、M、N、O、P、Q等)
1.电子的能层由内向外排序,其序号、符号以及能容纳的最多电子数
能层 一 二 三 四 五 六 七 n
符号 K L M N O P Q -----
最多电子数 2 8 18 32 50 72 98
2n2
2.数量规律: ①每一层最多容纳的电子数:2n2个。
②最外层电子数不超过8个(K层为最外层时不超过2个)。
③次外层电子数不超过18个,倒数第三层不超过32个。
一. 能层
展10min+评12min
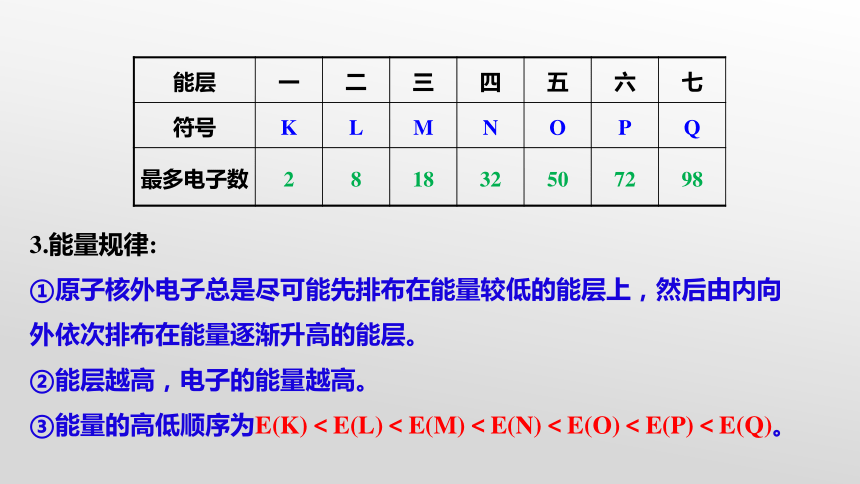
3.能量规律:
①原子核外电子总是尽可能先排布在能量较低的能层上,然后由内向外依次排布在能量逐渐升高的能层。
②能层越高,电子的能量越高。
③能量的高低顺序为E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)。
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
(1) 多电子原子中,同一能层电子的能量可能不同,把能层分为不同的能级。(s、p、d、f 等)
(2)表示方法:分别用相应能层的序数和字母s、p、d、f 等表示。
二. 能级
能级符号前面用数字表示能层序数。
【例】:K层中只有1s能级,L层中有2s和2p能级
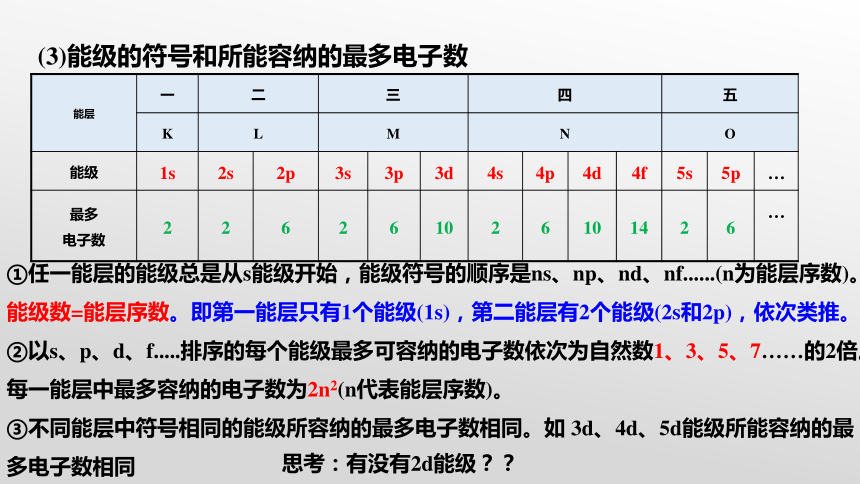
(3)能级的符号和所能容纳的最多电子数
能层 一 二 三 四 五 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多 电子数 2 2 6 2 6 10 2 6 10 14 2 6 …
①任一能层的能级总是从s能级开始,能级符号的顺序是ns、np、nd、nf......(n为能层序数)。
能级数=能层序数。即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),依次类推。
②以s、p、d、f.....排序的每个能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。每一能层中最多容纳的电子数为2n2(n代表能层序数)。
③不同能层中符号相同的能级所容纳的最多电子数相同。如 3d、4d、5d能级所能容纳的最多电子数相同
思考:有没有2d能级??
相同能层
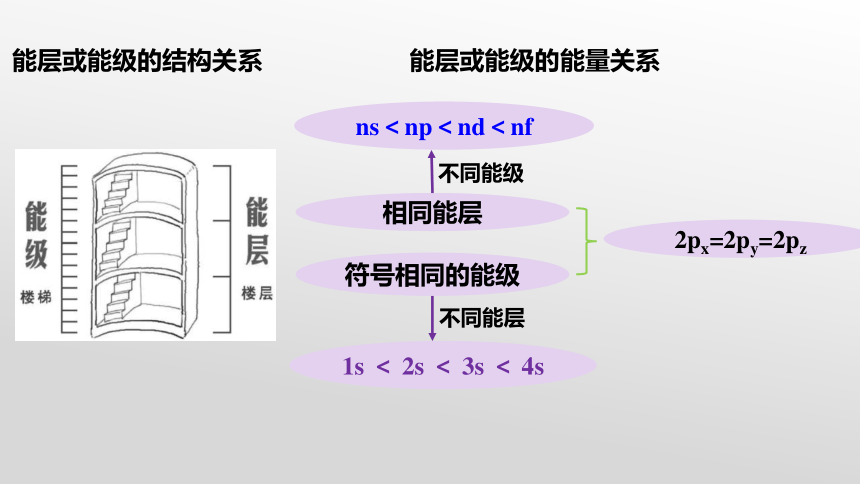
ns<np<nd<nf
符号相同的能级
1s < 2s < 3s < 4s
不同能级
不同能层
2px=2py=2pz
能层或能级的能量关系
能层或能级的结构关系
原子
吸
收
能
量
释
放
能
量
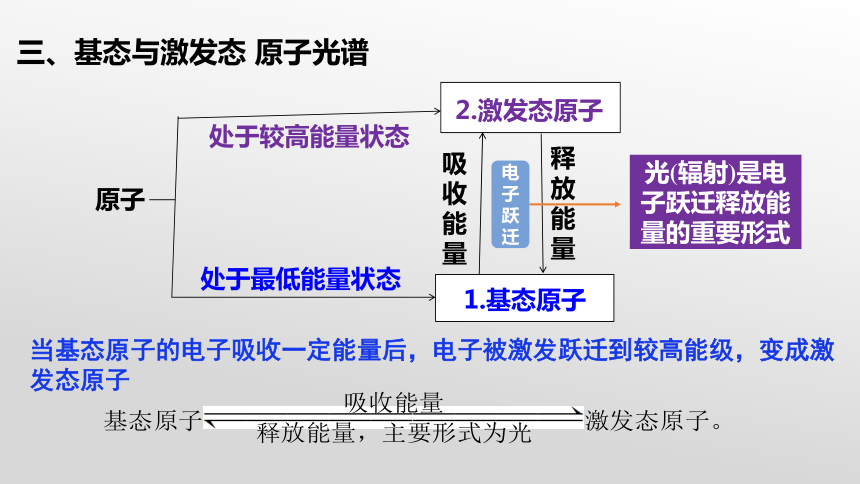
处于最低能量状态
处于较高能量状态
1.基态原子
2.激发态原子
电子跃迁
光(辐射)是电子跃迁释放能量的重要形式
三、基态与激发态 原子光谱
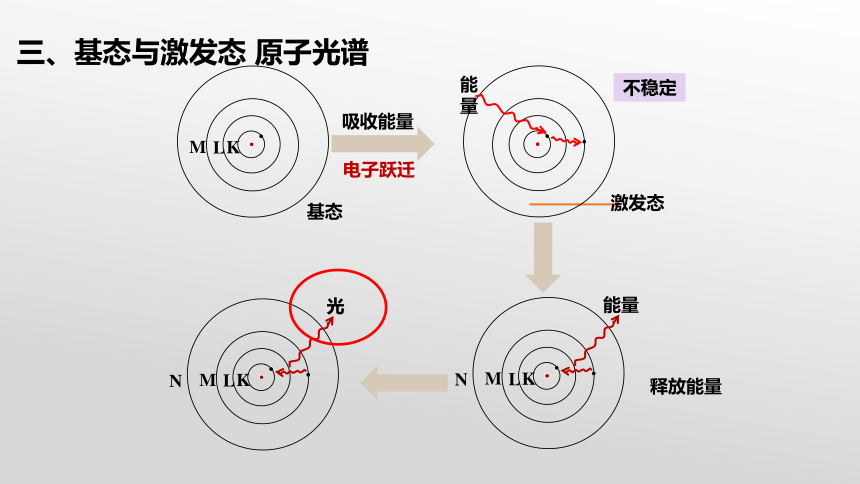
当基态原子的电子吸收一定能量后,电子被激发跃迁到较高能级,变成激发态原子
三、基态与激发态 原子光谱
基态
K
L
M
激发态
能量
不稳定
吸收能量
电子跃迁
能量
K
L
M
N
光
K
L
M
N
释放能量
(1)电子跃迁的能量变化与可见现象
激发态原子不稳定,电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,将释放能量。光(辐射)是电子跃迁释放能量的重要形式之一。LED灯光、霓虹灯光、荧光、激光、焰火等可见光都与原子核外电子发生跃迁释放能量有关。
(2)金属元素的焰色的成因
金属原子中,核外电子按一定轨道顺序排列,轨道离核越远,能量越高。灼(燃)烧时,电子获得能量,能量较低的电子发生跃迁,从基态变为激发态。随即电子又从能量较高的激发态跃迁到能量较低的激发态乃至基态,便以光(辐射)的形式释放能量,形成不同的焰色。
特别提醒:
①电子的跃迁是物理变化(未发生电子转移),而原子得失电子时发生的是化学变化。
②一般在能量相近的能级间发生电子跃迁。如1s22s22p2 表示基态碳原子,1s22s12p3为激发态碳原子(电子数不变)。
③激发态原子不稳定,易释放能量变为基态原子。
能量:1S12S1>1S2 稳定性:1S12S1<1S2
不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的发射光谱或吸收光谱,总称原子光谱。
发射光谱
吸收光谱
特征:暗背景,亮线, 线状不连续
特征:亮背景,暗线,线状不连续
2.原子光谱
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
He 氦
原子光谱的应用
引课视频:能级交错及构造原理
一、构造原理
1、概念:
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理(是一个思维模型)。
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p…
2、构造原理顺序:
一般规律为:ns<(n-2)f<(n-1)d<np
记忆方法一——构造原理示意图:
每一行对应一个能层
每一小圈对应一个能级
羊肉串法
3、能级交错:
从第3电子层开始出现此现象。
如:E4s源于光谱学事实
构造原理告诉我们,随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层,如电子是按3p→4s→3d的顺序而不是按3p→3d→4s的顺序填充的,这种现象被称为能级交错。
——各能级的能量高低顺序
[思考]
为什么K原子的原子结构示意图不是 ,而是
K原子在排满第二层后,先排布3s、3p能级,3d能级能量高于4s能级,故最后一个电子排入4s能级而不是3d能级,所以它的原子结构示意图是 。
课堂练习:构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d) B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)E(4s)>E(4f)>E(3d)
B
方法技巧 判断能级能量高低的方法
(1)首先看能层,一般能层序数越大,能量越高。
(2)再看能级,同一能层中的各能级,能量由低到高的顺序是ns(3)还要注意能级交错现象,即高能层的s、p能级的能量可能会小于低能层的d、f能级,如4s<3d,6p<5f等。
二、电子排布式
按照构造原理,用核外电子分布的能级及各能级上的电子数来表示电子排布的式子。
1、概念:
2、表示方法:
写出从氢到碳的基态原子电子排布式:
Na:1s2 2s22p6 3s1
K
L
M
K
L
M
Na的电子排布式
Na的原子结构示意图
能层序数
能级符号
该能级上排布的电子数
3、电子排布式的书写——“三步法”书写基态原子电子排布式
第一步:按照构造原理写出电子填入能级的顺序,
第二步:根据各能级容纳的电子数填充电子。
第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。
课堂练习3:写出下列原子的电子排布式:
O:_______________ Cl:_________________
S:_________________ Al:________________
P: _________________ Ar:_________________
1s22s22p63s23p5
1s22s22p63s23p64s2
1s22s22p4
1s22s22p63s23p6
1s22s22p63s23p3
1s22s22p63s23p1
课堂练习4:写出下列原子的电子排布式:
26Fe: _______________________
23V:_______________________
Br:___________________________
Zn:____________________________
1s22s22p63s23p64s23d6
1s22s22p63s23p63d64s2
特别提醒:
充入电子时按构造原理,而书写时按能层次序!
1s22s22p63s23p63d34s2
1s22s22p63s23p63d104s24p5
1s22s22p63s23p63d104s2
要求:写出1~36号元素基态原子的电子排布式。
记前36号元素核电荷数、名称、元素符号。
从元素周期表中查出铜的外围电子层排布。是否符合构造原理?写出其电子排布式。
根据构造原理写出Cu电子排布式
1s22s22p63s23p63d94s2
价电子排布
3d94s2
3d104s1
说明当p、d、f 能级处于全空、全充满p6、d10、f14 或半充满状态p3、d5、f7 时,能量相对较低,原子结构较稳定。
Cu原子的电子排布式
1s22s22p63s23p63d104s1
Cr原子的电子排布式
1s22s22p63s23p63d54s1
(1)按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?
He 1s2 Ne 2s22p6 Ar 3s23p6
Kr 4s 24p6 Xe 5s 25p6 Rn 6s 26p6
通式:ns2np6
【思考与交流】 课本P11
(3)为突出化合价与电子排布式的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。例如,Fe的简化电子排布式为[Ar]3d64s2,价层电子排布为3d64s2。元素周期表只给出价层电子排布。请从书中找出Na、Al、Cl、Mn、Br的价层电子排布。
Na:3s1
Al:3s2 3p1
Cl:3s2 3p5
Mn:3d5 4s2
Br:4s24p5
(2)简化电子排布式:为避免电子排布式过于繁琐,我们可以把内层电子达到稀有气体结构的部分,以相应稀有气体元素符号外加方括号表示。如钠的电子排布式可简化为[Ne]3s1。写出8和26号元素的简化电子排布式。
Na:1s22s22p63s1
[Ne]3s1
简化为
表示钠的内层电子排布与稀有气体元素Ne的核外电子排布相同
O:1s22s22p4
简化为
[He]2s22p4
Fe:1s22s22p63s23p63d64s2
[Ar]3d64s2
简化为
1s22s22p63s23p63d104s24p5
35Br:
[Ar]3d104s24p5
课堂练习5:下列化学用语的应用错误 的是( @45@ )。
A.
B.
C.基态
D.基态
A
2、价层电子排布式
①价电子层的定义:为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。也叫外围电子层排布。
②价电子的表示:
对于主族元素和零族元素来说,价电子就是最外层电子
例如:Cl的价层电子排布式为3s23p5
对于副族和第VIII族元素来说,价电子除最外层电子外,还可能包括次外层电子
例如:Mn的价层电子排布式为3d54s2
Li 1s22s1 [He] 2s1
O 1s22s22p4 [He] 2s22p4
F 1s22s22p5 [He] 2s22p5
Si 1s22s22p63s23p2 [Ne] 3s23p2
P 1s22s22p63s23p3 [Ne] 3s23p3
K 1s22s22p63s23p64s1 [Ar] 4s1
Cr 1s22s22p63s23p63d54s1 [Ar] 3d54s1
Zn 1s22s22p63s23p63d104s2 [Ar] 3d104s2
2s1
2s22p4
2s22p5
3s23p2
3s23p3
4s1
3d54s1
3d104s2
电子排布式
简化电子排布式
价层电子排布式
元素符号
3、离子的电子排布式的书写:
(1)判断该原子变成离子时会得到电子或失去电子数。
(2)原子失去电子时,总是先失去最外层电子。一般来说,主族元素只失去最外层电子,而副族和第Ⅷ族元素可能会进一步失去内层电子。
(3)原子得到电子形成阴离子时,得到的电子填充在最外层的能级上。
(4)离子最外层电子可能超过8个
如:Cl- 电子排布式为1s22s22p63s23p6
Zn2+电子排布式为1s22s22p63s23p63d10
Fe 电子排布式为 1s22s22p63s23p63d64s2
Fe2+ 1s22s22p63s23p63d6
Fe3+ 1s22s22p63s23p63d5
课堂练习6:请写出S2-、 29Cu2+ 、Fe2+、Fe3+离子的电子排布式?
S2- :1s22s22p63s23p6
Cu2+ :1s22s22p63s23p63d9
Fe2+ :1s22s22p63s23p63d6
Fe3+ :1s22s22p63s23p63d5
D
C
当基态原子的电子吸收一定能量后,电子被激发跃迁到较高能级,变成激发态原子
B项先不用考虑, 讲下节内容会提到
【例题1】 已知n为能层序数,下列有关认识正确的是( )
A.各能层含有的电子数为2n2
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍
答案:D
解析:各能层最多含有的电子数为2n2,A项错误;各能层的能级都是从s能级开始,每个能层上的能级数与能层序数相等,并不是所有能层的能级都是从s能级开始到f能级结束,如第1、2、3能层,B项错误;各能层含有的能级数与其能层序数相等,C项错误;各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍,D项正确。
典例分析
测5’
能层(n) 一 二 三 四 五 六 七 …
符号 K L M N O P Q …
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s … … … …
最多容纳电子数 2 2 6 2 6 10 2 6 10 14 2 … … … …
2 8 18 32 50 … … 每一能层最多可容纳的电子数是2n2
离核远近 由近到远 不同能层能量 逐渐增大 同一能层各能级的能量 逐渐增大
【课堂小结】
小结:能层、能级与最多容纳的电子数、能量之间的相互关系
能级
基态与激发态
原子光谱
构 造原理
【课堂小结】
小结:能层、能级与最多容纳的电子数、能量之间的相互关系
课堂小结
1、下列有关构造原理的说法错误 的是( @43@ )。
A.原子核外电子填充 、 、 能级的顺序为
B.某基态原子价层电子的排布式为
C.所有基态原子的核外电子排布都遵循构造原理
D.构造原理中的电子排布能级顺序,实质是各能级能量由低到高的顺序
C
C
A
A
C
测5min
作业:
必做:课本P17 1-4、7、8题,
高考调研小本1-14
选做:高考调研小本15、16
走进奇妙的化学世界
选择性必修2
第一章
原子结构与性质
第一节
原子结构
【复习回顾】原子结构
原子
原子核
核外电子(-)
质子(+)
中子(不带电)
核电荷数(z)=核内质子数=核外电子数
质量数(A) = 质子数(Z) + 中子数(N)
学习
目标
PART
01
知道电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
PART
03
了解核外电子的运动状态,知道原子核外电子的能层分布、能级分布及其能量的关系。(重点)
PART
02
PART
02
了解原子核外电子排布的构造原理,能写出1~36号元素基态原子的电子排布式(重难点)。
导3min
学7min+助8min
1.阅读教材对能层定义、能层的符号、排列顺序、能层与电子层、电子能量的关系?(自主)
2.理解能级的概念,完成课本P7的思考与讨论(合作+展示)
3.阅读课本理解基态原子、激发态原子的定义,两者的关系?电子跃迁是物理变化还是化学变化?(合作+展示)
4.阅读课本第8页图1-5,理解何为构造原理?每一横行,每一个小圆圈代表什么?电子填充顺序是怎样的?为何要按这个顺序填充(能级能量角度考虑)?试比较2S与4S;4S与 3d能级的能量大小。(自主)
5.阅读课本第9页理解基态原子电子排布式如何按照构造原理书写?尝试书写Cl,O,Al,26Fe,Cu基态原子电子排布式。(合作+展示)
6.按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?Cl,O,Al,26Fe,Cu基态原子电子排布式能否进行简化?(合作+展示)
7.尝试根据26Fe基态原子电子排布式写出铁原子结构示意图。(合作+展示)
核外电子按能量不同分成能层。(K、L、M、N、O、P、Q等)
1.电子的能层由内向外排序,其序号、符号以及能容纳的最多电子数
能层 一 二 三 四 五 六 七 n
符号 K L M N O P Q -----
最多电子数 2 8 18 32 50 72 98
2n2
2.数量规律: ①每一层最多容纳的电子数:2n2个。
②最外层电子数不超过8个(K层为最外层时不超过2个)。
③次外层电子数不超过18个,倒数第三层不超过32个。
一. 能层
展10min+评12min
3.能量规律:
①原子核外电子总是尽可能先排布在能量较低的能层上,然后由内向外依次排布在能量逐渐升高的能层。
②能层越高,电子的能量越高。
③能量的高低顺序为E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)。
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
(1) 多电子原子中,同一能层电子的能量可能不同,把能层分为不同的能级。(s、p、d、f 等)
(2)表示方法:分别用相应能层的序数和字母s、p、d、f 等表示。
二. 能级
能级符号前面用数字表示能层序数。
【例】:K层中只有1s能级,L层中有2s和2p能级
(3)能级的符号和所能容纳的最多电子数
能层 一 二 三 四 五 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多 电子数 2 2 6 2 6 10 2 6 10 14 2 6 …
①任一能层的能级总是从s能级开始,能级符号的顺序是ns、np、nd、nf......(n为能层序数)。
能级数=能层序数。即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),依次类推。
②以s、p、d、f.....排序的每个能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。每一能层中最多容纳的电子数为2n2(n代表能层序数)。
③不同能层中符号相同的能级所容纳的最多电子数相同。如 3d、4d、5d能级所能容纳的最多电子数相同
思考:有没有2d能级??
相同能层
ns<np<nd<nf
符号相同的能级
1s < 2s < 3s < 4s
不同能级
不同能层
2px=2py=2pz
能层或能级的能量关系
能层或能级的结构关系
原子
吸
收
能
量
释
放
能
量
处于最低能量状态
处于较高能量状态
1.基态原子
2.激发态原子
电子跃迁
光(辐射)是电子跃迁释放能量的重要形式
三、基态与激发态 原子光谱
当基态原子的电子吸收一定能量后,电子被激发跃迁到较高能级,变成激发态原子
三、基态与激发态 原子光谱
基态
K
L
M
激发态
能量
不稳定
吸收能量
电子跃迁
能量
K
L
M
N
光
K
L
M
N
释放能量
(1)电子跃迁的能量变化与可见现象
激发态原子不稳定,电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,将释放能量。光(辐射)是电子跃迁释放能量的重要形式之一。LED灯光、霓虹灯光、荧光、激光、焰火等可见光都与原子核外电子发生跃迁释放能量有关。
(2)金属元素的焰色的成因
金属原子中,核外电子按一定轨道顺序排列,轨道离核越远,能量越高。灼(燃)烧时,电子获得能量,能量较低的电子发生跃迁,从基态变为激发态。随即电子又从能量较高的激发态跃迁到能量较低的激发态乃至基态,便以光(辐射)的形式释放能量,形成不同的焰色。
特别提醒:
①电子的跃迁是物理变化(未发生电子转移),而原子得失电子时发生的是化学变化。
②一般在能量相近的能级间发生电子跃迁。如1s22s22p2 表示基态碳原子,1s22s12p3为激发态碳原子(电子数不变)。
③激发态原子不稳定,易释放能量变为基态原子。
能量:1S12S1>1S2 稳定性:1S12S1<1S2
不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的发射光谱或吸收光谱,总称原子光谱。
发射光谱
吸收光谱
特征:暗背景,亮线, 线状不连续
特征:亮背景,暗线,线状不连续
2.原子光谱
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
He 氦
原子光谱的应用
引课视频:能级交错及构造原理
一、构造原理
1、概念:
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理(是一个思维模型)。
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p…
2、构造原理顺序:
一般规律为:ns<(n-2)f<(n-1)d<np
记忆方法一——构造原理示意图:
每一行对应一个能层
每一小圈对应一个能级
羊肉串法
3、能级交错:
从第3电子层开始出现此现象。
如:E4s
构造原理告诉我们,随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层,如电子是按3p→4s→3d的顺序而不是按3p→3d→4s的顺序填充的,这种现象被称为能级交错。
——各能级的能量高低顺序
[思考]
为什么K原子的原子结构示意图不是 ,而是
K原子在排满第二层后,先排布3s、3p能级,3d能级能量高于4s能级,故最后一个电子排入4s能级而不是3d能级,所以它的原子结构示意图是 。
课堂练习:构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d) B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)
B
方法技巧 判断能级能量高低的方法
(1)首先看能层,一般能层序数越大,能量越高。
(2)再看能级,同一能层中的各能级,能量由低到高的顺序是ns
二、电子排布式
按照构造原理,用核外电子分布的能级及各能级上的电子数来表示电子排布的式子。
1、概念:
2、表示方法:
写出从氢到碳的基态原子电子排布式:
Na:1s2 2s22p6 3s1
K
L
M
K
L
M
Na的电子排布式
Na的原子结构示意图
能层序数
能级符号
该能级上排布的电子数
3、电子排布式的书写——“三步法”书写基态原子电子排布式
第一步:按照构造原理写出电子填入能级的顺序,
第二步:根据各能级容纳的电子数填充电子。
第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。
课堂练习3:写出下列原子的电子排布式:
O:_______________ Cl:_________________
S:_________________ Al:________________
P: _________________ Ar:_________________
1s22s22p63s23p5
1s22s22p63s23p64s2
1s22s22p4
1s22s22p63s23p6
1s22s22p63s23p3
1s22s22p63s23p1
课堂练习4:写出下列原子的电子排布式:
26Fe: _______________________
23V:_______________________
Br:___________________________
Zn:____________________________
1s22s22p63s23p64s23d6
1s22s22p63s23p63d64s2
特别提醒:
充入电子时按构造原理,而书写时按能层次序!
1s22s22p63s23p63d34s2
1s22s22p63s23p63d104s24p5
1s22s22p63s23p63d104s2
要求:写出1~36号元素基态原子的电子排布式。
记前36号元素核电荷数、名称、元素符号。
从元素周期表中查出铜的外围电子层排布。是否符合构造原理?写出其电子排布式。
根据构造原理写出Cu电子排布式
1s22s22p63s23p63d94s2
价电子排布
3d94s2
3d104s1
说明当p、d、f 能级处于全空、全充满p6、d10、f14 或半充满状态p3、d5、f7 时,能量相对较低,原子结构较稳定。
Cu原子的电子排布式
1s22s22p63s23p63d104s1
Cr原子的电子排布式
1s22s22p63s23p63d54s1
(1)按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?
He 1s2 Ne 2s22p6 Ar 3s23p6
Kr 4s 24p6 Xe 5s 25p6 Rn 6s 26p6
通式:ns2np6
【思考与交流】 课本P11
(3)为突出化合价与电子排布式的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。例如,Fe的简化电子排布式为[Ar]3d64s2,价层电子排布为3d64s2。元素周期表只给出价层电子排布。请从书中找出Na、Al、Cl、Mn、Br的价层电子排布。
Na:3s1
Al:3s2 3p1
Cl:3s2 3p5
Mn:3d5 4s2
Br:4s24p5
(2)简化电子排布式:为避免电子排布式过于繁琐,我们可以把内层电子达到稀有气体结构的部分,以相应稀有气体元素符号外加方括号表示。如钠的电子排布式可简化为[Ne]3s1。写出8和26号元素的简化电子排布式。
Na:1s22s22p63s1
[Ne]3s1
简化为
表示钠的内层电子排布与稀有气体元素Ne的核外电子排布相同
O:1s22s22p4
简化为
[He]2s22p4
Fe:1s22s22p63s23p63d64s2
[Ar]3d64s2
简化为
1s22s22p63s23p63d104s24p5
35Br:
[Ar]3d104s24p5
课堂练习5:下列化学用语的应用
A.
B.
C.基态
D.基态
A
2、价层电子排布式
①价电子层的定义:为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。也叫外围电子层排布。
②价电子的表示:
对于主族元素和零族元素来说,价电子就是最外层电子
例如:Cl的价层电子排布式为3s23p5
对于副族和第VIII族元素来说,价电子除最外层电子外,还可能包括次外层电子
例如:Mn的价层电子排布式为3d54s2
Li 1s22s1 [He] 2s1
O 1s22s22p4 [He] 2s22p4
F 1s22s22p5 [He] 2s22p5
Si 1s22s22p63s23p2 [Ne] 3s23p2
P 1s22s22p63s23p3 [Ne] 3s23p3
K 1s22s22p63s23p64s1 [Ar] 4s1
Cr 1s22s22p63s23p63d54s1 [Ar] 3d54s1
Zn 1s22s22p63s23p63d104s2 [Ar] 3d104s2
2s1
2s22p4
2s22p5
3s23p2
3s23p3
4s1
3d54s1
3d104s2
电子排布式
简化电子排布式
价层电子排布式
元素符号
3、离子的电子排布式的书写:
(1)判断该原子变成离子时会得到电子或失去电子数。
(2)原子失去电子时,总是先失去最外层电子。一般来说,主族元素只失去最外层电子,而副族和第Ⅷ族元素可能会进一步失去内层电子。
(3)原子得到电子形成阴离子时,得到的电子填充在最外层的能级上。
(4)离子最外层电子可能超过8个
如:Cl- 电子排布式为1s22s22p63s23p6
Zn2+电子排布式为1s22s22p63s23p63d10
Fe 电子排布式为 1s22s22p63s23p63d64s2
Fe2+ 1s22s22p63s23p63d6
Fe3+ 1s22s22p63s23p63d5
课堂练习6:请写出S2-、 29Cu2+ 、Fe2+、Fe3+离子的电子排布式?
S2- :1s22s22p63s23p6
Cu2+ :1s22s22p63s23p63d9
Fe2+ :1s22s22p63s23p63d6
Fe3+ :1s22s22p63s23p63d5
D
C
当基态原子的电子吸收一定能量后,电子被激发跃迁到较高能级,变成激发态原子
B项先不用考虑, 讲下节内容会提到
【例题1】 已知n为能层序数,下列有关认识正确的是( )
A.各能层含有的电子数为2n2
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍
答案:D
解析:各能层最多含有的电子数为2n2,A项错误;各能层的能级都是从s能级开始,每个能层上的能级数与能层序数相等,并不是所有能层的能级都是从s能级开始到f能级结束,如第1、2、3能层,B项错误;各能层含有的能级数与其能层序数相等,C项错误;各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍,D项正确。
典例分析
测5’
能层(n) 一 二 三 四 五 六 七 …
符号 K L M N O P Q …
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s … … … …
最多容纳电子数 2 2 6 2 6 10 2 6 10 14 2 … … … …
2 8 18 32 50 … … 每一能层最多可容纳的电子数是2n2
离核远近 由近到远 不同能层能量 逐渐增大 同一能层各能级的能量 逐渐增大
【课堂小结】
小结:能层、能级与最多容纳的电子数、能量之间的相互关系
能级
基态与激发态
原子光谱
构 造原理
【课堂小结】
小结:能层、能级与最多容纳的电子数、能量之间的相互关系
课堂小结
1、下列有关构造原理的说法
A.原子核外电子填充 、 、 能级的顺序为
B.某基态原子价层电子的排布式为
C.所有基态原子的核外电子排布都遵循构造原理
D.构造原理中的电子排布能级顺序,实质是各能级能量由低到高的顺序
C
C
A
A
C
测5min
作业:
必做:课本P17 1-4、7、8题,
高考调研小本1-14
选做:高考调研小本15、16
