1.2.1原子结构与元素周期表(共25张PPT) 2024-2025学年人教版(2019)高中化学选择性必修2
文档属性
| 名称 | 1.2.1原子结构与元素周期表(共25张PPT) 2024-2025学年人教版(2019)高中化学选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 19:46:15 | ||
图片预览







文档简介
(共25张PPT)
1.2.1原子结构与元素周期表
C与N原子序数相似,单质的性质却相差很大
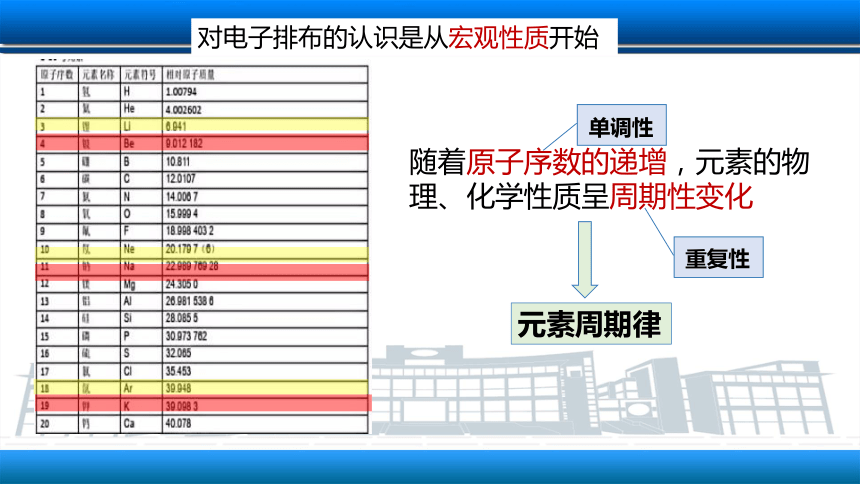
对电子排布的认识是从宏观性质开始
氮气
对电子排布的认识是从宏观性质开始
Na和Mg原子序数相似,单质的性质非常相似
Na
Mg
对电子排布的认识是从宏观性质开始
XX和XX原子序数相差很大,性质却非常相似?
2
10
18
36
54
XX和XX原子序数相差很大,性质却非常相似?
对电子排布的认识是从宏观性质开始
3 Li 11 Na 19 K
XX和XX原子序数相差很大,性质却非常相似?
对电子排布的认识是从宏观性质开始
对电子排布的认识是从宏观性质开始
原子有不同的带电微粒数目,却有相似的化学行为
原子有相似的带电微粒数目,却有很不相同的化学行为
核外电子不只有“数”,还有“排布”
对电子排布的认识是从宏观性质开始
随着原子序数的递增,元素的物理、化学性质呈周期性变化
单调性
重复性
元素周期律
日历:体现周期性的表格
1、根据基态原子电子排布,解释元素周期表编排理由。
2、为何元素周期表中间凹下去?
3、为何有单列的两行元素?(镧系、锕系)
理解元素周期表的结构
理解元素周期表的结构
理解元素周期表的横行
1234567
横行:周期
1s1→1s2
2s1→2p6
3s1→3p6
4s1→4p6
5s1→5p6
6s1→6p6
7s1→7p6
周期数=电子层数=能层序数
能级:电子数 1s: 2
2s2p: 8
3s3p: 8
4s3d4p: 18
5s4d5p: 18
6s4f5d6p: 32
7s5f6d7p: 32
每周期元素数目
短周期
长周期
765432
1
邻组间能级能量差较大
同组内能级能量差较小
7个能级组~7个周期
18个纵行:族
7主(A)7副(B)+第Ⅷ组+0族
主族序数=最外层电子数=价电子总数
副主族序数=价电子总数(有例外)
理解元素周期表的纵行
课后作业
①在元素周期表框架中填入周期表表头(周期序数、族序数)
②将1~36号元素的原子序数、元素符号、价电子排布填入
③每个主族上方写出最外层电子排布通式
④分别计算出各周期IA族与0族原子序数,填入表中
理解元素周期表的分区
s
d
ds
f
p
(n-2)f1~14ns2
(n-1)d10ns1~2
ns1~2
ns2 np1~6
(n-1)d1~8ns2
3d54s1
3d104s1
1s2
4d10
1、已知某元素在周期表中位于第五周期、ⅦA族位置上。试写出该元素基态原子的价电子排布式、原子序数和所在分区名称
2
8
8
18
18
32
32
每周期
元素种数
2
10
18
36
54
86
118
1
3
11
19
37
55
87
ⅠA、ⅡA:某元素原子序数=同族上一元素+该元素上一周期元素种数
其它族: 某元素原子序数=同族上一元素+该元素所处周期元素种数
2、同周期的ⅡA族与ⅢA族元素的原子序数分别为A、B,则表示原子序数A、B关系的代数式可表示为:
3、A、B两元素,A原子的M层和N层电子数分别比B原子的M层和N层的电子数少5个和4个,则A的周期和族可能是 ,B的周期和族可能是 .
在元素周期表中,某些主族元素与右下方的主族元素(如图)的有些性质是相似的,这种相似性被称为对角线规则
体现对角线规则的相关元素
①对角线规则是从相关元素及其化合物的许多
性质中总结出来的经验规则,不是定理。
②相似性:例如 :B和Si的含氧酸都是弱酸。
对角线规则
铍与铝
对角线规则
铍、铝的单质、氧化物、氢氧化物,都是两性物质。请参考Al、Al2O3与酸、碱的反应,分别写出Be、BeO与酸、碱反应的离子方程式。
锂与镁
①锂和镁在O2中燃烧,并不生成过氧化物,都只生成氧化物(Li2O、MgO)。
②锂和镁都能直接与N2反应生成氮化物(Li3N、Mg3N2)。
③锂和镁的氢氧化物在加热时都可分解生成氧化物(Li2O、MgO)和H2O。
④锂和镁的碳酸盐均不稳定,受热均能分解生成相应氧化物和CO2。
⑤含锂和镁的某些盐,如碳酸盐、磷酸盐等均难溶于水。
对角线规则
感谢聆听!
1.2.1原子结构与元素周期表
C与N原子序数相似,单质的性质却相差很大
对电子排布的认识是从宏观性质开始
氮气
对电子排布的认识是从宏观性质开始
Na和Mg原子序数相似,单质的性质非常相似
Na
Mg
对电子排布的认识是从宏观性质开始
XX和XX原子序数相差很大,性质却非常相似?
2
10
18
36
54
XX和XX原子序数相差很大,性质却非常相似?
对电子排布的认识是从宏观性质开始
3 Li 11 Na 19 K
XX和XX原子序数相差很大,性质却非常相似?
对电子排布的认识是从宏观性质开始
对电子排布的认识是从宏观性质开始
原子有不同的带电微粒数目,却有相似的化学行为
原子有相似的带电微粒数目,却有很不相同的化学行为
核外电子不只有“数”,还有“排布”
对电子排布的认识是从宏观性质开始
随着原子序数的递增,元素的物理、化学性质呈周期性变化
单调性
重复性
元素周期律
日历:体现周期性的表格
1、根据基态原子电子排布,解释元素周期表编排理由。
2、为何元素周期表中间凹下去?
3、为何有单列的两行元素?(镧系、锕系)
理解元素周期表的结构
理解元素周期表的结构
理解元素周期表的横行
1234567
横行:周期
1s1→1s2
2s1→2p6
3s1→3p6
4s1→4p6
5s1→5p6
6s1→6p6
7s1→7p6
周期数=电子层数=能层序数
能级:电子数 1s: 2
2s2p: 8
3s3p: 8
4s3d4p: 18
5s4d5p: 18
6s4f5d6p: 32
7s5f6d7p: 32
每周期元素数目
短周期
长周期
765432
1
邻组间能级能量差较大
同组内能级能量差较小
7个能级组~7个周期
18个纵行:族
7主(A)7副(B)+第Ⅷ组+0族
主族序数=最外层电子数=价电子总数
副主族序数=价电子总数(有例外)
理解元素周期表的纵行
课后作业
①在元素周期表框架中填入周期表表头(周期序数、族序数)
②将1~36号元素的原子序数、元素符号、价电子排布填入
③每个主族上方写出最外层电子排布通式
④分别计算出各周期IA族与0族原子序数,填入表中
理解元素周期表的分区
s
d
ds
f
p
(n-2)f1~14ns2
(n-1)d10ns1~2
ns1~2
ns2 np1~6
(n-1)d1~8ns2
3d54s1
3d104s1
1s2
4d10
1、已知某元素在周期表中位于第五周期、ⅦA族位置上。试写出该元素基态原子的价电子排布式、原子序数和所在分区名称
2
8
8
18
18
32
32
每周期
元素种数
2
10
18
36
54
86
118
1
3
11
19
37
55
87
ⅠA、ⅡA:某元素原子序数=同族上一元素+该元素上一周期元素种数
其它族: 某元素原子序数=同族上一元素+该元素所处周期元素种数
2、同周期的ⅡA族与ⅢA族元素的原子序数分别为A、B,则表示原子序数A、B关系的代数式可表示为:
3、A、B两元素,A原子的M层和N层电子数分别比B原子的M层和N层的电子数少5个和4个,则A的周期和族可能是 ,B的周期和族可能是 .
在元素周期表中,某些主族元素与右下方的主族元素(如图)的有些性质是相似的,这种相似性被称为对角线规则
体现对角线规则的相关元素
①对角线规则是从相关元素及其化合物的许多
性质中总结出来的经验规则,不是定理。
②相似性:例如 :B和Si的含氧酸都是弱酸。
对角线规则
铍与铝
对角线规则
铍、铝的单质、氧化物、氢氧化物,都是两性物质。请参考Al、Al2O3与酸、碱的反应,分别写出Be、BeO与酸、碱反应的离子方程式。
锂与镁
①锂和镁在O2中燃烧,并不生成过氧化物,都只生成氧化物(Li2O、MgO)。
②锂和镁都能直接与N2反应生成氮化物(Li3N、Mg3N2)。
③锂和镁的氢氧化物在加热时都可分解生成氧化物(Li2O、MgO)和H2O。
④锂和镁的碳酸盐均不稳定,受热均能分解生成相应氧化物和CO2。
⑤含锂和镁的某些盐,如碳酸盐、磷酸盐等均难溶于水。
对角线规则
感谢聆听!
