1.1.1原子结构模型(共31张PPT) 2024-2025学年鲁科版(2019)高中化学选择性必修2
文档属性
| 名称 | 1.1.1原子结构模型(共31张PPT) 2024-2025学年鲁科版(2019)高中化学选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 20:00:02 | ||
图片预览











文档简介
(共31张PPT)
1.1.1 原子结构模型
学习目标定位
1、了解原子结构模型的演变历程和玻尔的原子结构模型的内容、原子轨道和电子云的含义。
2、知道基态、激发态和原子光谱等概念,认识原子光谱分析的应用、描述原子核外电子运动状态的四个量子数的含义。
3、理解用四个量子数描述原子核外电子的运动状态。
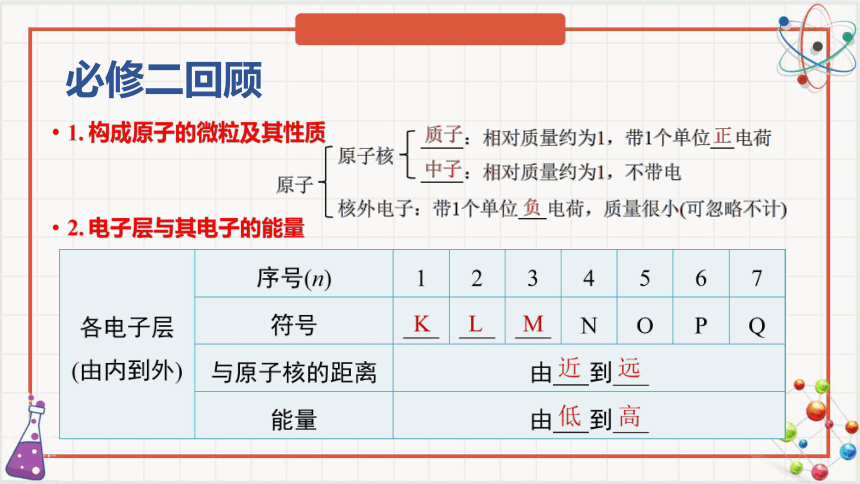
必修二回顾
1. 构成原子的微粒及其性质
2. 电子层与其电子的能量
必修二回顾
3. 原子核外电子排布的一般规律
(1)“一低”——电子首先排布在能量较低的电子层里,排满能量较低的电子层后,再排能量较高的电子层。
(2)
引入新课
通过必修的学习,我们对原子结构的知识已经有了初步了解。
宏观物体的运动与微观粒子的运动有什么区别?
原子核外电子的运动状态应当如何描述?
元素的性质与原子结构之间究竟有怎样的关系?
化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的自然科学。结构决定性质、性质决定应用。
一、原子结构发展史
不同时期的原子结构模型
一、原子结构发展史
1. 道尔顿原子模型(1803年):原子是组成物质的基本粒子,它们是坚实的、不可再分的实心球。
2. 汤姆逊原子模型(1903年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
3. 卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
4. 玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速的圆周运动。
5. 原子结构的量子力学模型(20世纪20年代中期):现代物质结构学说。
二、氢原子光谱和玻尔原子结构模型
1. 处于最低能量状态的原子称为基态原子。若基态原子的电子吸收能量后,电子跃迁至能量较高轨道成为激发态原子。
原子基态与激发态相互转化间的能量变化:
2. 光是电子释放能量的重要形式之一,不同
元素的原子发生跃迁时会吸收或释放不同的光,若用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,则可确立某种元素的原子,这些光谱总称原子光谱。
二、氢原子光谱和玻尔原子结构模型
二、氢原子光谱和玻尔原子结构模型
3. 原子光谱的三大应用:
光谱分析法:通过比较未知物质光谱与已知元素光谱,识别未知物质中的元素。
定性分析:根据光谱图中是否出现某些特征谱线,可以判断是否存在某种元素。这是因为每种元素都有其独特的发射光谱或吸收光谱。
定量分析:根据特征谱线的强度,可以测定某种元素的含量。谱线强度与元素浓度之间存在一定的关系,通过测量谱线强度可以推算出元素的浓度。
核式模型的特点:不稳定,连续光谱,不符合原子稳定与线状光谱的特点
二、氢原子光谱和玻尔原子结构模型
3. 玻尔电子分层排布模型
(1)电子在固定轨道上运动不辐射能量;
原子中的电子在具有确定半径的圆周轨道上绕原子核运动,并不辐射能量。
(2)电子所处的轨道的能量是量子化的;
不同轨道上运动的电子具有不同的能量,而且能量值是不连
续的,称为能量“量子化”。轨道能量依n值(1、2、3······)
的增大而升高,n称为量子数。对氢原子而言,电子处在n=1的轨道时能量最低,这种状态称为基态;能量高于基态能量的状态称为激发态。
玻尔电子分层排布模型
3. 玻尔电子分层排布模型
(3)原子光谱源自核外电子在能量不同的轨道之间的跃迁;电子跃迁吸收(或放出)的能量也是量子化的。
只有当电子从一个轨道跃迁到另一个轨道时,才会辐射或吸收能量。当辐射或吸收的能量以光的形式表现出来并被记录时,就形成了光谱。
玻尔原子结构模型能成功解释氢原子光谱为线状光谱,却不
能解释复杂的原子光谱(P4 联想·质疑)量子力学模型可以
解释氢原子光谱及复杂的原子光谱。
判断正误
(1)光是电子跃迁释放能量的重要形式之一( )
(2)氢原子外围只有一个电子,故氢原子光谱只有一条谱线( )
(3)氢原子光谱属于线状光谱( )
(4)基态氢原子转变成激发态氢原子时释放能量( )
(5)焰色试验与电子跃迁有关,属于化学变化( )
√
×
×
√
×
三、量子力学理论
1. 电子层
量子力学理论依然用量子数 n ,习惯上将 n 描述的电子运动状态称为电子层。n 的取值为正整数1,2,3,4,5,6,…,对应的符号为 K,L,M,N,O,P 等。n 越大,电子离核的平均距离越远、能量越高。
2. 能级
当量子数 n 相同时,电子所具有的能量也可能不同,因此,对同一个电子层,还可分为若干个能级。n = x,就有 x 个能级,分别用 s、p、d、f 表示。
能级理论可以解释相同两个能层之间出现多条谱线的原因。
三、量子力学理论
科学实验又发现,在存在外磁场时,处于同一能级的电子的空间运动状态还会不同,此时谱线可能分裂为多条。
3. 原子轨道
用原子轨道来描述原子中的单个电子的空间运动状态。当n=1时,有1个能级,1个原子轨道,记作1s;当n=2时,有2个能级,4个原子轨道,记作2s、2px、2py、2pz;当n=3时,有3个能级,9个原子轨道,记作3s、3px、3py、3pz,和5个d轨道等等。
无外磁场时,同一能级的原子轨道能量相同。
原子轨道
轨道理论解释了同一能级中出现多条谱线的原因。
量子数n 符号 能级符号 原子轨道 原子轨道数
n=1 K s 1s 1
n=2 L s 2s 1
p 2p 3
n=3 M s 3s 1
p 3p 3
d 3d 5
… … … … …
三、量子力学理论
不仅如此,处在同一原子轨道上的电子运动状态也不完全相同
4. 电子的“自旋”
处于同一轨道上的电子自旋运动状态只能有两种,分别用符号“↑”和“↓”表示。
“自旋”并不意味着电子“自转”,其实质仍在探索。
不同原子轨道上的能量大小比较:
总结归纳
(1) 在多电子原子中,核外电子处于不同的电子层,电子层序数(主量子数) n 越大,电子离核越远,能量越高。
(2) 处于同一电子层的电子,能量可能不同,可以把它们分成若干个不同的能级,用 s、p、d、f 等符号表示,其能量为 ns < np < nd < nf,能级数等于电子层数。
(3) 同一能级中,根据电子运动方向的不同,可分为若干个不同的原子轨道,同一能级上的原子轨道的能量相同,每个电子层中原子轨道总数为 n2 个。
(4) 处于同一个原子轨道上的电子有两种不同的自旋状态。在同一个原子中不存在两个运动状态完全相同的电子。
四、电子云与原子轨道图形描述
1.原子轨道的图形描述
(1)对象:原子中单个电子的空间运动状态。
(2)意义:表示原子轨道的空间分布。
(3)形状:s轨道呈球形,具有球对称性;p轨道在空间的分布特点是分别相对于x、y、z轴对称,呈哑铃形(∞)如图:
四、电子云与原子轨道图形描述
2.电子在核外的空间分布
(1)原子核外电子的运动特点
与对宏观物体运动的描述不同,对于质量非常小、运行速度极快且运动空间极小的微观粒子(如电子,其质量仅为9.1×10-31 kg)而言,人们不可能同时准确地测定它的位置和速度,但能通过对波函数进行数学处理计算出电子在某个地方出现的概率。
(2)电子云图
四、电子云与原子轨道图形描述
2.电子在核外的空间分布
(2)电子云图
①概念:描述电子在核外空间某处单位体积内的概率分布的图形。
②含义:用单位体积内小点的疏密程度来表示电子在原子核外某处单位体积内出现概率的大小。
③电子云图的形状:s能级的电子概率分布呈球形;p能级的电子概率分布呈哑铃形,有3种空间伸展方向。
四、电子云与原子轨道图形描述
2.电子在核外的空间分布
(2)电子云图
④意义:电子云不仅表示电子在核外空间某处单位体积内出现的概率,同时说明量子力学中轨道的含义与玻尔轨道的含义完全不同,它既不是圆周轨道,也不是其他经典意义上的固定轨迹。
⑤电子在 1s 轨道的电子云图如图所示。
1s轨道上的电子云图呈球形对称,离核越近,单位体积内电子出现的概率越大。
四、电子云与原子轨道图形描述
3. 原子轨道图形描述
图1给出的是 1s 原子轨道、2s 原子轨道和 3s 原子轨道的示意图,图 2 给出的是同能级中三个 p 原子轨道的示意图。
总结归纳
(1) s 原子轨道在三维空间分布的图形是球形。即 s 原子轨道具有球对称性。量子数 n 不同时,s 原子轨道的形状相似、大小不同,1s < 2s < 3s <…
(2) p 原子轨道在三维空间分布的特征是三个p原子轨道分别相对于 x、y、z 轴对称,轨道的形状为相同大小的哑铃形。即三个 p 原子轨道都是相同大小的、具有轴对称性的哑铃形,它们分别沿 x、y、z 轴三个相互垂直的方向伸展。量子数 n 不同时,p 原子轨道的形状相似、大小不同,2p < 3p < 4p <…
(3)同理,d 原子轨道、f 原子轨道等也都有相应的图像。
判断正误
(1)不同电子层的s能级中电子的能量完全相同( )
(2)第三电子层有s、p共两个能级( )
(3)当电子层数为n=2时,有2s、2px、2py、2pz四个原子轨道( )
(4)各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7( )
(5)各电子层的能级都是从s能级开始至f能级结束( )
(6)处于s能级的电子能量一定比处于p能级的电子能量低( )
×
×
√
√
×
×
应用体验
1.原子核外电子的运动状态决定因素有___________________________
。
(1)Na原子核外有 个电子,有 种运动状态,即一个原子中______
(填“存在”或“不存在”)运动状态相同的电子。
(2)电子层数n=5时,该层电子的空间运动状态有 种,原子轨道总数 个,s能级的表示符号为 。
电子层、能级、原子轨道、自
旋状态
11
11
不存在
25
25
5s
应用体验
2.下列各电子层不包含d能级的是
A.O层 B.N层 C.M层 D.K层
3.下列能级符号不正确的是
A.6s B.2d C.3p D.4f
D
B
跟踪强化
1、玻尔理论不能解释( )
A.氢原子光谱为线状光谱
B.在一给定的稳定轨道上,运动的核外电子不辐射能量
C.氢原子的可见光区谱线
D.在有外加磁场时氢原子光谱有多条谱线
D
跟踪强化
2、对充有氖气的霓虹灯管通电,灯管发出红光。产生这一现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
A
跟踪强化
3、观察1s轨道上电子云示意图,判断下列说法正确的是( )
A.一个小黑点表示1个自由运动的电子
B.1s轨道的电子云形状为圆形的面
C.电子在1s轨道上运动像地球围绕太阳旋转
D.1s轨道电子云的点的疏密表示电子在某一位置出现概率的大小
D
跟踪强化
4、下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.s 轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p 轨道呈哑铃形,在空间有两个伸展方向
D.与s电子原子轨道相同,p电子原子轨道的平均半径随电子层的增大而增大
D
1.1.1 原子结构模型
学习目标定位
1、了解原子结构模型的演变历程和玻尔的原子结构模型的内容、原子轨道和电子云的含义。
2、知道基态、激发态和原子光谱等概念,认识原子光谱分析的应用、描述原子核外电子运动状态的四个量子数的含义。
3、理解用四个量子数描述原子核外电子的运动状态。
必修二回顾
1. 构成原子的微粒及其性质
2. 电子层与其电子的能量
必修二回顾
3. 原子核外电子排布的一般规律
(1)“一低”——电子首先排布在能量较低的电子层里,排满能量较低的电子层后,再排能量较高的电子层。
(2)
引入新课
通过必修的学习,我们对原子结构的知识已经有了初步了解。
宏观物体的运动与微观粒子的运动有什么区别?
原子核外电子的运动状态应当如何描述?
元素的性质与原子结构之间究竟有怎样的关系?
化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的自然科学。结构决定性质、性质决定应用。
一、原子结构发展史
不同时期的原子结构模型
一、原子结构发展史
1. 道尔顿原子模型(1803年):原子是组成物质的基本粒子,它们是坚实的、不可再分的实心球。
2. 汤姆逊原子模型(1903年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
3. 卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
4. 玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速的圆周运动。
5. 原子结构的量子力学模型(20世纪20年代中期):现代物质结构学说。
二、氢原子光谱和玻尔原子结构模型
1. 处于最低能量状态的原子称为基态原子。若基态原子的电子吸收能量后,电子跃迁至能量较高轨道成为激发态原子。
原子基态与激发态相互转化间的能量变化:
2. 光是电子释放能量的重要形式之一,不同
元素的原子发生跃迁时会吸收或释放不同的光,若用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,则可确立某种元素的原子,这些光谱总称原子光谱。
二、氢原子光谱和玻尔原子结构模型
二、氢原子光谱和玻尔原子结构模型
3. 原子光谱的三大应用:
光谱分析法:通过比较未知物质光谱与已知元素光谱,识别未知物质中的元素。
定性分析:根据光谱图中是否出现某些特征谱线,可以判断是否存在某种元素。这是因为每种元素都有其独特的发射光谱或吸收光谱。
定量分析:根据特征谱线的强度,可以测定某种元素的含量。谱线强度与元素浓度之间存在一定的关系,通过测量谱线强度可以推算出元素的浓度。
核式模型的特点:不稳定,连续光谱,不符合原子稳定与线状光谱的特点
二、氢原子光谱和玻尔原子结构模型
3. 玻尔电子分层排布模型
(1)电子在固定轨道上运动不辐射能量;
原子中的电子在具有确定半径的圆周轨道上绕原子核运动,并不辐射能量。
(2)电子所处的轨道的能量是量子化的;
不同轨道上运动的电子具有不同的能量,而且能量值是不连
续的,称为能量“量子化”。轨道能量依n值(1、2、3······)
的增大而升高,n称为量子数。对氢原子而言,电子处在n=1的轨道时能量最低,这种状态称为基态;能量高于基态能量的状态称为激发态。
玻尔电子分层排布模型
3. 玻尔电子分层排布模型
(3)原子光谱源自核外电子在能量不同的轨道之间的跃迁;电子跃迁吸收(或放出)的能量也是量子化的。
只有当电子从一个轨道跃迁到另一个轨道时,才会辐射或吸收能量。当辐射或吸收的能量以光的形式表现出来并被记录时,就形成了光谱。
玻尔原子结构模型能成功解释氢原子光谱为线状光谱,却不
能解释复杂的原子光谱(P4 联想·质疑)量子力学模型可以
解释氢原子光谱及复杂的原子光谱。
判断正误
(1)光是电子跃迁释放能量的重要形式之一( )
(2)氢原子外围只有一个电子,故氢原子光谱只有一条谱线( )
(3)氢原子光谱属于线状光谱( )
(4)基态氢原子转变成激发态氢原子时释放能量( )
(5)焰色试验与电子跃迁有关,属于化学变化( )
√
×
×
√
×
三、量子力学理论
1. 电子层
量子力学理论依然用量子数 n ,习惯上将 n 描述的电子运动状态称为电子层。n 的取值为正整数1,2,3,4,5,6,…,对应的符号为 K,L,M,N,O,P 等。n 越大,电子离核的平均距离越远、能量越高。
2. 能级
当量子数 n 相同时,电子所具有的能量也可能不同,因此,对同一个电子层,还可分为若干个能级。n = x,就有 x 个能级,分别用 s、p、d、f 表示。
能级理论可以解释相同两个能层之间出现多条谱线的原因。
三、量子力学理论
科学实验又发现,在存在外磁场时,处于同一能级的电子的空间运动状态还会不同,此时谱线可能分裂为多条。
3. 原子轨道
用原子轨道来描述原子中的单个电子的空间运动状态。当n=1时,有1个能级,1个原子轨道,记作1s;当n=2时,有2个能级,4个原子轨道,记作2s、2px、2py、2pz;当n=3时,有3个能级,9个原子轨道,记作3s、3px、3py、3pz,和5个d轨道等等。
无外磁场时,同一能级的原子轨道能量相同。
原子轨道
轨道理论解释了同一能级中出现多条谱线的原因。
量子数n 符号 能级符号 原子轨道 原子轨道数
n=1 K s 1s 1
n=2 L s 2s 1
p 2p 3
n=3 M s 3s 1
p 3p 3
d 3d 5
… … … … …
三、量子力学理论
不仅如此,处在同一原子轨道上的电子运动状态也不完全相同
4. 电子的“自旋”
处于同一轨道上的电子自旋运动状态只能有两种,分别用符号“↑”和“↓”表示。
“自旋”并不意味着电子“自转”,其实质仍在探索。
不同原子轨道上的能量大小比较:
总结归纳
(1) 在多电子原子中,核外电子处于不同的电子层,电子层序数(主量子数) n 越大,电子离核越远,能量越高。
(2) 处于同一电子层的电子,能量可能不同,可以把它们分成若干个不同的能级,用 s、p、d、f 等符号表示,其能量为 ns < np < nd < nf,能级数等于电子层数。
(3) 同一能级中,根据电子运动方向的不同,可分为若干个不同的原子轨道,同一能级上的原子轨道的能量相同,每个电子层中原子轨道总数为 n2 个。
(4) 处于同一个原子轨道上的电子有两种不同的自旋状态。在同一个原子中不存在两个运动状态完全相同的电子。
四、电子云与原子轨道图形描述
1.原子轨道的图形描述
(1)对象:原子中单个电子的空间运动状态。
(2)意义:表示原子轨道的空间分布。
(3)形状:s轨道呈球形,具有球对称性;p轨道在空间的分布特点是分别相对于x、y、z轴对称,呈哑铃形(∞)如图:
四、电子云与原子轨道图形描述
2.电子在核外的空间分布
(1)原子核外电子的运动特点
与对宏观物体运动的描述不同,对于质量非常小、运行速度极快且运动空间极小的微观粒子(如电子,其质量仅为9.1×10-31 kg)而言,人们不可能同时准确地测定它的位置和速度,但能通过对波函数进行数学处理计算出电子在某个地方出现的概率。
(2)电子云图
四、电子云与原子轨道图形描述
2.电子在核外的空间分布
(2)电子云图
①概念:描述电子在核外空间某处单位体积内的概率分布的图形。
②含义:用单位体积内小点的疏密程度来表示电子在原子核外某处单位体积内出现概率的大小。
③电子云图的形状:s能级的电子概率分布呈球形;p能级的电子概率分布呈哑铃形,有3种空间伸展方向。
四、电子云与原子轨道图形描述
2.电子在核外的空间分布
(2)电子云图
④意义:电子云不仅表示电子在核外空间某处单位体积内出现的概率,同时说明量子力学中轨道的含义与玻尔轨道的含义完全不同,它既不是圆周轨道,也不是其他经典意义上的固定轨迹。
⑤电子在 1s 轨道的电子云图如图所示。
1s轨道上的电子云图呈球形对称,离核越近,单位体积内电子出现的概率越大。
四、电子云与原子轨道图形描述
3. 原子轨道图形描述
图1给出的是 1s 原子轨道、2s 原子轨道和 3s 原子轨道的示意图,图 2 给出的是同能级中三个 p 原子轨道的示意图。
总结归纳
(1) s 原子轨道在三维空间分布的图形是球形。即 s 原子轨道具有球对称性。量子数 n 不同时,s 原子轨道的形状相似、大小不同,1s < 2s < 3s <…
(2) p 原子轨道在三维空间分布的特征是三个p原子轨道分别相对于 x、y、z 轴对称,轨道的形状为相同大小的哑铃形。即三个 p 原子轨道都是相同大小的、具有轴对称性的哑铃形,它们分别沿 x、y、z 轴三个相互垂直的方向伸展。量子数 n 不同时,p 原子轨道的形状相似、大小不同,2p < 3p < 4p <…
(3)同理,d 原子轨道、f 原子轨道等也都有相应的图像。
判断正误
(1)不同电子层的s能级中电子的能量完全相同( )
(2)第三电子层有s、p共两个能级( )
(3)当电子层数为n=2时,有2s、2px、2py、2pz四个原子轨道( )
(4)各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7( )
(5)各电子层的能级都是从s能级开始至f能级结束( )
(6)处于s能级的电子能量一定比处于p能级的电子能量低( )
×
×
√
√
×
×
应用体验
1.原子核外电子的运动状态决定因素有___________________________
。
(1)Na原子核外有 个电子,有 种运动状态,即一个原子中______
(填“存在”或“不存在”)运动状态相同的电子。
(2)电子层数n=5时,该层电子的空间运动状态有 种,原子轨道总数 个,s能级的表示符号为 。
电子层、能级、原子轨道、自
旋状态
11
11
不存在
25
25
5s
应用体验
2.下列各电子层不包含d能级的是
A.O层 B.N层 C.M层 D.K层
3.下列能级符号不正确的是
A.6s B.2d C.3p D.4f
D
B
跟踪强化
1、玻尔理论不能解释( )
A.氢原子光谱为线状光谱
B.在一给定的稳定轨道上,运动的核外电子不辐射能量
C.氢原子的可见光区谱线
D.在有外加磁场时氢原子光谱有多条谱线
D
跟踪强化
2、对充有氖气的霓虹灯管通电,灯管发出红光。产生这一现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
A
跟踪强化
3、观察1s轨道上电子云示意图,判断下列说法正确的是( )
A.一个小黑点表示1个自由运动的电子
B.1s轨道的电子云形状为圆形的面
C.电子在1s轨道上运动像地球围绕太阳旋转
D.1s轨道电子云的点的疏密表示电子在某一位置出现概率的大小
D
跟踪强化
4、下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.s 轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p 轨道呈哑铃形,在空间有两个伸展方向
D.与s电子原子轨道相同,p电子原子轨道的平均半径随电子层的增大而增大
D
