1.3.1原子半径、电离能及其变化规律(共34张PPT) 2024-2025学年鲁科版(2019)高中化学选择性必修2
文档属性
| 名称 | 1.3.1原子半径、电离能及其变化规律(共34张PPT) 2024-2025学年鲁科版(2019)高中化学选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 20:02:19 | ||
图片预览











文档简介
(共34张PPT)
1.3.1 原子半径、电离能及其变化规律
学习目标定位
1、了解原子半径的意义及其测定方法,知道原子半径与原子核外电子排布的关系,并能解释原子半径在周期表中的变化规律。
2、知道原子结构与元素性质间的关系规律,正确理解元素电离能的含义及其变化规律,会用电离能的概念分析解释元素的某些性质。
回顾
一、同周期元素性质递变规律(从左到右)
1. 原子结构:
①原子电子层数相同,核电荷数不断增多,原子序数不断增大,最外层电子数不断增多,最高正价不断升高,原子核对核外电子吸引能力逐渐增强,半径逐渐减小。
2. 元素性质:
②元素原子得电子能力逐渐增强,失电子能力逐渐减弱;元素金属性逐渐减弱,非金属性逐渐增强。
回顾
一、同周期元素性质递变规律(从左到右)
2. 元素性质:
③金属单质还原性越来越弱,对应阳离子氧化性越来越强;非金属单质氧化性越来越强,对应阴离子还原性越来越弱。
3. 外在表现:
④金属与水(或酸)反应置换出氢气的难易程度越来越困难;非金属与氢气反应难易程度越来越容易,气态氢化物的稳定性越来越强。
⑤最高价氧化物对应水化物的碱性越来越弱,酸性越来越强。
回顾
二、同主族元素性质递变规律(从上到下)
1. 原子结构:
①最外层电子数相同,性质相似,电子层数逐渐增多,电子离核距离越来越远,半径逐渐变大。
2. 元素性质:
②元素原子失电子能力逐渐增强,得电子能力逐渐减弱;元素金属性逐渐增强,非金属性逐渐减弱。
回顾
二、同主族元素性质递变规律(从上到下)
2. 元素性质:
③金属单质还原性越来越强,对应阳离子氧化性越来越弱;非金属单质氧化性越来越弱,对应阴离子还原性越来越强。
3. 外在表现:
④金属与水(或酸)反应置换出氢气的难易程度越来越容易;非金属与氢气反应难易程度越来越困难,气态氢化物的稳定性越来越弱。
⑤最高价氧化物对应水化物的碱性越来越强,酸性越来越弱。
一、原子半径及其变化规律
根据量子力学理论,在原子核外,从原子核附近到离核很远的地方,电子都有可能出现,因此原子并不是一个具有明确“边界”的实体,即原子并没有经典意义上的半径。
1. 原子半径的测定方法
方法一:根据固态单质的密度算出1mol原子的体积,再除以阿伏伽德罗常数,得到一个原子在固态单质中平均占有体积,进而得到原子半径。
方法二:制定化合物中两个相邻原子的核间距为两个原子的半径之和,再通过实验测定分子或固体中原子的核间距,从而求得相关原子的原子半径。(常用)
一、原子半径及其变化规律
2. 原子半径的种类
①共价半径:由共价分子或共价晶体中原子的核间距计算得出。
②范德华半径(范式半径):由分子晶体中共价分子之间的最短距离计算得出。
③金属半径:由金属晶体中原子之间的最短距离计算得出。
金属:有共价半径、金属半径。
稀有气体:只有范式半径。
非金属(除稀有气体):有共价半径和范式半径,且总有 r 范> r 共。
高中教材用共价半径,所以稀有气体半径与同周期其他元素无可比性。
一、原子半径及其变化规律
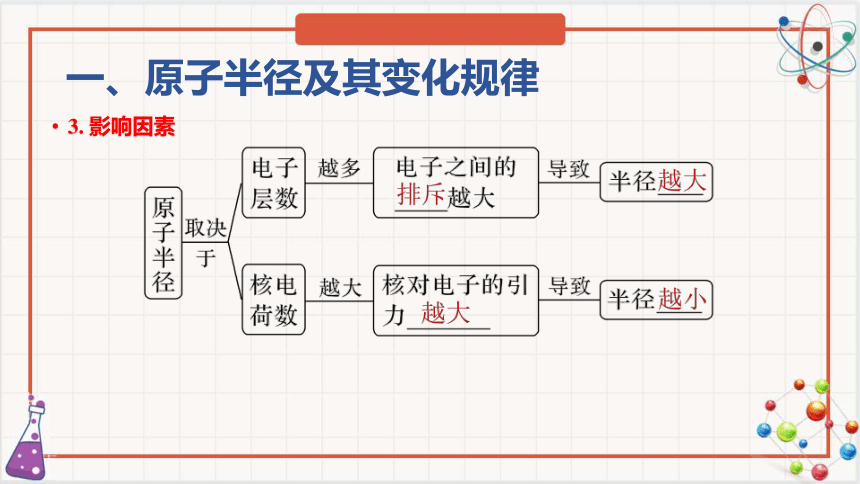
3. 影响因素
一、原子半径及其变化规律
4. 原子半径变化规律
同周期主族元素:从左到右,原子半径逐渐减小(除稀有气体元素外)。
增加电子产生的电子间的排斥作用小于核电荷增加核对外层电子的吸引作用。
同主族元素:从上到下,原子半径逐渐增大。
核电荷增加核对外层电子的吸引作用小于增加电子产生的电子间的排斥作用。
同周期副族元素:从左到右,原子半径呈递减趋势,但变化幅度不大。
增加的电子都分布在(n-1)d轨道上,它对外层电子的排斥作用与核电荷增加带来的核对电子的有效吸引作用大致相当。
一、原子半径及其变化规律
5. 比较微粒半径大小的规律
(1)同周期从左到右,原子半径依次减小。
(2)同主族从上到下,原子半径依次增大。
(3)同种元素形成的粒子半径
阳离子半径 < 原子半径,原子半径 < 阴离子半径,且阳离子价态越高,半径越小。
(4)核外电子数相同的微粒,核电荷数(或原子序数)越小,微粒半径越大。
(5)利用参照物比较核电荷数和电子数都不相同的微粒的半径。
判断正误
(1)原子半径就是最外层电子到原子核的实际距离( )
(2)同周期元素从左到右,原子半径逐渐增大( )
(3)同周期的过渡元素,从左到右原子半径一定减小( )
(4)同主族元素从上到下,随电子层数的增多,原子半径逐渐增大( )
×
×
×
√
跟踪强化
1、下列四种粒子中,半径按由大到小排列顺序正确的是( )
①基态X的原子结构示意图为
②基态Y的价电子排布式为3s23p5
③基态Z2-的轨道表示式为
④W基态原子有2个电子层,电子式为
A.①>②>③>④ B.③>④>①>②
C.③>①>②>④ D.①>②>④>③
C
S
Cl
S2-
F
二、元素电离能及其变化规律
对原子得失电子能力仅有定性分析不足以满足科学研究和生产实践的需要,人们在不断寻找能定量分析原子得失电子能力的方法。
1. 概念:气态基态原子或气态基态离子失去一个电子所需要的的最小能量称为电离能,常用符号 I 表示,单位为 KJ·mol-1。
2. 意义:电离能越小,表示在气态时该原子越容易失去电子;反之,电离能越大,表示在气态时该原子越难失去电子。
因此,运用电离能数值可以判断金属原子在气态时失去电子的难易程度。
二、元素电离能及其变化规律
3. 元素的逐级电离能
(1)第一电离能是指处于基态的气态原子失去一个电子,生成+1价气态阳离子所需要的能量,符号为 I1。
M(g)===M+(g)+e- I1
(2)第二电离能是指由+1价气态阳离子再失去一个电子形成+2 价气态阳离子所需要的能量,符号为 I2。依次还有第三电离能 I3,第四电离能 I4 等。
M+(g)===M2+(g)+e- I2
M2+(g)===M3+(g)+e- I3
(3)同一元素的电离能按I1、I2、I3……顺序,变化规律是依次增大。
二、元素电离能及其变化规律
4. 第一电离能变化规律(P24)
二、元素电离能及其变化规律
4. 第一电离能变化规律
(1)同一周期:从左到右,元素的 I1 总体上逐渐增大,原子越来越难失去电子。
原因:随着核电荷数增大,原子半径逐渐减小,核对外层电子的有效吸引作用依次增强。
(2)同一主族:自上而下,元素的 I1 逐渐减小,原子越来越容易失去电子。
原因:同主族元素原子的价电子数相同,原子半径逐渐增大,原子核对核外电子的有效吸引作用逐渐减弱。
二、元素电离能及其变化规律
4. 第一电离能变化规律
(3)过渡元素:过渡元素 I1 变化不太规则,同一周期,从左到右,I1 略有增加。
原因:对这些元素的原子来说,增加的电子大部分排布在 (n-1)d 或 (n-2)f 轨道上,原子核对外层电子的有效吸引作用变化不是太大。
(4)同周期 ⅡA 族和 ⅤA 族元素的 I1 的变化出现反常:
原因:ⅡA族的元素原子的最外层原子轨道为ns2全充满稳定状态;ⅤA 族元素原子的最外层原子轨道为np3半充满的稳定状态。
二、元素电离能及其变化规律
5. 应用
(1)判断元素金属性、非金属性的强弱
一般来说,第一电离能越大,非金属性越强;第一电离能越小,金属性越强。
(2)确定元素核外电子的排布
(3)确定元素的化合价
二、元素电离能及其变化规律
5. 应用:下表为Na、Mg、Al 的电离能(kJ·mol-1)。
(1)为什么同一元素的电离能逐级增大?
(2)钠原子为什么容易失去1个电子成为+1价的阳离子?
(3)上表中能够说明镁、铝原子通常分别形成Mg2+、Al3+的依据是什么?
元素 电离能 Na Mg Al
I1 496 738 577
I2 4 562 1 451 1 817
I3 6 912 7 733 2 745
I4 9 543 10 540 11 575
二、元素电离能及其变化规律
5. 应用:下表为Na、Mg、Al 的电离能(kJ·mol-1)。
(1)为什么同一元素的电离能逐级增大?
原子首先失去的是能量最高的电子,故第一电离能较小,原子失去电子后变成阳离子,离子半径变小,核电荷对电子的引力增强,从而使电离能逐级增大。
元素 电离能 Na Mg Al
I1 496 738 577
I2 4 562 1 451 1 817
I3 6 912 7 733 2 745
I4 9 543 10 540 11 575
二、元素电离能及其变化规律
5. 应用:下表为Na、Mg、Al 的电离能(kJ·mol-1)。
(2)钠原子为什么容易失去1个电子成为+1价的阳离子?
钠原子的I2 I1,说明钠原子很容易失去1个电子形成Na+,1s22s22p6稳定结构,核对外层电子的有效吸引作用变得更强。因此,钠元素常见价态为+1价。
元素 电离能 Na Mg Al
I1 496 738 577
I2 4 562 1 451 1 817
I3 6 912 7 733 2 745
I4 9 543 10 540 11 575
二、元素电离能及其变化规律
5. 应用:下表为Na、Mg、Al 的电离能(kJ·mol-1)。
(3)上表中能够说明镁、铝原子通常分别形成Mg2+、Al3+的依据是什么?
Mg形成+2价阳离子的依据是I3 I2。Al通常形成+3价阳离子的依据是I4 I3。
元素 电离能 Na Mg Al
I1 496 738 577
I2 4 562 1 451 1 817
I3 6 912 7 733 2 745
I4 9 543 10 540 11 575
二、元素电离能及其变化规律
5. 应用
(2)确定元素核外电子的排布
当相邻逐级电离能突然变大时,说明其电子层发生了变化,
即同一电子层中电离能相近,不同电子层中电离能有很大的差距。
(3)确定元素的化合价
如果 ,即电离能在 In 与 In+1 之间发生突变(4倍及以上),则元素的原子易形成+n 价离子,并且主族元素的最高化合价为+n 价。
追根寻源(鲁科版P24)
化学史话(沪教版、苏教版)
化学史话(沪教版、苏教版)
判断正误
(1)氮原子的原子半径及第一电离能都比氧原子的大( )
(2)M(g)===M2+(g)+2e-所需能量不是第二电离能( )
(3)同主族元素,随原子序数的递增,第一电离能逐渐减小( )
(4)原子的电离能大小:I1>I2>I3( )
(5)第一电离能小的元素的金属性一定强( )
√
√
×
√
×
三、电子亲和能
1. 概念:元素的气态原子(或离子)获得一个电子所放出的能量称为电子亲和能,单位为KJ·mol-1。
习惯上规定:体系放出能量时电子亲和能为正,体系吸收能量时电子亲和能为负。
2. 意义:电子亲和能反应元素的气态原子结合电子的难易程度。
元素的电子亲和能没有表现出简单的变化规律,且不易测定,准确性差,来自不同文献的数据往往不同,因此应用不如电离能广泛。
三、电子亲和能
【思考】氟的电子亲和能比氯小,为什么?
氟的原子半径过小,周围电子密度较大,当 F 形成 F- 时,电子之间互相排斥而消耗能量,放出的能量少。
跟踪强化
2、下列有关电离能的说法中,正确的是( )
A.第一电离能越大的原子失电子的能力越强
B.第一电离能是元素的原子失去核外第一个电子需要的能量
C.同一周期中,主族元素原子第一电离能从左到右越来越大
D.可通过一种元素各级电离能的数值,判断元素可能的化合价
D
跟踪强化
3、下列说法正确的是( )
A.第3周期所含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大
D.钾的第一电离能比镁的第一电离能大
A
跟踪强化
(2)[2019·全国卷Ⅰ,35(1)]下列状态的镁中,电离最外层一个电子所需能量最大的是_____(填标号)。
A
跟踪强化
5.元素的第一电离能(设其为I1)的周期性变化如图所示。
试根据元素在元素周期表中的位置,
分析图中曲线的变化特点,并回答下
列问题:
(3)推测气态基态钙原子失去最外层一个
电子所需能量的范围:_____________<I1<_____________。
419 kJ·mol-1 738 kJ·mol-1
1.3.1 原子半径、电离能及其变化规律
学习目标定位
1、了解原子半径的意义及其测定方法,知道原子半径与原子核外电子排布的关系,并能解释原子半径在周期表中的变化规律。
2、知道原子结构与元素性质间的关系规律,正确理解元素电离能的含义及其变化规律,会用电离能的概念分析解释元素的某些性质。
回顾
一、同周期元素性质递变规律(从左到右)
1. 原子结构:
①原子电子层数相同,核电荷数不断增多,原子序数不断增大,最外层电子数不断增多,最高正价不断升高,原子核对核外电子吸引能力逐渐增强,半径逐渐减小。
2. 元素性质:
②元素原子得电子能力逐渐增强,失电子能力逐渐减弱;元素金属性逐渐减弱,非金属性逐渐增强。
回顾
一、同周期元素性质递变规律(从左到右)
2. 元素性质:
③金属单质还原性越来越弱,对应阳离子氧化性越来越强;非金属单质氧化性越来越强,对应阴离子还原性越来越弱。
3. 外在表现:
④金属与水(或酸)反应置换出氢气的难易程度越来越困难;非金属与氢气反应难易程度越来越容易,气态氢化物的稳定性越来越强。
⑤最高价氧化物对应水化物的碱性越来越弱,酸性越来越强。
回顾
二、同主族元素性质递变规律(从上到下)
1. 原子结构:
①最外层电子数相同,性质相似,电子层数逐渐增多,电子离核距离越来越远,半径逐渐变大。
2. 元素性质:
②元素原子失电子能力逐渐增强,得电子能力逐渐减弱;元素金属性逐渐增强,非金属性逐渐减弱。
回顾
二、同主族元素性质递变规律(从上到下)
2. 元素性质:
③金属单质还原性越来越强,对应阳离子氧化性越来越弱;非金属单质氧化性越来越弱,对应阴离子还原性越来越强。
3. 外在表现:
④金属与水(或酸)反应置换出氢气的难易程度越来越容易;非金属与氢气反应难易程度越来越困难,气态氢化物的稳定性越来越弱。
⑤最高价氧化物对应水化物的碱性越来越强,酸性越来越弱。
一、原子半径及其变化规律
根据量子力学理论,在原子核外,从原子核附近到离核很远的地方,电子都有可能出现,因此原子并不是一个具有明确“边界”的实体,即原子并没有经典意义上的半径。
1. 原子半径的测定方法
方法一:根据固态单质的密度算出1mol原子的体积,再除以阿伏伽德罗常数,得到一个原子在固态单质中平均占有体积,进而得到原子半径。
方法二:制定化合物中两个相邻原子的核间距为两个原子的半径之和,再通过实验测定分子或固体中原子的核间距,从而求得相关原子的原子半径。(常用)
一、原子半径及其变化规律
2. 原子半径的种类
①共价半径:由共价分子或共价晶体中原子的核间距计算得出。
②范德华半径(范式半径):由分子晶体中共价分子之间的最短距离计算得出。
③金属半径:由金属晶体中原子之间的最短距离计算得出。
金属:有共价半径、金属半径。
稀有气体:只有范式半径。
非金属(除稀有气体):有共价半径和范式半径,且总有 r 范> r 共。
高中教材用共价半径,所以稀有气体半径与同周期其他元素无可比性。
一、原子半径及其变化规律
3. 影响因素
一、原子半径及其变化规律
4. 原子半径变化规律
同周期主族元素:从左到右,原子半径逐渐减小(除稀有气体元素外)。
增加电子产生的电子间的排斥作用小于核电荷增加核对外层电子的吸引作用。
同主族元素:从上到下,原子半径逐渐增大。
核电荷增加核对外层电子的吸引作用小于增加电子产生的电子间的排斥作用。
同周期副族元素:从左到右,原子半径呈递减趋势,但变化幅度不大。
增加的电子都分布在(n-1)d轨道上,它对外层电子的排斥作用与核电荷增加带来的核对电子的有效吸引作用大致相当。
一、原子半径及其变化规律
5. 比较微粒半径大小的规律
(1)同周期从左到右,原子半径依次减小。
(2)同主族从上到下,原子半径依次增大。
(3)同种元素形成的粒子半径
阳离子半径 < 原子半径,原子半径 < 阴离子半径,且阳离子价态越高,半径越小。
(4)核外电子数相同的微粒,核电荷数(或原子序数)越小,微粒半径越大。
(5)利用参照物比较核电荷数和电子数都不相同的微粒的半径。
判断正误
(1)原子半径就是最外层电子到原子核的实际距离( )
(2)同周期元素从左到右,原子半径逐渐增大( )
(3)同周期的过渡元素,从左到右原子半径一定减小( )
(4)同主族元素从上到下,随电子层数的增多,原子半径逐渐增大( )
×
×
×
√
跟踪强化
1、下列四种粒子中,半径按由大到小排列顺序正确的是( )
①基态X的原子结构示意图为
②基态Y的价电子排布式为3s23p5
③基态Z2-的轨道表示式为
④W基态原子有2个电子层,电子式为
A.①>②>③>④ B.③>④>①>②
C.③>①>②>④ D.①>②>④>③
C
S
Cl
S2-
F
二、元素电离能及其变化规律
对原子得失电子能力仅有定性分析不足以满足科学研究和生产实践的需要,人们在不断寻找能定量分析原子得失电子能力的方法。
1. 概念:气态基态原子或气态基态离子失去一个电子所需要的的最小能量称为电离能,常用符号 I 表示,单位为 KJ·mol-1。
2. 意义:电离能越小,表示在气态时该原子越容易失去电子;反之,电离能越大,表示在气态时该原子越难失去电子。
因此,运用电离能数值可以判断金属原子在气态时失去电子的难易程度。
二、元素电离能及其变化规律
3. 元素的逐级电离能
(1)第一电离能是指处于基态的气态原子失去一个电子,生成+1价气态阳离子所需要的能量,符号为 I1。
M(g)===M+(g)+e- I1
(2)第二电离能是指由+1价气态阳离子再失去一个电子形成+2 价气态阳离子所需要的能量,符号为 I2。依次还有第三电离能 I3,第四电离能 I4 等。
M+(g)===M2+(g)+e- I2
M2+(g)===M3+(g)+e- I3
(3)同一元素的电离能按I1、I2、I3……顺序,变化规律是依次增大。
二、元素电离能及其变化规律
4. 第一电离能变化规律(P24)
二、元素电离能及其变化规律
4. 第一电离能变化规律
(1)同一周期:从左到右,元素的 I1 总体上逐渐增大,原子越来越难失去电子。
原因:随着核电荷数增大,原子半径逐渐减小,核对外层电子的有效吸引作用依次增强。
(2)同一主族:自上而下,元素的 I1 逐渐减小,原子越来越容易失去电子。
原因:同主族元素原子的价电子数相同,原子半径逐渐增大,原子核对核外电子的有效吸引作用逐渐减弱。
二、元素电离能及其变化规律
4. 第一电离能变化规律
(3)过渡元素:过渡元素 I1 变化不太规则,同一周期,从左到右,I1 略有增加。
原因:对这些元素的原子来说,增加的电子大部分排布在 (n-1)d 或 (n-2)f 轨道上,原子核对外层电子的有效吸引作用变化不是太大。
(4)同周期 ⅡA 族和 ⅤA 族元素的 I1 的变化出现反常:
原因:ⅡA族的元素原子的最外层原子轨道为ns2全充满稳定状态;ⅤA 族元素原子的最外层原子轨道为np3半充满的稳定状态。
二、元素电离能及其变化规律
5. 应用
(1)判断元素金属性、非金属性的强弱
一般来说,第一电离能越大,非金属性越强;第一电离能越小,金属性越强。
(2)确定元素核外电子的排布
(3)确定元素的化合价
二、元素电离能及其变化规律
5. 应用:下表为Na、Mg、Al 的电离能(kJ·mol-1)。
(1)为什么同一元素的电离能逐级增大?
(2)钠原子为什么容易失去1个电子成为+1价的阳离子?
(3)上表中能够说明镁、铝原子通常分别形成Mg2+、Al3+的依据是什么?
元素 电离能 Na Mg Al
I1 496 738 577
I2 4 562 1 451 1 817
I3 6 912 7 733 2 745
I4 9 543 10 540 11 575
二、元素电离能及其变化规律
5. 应用:下表为Na、Mg、Al 的电离能(kJ·mol-1)。
(1)为什么同一元素的电离能逐级增大?
原子首先失去的是能量最高的电子,故第一电离能较小,原子失去电子后变成阳离子,离子半径变小,核电荷对电子的引力增强,从而使电离能逐级增大。
元素 电离能 Na Mg Al
I1 496 738 577
I2 4 562 1 451 1 817
I3 6 912 7 733 2 745
I4 9 543 10 540 11 575
二、元素电离能及其变化规律
5. 应用:下表为Na、Mg、Al 的电离能(kJ·mol-1)。
(2)钠原子为什么容易失去1个电子成为+1价的阳离子?
钠原子的I2 I1,说明钠原子很容易失去1个电子形成Na+,1s22s22p6稳定结构,核对外层电子的有效吸引作用变得更强。因此,钠元素常见价态为+1价。
元素 电离能 Na Mg Al
I1 496 738 577
I2 4 562 1 451 1 817
I3 6 912 7 733 2 745
I4 9 543 10 540 11 575
二、元素电离能及其变化规律
5. 应用:下表为Na、Mg、Al 的电离能(kJ·mol-1)。
(3)上表中能够说明镁、铝原子通常分别形成Mg2+、Al3+的依据是什么?
Mg形成+2价阳离子的依据是I3 I2。Al通常形成+3价阳离子的依据是I4 I3。
元素 电离能 Na Mg Al
I1 496 738 577
I2 4 562 1 451 1 817
I3 6 912 7 733 2 745
I4 9 543 10 540 11 575
二、元素电离能及其变化规律
5. 应用
(2)确定元素核外电子的排布
当相邻逐级电离能突然变大时,说明其电子层发生了变化,
即同一电子层中电离能相近,不同电子层中电离能有很大的差距。
(3)确定元素的化合价
如果 ,即电离能在 In 与 In+1 之间发生突变(4倍及以上),则元素的原子易形成+n 价离子,并且主族元素的最高化合价为+n 价。
追根寻源(鲁科版P24)
化学史话(沪教版、苏教版)
化学史话(沪教版、苏教版)
判断正误
(1)氮原子的原子半径及第一电离能都比氧原子的大( )
(2)M(g)===M2+(g)+2e-所需能量不是第二电离能( )
(3)同主族元素,随原子序数的递增,第一电离能逐渐减小( )
(4)原子的电离能大小:I1>I2>I3( )
(5)第一电离能小的元素的金属性一定强( )
√
√
×
√
×
三、电子亲和能
1. 概念:元素的气态原子(或离子)获得一个电子所放出的能量称为电子亲和能,单位为KJ·mol-1。
习惯上规定:体系放出能量时电子亲和能为正,体系吸收能量时电子亲和能为负。
2. 意义:电子亲和能反应元素的气态原子结合电子的难易程度。
元素的电子亲和能没有表现出简单的变化规律,且不易测定,准确性差,来自不同文献的数据往往不同,因此应用不如电离能广泛。
三、电子亲和能
【思考】氟的电子亲和能比氯小,为什么?
氟的原子半径过小,周围电子密度较大,当 F 形成 F- 时,电子之间互相排斥而消耗能量,放出的能量少。
跟踪强化
2、下列有关电离能的说法中,正确的是( )
A.第一电离能越大的原子失电子的能力越强
B.第一电离能是元素的原子失去核外第一个电子需要的能量
C.同一周期中,主族元素原子第一电离能从左到右越来越大
D.可通过一种元素各级电离能的数值,判断元素可能的化合价
D
跟踪强化
3、下列说法正确的是( )
A.第3周期所含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大
D.钾的第一电离能比镁的第一电离能大
A
跟踪强化
(2)[2019·全国卷Ⅰ,35(1)]下列状态的镁中,电离最外层一个电子所需能量最大的是_____(填标号)。
A
跟踪强化
5.元素的第一电离能(设其为I1)的周期性变化如图所示。
试根据元素在元素周期表中的位置,
分析图中曲线的变化特点,并回答下
列问题:
(3)推测气态基态钙原子失去最外层一个
电子所需能量的范围:_____________<I1<_____________。
419 kJ·mol-1 738 kJ·mol-1
