1.1量子力学对原子核外电子运动状态的描述(共32张PPT) 2024-2025学年鲁科版(2019)高中化学选择性必修2
文档属性
| 名称 | 1.1量子力学对原子核外电子运动状态的描述(共32张PPT) 2024-2025学年鲁科版(2019)高中化学选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 65.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 20:10:38 | ||
图片预览








文档简介
(共32张PPT)
1.1 量子力学对原子核外电子运动状态的描述
二、量子力学对原子核外电子运动状态的描述
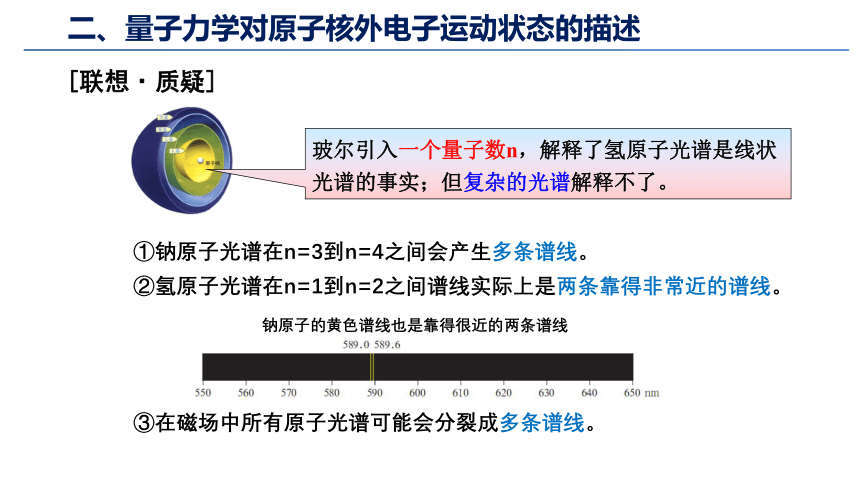
玻尔引入一个量子数n,解释了氢原子光谱是线状光谱的事实;但复杂的光谱解释不了。
[联想·质疑]
①钠原子光谱在n=3到n=4之间会产生多条谱线。
②氢原子光谱在n=1到n=2之间谱线实际上是两条靠得非常近的谱线。
钠原子的黄色谱线也是靠得很近的两条谱线
③在磁场中所有原子光谱可能会分裂成多条谱线。
二、量子力学对原子核外电子运动状态的描述
原子中电子的运动状态应用四个量子数来描述。
量子力学理论
——20 世纪 20 年代中期建立
二、量子力学对原子核外电子运动状态的描述
1. 电子层(能层) n
描述原子轨道离核的远近
分层标准 电子离核的远近
电子层(n) 1 2 3 4 5 6 7
符号 __ __ __ __ __ __ __
能量 _______
离核 _______
K
L
M
N
O
P
Q
低→高
近→远
二、量子力学对原子核外电子运动状态的描述
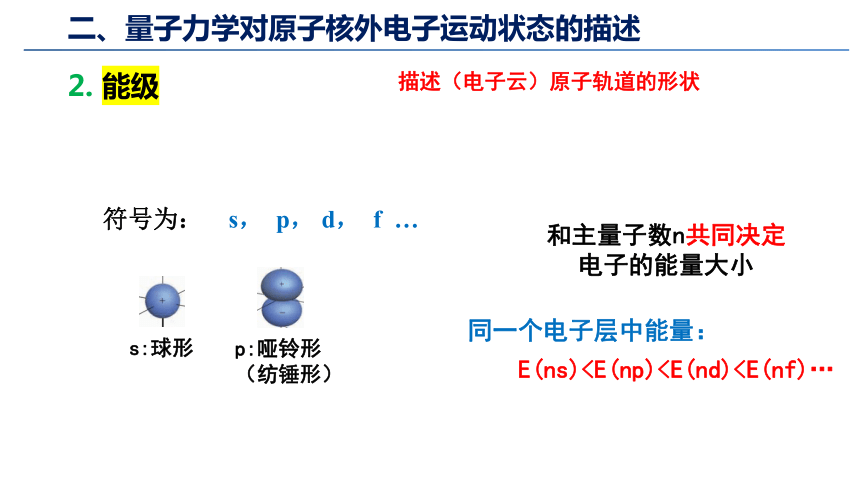
2. 能级
描述(电子云)原子轨道的形状
符号为: s, p, d, f …
s:球形
p:哑铃形
(纺锤形)
和主量子数n共同决定电子的能量大小
同一个电子层中能量:
E(ns)二、量子力学对原子核外电子运动状态的描述
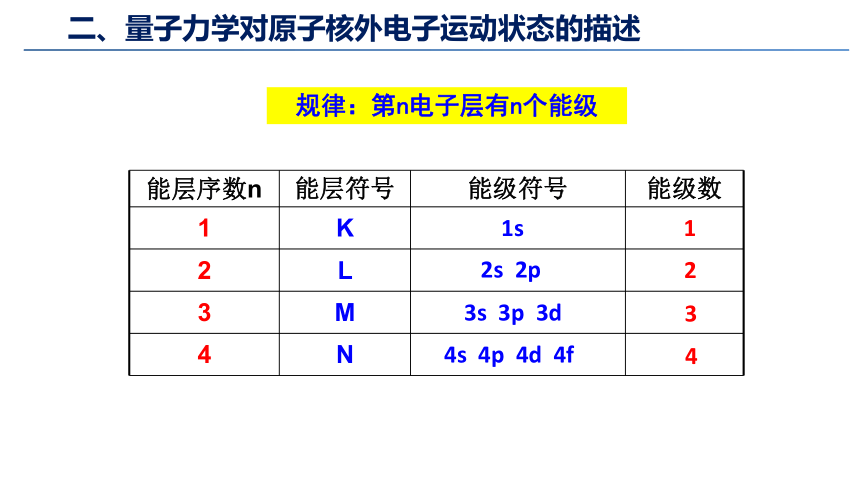
能层序数n 能层符号 能级符号 能级数
1 K
2 L
3 M
4 N
规律:第n电子层有n个能级
1
2
3
4
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
二、量子力学对原子核外电子运动状态的描述
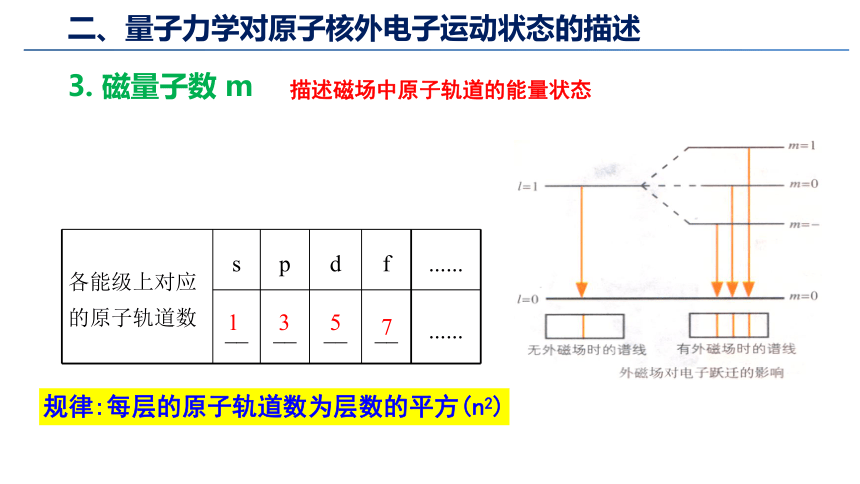
3. 磁量子数 m
描述磁场中原子轨道的能量状态
各能级上对应的原子轨道数 s p d f ......
__ __ __ __ ......
1
3
5
7
规律:每层的原子轨道数为层数的平方(n2)
二、量子力学对原子核外电子运动状态的描述
4. 自旋量子数 ms
描述在能量完全相同时电子运动的特殊状态(电子自旋状态)
ms = +1/2 (通常用符号 ↑ 表示)
ms = -1/2 (通常用符号 ↓ 表示)
轨道的标记——量子数
主量子数n:主要决定原子轨道能量的高低
角量子数l:和主量子数一起决定轨道的能量
磁量子数m:没有磁场时能量相同,不同的m与磁场的作用不同其能量不同
自旋:一种奇特的量子化运动
自旋量子数ms
一组n、l、m、ms确定一个电子,没有任何两个电子的运动状态相同。(泡利不相容原理)
原子中电子的运动状态应用多个量子数来描述.
量子力学中单个电子的空间运动状态称为原子轨道.
二、量子力学对原子核外运动状态的描述
1.原子轨道
电子层
(1)含义:量子数n所描述的电子运动状态称为电子层,n的取值为正整数1、2、3、4、5、6等,对应的符号分别为K、L、M、N、O、P等。
(2)电子的能量与电子层的关系一般而言,n越大,电子离核的平均距离越远,电子具有的能量越高。
能级
(1)含义:在含有多个电子的原子中,同一电子层的电子,能量也可能不同,可以把它们分为不同能级,当n=x时,有x个能级,分别用s、p、d、f等表示。
(2)电子的能量与能级的关系
多电子原子中,同一电子层各能级的能量顺序为E(ns)< E(np)电子层(n) 1 2 3 4 5
电子层符号
能级
最多电子数
电子层、能级和原子轨道的关系
K
L
M
N
O
1s
2s
2p
3s
3p
3d
4s
4p
4f
5s
4d
……
2
2
6
2
6
10
2
6
14
2
10
……
2
8
18
32
2n2(n代表
电子层数)
自旋
核外运动的电子还存在一种被称为“自旋”的量子化状态。处于同一原子轨道上的电子自旋状态只能有两种,分别用符号“↑”和“↓”表示。
二、量子力学对原子核外电子运动状态的描述
原子轨道示意图:
二、量子力学对原子核外电子运动状态的描述
d 轨道(l = 2, m = +2, +1, 0, -1, -2)
m 五种取值, 空间五种取向, 五条等价(简并) d 轨道。
二、量子力学对原子核外电子运动状态的描述
f 轨道 ( l = 3, m = +3, +2, +1, 0, -1, -2, -3 )
m 七种取值, 空间七种取向, 七条等价(简并) f 轨道。
二、量子力学对原子核外电子运动状态的描述
【小结】原子中电子的运动状态由四个因素来决定。
量子力学中单个电子的空间运动状态称为原子轨道。
②能级 描述原子轨道的形状
③原子轨道 决定原子轨道的空间取向
④电子自旋
①电子层(能层)n 描述原子轨道离核的远近
一个原子中不存在运动状态相同的电子。
例:Na原子核外有 个电子,有 种运动状态。
利用①电子层②能级③原子轨道可以描述一个电子的空间运动状态,即可将一个原子轨道描述出来。
11
11
二、量子力学对原子核外电子运动状态的描述
电子云:描述电子在空间出现的概率大小的图形.
量
子
理
论
释
疑
问:层是什么?
答:层不是层。
问:“轨道”是什么?
答:“轨道”不是轨迹。
问:“自旋”是什么?
答:“自旋”不是旋转。
问:量子数什么含义?
答:就是个数。
问:波函数是什么?
答:不知道。
问:……要这些干嘛?
答:量子数→波函数→概率和能量
原子——核与电子相互作用的能量较低的稳定状态
轨道
磁场
轨道的图示
三、基态原子的核外电子排布
Na
K
L
M
2
2s
2p
3d
1s
8
1
3s
3p
2
2
2
2
2
1
原则一:能量最低原理
基态原子核外电子总是尽可能先排布在能量最低的轨道上,然后由里及外依次排布在能量较高的轨道上。也可以说,核外电子遵循的排布规则使整个原子的能量处于最低状态。
三、基态原子的核外电子排布
Na
K
L
M
2
2s
2p
3d
1s
8
1
3s
3p
2
2
2
2
2
1
原则二:泡利不相容原理
一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋状态不同。
He
↑↑
↑↓
三、基态原子的核外电子排布
Na
K
L
M
2
2s
2p
3d
1s
8
1
3s
3p
2
2
2
2
2
1
原则三:洪特规则
对于基态原子,核外电子在能量相同的原子轨道上排布时,将尽可能分占不同的原子轨道并且自旋状态相同,使体系的总能量达到最低。
氮(N)
三、基态原子的核外电子排布
方法引导
核外电子排布的表示方法
1.电子排布式
2.轨道表示式
在ns、np、nd等符号的右上角用数字表示出电子的数目。
1s22s22p63s1
钠
用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。
钠
三、基态原子的核外电子排布
构造原理
为了使整个原子体系的能量最低,随着原子序数的递增,基态原子的"外层电子"按照箭头的方向依次排布在各原子轨道上∶
1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、 6s……
电子填满了一个能级,开始填入下一个能级。
三、基态原子的核外电子排布
写出Mn元素(25号)基态原子的电子排布式和轨道表示式。
1s22s22p63s23p63d54s2
电子按构造原理顺序在原子轨道上排布,但书写电子排布式或轨道表示式时,应按电子层数由小到大的顺序书写。
排布顺序:1s 2s 2p 3s 3p 4s 3d 4p
书写顺序:1s 2s 2p 3s 3p 3d 4s 4p
三、基态原子的核外电子排布
1s22s22p63s23p63d44s2
1s22s22p63s23p63d104s1
1s22s22p63s23p63d54s1
1s22s22p63s23p63d94s2
铬Cr:
铜Cu:
半满
全满
写出Cr、Cu元素基态原子的电子排布式和轨道表示式。
24
29
洪特通过分析光谱实验的结果指出,能量相同的原子轨道在全充满(如 d10)、半充满(如 d5)和全空(如 d0)状态时,体系的能量较低。 ——洪特规则的特例(没有普适性)
1.1 量子力学对原子核外电子运动状态的描述
二、量子力学对原子核外电子运动状态的描述
玻尔引入一个量子数n,解释了氢原子光谱是线状光谱的事实;但复杂的光谱解释不了。
[联想·质疑]
①钠原子光谱在n=3到n=4之间会产生多条谱线。
②氢原子光谱在n=1到n=2之间谱线实际上是两条靠得非常近的谱线。
钠原子的黄色谱线也是靠得很近的两条谱线
③在磁场中所有原子光谱可能会分裂成多条谱线。
二、量子力学对原子核外电子运动状态的描述
原子中电子的运动状态应用四个量子数来描述。
量子力学理论
——20 世纪 20 年代中期建立
二、量子力学对原子核外电子运动状态的描述
1. 电子层(能层) n
描述原子轨道离核的远近
分层标准 电子离核的远近
电子层(n) 1 2 3 4 5 6 7
符号 __ __ __ __ __ __ __
能量 _______
离核 _______
K
L
M
N
O
P
Q
低→高
近→远
二、量子力学对原子核外电子运动状态的描述
2. 能级
描述(电子云)原子轨道的形状
符号为: s, p, d, f …
s:球形
p:哑铃形
(纺锤形)
和主量子数n共同决定电子的能量大小
同一个电子层中能量:
E(ns)
能层序数n 能层符号 能级符号 能级数
1 K
2 L
3 M
4 N
规律:第n电子层有n个能级
1
2
3
4
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
二、量子力学对原子核外电子运动状态的描述
3. 磁量子数 m
描述磁场中原子轨道的能量状态
各能级上对应的原子轨道数 s p d f ......
__ __ __ __ ......
1
3
5
7
规律:每层的原子轨道数为层数的平方(n2)
二、量子力学对原子核外电子运动状态的描述
4. 自旋量子数 ms
描述在能量完全相同时电子运动的特殊状态(电子自旋状态)
ms = +1/2 (通常用符号 ↑ 表示)
ms = -1/2 (通常用符号 ↓ 表示)
轨道的标记——量子数
主量子数n:主要决定原子轨道能量的高低
角量子数l:和主量子数一起决定轨道的能量
磁量子数m:没有磁场时能量相同,不同的m与磁场的作用不同其能量不同
自旋:一种奇特的量子化运动
自旋量子数ms
一组n、l、m、ms确定一个电子,没有任何两个电子的运动状态相同。(泡利不相容原理)
原子中电子的运动状态应用多个量子数来描述.
量子力学中单个电子的空间运动状态称为原子轨道.
二、量子力学对原子核外运动状态的描述
1.原子轨道
电子层
(1)含义:量子数n所描述的电子运动状态称为电子层,n的取值为正整数1、2、3、4、5、6等,对应的符号分别为K、L、M、N、O、P等。
(2)电子的能量与电子层的关系一般而言,n越大,电子离核的平均距离越远,电子具有的能量越高。
能级
(1)含义:在含有多个电子的原子中,同一电子层的电子,能量也可能不同,可以把它们分为不同能级,当n=x时,有x个能级,分别用s、p、d、f等表示。
(2)电子的能量与能级的关系
多电子原子中,同一电子层各能级的能量顺序为E(ns)< E(np)
电子层符号
能级
最多电子数
电子层、能级和原子轨道的关系
K
L
M
N
O
1s
2s
2p
3s
3p
3d
4s
4p
4f
5s
4d
……
2
2
6
2
6
10
2
6
14
2
10
……
2
8
18
32
2n2(n代表
电子层数)
自旋
核外运动的电子还存在一种被称为“自旋”的量子化状态。处于同一原子轨道上的电子自旋状态只能有两种,分别用符号“↑”和“↓”表示。
二、量子力学对原子核外电子运动状态的描述
原子轨道示意图:
二、量子力学对原子核外电子运动状态的描述
d 轨道(l = 2, m = +2, +1, 0, -1, -2)
m 五种取值, 空间五种取向, 五条等价(简并) d 轨道。
二、量子力学对原子核外电子运动状态的描述
f 轨道 ( l = 3, m = +3, +2, +1, 0, -1, -2, -3 )
m 七种取值, 空间七种取向, 七条等价(简并) f 轨道。
二、量子力学对原子核外电子运动状态的描述
【小结】原子中电子的运动状态由四个因素来决定。
量子力学中单个电子的空间运动状态称为原子轨道。
②能级 描述原子轨道的形状
③原子轨道 决定原子轨道的空间取向
④电子自旋
①电子层(能层)n 描述原子轨道离核的远近
一个原子中不存在运动状态相同的电子。
例:Na原子核外有 个电子,有 种运动状态。
利用①电子层②能级③原子轨道可以描述一个电子的空间运动状态,即可将一个原子轨道描述出来。
11
11
二、量子力学对原子核外电子运动状态的描述
电子云:描述电子在空间出现的概率大小的图形.
量
子
理
论
释
疑
问:层是什么?
答:层不是层。
问:“轨道”是什么?
答:“轨道”不是轨迹。
问:“自旋”是什么?
答:“自旋”不是旋转。
问:量子数什么含义?
答:就是个数。
问:波函数是什么?
答:不知道。
问:……要这些干嘛?
答:量子数→波函数→概率和能量
原子——核与电子相互作用的能量较低的稳定状态
轨道
磁场
轨道的图示
三、基态原子的核外电子排布
Na
K
L
M
2
2s
2p
3d
1s
8
1
3s
3p
2
2
2
2
2
1
原则一:能量最低原理
基态原子核外电子总是尽可能先排布在能量最低的轨道上,然后由里及外依次排布在能量较高的轨道上。也可以说,核外电子遵循的排布规则使整个原子的能量处于最低状态。
三、基态原子的核外电子排布
Na
K
L
M
2
2s
2p
3d
1s
8
1
3s
3p
2
2
2
2
2
1
原则二:泡利不相容原理
一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋状态不同。
He
↑↑
↑↓
三、基态原子的核外电子排布
Na
K
L
M
2
2s
2p
3d
1s
8
1
3s
3p
2
2
2
2
2
1
原则三:洪特规则
对于基态原子,核外电子在能量相同的原子轨道上排布时,将尽可能分占不同的原子轨道并且自旋状态相同,使体系的总能量达到最低。
氮(N)
三、基态原子的核外电子排布
方法引导
核外电子排布的表示方法
1.电子排布式
2.轨道表示式
在ns、np、nd等符号的右上角用数字表示出电子的数目。
1s22s22p63s1
钠
用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。
钠
三、基态原子的核外电子排布
构造原理
为了使整个原子体系的能量最低,随着原子序数的递增,基态原子的"外层电子"按照箭头的方向依次排布在各原子轨道上∶
1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、 6s……
电子填满了一个能级,开始填入下一个能级。
三、基态原子的核外电子排布
写出Mn元素(25号)基态原子的电子排布式和轨道表示式。
1s22s22p63s23p63d54s2
电子按构造原理顺序在原子轨道上排布,但书写电子排布式或轨道表示式时,应按电子层数由小到大的顺序书写。
排布顺序:1s 2s 2p 3s 3p 4s 3d 4p
书写顺序:1s 2s 2p 3s 3p 3d 4s 4p
三、基态原子的核外电子排布
1s22s22p63s23p63d44s2
1s22s22p63s23p63d104s1
1s22s22p63s23p63d54s1
1s22s22p63s23p63d94s2
铬Cr:
铜Cu:
半满
全满
写出Cr、Cu元素基态原子的电子排布式和轨道表示式。
24
29
洪特通过分析光谱实验的结果指出,能量相同的原子轨道在全充满(如 d10)、半充满(如 d5)和全空(如 d0)状态时,体系的能量较低。 ——洪特规则的特例(没有普适性)
