3.2.2第三章第二节几种简单的晶体结构模型第2课时 (共33张PPT)2024-2025学年鲁科版(2019)高中化学选择性必修2
文档属性
| 名称 | 3.2.2第三章第二节几种简单的晶体结构模型第2课时 (共33张PPT)2024-2025学年鲁科版(2019)高中化学选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-10 00:00:00 | ||
图片预览



文档简介
(共33张PPT)
第三章第2节
几种简单的晶体结构模型
第2课时 离子晶体
学习目标
掌握典型的四种离子晶体结构模型
了解离子晶体结构与性质的关系
二、离子晶体
⑴定义:是阴、阳离子在空间呈现周期性重复排列所形成的晶体。
⑵构成离子晶体的微粒:阴、阳离子。
⑶离子晶体中微粒间的作用力:离子键(无饱和性、方向性)。
⑷常见的离子晶体:强碱、大多数盐、活泼金属氧化物。
1、离子晶体的概念
⑸影响离子键强弱的因素:
①离子半径(阴阳离子的核间距)②离子所带电荷数
离子半径越小,离子所带电荷数越多,离子键越强、离子晶体的熔点越高。
2、几种离子晶体的结构
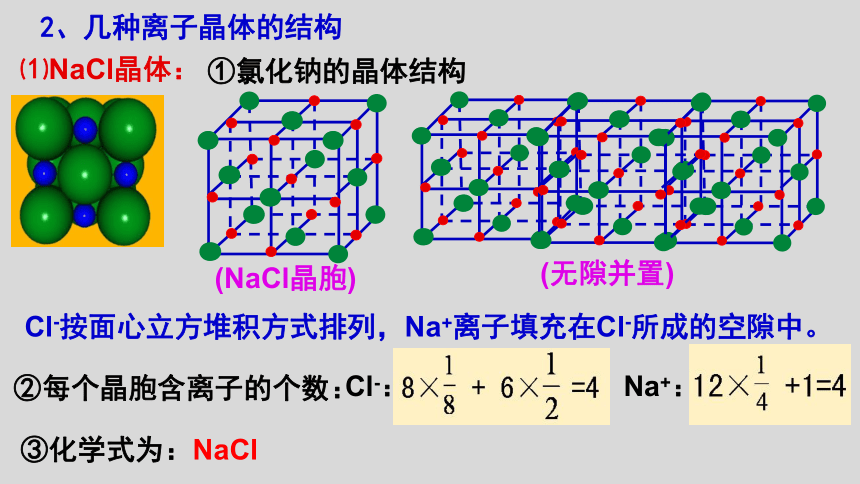
⑴NaCl晶体:
①氯化钠的晶体结构
Cl-按面心立方堆积方式排列,Na+离子填充在Cl-所成的空隙中。
(无隙并置)
(NaCl晶胞)
②每个晶胞含离子的个数:
③化学式为:NaCl
Na+:
Cl-:
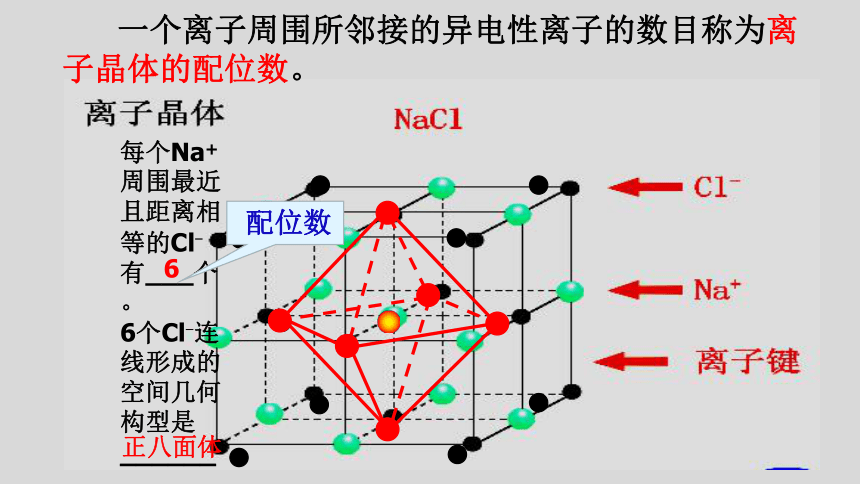
每个Na+
周围最近且距离相等的Cl-有___个。
6个Cl-连线形成的空间几何构型是______。
配位数
一个离子周围所邻接的异电性离子的数目称为离子晶体的配位数。
6
正八面体
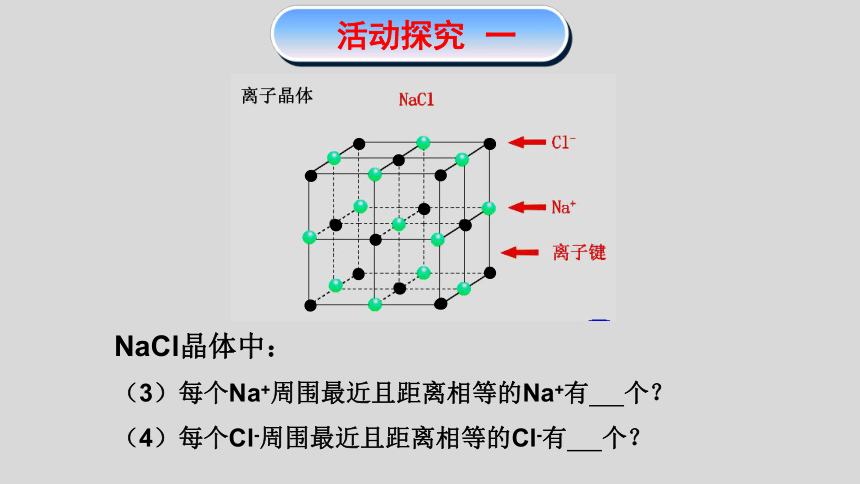
活动探究 一
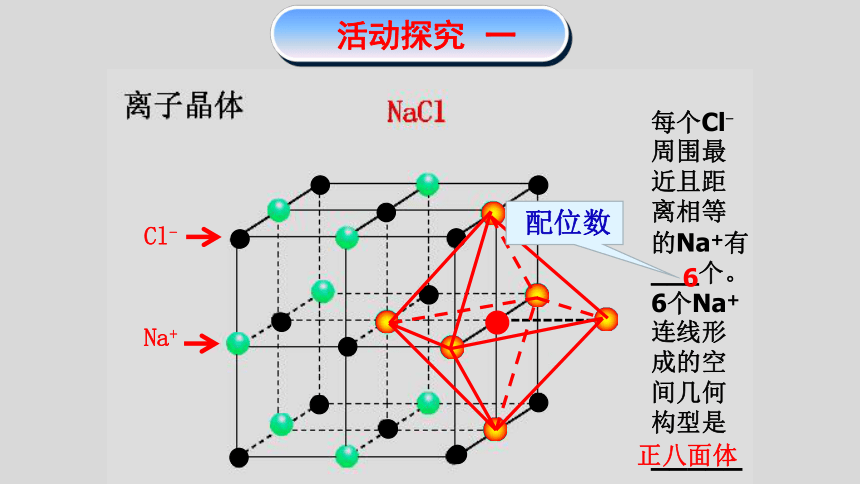
Na+
Cl-
每个Cl-
周围最近且距离相等的Na+有___个。
6个Na+连线形成的空间几何构型是
_____。
配位数
6
正八面体
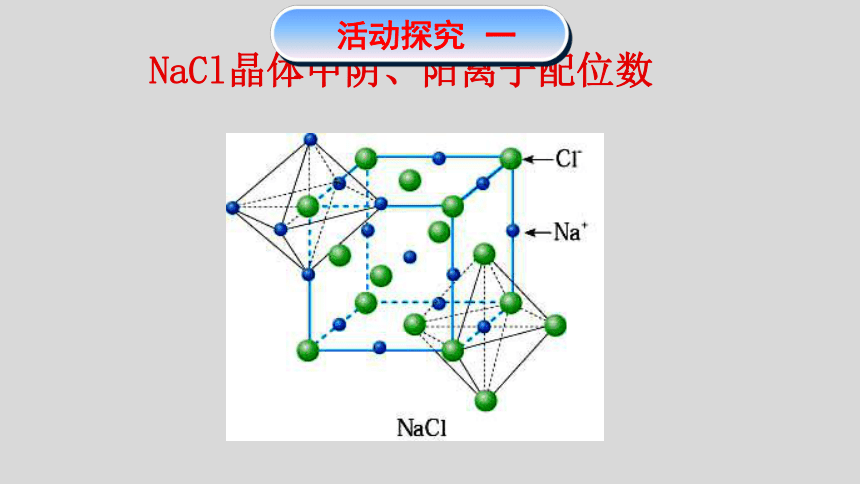
NaCl晶体中阴、阳离子配位数
活动探究 一
活动探究 一
NaCl晶体中:
(3)每个Na+周围最近且距离相等的Na+有 个?
(4)每个Cl-周围最近且距离相等的Cl-有 个?
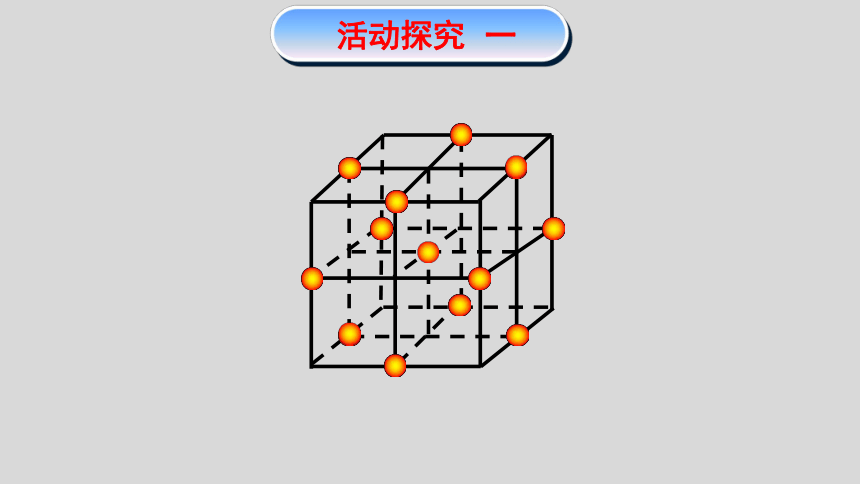
活动探究 一
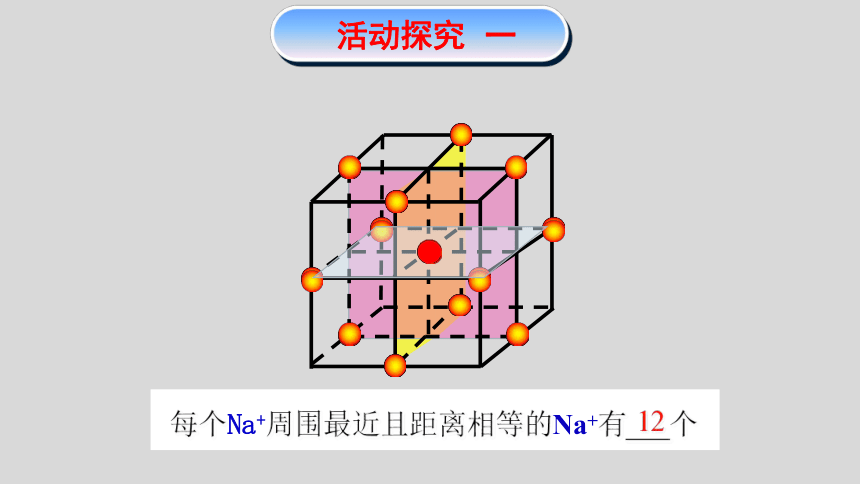
每个Na+周围最近且距离相等的Na+有___个
活动探究 一
12
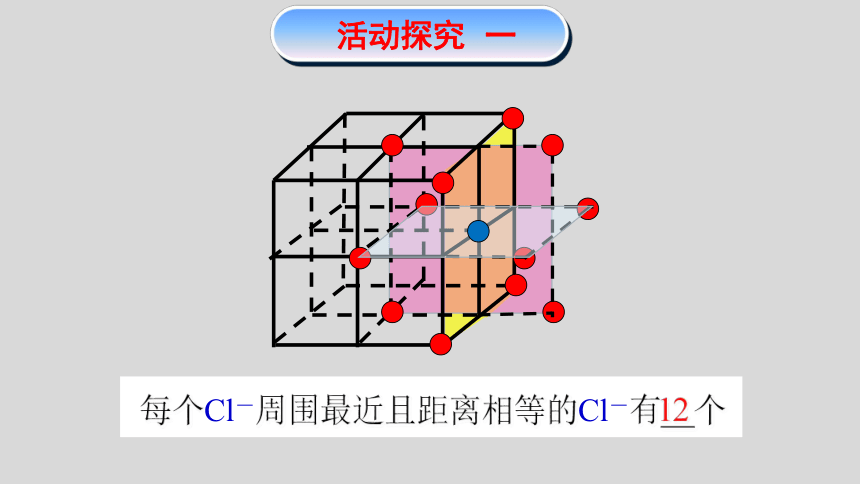
每个Cl-周围最近且距离相等的Cl-有__个
活动探究 一
12
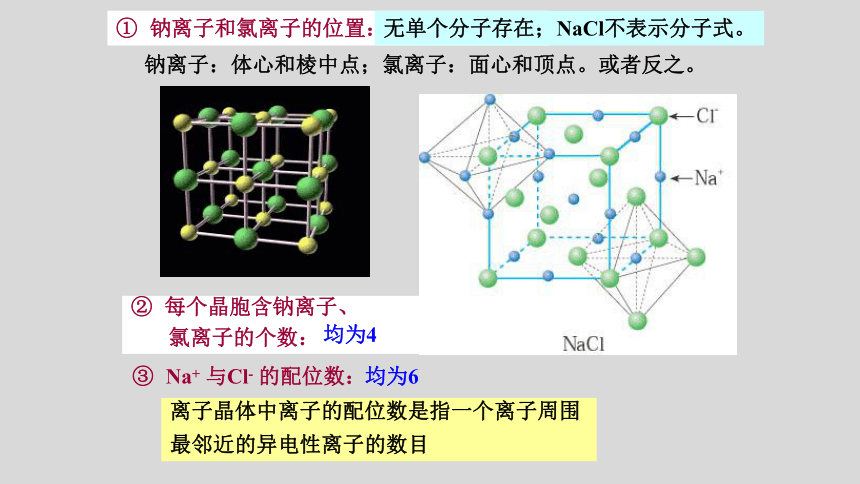
① 钠离子和氯离子的位置:
钠离子:体心和棱中点;氯离子:面心和顶点。或者反之。
③ Na+ 与Cl- 的配位数:
② 每个晶胞含钠离子、
氯离子的个数:
均为4
离子晶体中离子的配位数是指一个离子周围
最邻近的异电性离子的数目
均为6
无单个分子存在;NaCl不表示分子式。
(NaCl晶胞)
④晶体中Na+ 与Cl-的具体关系:
每个Na+周围最近且等距离的Cl-有几个?
每个 Cl- 周围最近且等距离的 Na+呢?
与一个Cl-(Na+ )相邻最近且距离相等的Cl-(Na+ )有多少个?
6个
6个
12个
⑤晶体中Na+ 与Cl-的空间坐标(以晶胞参数(棱长)a为单位长度):
注意:坐标原点的选择,坐标轴的方向,坐标轴单位(晶胞棱长)
(0,0,0)
Cl-
Na+
(0.5,0,0)
(1,0,0.5)
(0.5,0.5,1)
(1,1,1)
(0.5,0.5,0.5)
a
⑵CsCl晶体:
①氯化铯的晶体结构
Cl-按简单立方堆积方式排列,Cs+离子填在Cl-所成的空隙中。
CsCl晶胞
每个晶胞中: Cl-个数为8×1/8=1 Cs+个数为 1
③化学式的确定:CsCl
②每个晶胞含离子的个数:
(无隙并置)
Cl-
Cs+
在CsCl晶体的一个晶胞中Cl-的个数等于___,Cs+的个数等于___
8× =1
1 × 1 =1
1
1
Cs+:Cl- =1:1,晶胞还呈电中性。
由此可见,在离子晶体中,其实并不存在单独的“CsCl”分子,只是在整个晶体中Cs+与Cl-的个数比为1:1,因此CsCl”这一化学式表示的只是氯化铯的组成。
活动探究 二
顶点:
体心:
Cl-
Cs+
CsCl晶体中:
(1)每个Cs+周围最近且距离相等的Cl-有 个?
(2)每个Cl-周围最近且距离相等的Cs+有 个?
(3)每个Cs+周围最近且距离相等的Cs+有 个?
(4)每个Cl-周围最近且距离相等的Cl-有 个?
活动探究 二
CsCl的晶体结构及晶胞构示意图
CsCl晶体中:
(1)每个Cs+周围最近且距
离相等的Cl-有 个?
8
(2)每个Cl-周围最近且距离
相等的Cs+有 个?
8
活动探究 二
Cl-
Cs+
配位数
配位数
CsCl晶体中:
(3)每个Cs+周围最近且距离相等的Cs+有 个?
6
活动探究 二
Cs+
Cl-
Cl-
6
CsCl晶体中:
(4)每个Cl-周围最近且距离相等的Cl-有 个?
活动探究 二
Cs+
Cl-
(2)氯化铯型晶胞
---Cs+
---Cl-
①铯离子和氯离子的位置:
铯离子:体心;氯离子:顶点。或反之。
②每个晶胞含铯离子、氯离子的个数:
均为1
③Cs+ 与Cl- 的配位数:
均为8
④在氯化铯晶体中,每个铯离子周围最近且等距离的铯离子有 ____个,每个氯离子周围最近且等距离的氯离子有____个。
6
6
④晶体中Cs+ 与Cl-的具体关系:
每个Cs+周围最近且等距离的Cl-有几个?
每个 Cl- 周围最近且等距离的Cs+呢?
与一个 Cl-相邻最近且距离相等的 Cl-有多少个?
每个Cs+周围距离相等且最近的Cs+共有?
8个
8个
6个
6个
⑤晶体中Cs+与Cl-的空间坐标(以晶胞参数(棱长)a为单位长度)
Cl-
Cs+
(0,0,0)
(0,1,1)
(1,1,1)
(1,0,0)
(0.5,0.5,0.5)
a
⑶ZnS晶体:
S2-按 面心立方堆积方式排列,Zn2+ 离子填在S2-所成的空隙中。
①ZnS的晶体结构
ZnS晶胞
③化学式的确定:ZnS
S2-个数为8×1/8+6×1/2=4 Zn2+个数为 4
②每个晶胞含离子的个数:
④晶体中Zn2+ 与 S2- 的具体关系:
每个Zn2+周围最近且等距离的S2-有几个?
每个 S2- 周围最近且等距离的Zn2+呢?
与一个S2-(Zn2+)相邻最近且距离相等的S2-(Zn2+)有多少个?
4个
4个
12个
②Zn2+、S2-的配位数:
① 每个ZnS晶胞中含阴、阳离子:
(3)ZnS型晶胞
均为4
均为4
③Zn2+、S2-的最短距离为:
晶胞体对
角线的
⑤晶体中Zn2+ 与 S2- 的空间坐标(以晶胞参数(棱长)a为单位长度)
(0,0,0)
(0.5,0.5,0)
(1,1,1)
(1,0,0)
(0.25,0.25,0.75)
S2-
Zn2+
(0.75,0.75,0.75)
(0.75,0.25,0.25)
a
CaF2晶胞
⑷CaF2晶体:
Ca2+按 面心立方堆积方式排列,F 填在Ca2+所成的空隙中。
①CaF2的晶体结构
③化学式的确定:CaF2
Ca2+个数为8×1/8+6×1/2=4
F 个数为 8
②每个晶胞含离子的个数:
④晶体中Ca2+ 与 F 的具体关系:
每个Ca2+ 周围最近且等距离的 F 有几个?
每个 F 周围最近且等距离的Ca2+ 呢?
与一个 Ca2+ 相邻最近且距离相等的Ca2+有多少个?
与一个 F 相邻最近且距离相等的 F 有多少个?
8个
4个
12个
6个
(4) CaF2型晶胞
Ca2+
F-
4
8
②Ca2+的配位数:
① 每个CaF2晶胞中含阴、阳离子:
Ca2+为4、
F-为8
F- 的配位数:
③Ca2+、F- 的最短距离为:
晶胞体对角线的
⑤晶体中Ca2+ 与 F 的空间坐标(以晶胞参数(棱长)a为单位长度)
(0,0,0)
(0.5,0.5,0)
(1,1,1)
(0.25,0.25,0.25)
(0.25,0.75,0.75)
(0.75,0.75,0.25)
(0.75,0.25,0.75)
Ca2+
F
a
3、常见的离子晶体
晶胞
晶胞中 微粒数 Na+、Cl-都 为4 Cs+、Cl-都 为1 Zn2+、S2-都 为4 F-为8,
Ca2+为4
阴、阳离子个数比 1∶1 1∶1 1∶1 2∶1
化学式 NaCl CsCl ZnS CaF2
符合类型 Li、Na、K、Rb的卤化物, AgF、MgO等 CsBr、CsI、 NH4Cl等 BeO、BeS等 BaF2、PbF2、
CeO2等
4、晶格能的定义及影响因素
⑴晶格能:
将1mol 离子晶体完全气化为气态阴、阳离子所吸收的能量。
⑵意义:
一般而言,晶格能越大,离子晶体越稳定,晶体的熔点越高,硬度越大。在一定程度上可以用来衡量离子键的强弱。
⑶晶格能的影响因素:
规律:离子半径越小,离子所带电荷越多,晶格能越大;反之,越小。除此之外,晶格能的大小还与离子晶体的结构类型有关。
晶体 离子间距/pm 晶格能/(kJ·mol-1) 熔点/℃
NaCl 276 787 801
NaBr 290 736 750
NaI 311 686 662
MgO 205 3 890 2 800
事实上,离子晶体远比我们想象的要复杂,构成晶体的离子未必都是单原子离子,如NH4+等阳离子,以及SO42-、CH3COO-、苯甲酸根离子( )等阴离子。在由这些离子构成的离子晶体中,随着离子体积的增大,阴、阳离子间的距离增大,离子之间的作用力减弱,晶体的熔点也随之降低。
在许多离子化合物的晶体中,微粒之间的相互作用不再是典型的离子键,而存在氢键、范德华力等作用力。这些晶体的熔点远比NaCl等晶体低得多,有些离子构成的物质在常温下甚至以液态形式存在。
(3)在固态时不导电,熔融状态或在水溶液中能导电。
5、离子晶体的物理性质
⑷离子晶体熔点的比较
(1)熔点较高,而且随着离子电荷的增加,离子间距的缩短,晶格能增大,熔点升高。
(2)一般易溶于水,而难溶于非极性溶剂。
【微点拨】(1)离子晶体中不存在分子,化学式仅表示晶体中阴、阳离子最简整数比。
(2)离子晶体区别于其他晶体的突出特点是晶体固态时不导电但熔融状态下能导电。而金属晶体无论在固态还是熔融状态都可以导电。
练习:如图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)
C
第三章第2节
几种简单的晶体结构模型
第2课时 离子晶体
学习目标
掌握典型的四种离子晶体结构模型
了解离子晶体结构与性质的关系
二、离子晶体
⑴定义:是阴、阳离子在空间呈现周期性重复排列所形成的晶体。
⑵构成离子晶体的微粒:阴、阳离子。
⑶离子晶体中微粒间的作用力:离子键(无饱和性、方向性)。
⑷常见的离子晶体:强碱、大多数盐、活泼金属氧化物。
1、离子晶体的概念
⑸影响离子键强弱的因素:
①离子半径(阴阳离子的核间距)②离子所带电荷数
离子半径越小,离子所带电荷数越多,离子键越强、离子晶体的熔点越高。
2、几种离子晶体的结构
⑴NaCl晶体:
①氯化钠的晶体结构
Cl-按面心立方堆积方式排列,Na+离子填充在Cl-所成的空隙中。
(无隙并置)
(NaCl晶胞)
②每个晶胞含离子的个数:
③化学式为:NaCl
Na+:
Cl-:
每个Na+
周围最近且距离相等的Cl-有___个。
6个Cl-连线形成的空间几何构型是______。
配位数
一个离子周围所邻接的异电性离子的数目称为离子晶体的配位数。
6
正八面体
活动探究 一
Na+
Cl-
每个Cl-
周围最近且距离相等的Na+有___个。
6个Na+连线形成的空间几何构型是
_____。
配位数
6
正八面体
NaCl晶体中阴、阳离子配位数
活动探究 一
活动探究 一
NaCl晶体中:
(3)每个Na+周围最近且距离相等的Na+有 个?
(4)每个Cl-周围最近且距离相等的Cl-有 个?
活动探究 一
每个Na+周围最近且距离相等的Na+有___个
活动探究 一
12
每个Cl-周围最近且距离相等的Cl-有__个
活动探究 一
12
① 钠离子和氯离子的位置:
钠离子:体心和棱中点;氯离子:面心和顶点。或者反之。
③ Na+ 与Cl- 的配位数:
② 每个晶胞含钠离子、
氯离子的个数:
均为4
离子晶体中离子的配位数是指一个离子周围
最邻近的异电性离子的数目
均为6
无单个分子存在;NaCl不表示分子式。
(NaCl晶胞)
④晶体中Na+ 与Cl-的具体关系:
每个Na+周围最近且等距离的Cl-有几个?
每个 Cl- 周围最近且等距离的 Na+呢?
与一个Cl-(Na+ )相邻最近且距离相等的Cl-(Na+ )有多少个?
6个
6个
12个
⑤晶体中Na+ 与Cl-的空间坐标(以晶胞参数(棱长)a为单位长度):
注意:坐标原点的选择,坐标轴的方向,坐标轴单位(晶胞棱长)
(0,0,0)
Cl-
Na+
(0.5,0,0)
(1,0,0.5)
(0.5,0.5,1)
(1,1,1)
(0.5,0.5,0.5)
a
⑵CsCl晶体:
①氯化铯的晶体结构
Cl-按简单立方堆积方式排列,Cs+离子填在Cl-所成的空隙中。
CsCl晶胞
每个晶胞中: Cl-个数为8×1/8=1 Cs+个数为 1
③化学式的确定:CsCl
②每个晶胞含离子的个数:
(无隙并置)
Cl-
Cs+
在CsCl晶体的一个晶胞中Cl-的个数等于___,Cs+的个数等于___
8× =1
1 × 1 =1
1
1
Cs+:Cl- =1:1,晶胞还呈电中性。
由此可见,在离子晶体中,其实并不存在单独的“CsCl”分子,只是在整个晶体中Cs+与Cl-的个数比为1:1,因此CsCl”这一化学式表示的只是氯化铯的组成。
活动探究 二
顶点:
体心:
Cl-
Cs+
CsCl晶体中:
(1)每个Cs+周围最近且距离相等的Cl-有 个?
(2)每个Cl-周围最近且距离相等的Cs+有 个?
(3)每个Cs+周围最近且距离相等的Cs+有 个?
(4)每个Cl-周围最近且距离相等的Cl-有 个?
活动探究 二
CsCl的晶体结构及晶胞构示意图
CsCl晶体中:
(1)每个Cs+周围最近且距
离相等的Cl-有 个?
8
(2)每个Cl-周围最近且距离
相等的Cs+有 个?
8
活动探究 二
Cl-
Cs+
配位数
配位数
CsCl晶体中:
(3)每个Cs+周围最近且距离相等的Cs+有 个?
6
活动探究 二
Cs+
Cl-
Cl-
6
CsCl晶体中:
(4)每个Cl-周围最近且距离相等的Cl-有 个?
活动探究 二
Cs+
Cl-
(2)氯化铯型晶胞
---Cs+
---Cl-
①铯离子和氯离子的位置:
铯离子:体心;氯离子:顶点。或反之。
②每个晶胞含铯离子、氯离子的个数:
均为1
③Cs+ 与Cl- 的配位数:
均为8
④在氯化铯晶体中,每个铯离子周围最近且等距离的铯离子有 ____个,每个氯离子周围最近且等距离的氯离子有____个。
6
6
④晶体中Cs+ 与Cl-的具体关系:
每个Cs+周围最近且等距离的Cl-有几个?
每个 Cl- 周围最近且等距离的Cs+呢?
与一个 Cl-相邻最近且距离相等的 Cl-有多少个?
每个Cs+周围距离相等且最近的Cs+共有?
8个
8个
6个
6个
⑤晶体中Cs+与Cl-的空间坐标(以晶胞参数(棱长)a为单位长度)
Cl-
Cs+
(0,0,0)
(0,1,1)
(1,1,1)
(1,0,0)
(0.5,0.5,0.5)
a
⑶ZnS晶体:
S2-按 面心立方堆积方式排列,Zn2+ 离子填在S2-所成的空隙中。
①ZnS的晶体结构
ZnS晶胞
③化学式的确定:ZnS
S2-个数为8×1/8+6×1/2=4 Zn2+个数为 4
②每个晶胞含离子的个数:
④晶体中Zn2+ 与 S2- 的具体关系:
每个Zn2+周围最近且等距离的S2-有几个?
每个 S2- 周围最近且等距离的Zn2+呢?
与一个S2-(Zn2+)相邻最近且距离相等的S2-(Zn2+)有多少个?
4个
4个
12个
②Zn2+、S2-的配位数:
① 每个ZnS晶胞中含阴、阳离子:
(3)ZnS型晶胞
均为4
均为4
③Zn2+、S2-的最短距离为:
晶胞体对
角线的
⑤晶体中Zn2+ 与 S2- 的空间坐标(以晶胞参数(棱长)a为单位长度)
(0,0,0)
(0.5,0.5,0)
(1,1,1)
(1,0,0)
(0.25,0.25,0.75)
S2-
Zn2+
(0.75,0.75,0.75)
(0.75,0.25,0.25)
a
CaF2晶胞
⑷CaF2晶体:
Ca2+按 面心立方堆积方式排列,F 填在Ca2+所成的空隙中。
①CaF2的晶体结构
③化学式的确定:CaF2
Ca2+个数为8×1/8+6×1/2=4
F 个数为 8
②每个晶胞含离子的个数:
④晶体中Ca2+ 与 F 的具体关系:
每个Ca2+ 周围最近且等距离的 F 有几个?
每个 F 周围最近且等距离的Ca2+ 呢?
与一个 Ca2+ 相邻最近且距离相等的Ca2+有多少个?
与一个 F 相邻最近且距离相等的 F 有多少个?
8个
4个
12个
6个
(4) CaF2型晶胞
Ca2+
F-
4
8
②Ca2+的配位数:
① 每个CaF2晶胞中含阴、阳离子:
Ca2+为4、
F-为8
F- 的配位数:
③Ca2+、F- 的最短距离为:
晶胞体对角线的
⑤晶体中Ca2+ 与 F 的空间坐标(以晶胞参数(棱长)a为单位长度)
(0,0,0)
(0.5,0.5,0)
(1,1,1)
(0.25,0.25,0.25)
(0.25,0.75,0.75)
(0.75,0.75,0.25)
(0.75,0.25,0.75)
Ca2+
F
a
3、常见的离子晶体
晶胞
晶胞中 微粒数 Na+、Cl-都 为4 Cs+、Cl-都 为1 Zn2+、S2-都 为4 F-为8,
Ca2+为4
阴、阳离子个数比 1∶1 1∶1 1∶1 2∶1
化学式 NaCl CsCl ZnS CaF2
符合类型 Li、Na、K、Rb的卤化物, AgF、MgO等 CsBr、CsI、 NH4Cl等 BeO、BeS等 BaF2、PbF2、
CeO2等
4、晶格能的定义及影响因素
⑴晶格能:
将1mol 离子晶体完全气化为气态阴、阳离子所吸收的能量。
⑵意义:
一般而言,晶格能越大,离子晶体越稳定,晶体的熔点越高,硬度越大。在一定程度上可以用来衡量离子键的强弱。
⑶晶格能的影响因素:
规律:离子半径越小,离子所带电荷越多,晶格能越大;反之,越小。除此之外,晶格能的大小还与离子晶体的结构类型有关。
晶体 离子间距/pm 晶格能/(kJ·mol-1) 熔点/℃
NaCl 276 787 801
NaBr 290 736 750
NaI 311 686 662
MgO 205 3 890 2 800
事实上,离子晶体远比我们想象的要复杂,构成晶体的离子未必都是单原子离子,如NH4+等阳离子,以及SO42-、CH3COO-、苯甲酸根离子( )等阴离子。在由这些离子构成的离子晶体中,随着离子体积的增大,阴、阳离子间的距离增大,离子之间的作用力减弱,晶体的熔点也随之降低。
在许多离子化合物的晶体中,微粒之间的相互作用不再是典型的离子键,而存在氢键、范德华力等作用力。这些晶体的熔点远比NaCl等晶体低得多,有些离子构成的物质在常温下甚至以液态形式存在。
(3)在固态时不导电,熔融状态或在水溶液中能导电。
5、离子晶体的物理性质
⑷离子晶体熔点的比较
(1)熔点较高,而且随着离子电荷的增加,离子间距的缩短,晶格能增大,熔点升高。
(2)一般易溶于水,而难溶于非极性溶剂。
【微点拨】(1)离子晶体中不存在分子,化学式仅表示晶体中阴、阳离子最简整数比。
(2)离子晶体区别于其他晶体的突出特点是晶体固态时不导电但熔融状态下能导电。而金属晶体无论在固态还是熔融状态都可以导电。
练习:如图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)
C
