浙江省临海市杜桥中学高中化学选修四课件:专题三 第一单元 弱电解质的电离平衡(共14张PPT)
文档属性
| 名称 | 浙江省临海市杜桥中学高中化学选修四课件:专题三 第一单元 弱电解质的电离平衡(共14张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 210.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-17 15:22:26 | ||
图片预览





文档简介
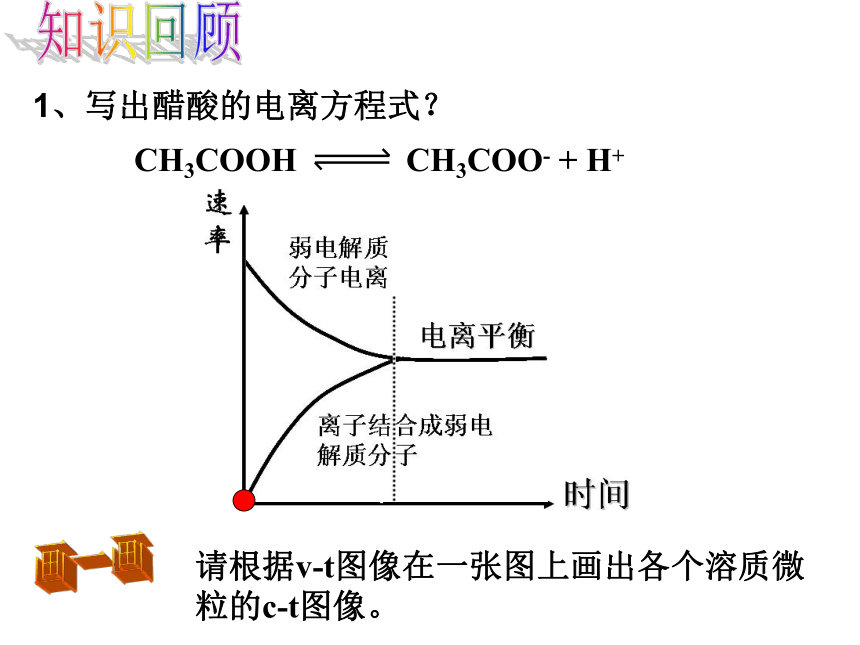
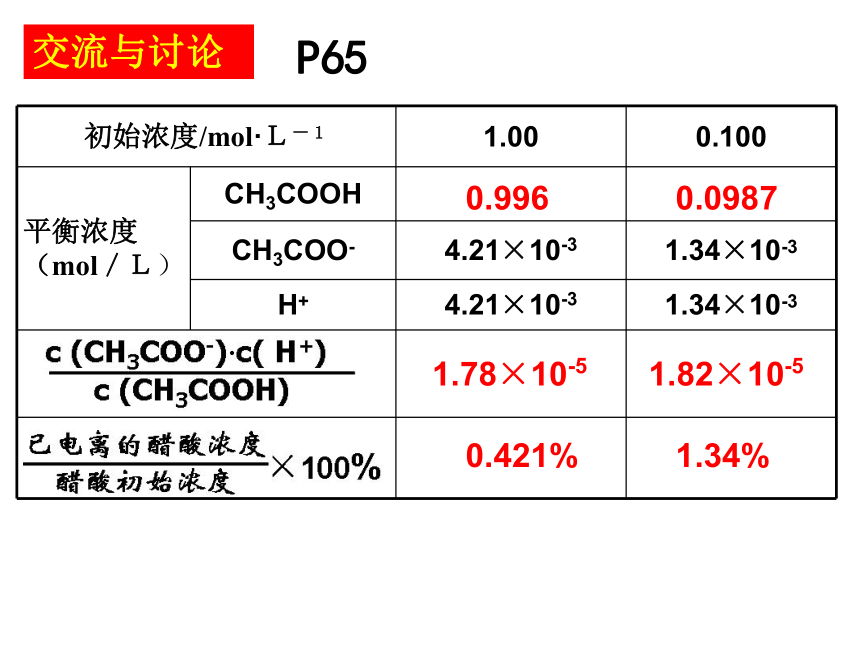
课件14张PPT。弱电解质的电离平衡第三专题 溶液中的离子反应第一单元 弱电解质的电离平衡知识回顾1、写出醋酸的电离方程式?请根据v-t图像在一张图上画出各个溶质微粒的c-t图像。画一画1.78×10-51.82×10-50.9960.09870.421%1.34%P65交流与讨论K值越大,电离程度越大,相应酸 (或碱)的酸(或碱)性越强。①表达式:②意义:弱电解质的电离平衡常数只受温度变化的影响③影响因素:电离平衡常数①表达式 在一定条件下,弱电解质电离程度的大小②意义:③影响电离度的因素A、温度B、浓度一般而言,弱电解质溶液的浓度越大,电离度越小温度越高,电离度越大电离度(1)温度(2)浓度越热越电离越稀越电离影响电离平衡移动的因素想一想例题 乙酰水杨酸(俗称阿司匹林)是一种一元弱酸(可用HA表示)。在一定温度下,0.1mol·L-1乙酰水杨酸水溶液中,乙酰水杨酸的电离度为5.7%,求该酸的电离平衡常数? 25 ℃时,1mol/L的氨水中一水合氨的电离度为0.42%,求一水合氨的电离平衡常数? 问题解决1.8×10-5左减小减小减小不变右减小减小增大不变左增大增大减小不变右增大减小增大不变右增大增大减小不变右增大增大增大增大学以致用C2、现有两瓶醋酸溶液,其物质的量浓度分别为1 mol/L和0.1 mol/L,那么这两瓶溶液的氢离子浓度的比值是大于10、小于10、还是等于10 ?小于10。若电离度相同,则两瓶氢离子浓度比值刚好为10,但事实上浓溶液的电离度较小,所以浓度的比值小于10。练习3、H2S溶液中存在着H2S H+ + HS- 和HS-- H+ + S2-
的平衡。当向H2S溶液中加入CuSO4溶液,电离平衡向
移动,C(S2-) ,C(H+) ,
当向溶液中通入SO2气体,平衡向 移动,
C(S2-) ,C(H+) ;
当加入同浓度的H2S溶液时,平衡 移动。正向减少增大逆向减少减少不4、在1L浓度为cmol/L的弱酸HA溶液中,HA、H+和A-的物质的量之和为nmol,则HA的电离度是多少?5、25℃时,0.1mol/L的HCOOH溶液中,HCOOH的电离度为4.24%,求溶液中的氢离子浓度及HCOOH的平衡常数。c(H+)=4.24×10-3mol/L Ka=1.8×10-4逆减小减小增大减小不变逆增大增大减小减小不变正减小减小增大增大不变正增大减小减小增大不变正增大增大增大减小不变正增大增大增大增大增大6、 250℃时,稀的氨水溶液达到平衡,改变下列条件,请填表: 弱电解质加水稀释时,电离程度_____,离子浓度 ? (填变大、变小、不变或不能确定) 变大不能确定 画出用水稀释冰醋酸时离子浓度随加水量的变化曲线。思考
的平衡。当向H2S溶液中加入CuSO4溶液,电离平衡向
移动,C(S2-) ,C(H+) ,
当向溶液中通入SO2气体,平衡向 移动,
C(S2-) ,C(H+) ;
当加入同浓度的H2S溶液时,平衡 移动。正向减少增大逆向减少减少不4、在1L浓度为cmol/L的弱酸HA溶液中,HA、H+和A-的物质的量之和为nmol,则HA的电离度是多少?5、25℃时,0.1mol/L的HCOOH溶液中,HCOOH的电离度为4.24%,求溶液中的氢离子浓度及HCOOH的平衡常数。c(H+)=4.24×10-3mol/L Ka=1.8×10-4逆减小减小增大减小不变逆增大增大减小减小不变正减小减小增大增大不变正增大减小减小增大不变正增大增大增大减小不变正增大增大增大增大增大6、 250℃时,稀的氨水溶液达到平衡,改变下列条件,请填表: 弱电解质加水稀释时,电离程度_____,离子浓度 ? (填变大、变小、不变或不能确定) 变大不能确定 画出用水稀释冰醋酸时离子浓度随加水量的变化曲线。思考
