浙江省临海市杜桥中学高中化学选修四课件:专题一 第一单元 化学反应的焓变(共18张PPT)
文档属性
| 名称 | 浙江省临海市杜桥中学高中化学选修四课件:专题一 第一单元 化学反应的焓变(共18张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 762.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-17 15:23:25 | ||
图片预览






文档简介
(共18张PPT)
专题1 化学反应与能量变化
第一单元 化学反应的热效应
化学反应的焓变
2、符号: ΔH ,单位:kJ/mol 或 kJ mol-1
化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热。
在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变。
一、反应热 焓变
1、定义:
放热反应:
ΔH<0 或 ΔH为“-”
ΔH>0 或 ΔH为“+”
吸热反应:
化学反应中为什么会有能量的变化?
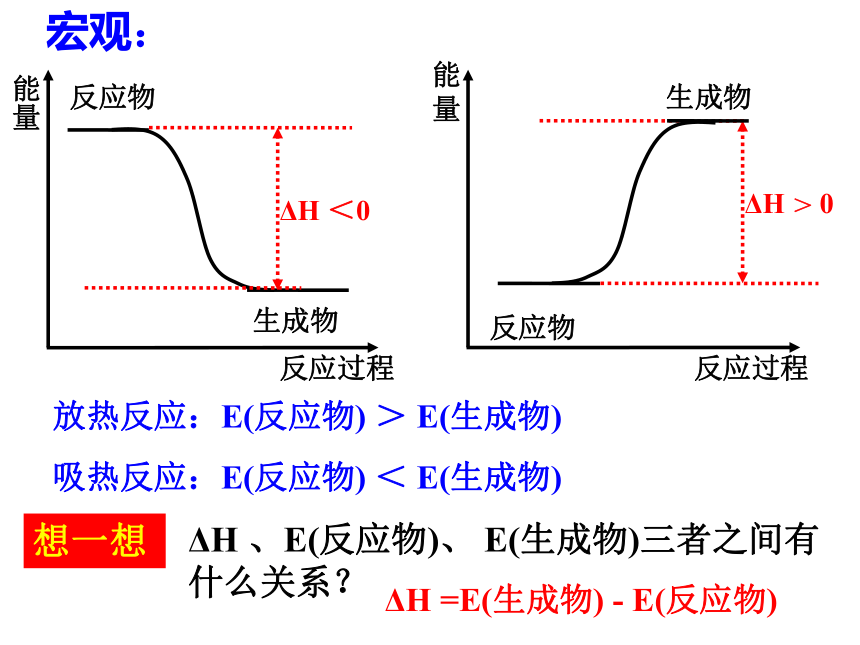
宏观:
反应物和生成物所具有的能量不同。
交流与讨论
放热反应:E(反应物) > E(生成物)
反应物
生成物
能量
反应过程
ΔH <0
ΔH > 0
吸热反应:E(反应物) < E(生成物)
宏观:
想一想
ΔH 、E(反应物)、 E(生成物)三者之间有什么关系?
反应物
生成物
反应过程
能量
ΔH =E(生成物) - E(反应物)
化学反应中为什么会有能量的变化?
宏观:
反应物和生成物所具有的能量不同.
交流与讨论
微观:
断开1mol N2中的共价键需要吸收946kJ热量
断开1mol O2中的共价键需要吸收498kJ热量
形成1mol NO中的共价键会放出632kJ热量
请从理论上计算一下该反应的反应热?
实验测得,1mol N2与1mol O2反应生成2molNO时,会吸收182.6kJ的热量,它是从哪来的
交流与思考
N2+ O2== 2NO
放电
问题与解决
1、已知:
断裂1molH2(g)中的H—H键需要吸收436kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1molH—O键放出463kJ的能量。
请你判断2H2+O2=2H2O是放热还是吸热,并求出相应的反应热?
二、热化学方程式:
1、概念:
可以表示反应热的化学方程式叫做热化学方程式。
H2(g)+Cl2(g)=2HCl(g) = -184.6 kJ/mol
H
CH4(g)+2O2(g)=CO2(g)+2H2O(l) = -890.3 kJ/mol
H
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) = -57.3 kJ/mol
H
交流与讨论
因为物质的聚集状态不同所含的能量也不同。
热化学方程式中的化学计量数仅表示物质的量不表示分子数。
(2)热化学方程式中各物质前的化学计量数既可以是整数,又可以是分数。
(1)热化学方程式中的△H的 “+”与“-”一定要注明, “+”代表吸热, “-”代表放热。
无论热化学方程式中化学计量数为多少,△H的单位总是kJ/mol,但△H的数值与反应式中的系数成比例
(3)反应物和生成物要注明聚集状态。
2、书写热化学方程式应注意以下几点 :
反应放出或吸收的热量的多少与外界的温度和压强有关,不注明的指101kPa和25℃时的数据。
(5)要注明温度和压强
(4)不需要标明反应的条件
2、书写热化学方程式应注意以下几点 :
交流与讨论
问题解决
1、N2 (g)与H2 (g)反应生成17gNH3 (g) ,放出46.1 kJ热量。
2、1molC2H5OH (l)完全 燃烧生成CO2 (g) 和H2O (l) ,放出1366. 8 kJ热量。
3、标准状况下,44.8 LC2H2 (g)在O2 (g)中完全燃烧生成CO2 (g)和H2O (l) ,放出2598. 8 kJ热量
4、24g C(石墨)与适量H2O (g)反应生成CO (g)和H2 (g) ,吸收262.6 kJ热量。
1、已知在25℃、101kPa下,1g C8H18 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。
2、酒精(C2H5OH)完全燃烧生成22.4LCO2(折算为标准状况)和液态水 ,放出683.4kJ热量。
练一练
书本P11
1、已知
①H2(g)+ O2(g)=H2O(g) △H= a kJ/mol
④2H2(g)+O2(g)=2H2O(l) △H= d kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H= b kJ/mol
③H2(g)+ O2(g)=H2O(l) △H= c kJ/mol
下列关系中正确的是( )
A、ad>0
C、2a=b<0 D、2c=d>0
1、在同温同压下,下列各组热化学方程式中Q2>Q1的是 ( )
A、H2(g)+Cl2(g)=2HCl(g) △H= - Q1
1/2H2(g)+1/2Cl2(g)=HCl(g) △H= - Q2
B、C(s)+1/2O2(g)=CO (g) △H= - Q1
C(s)+O2(g)=CO2 (g) △H= - Q2
C、2H2(g)+O2(g)=2H2O(l) △H= - Q1
2H2(g)+O2(g)=2H2O(g) △H= - Q2
D、S(g)+O2(g)=SO2 (g) △H= - Q1
S(s)+O2(g)=SO2 (g) △H= - Q2
随堂练习
A、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol
B、C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H= +2b kJ/mol
C、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mol
D、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H= +b kJ/mol
A
2、(05全国卷I 第13题 )已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
随堂练习
专题1 化学反应与能量变化
第一单元 化学反应的热效应
化学反应的焓变
2、符号: ΔH ,单位:kJ/mol 或 kJ mol-1
化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热。
在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变。
一、反应热 焓变
1、定义:
放热反应:
ΔH<0 或 ΔH为“-”
ΔH>0 或 ΔH为“+”
吸热反应:
化学反应中为什么会有能量的变化?
宏观:
反应物和生成物所具有的能量不同。
交流与讨论
放热反应:E(反应物) > E(生成物)
反应物
生成物
能量
反应过程
ΔH <0
ΔH > 0
吸热反应:E(反应物) < E(生成物)
宏观:
想一想
ΔH 、E(反应物)、 E(生成物)三者之间有什么关系?
反应物
生成物
反应过程
能量
ΔH =E(生成物) - E(反应物)
化学反应中为什么会有能量的变化?
宏观:
反应物和生成物所具有的能量不同.
交流与讨论
微观:
断开1mol N2中的共价键需要吸收946kJ热量
断开1mol O2中的共价键需要吸收498kJ热量
形成1mol NO中的共价键会放出632kJ热量
请从理论上计算一下该反应的反应热?
实验测得,1mol N2与1mol O2反应生成2molNO时,会吸收182.6kJ的热量,它是从哪来的
交流与思考
N2+ O2== 2NO
放电
问题与解决
1、已知:
断裂1molH2(g)中的H—H键需要吸收436kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1molH—O键放出463kJ的能量。
请你判断2H2+O2=2H2O是放热还是吸热,并求出相应的反应热?
二、热化学方程式:
1、概念:
可以表示反应热的化学方程式叫做热化学方程式。
H2(g)+Cl2(g)=2HCl(g) = -184.6 kJ/mol
H
CH4(g)+2O2(g)=CO2(g)+2H2O(l) = -890.3 kJ/mol
H
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) = -57.3 kJ/mol
H
交流与讨论
因为物质的聚集状态不同所含的能量也不同。
热化学方程式中的化学计量数仅表示物质的量不表示分子数。
(2)热化学方程式中各物质前的化学计量数既可以是整数,又可以是分数。
(1)热化学方程式中的△H的 “+”与“-”一定要注明, “+”代表吸热, “-”代表放热。
无论热化学方程式中化学计量数为多少,△H的单位总是kJ/mol,但△H的数值与反应式中的系数成比例
(3)反应物和生成物要注明聚集状态。
2、书写热化学方程式应注意以下几点 :
反应放出或吸收的热量的多少与外界的温度和压强有关,不注明的指101kPa和25℃时的数据。
(5)要注明温度和压强
(4)不需要标明反应的条件
2、书写热化学方程式应注意以下几点 :
交流与讨论
问题解决
1、N2 (g)与H2 (g)反应生成17gNH3 (g) ,放出46.1 kJ热量。
2、1molC2H5OH (l)完全 燃烧生成CO2 (g) 和H2O (l) ,放出1366. 8 kJ热量。
3、标准状况下,44.8 LC2H2 (g)在O2 (g)中完全燃烧生成CO2 (g)和H2O (l) ,放出2598. 8 kJ热量
4、24g C(石墨)与适量H2O (g)反应生成CO (g)和H2 (g) ,吸收262.6 kJ热量。
1、已知在25℃、101kPa下,1g C8H18 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。
2、酒精(C2H5OH)完全燃烧生成22.4LCO2(折算为标准状况)和液态水 ,放出683.4kJ热量。
练一练
书本P11
1、已知
①H2(g)+ O2(g)=H2O(g) △H= a kJ/mol
④2H2(g)+O2(g)=2H2O(l) △H= d kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H= b kJ/mol
③H2(g)+ O2(g)=H2O(l) △H= c kJ/mol
下列关系中正确的是( )
A、a
C、2a=b<0 D、2c=d>0
1、在同温同压下,下列各组热化学方程式中Q2>Q1的是 ( )
A、H2(g)+Cl2(g)=2HCl(g) △H= - Q1
1/2H2(g)+1/2Cl2(g)=HCl(g) △H= - Q2
B、C(s)+1/2O2(g)=CO (g) △H= - Q1
C(s)+O2(g)=CO2 (g) △H= - Q2
C、2H2(g)+O2(g)=2H2O(l) △H= - Q1
2H2(g)+O2(g)=2H2O(g) △H= - Q2
D、S(g)+O2(g)=SO2 (g) △H= - Q1
S(s)+O2(g)=SO2 (g) △H= - Q2
随堂练习
A、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol
B、C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H= +2b kJ/mol
C、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mol
D、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H= +b kJ/mol
A
2、(05全国卷I 第13题 )已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
随堂练习
