3.4 配合物与超分子 课时练 (含解析)2024-2025学年人教版2019 选择性必修2
文档属性
| 名称 | 3.4 配合物与超分子 课时练 (含解析)2024-2025学年人教版2019 选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 99.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-12 00:00:00 | ||
图片预览

文档简介
3.6 配合物与超分子
(30分钟 100分)
班级 姓名 成绩
【课时目标】
基础 达标 1.能判断配位键及理解配位键成因 2.判断配位化合物,举例说明有关配位化合物的相关概念 3.了解超分子的结构特点与性质
素养 突破 1.能用配位键理论分析配合物中配位键数目、配位数 2.解释配位化合物在生产、生活中的运用
【课时必刷】
A级 基础训练题
1.(9分)我国科学家制得了SiO2超分子纳米管。下列叙述正确的是 ( )
A.SiO2晶体与干冰的晶体结构相似
B.SiO2耐腐蚀,不与任何酸反应
C.该SiO2超分子纳米管具有分子识别和自组装特征
D.光纤的主要成分是SiO2,具有导电性
2.(9分)某锰的化合物的结构简式如图,其分子不含有的作用力是 ( )
A.离子键 B.氢键
C.配位键 D.非极性键
3.(9分)1 mol下列配离子所含配位键数目最少的是 ( )
A.[Cu(H2O)4]2+ B.[B(OH)4]-
C.[Fe(SCN)6]3- D.Fe(CO)5
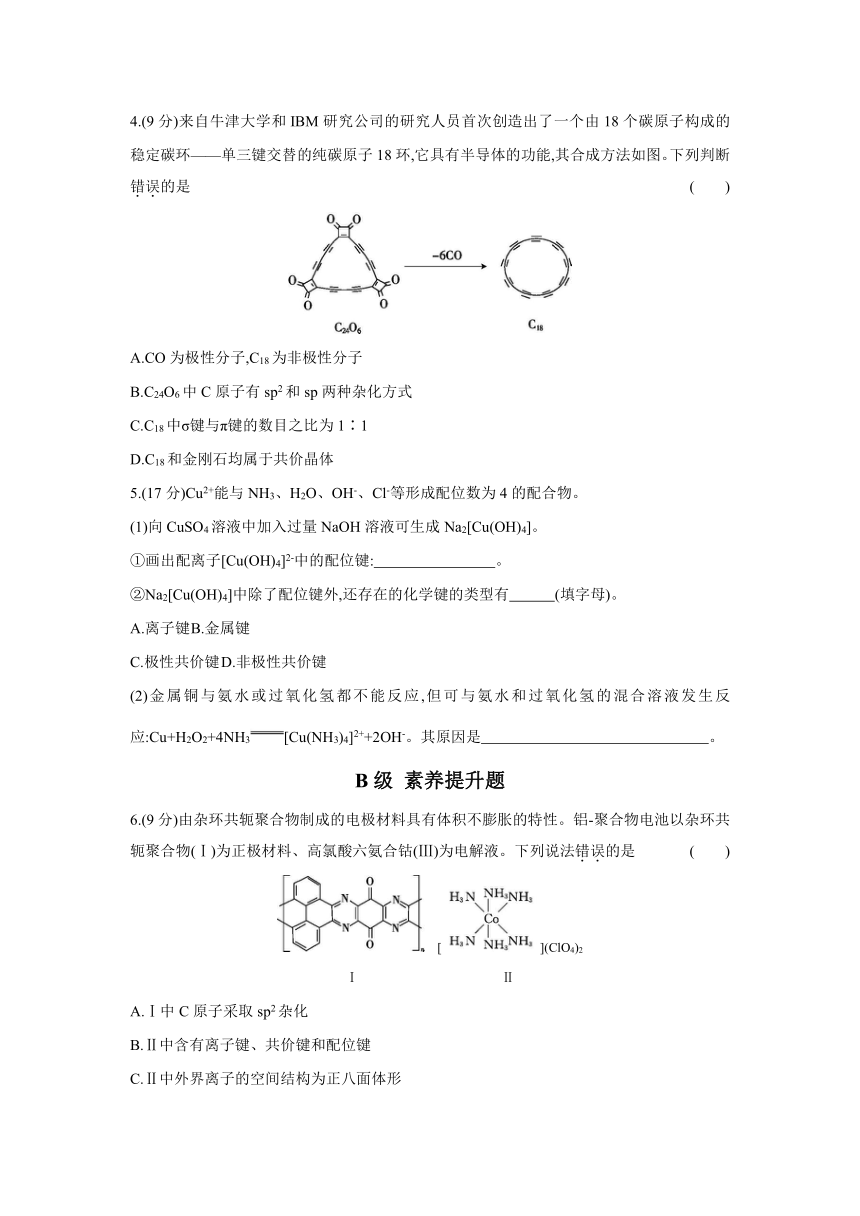
4.(9分)来自牛津大学和IBM研究公司的研究人员首次创造出了一个由18个碳原子构成的稳定碳环——单三键交替的纯碳原子18环,它具有半导体的功能,其合成方法如图。下列判断错误的是 ( )
A.CO为极性分子,C18为非极性分子
B.C24O6中C原子有sp2和sp两种杂化方式
C.C18中σ键与π键的数目之比为1∶1
D.C18和金刚石均属于共价晶体
5.(17分)Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键: 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键的类型有 (填字母)。
A.离子键 B.金属键
C.极性共价键 D.非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3[Cu(NH3)4]2++2OH-。其原因是 。
B级 素养提升题
6.(9分)由杂环共轭聚合物制成的电极材料具有体积不膨胀的特性。铝-聚合物电池以杂环共轭聚合物(Ⅰ)为正极材料、高氯酸六氨合钴(Ⅲ)为电解液。下列说法错误的是 ( )
[](ClO4)2
Ⅰ Ⅱ
A.Ⅰ中C原子采取sp2杂化
B.Ⅱ中含有离子键、共价键和配位键
C.Ⅱ中外界离子的空间结构为正八面体形
D.Ⅱ中内界离子的中心原子的配位数为6
7.(9分)把CoCl2溶于水后加氨水先生成Co(OH)2沉淀,后沉淀溶解,再加氨水,生成了[Co(NH3)6]Cl2,此时向溶液中通入空气,得到的一种产物的组成可以用CoCl3·5NH3表示,Co的配位数是6,把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,析出氯化银沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。下列说法错误的是 ( )
A.产物CoCl3·5NH3中的配位体为氨分子和氯离子
B.通入空气后得到的溶液中含有[Co(NH3)5Cl]2+
C.[Co(NH3)6]Cl2的中心离子的价电子排布式为3d54s2
D.[Co(NH3)6]Cl2中含有配位键、极性共价键、离子键
8.(20分)有色金属资源是全球各国工业发展的重要保证。钛、钴、锰等有色金属及化合物在磁性材料、新型电池等许多领域都有着广泛的应用。请回答下列问题:
(1)Mn(BH4)2是一种储氢材料,B中配位键的数目为 ,B的空间结构是 。
(2)TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。
①TiCl4(H2NCH2CH2NH2)中提供电子对形成配位键的原子是 。
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物的稳定性较差的是 (填“Mg2+”或“Cu2+”)。
(3)钴氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
①用过量KCN处理含Co2+的盐溶液,可生成紫色的[Co(CN)6]4-。[Co(CN)6]4-中所含σ键与π键的数目之比为 。
②Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液,产生白色沉淀;在第二种配合物溶液中加入硝酸银溶液,产生淡黄色沉淀。则第二种配合物的配体为 。
C级 情境创新题
9.(9分)卟啉锌超分子的结构如图所示。下列说法中正确的是 ( )
A.卟啉锌中第一电离能最大的元素是Br
B.卟啉锌超分子中氮原子采取的杂化方式都为sp2
C.卟啉锌超分子中①②③④处的化学键属于配位键的是①
D.卟啉锌的晶体类型为共价晶体
参 考 答 案
1.C 解析:SiO2是共价晶体,而干冰是分子晶体,二者晶体结构不相似,A项错误;SiO2耐腐蚀,但可与氢氟酸反应,B项错误;超分子的两个重要特征是分子识别和自组装,C项正确;光纤的主要成分是SiO2,二氧化硅不导电,D项错误。
2.A 解析:分子内4个Mn—N键中有2个是极性键,有2个是配位键;O和H原子之间形成了氢键;分子中的C—C键是非极性键。
3.B 解析:A项,配位键数目为4NA;B项,配位键数目为NA;C项,配位键数目为6NA;D项,配位键数目为5NA。
4.D 解析:C18属于分子晶体,金刚石属于共价晶体,D项错误。
5.(1)
②AC
(2)过氧化氢为氧化剂,将Cu氧化为Cu2+,氨分子与Cu2+形成配位键
6.C 解析:Ⅱ中外界离子为Cl,Cl中氯原子采取sp3杂化,Cl的空间结构为正四面体形,C项错误。
7.C 解析:配合物的内界不能电离,外界可以电离。Co的配位数是6,把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,每1 mol CoCl3·5NH3只生成2 mol AgCl,说明外界有2个Cl-,所以CoCl3·5NH3可表示为[Co(NH3)5Cl] Cl2。由以上分析可知,CoCl3·5NH3的配位体为5个氨分子和1个氯离子,A项正确;[Co(NH3)5Cl]Cl2电离出[Co(NH3)5Cl]2+和Cl-,所以通入空气后得到的溶液中含有[Co(NH3)5Cl]2+,B项正确;[Co(NH3)6]Cl2的中心离子是Co2+,价电子排布式为3d7,C项错误;[Co(NH3)6]Cl2中含有配位键、极性共价键、离子键,D项正确。
8.(1)1;正四面体形
(2)①N
②Mg2+
(3)①1∶1
②S、NH3
9.B 解析:卟啉锌中第一电离能最大的元素是N,A项错误;卟啉锌超分子中①②③④处的化学键属于配位键的是②,C项错误;卟啉锌属于超分子,其晶体类型为分子晶体,D项错误。
(30分钟 100分)
班级 姓名 成绩
【课时目标】
基础 达标 1.能判断配位键及理解配位键成因 2.判断配位化合物,举例说明有关配位化合物的相关概念 3.了解超分子的结构特点与性质
素养 突破 1.能用配位键理论分析配合物中配位键数目、配位数 2.解释配位化合物在生产、生活中的运用
【课时必刷】
A级 基础训练题
1.(9分)我国科学家制得了SiO2超分子纳米管。下列叙述正确的是 ( )
A.SiO2晶体与干冰的晶体结构相似
B.SiO2耐腐蚀,不与任何酸反应
C.该SiO2超分子纳米管具有分子识别和自组装特征
D.光纤的主要成分是SiO2,具有导电性
2.(9分)某锰的化合物的结构简式如图,其分子不含有的作用力是 ( )
A.离子键 B.氢键
C.配位键 D.非极性键
3.(9分)1 mol下列配离子所含配位键数目最少的是 ( )
A.[Cu(H2O)4]2+ B.[B(OH)4]-
C.[Fe(SCN)6]3- D.Fe(CO)5
4.(9分)来自牛津大学和IBM研究公司的研究人员首次创造出了一个由18个碳原子构成的稳定碳环——单三键交替的纯碳原子18环,它具有半导体的功能,其合成方法如图。下列判断错误的是 ( )
A.CO为极性分子,C18为非极性分子
B.C24O6中C原子有sp2和sp两种杂化方式
C.C18中σ键与π键的数目之比为1∶1
D.C18和金刚石均属于共价晶体
5.(17分)Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键: 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键的类型有 (填字母)。
A.离子键 B.金属键
C.极性共价键 D.非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3[Cu(NH3)4]2++2OH-。其原因是 。
B级 素养提升题
6.(9分)由杂环共轭聚合物制成的电极材料具有体积不膨胀的特性。铝-聚合物电池以杂环共轭聚合物(Ⅰ)为正极材料、高氯酸六氨合钴(Ⅲ)为电解液。下列说法错误的是 ( )
[](ClO4)2
Ⅰ Ⅱ
A.Ⅰ中C原子采取sp2杂化
B.Ⅱ中含有离子键、共价键和配位键
C.Ⅱ中外界离子的空间结构为正八面体形
D.Ⅱ中内界离子的中心原子的配位数为6
7.(9分)把CoCl2溶于水后加氨水先生成Co(OH)2沉淀,后沉淀溶解,再加氨水,生成了[Co(NH3)6]Cl2,此时向溶液中通入空气,得到的一种产物的组成可以用CoCl3·5NH3表示,Co的配位数是6,把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,析出氯化银沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。下列说法错误的是 ( )
A.产物CoCl3·5NH3中的配位体为氨分子和氯离子
B.通入空气后得到的溶液中含有[Co(NH3)5Cl]2+
C.[Co(NH3)6]Cl2的中心离子的价电子排布式为3d54s2
D.[Co(NH3)6]Cl2中含有配位键、极性共价键、离子键
8.(20分)有色金属资源是全球各国工业发展的重要保证。钛、钴、锰等有色金属及化合物在磁性材料、新型电池等许多领域都有着广泛的应用。请回答下列问题:
(1)Mn(BH4)2是一种储氢材料,B中配位键的数目为 ,B的空间结构是 。
(2)TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。
①TiCl4(H2NCH2CH2NH2)中提供电子对形成配位键的原子是 。
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物的稳定性较差的是 (填“Mg2+”或“Cu2+”)。
(3)钴氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
①用过量KCN处理含Co2+的盐溶液,可生成紫色的[Co(CN)6]4-。[Co(CN)6]4-中所含σ键与π键的数目之比为 。
②Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液,产生白色沉淀;在第二种配合物溶液中加入硝酸银溶液,产生淡黄色沉淀。则第二种配合物的配体为 。
C级 情境创新题
9.(9分)卟啉锌超分子的结构如图所示。下列说法中正确的是 ( )
A.卟啉锌中第一电离能最大的元素是Br
B.卟啉锌超分子中氮原子采取的杂化方式都为sp2
C.卟啉锌超分子中①②③④处的化学键属于配位键的是①
D.卟啉锌的晶体类型为共价晶体
参 考 答 案
1.C 解析:SiO2是共价晶体,而干冰是分子晶体,二者晶体结构不相似,A项错误;SiO2耐腐蚀,但可与氢氟酸反应,B项错误;超分子的两个重要特征是分子识别和自组装,C项正确;光纤的主要成分是SiO2,二氧化硅不导电,D项错误。
2.A 解析:分子内4个Mn—N键中有2个是极性键,有2个是配位键;O和H原子之间形成了氢键;分子中的C—C键是非极性键。
3.B 解析:A项,配位键数目为4NA;B项,配位键数目为NA;C项,配位键数目为6NA;D项,配位键数目为5NA。
4.D 解析:C18属于分子晶体,金刚石属于共价晶体,D项错误。
5.(1)
②AC
(2)过氧化氢为氧化剂,将Cu氧化为Cu2+,氨分子与Cu2+形成配位键
6.C 解析:Ⅱ中外界离子为Cl,Cl中氯原子采取sp3杂化,Cl的空间结构为正四面体形,C项错误。
7.C 解析:配合物的内界不能电离,外界可以电离。Co的配位数是6,把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,每1 mol CoCl3·5NH3只生成2 mol AgCl,说明外界有2个Cl-,所以CoCl3·5NH3可表示为[Co(NH3)5Cl] Cl2。由以上分析可知,CoCl3·5NH3的配位体为5个氨分子和1个氯离子,A项正确;[Co(NH3)5Cl]Cl2电离出[Co(NH3)5Cl]2+和Cl-,所以通入空气后得到的溶液中含有[Co(NH3)5Cl]2+,B项正确;[Co(NH3)6]Cl2的中心离子是Co2+,价电子排布式为3d7,C项错误;[Co(NH3)6]Cl2中含有配位键、极性共价键、离子键,D项正确。
8.(1)1;正四面体形
(2)①N
②Mg2+
(3)①1∶1
②S、NH3
9.B 解析:卟啉锌中第一电离能最大的元素是N,A项错误;卟啉锌超分子中①②③④处的化学键属于配位键的是②,C项错误;卟啉锌属于超分子,其晶体类型为分子晶体,D项错误。
