北京育才学校2022-2023学年高二(上)期中化学(PDF版,含答案)
文档属性
| 名称 | 北京育才学校2022-2023学年高二(上)期中化学(PDF版,含答案) |

|
|
| 格式 | |||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-12 21:46:24 | ||
图片预览




文档简介
2022北京育才学校高二(上)期中
化 学
可能用到的相对原子质量:H:1 C:12 O:16 N:14 Al:27
第一部分 选择题(共 42 分)
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一
项。
1. 下列属于弱电解质的物质是
A. NaCl B. NaOH C. H2SO4 D. NH3 H2O
2. 下列溶液一定显酸性的是
c (H+A. )>c (OH- ) B. 含有H+ C. pH 7 D. 酚酞变红
3. 下列关于化学反应方向的说法正确的是
A. 凡是放热反应都是自发反应 B. 凡是熵增大的反应都是自发反应
C. 凡是吸热反应都不是自发反应 D. 反应是否自发,不只与反应热有关
4. 下列操作可以使水的离子积常数 Kw增大的是
A. 加热
B. 通入少量氯化氢气体
C. 通入少量氨气
D. 加入少量醋酸钠固体
5. 工业上处理含 CO、SO2烟道气的一种方法是将其在催化剂作用下转化为 S 和 CO2。已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol; S(s)+O2(g)=SO2(g) ΔH=-296 kJ/mol;则该条件下
2CO(g)+SO2(g)=S(s)+2CO2(g)的 ΔH等于
A. - 270 kJ/mol B. +26 kJ/mol C. -582 kJ/mol D. +270 kJ/mol
6. 据报道,在 300℃、70MPa 下由二氧化碳和氢气合成乙醇已成为现实: 2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g),下列叙述不.正.确.的是
A. 该反应一定是吸热反应
B. 使用催化剂可提高反应速率
C. 充入 CO2气体可提高 H2的平衡转化率
D. 从平衡混合气体中分离出 CH3CH2OH 和 H2O 可提高 CO2和 H2的利用率
7. 下列措施或事实不能用勒夏特列原理解释的是
A. Fe(SCN)3 溶液中加入铁粉后颜色变浅
B. 合成氨工业中使用铁触媒作催化剂
C. 在合成氨的反应中,降温或加压有利于氨的合成
D. 氨水稀释过程中,铵根数目增多
第1页/共10页
8. 反应2NO +O2 2NO2 条件相同时,分别测得 NO 的平衡转化率在不同压强( p1 、 p2 )下随温度变化
的曲线如图。下列说法中正确的是
A. p1 p2
B. 该反应为吸热反应
C. 随温度升高,该反应平衡常数减小
D. 其他条件不变,体积变为原来的 0.5 倍, c (NO2 )增大为原来的 2 倍
1
9. 下列关于室温下1L 0.1mol L NH3 H2O溶液的说法正确的是
A. NH3 H2O
+
的电离方程式: NH3 H2O=NH4 +OH
B. 加入少量 NH pH4Cl固体后,溶液的 增大
+
C. 滴加稀盐酸的过程中, n (NH4 )增大
3+
D. 与FeCl3 溶液反应的离子方程式:Fe +3OH =Fe(OH)3
10. N +2O 与CO在Fe 作用下发生反应的能量变化及反应历程如图所示。下列说法中,不.正.确.的是
A. 该反应的 H 0
B. Fe+使反应的活化能减小
C. 催化剂通过参与反应改变了反应历程
D. 上述过程在Fe+作用下,提高了 N2O 与CO的平衡转化率
1
11. 25°C 时,下列关于0.1 mol L 醋酸溶液的判断正确的是
A. c (CH3COO ) = 0.1 mol L 1 B. 与0.1 mol L 1 盐酸的 pH 相同
+
C. 加入CH3COONa (s) ,c (H )不变 D. 滴入 NaOH 浓溶液,溶液导电性增强
第2页/共10页
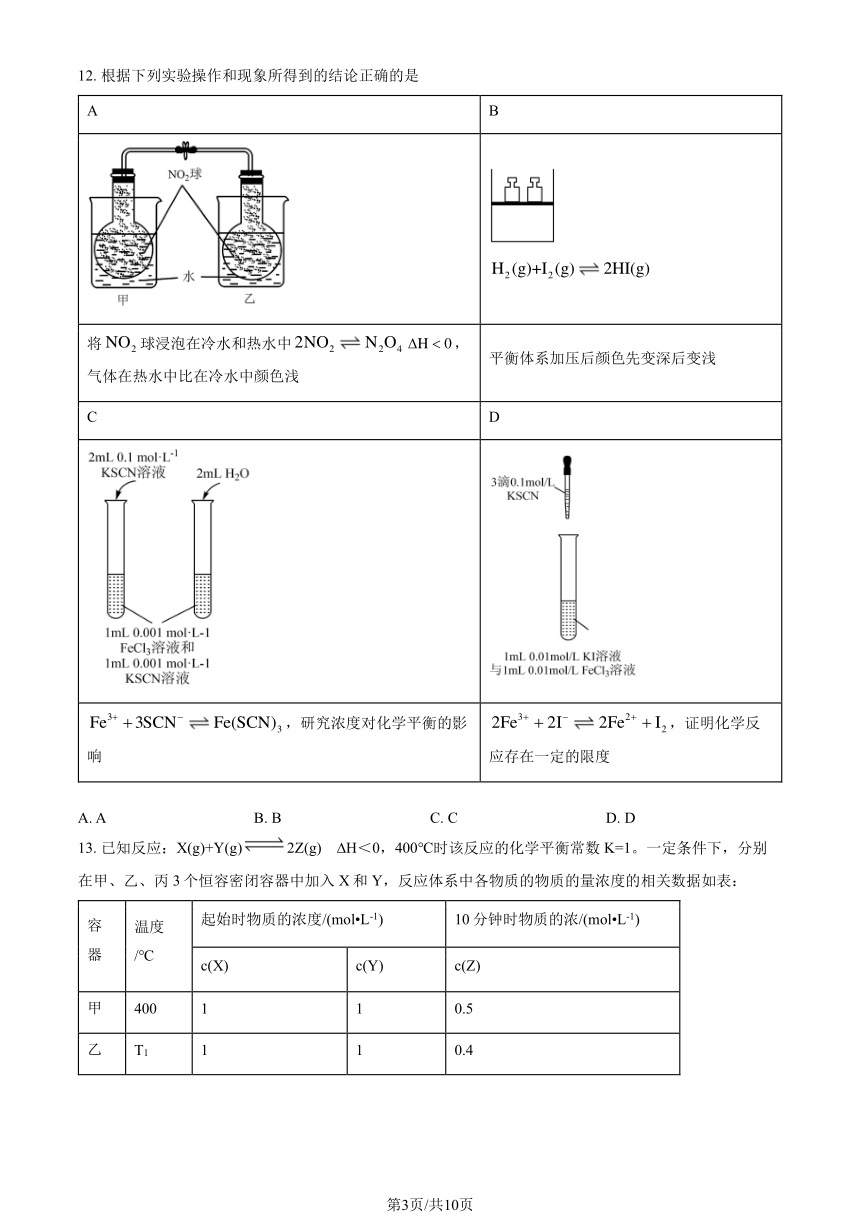
12. 根据下列实验操作和现象所得到的结论正确的是
A B
H2 (g)+I2 (g) 2HI(g)
将 NO2 球浸泡在冷水和热水中2NO2 N2O4 H 0,
平衡体系加压后颜色先变深后变浅
气体在热水中比在冷水中颜色浅
C D
3+ 3+ 2+Fe + 3SCN Fe(SCN)3 ,研究浓度对化学平衡的影 2Fe + 2I 2Fe + I2 ,证明化学反
响 应存在一定的限度
A. A B. B C. C D. D
13. 已知反应:X(g)+Y(g) 2Z(g) H<0,400℃时该反应的化学平衡常数 K=1。一定条件下,分别
在甲、乙、丙 3 个恒容密闭容器中加入 X 和 Y,反应体系中各物质的物质的量浓度的相关数据如表:
容 起始时物质的浓度/(mol L
-1) 10
温度 分钟时物质的浓
/(mol L-1)
器 /℃
c(X) c(Y) c(Z)
甲 400 1 1 0.5
乙 T1 1 1 0.4
第3页/共10页
丙 400 1 2 a
下列说法中,不.正.确.的是
A. 甲中,10 分钟内 X 的化学反应速率:v(X)=0.025mol L-1 min-1
B. 甲中,10 分钟时反应已达到化学平衡状态
C. 乙中,可能 T1<400℃
D. 丙中,a>0.5
14. 工业上可通过甲醇羰基化法制取甲酸甲酯( HCOOCH3 ):
CH3OH(g)+CO(g) HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH 和 CO,
测得相同时间内 CO 的转化率随温度变化如下图所示。下列说法不.正.确.的是
A. 增大压强甲醇转化率增大
B. b 点反应速率 υ =υ正 逆
C. 平衡常数K >K(75℃) (85℃) ,反应速率 υb <υd
D. 生产时反应温度控制在 80~85℃为宜
第二部分 非选择题(共 58 分)
15. 优化反应条件是研究化学反应的重要方面。以反应 Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 为例,
探究外界条件对化学反应速率的影响,实验方案如下表所示。
Na2S2O3溶液 H2SO实验 4溶液
蒸馏水
温度/℃
序号 浓度/(mol/L) 体积/mL 浓度/(mol/L) 体积/mL 体积/mL
Ⅰ 0.1 1.5 0.1 1.5 10 20
Ⅱ 0.1 2.5 0.1 1.5 9 a
Ⅲ 0.1 b 0.1 1.5 9 30
表中,a 为___________,b 为___________。上述三个实验中的反应速率最快的应该是实验___________(用
Ⅰ、Ⅱ、Ⅲ作答),实验证据为___________。
16. 下表是不同温度下水的离子积数据:
第4页/共10页
温度/℃ 25 t1 t2
水的离子积 KW 1 10
14 a 1 10 12
试回答以下问题:
(1)若25 t1 t2 ,则 a ___________1 10
14 (填“>”、“<”或“=”),作此判断的理由是___________。
(2)在 25℃时, pH = 3的HCl 溶液中,水电离产生的H+浓度为___________。
(3)25℃下,将 pH =13的 NaOH 溶液与 pH = 2 的稀盐酸等体积混合,所得混合溶液的pH
___________7(填“>”、“<”或“=”)。
17. 研究弱电解质的电离,有重要的实际意义。
Ⅰ.有机酸醋酸
(1)CH3COOH 的电离方程式是___________。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
A. c (CH3COO ) + B. c (H )
C. c (OH ) D. CH3COOH 电离平衡常数
c (CH COO 1 3 )
(3)将0.1mol L CH3COOH 溶液加水稀释, 的比值将________(填“变大”、“不变”或
c (CH3COOH )
“变小”)。
Ⅱ.对比弱酸酸性相对强弱
(4)某些弱酸在 25℃时的电离常数如下:
化学式 CH3COOH HSCN HCN HClO H2CO3
K1 = 4.4 10
7
电离常数 1.8 10 5 1.3 10 1 4.9 10 10 3.0 10 8
K2 = 4.7 10
11
①CH3COOH 和 NaOH 溶液反应的离子方程式是________。
②下列反应可以发生的是________(填字母)。
A.CH3COOH + Na2CO3 = NaHCO3 +CH3COONa
B.CH3COOH + NaCN = CH3COONa +HCN
C.CO2 +H2O + 2NaClO = Na2CO3 + 2HClO
D. NaHCO3 +HCN = NaCN +H2O +CO 2
18. 回收利用CO2 是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,其物质转化如图:
第5页/共10页
反应 A:CO2 (g)+ 4H2 (g) CH4 (g)+ 2H2O (g) ΔH 0,是回收利用CO2 的关键步骤。
(1)将原料气按 n (CO2 ) : n (H2 ) =1: 4置于恒容密闭容器中发生反应 A,在相同时间内测得H2O 的物
质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
①理论上,能提高CO2 平衡转化率的措施有___________(写出一条即可)。
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2 的转化效率,原因是
___________。
(2)下列关于空间站内物质和能量变化的说法中,不正确的是___________(填字母)。
a.反应 B 的能量变化是电能→化学能,或是光能→化学能
b.物质转化中 O、H 原子的利用率均为 100%
c.不用 Na2O2 作供氧剂的原因可能是 Na2O2 不易实现循环利用
(3)用CO2 (g)+ 2H2 (g) C (s)+ 2H2O (g)代替反应 A,可实现氢、氧元素完全循环利用,缺点是
使用一段时间后催化剂的催化效果会明显下降,其原因是___________。
19. 二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,
通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3 (s) MnO (s)+CO2 (g ) H1 = +a kJ mol
1
ii. 2MnO (s)+O2 (g ) 2MnO2 (s) H = +b kJ mol
1
2
①反应 i 的化学平衡常数表达式 K = ___________。
②焙烧MnCO3制取MnO2 的热化学方程式是_________________。
(2)焙烧(装置如图 1)时持续通入空气,并不断抽气的目的是________________。
第6页/共10页
(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图 2、图 3所
示。
①图 2 是在常压(0.1 MPa )下的研究结果,请在图 2中用虚线画出10 MPa 下MnCO3转化率与反应温
度的关系图______。
②常压下,要提高MnCO3的转化率,应选择的生产条件是____________焙烧6 8 h 。
③图 3 中,焙烧8 h 时,MnCO3的转化率:干空气<湿空气,原因是______________。
20. AlN 新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
物质 熔点/℃ 沸点/℃ 与 N2 反应温度 /℃ 相应化合物分解温度/℃
AlN :>2000(>1400 升华)
Al 660 2467 >800
AlCl3:(>181 升华)
Mg 649 1090 >300 Mg3N2 :>800
(1)AlN 的制备。
①化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和 NH3为原料制备AlN ,反应的化学方程式是______。
Ⅱ.上述反应适宜的温度范围是________℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
Al 与 N2 可直接化合为AlN 固体,AlN 能将Al 包裹,反应难以继续进行。控制温度,在Al 粉中均匀掺
入适量Mg 粉,可使Al 几乎全部转化为AlN 固体。该过程发生的反应有:___________、___________和
800 1400℃
2Al+ N2 2AlN 。
③碳热还原法。
以Al2O3 、C(石墨)和 N2 为原料,在高温下制备AlN 。
已知:i.2Al2O3 (s) 4Al(g)+3O (g) ΔH = +3351kJ mol
1
2 1
第7页/共10页
2C(石墨,s)+O (g) = 2CO (g) ΔH = 221kJ mol 1ii. 2 2
iii.2Al(g)+ N2 (g) = 2AlN (s) ΔH3 = 318kJ mol
1
运用平衡移动原理分析反应 ii 对反应 i 的可能影响:___________。
(2)AlN 的性质。AlN 粉末可发生水解的化学方程式是AlN + 4H2O = Al(OH)3 + NH3 H2O 。相同条
件下,不同粒径的AlN 粉末水解时溶液 pH 的变化如图所示。
解释 t1 t2 时间内两条曲线差异的可能原因:___________。
(3)AlN 含量检测。向 ag AlN样品中加入足量浓 NaOH 溶液,然后通入水蒸气将 NH3 全部蒸出,将
NH 13用过量的 v mL c mol L H SO 溶液吸收完全,剩余的H2SO1 1 2 4 4 用 v2mL c2mol L
1NaOH 溶液恰好
中和,则样品中AlN 的质量分数是___________。
第8页/共10页
参考答案
第一部分 选择题(共 42 分)
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一
项。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D A D A A A B C C D D D B B
第二部分 非选择题(共 58 分)
15. ①. 20 ②. 2.5 ③. Ⅲ ④. 实验Ⅲ中出现浑浊所需时间最短
16.(1) ①. ②. 水的电离是吸热的,温度升高,平衡正向移动,Kw 增大
(2)10 11mol / L
(3)>
17.(1)CH3COOH CH3COO
+H+ (2)B
(3)变大 (4) ①. CH3COOH +OH
= CH3COO
+H2O ②. AB
18.(1) ①. 加压、降温、提高原料气中H2 的比例等 ②. 前段加热,有利于加快反应速率;后段冷却,
有利于平衡正向移动,增大CO2 的转化率
(2)b (3)生成物碳颗粒附着在催化剂表面影响了催化效果(或催化剂中毒)
19. ①. c (CO2 )
②. 2MnCO3 (s)+O2 (g ) 2MnO2 (s)+ 2CO2 (g ) H = + (2a +b) kJ mol
1
③. 保持O2 的浓度,降低CO2 的浓度,使平衡正向移动,提高碳酸锰的转化率
④.
⑤. 湿空气中,3500C 左右 ⑥. 干空气中没有催化剂,反应速率比湿空气中慢,8h时未达到平衡。
一定温度 300 800℃
20.(1) ①. AlCl3 + NH3 AlN +3HCl ②. b ③. 3Mg + N2 Mg3N2 ④.
800℃
Mg3N2 3Mg +N2 ⑤. 反应 ii 能降低氧气浓度,有利于反应 i 正向移动
(2)粒径较小的AlN 表面积大,水解反应速率较大
第9页/共10页
4.1 10 2 (2c v c 3
(3) 1 1 2
v2 )10
a
第10页/共10页
化 学
可能用到的相对原子质量:H:1 C:12 O:16 N:14 Al:27
第一部分 选择题(共 42 分)
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一
项。
1. 下列属于弱电解质的物质是
A. NaCl B. NaOH C. H2SO4 D. NH3 H2O
2. 下列溶液一定显酸性的是
c (H+A. )>c (OH- ) B. 含有H+ C. pH 7 D. 酚酞变红
3. 下列关于化学反应方向的说法正确的是
A. 凡是放热反应都是自发反应 B. 凡是熵增大的反应都是自发反应
C. 凡是吸热反应都不是自发反应 D. 反应是否自发,不只与反应热有关
4. 下列操作可以使水的离子积常数 Kw增大的是
A. 加热
B. 通入少量氯化氢气体
C. 通入少量氨气
D. 加入少量醋酸钠固体
5. 工业上处理含 CO、SO2烟道气的一种方法是将其在催化剂作用下转化为 S 和 CO2。已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol; S(s)+O2(g)=SO2(g) ΔH=-296 kJ/mol;则该条件下
2CO(g)+SO2(g)=S(s)+2CO2(g)的 ΔH等于
A. - 270 kJ/mol B. +26 kJ/mol C. -582 kJ/mol D. +270 kJ/mol
6. 据报道,在 300℃、70MPa 下由二氧化碳和氢气合成乙醇已成为现实: 2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g),下列叙述不.正.确.的是
A. 该反应一定是吸热反应
B. 使用催化剂可提高反应速率
C. 充入 CO2气体可提高 H2的平衡转化率
D. 从平衡混合气体中分离出 CH3CH2OH 和 H2O 可提高 CO2和 H2的利用率
7. 下列措施或事实不能用勒夏特列原理解释的是
A. Fe(SCN)3 溶液中加入铁粉后颜色变浅
B. 合成氨工业中使用铁触媒作催化剂
C. 在合成氨的反应中,降温或加压有利于氨的合成
D. 氨水稀释过程中,铵根数目增多
第1页/共10页
8. 反应2NO +O2 2NO2 条件相同时,分别测得 NO 的平衡转化率在不同压强( p1 、 p2 )下随温度变化
的曲线如图。下列说法中正确的是
A. p1 p2
B. 该反应为吸热反应
C. 随温度升高,该反应平衡常数减小
D. 其他条件不变,体积变为原来的 0.5 倍, c (NO2 )增大为原来的 2 倍
1
9. 下列关于室温下1L 0.1mol L NH3 H2O溶液的说法正确的是
A. NH3 H2O
+
的电离方程式: NH3 H2O=NH4 +OH
B. 加入少量 NH pH4Cl固体后,溶液的 增大
+
C. 滴加稀盐酸的过程中, n (NH4 )增大
3+
D. 与FeCl3 溶液反应的离子方程式:Fe +3OH =Fe(OH)3
10. N +2O 与CO在Fe 作用下发生反应的能量变化及反应历程如图所示。下列说法中,不.正.确.的是
A. 该反应的 H 0
B. Fe+使反应的活化能减小
C. 催化剂通过参与反应改变了反应历程
D. 上述过程在Fe+作用下,提高了 N2O 与CO的平衡转化率
1
11. 25°C 时,下列关于0.1 mol L 醋酸溶液的判断正确的是
A. c (CH3COO ) = 0.1 mol L 1 B. 与0.1 mol L 1 盐酸的 pH 相同
+
C. 加入CH3COONa (s) ,c (H )不变 D. 滴入 NaOH 浓溶液,溶液导电性增强
第2页/共10页
12. 根据下列实验操作和现象所得到的结论正确的是
A B
H2 (g)+I2 (g) 2HI(g)
将 NO2 球浸泡在冷水和热水中2NO2 N2O4 H 0,
平衡体系加压后颜色先变深后变浅
气体在热水中比在冷水中颜色浅
C D
3+ 3+ 2+Fe + 3SCN Fe(SCN)3 ,研究浓度对化学平衡的影 2Fe + 2I 2Fe + I2 ,证明化学反
响 应存在一定的限度
A. A B. B C. C D. D
13. 已知反应:X(g)+Y(g) 2Z(g) H<0,400℃时该反应的化学平衡常数 K=1。一定条件下,分别
在甲、乙、丙 3 个恒容密闭容器中加入 X 和 Y,反应体系中各物质的物质的量浓度的相关数据如表:
容 起始时物质的浓度/(mol L
-1) 10
温度 分钟时物质的浓
/(mol L-1)
器 /℃
c(X) c(Y) c(Z)
甲 400 1 1 0.5
乙 T1 1 1 0.4
第3页/共10页
丙 400 1 2 a
下列说法中,不.正.确.的是
A. 甲中,10 分钟内 X 的化学反应速率:v(X)=0.025mol L-1 min-1
B. 甲中,10 分钟时反应已达到化学平衡状态
C. 乙中,可能 T1<400℃
D. 丙中,a>0.5
14. 工业上可通过甲醇羰基化法制取甲酸甲酯( HCOOCH3 ):
CH3OH(g)+CO(g) HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH 和 CO,
测得相同时间内 CO 的转化率随温度变化如下图所示。下列说法不.正.确.的是
A. 增大压强甲醇转化率增大
B. b 点反应速率 υ =υ正 逆
C. 平衡常数K >K(75℃) (85℃) ,反应速率 υb <υd
D. 生产时反应温度控制在 80~85℃为宜
第二部分 非选择题(共 58 分)
15. 优化反应条件是研究化学反应的重要方面。以反应 Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 为例,
探究外界条件对化学反应速率的影响,实验方案如下表所示。
Na2S2O3溶液 H2SO实验 4溶液
蒸馏水
温度/℃
序号 浓度/(mol/L) 体积/mL 浓度/(mol/L) 体积/mL 体积/mL
Ⅰ 0.1 1.5 0.1 1.5 10 20
Ⅱ 0.1 2.5 0.1 1.5 9 a
Ⅲ 0.1 b 0.1 1.5 9 30
表中,a 为___________,b 为___________。上述三个实验中的反应速率最快的应该是实验___________(用
Ⅰ、Ⅱ、Ⅲ作答),实验证据为___________。
16. 下表是不同温度下水的离子积数据:
第4页/共10页
温度/℃ 25 t1 t2
水的离子积 KW 1 10
14 a 1 10 12
试回答以下问题:
(1)若25 t1 t2 ,则 a ___________1 10
14 (填“>”、“<”或“=”),作此判断的理由是___________。
(2)在 25℃时, pH = 3的HCl 溶液中,水电离产生的H+浓度为___________。
(3)25℃下,将 pH =13的 NaOH 溶液与 pH = 2 的稀盐酸等体积混合,所得混合溶液的pH
___________7(填“>”、“<”或“=”)。
17. 研究弱电解质的电离,有重要的实际意义。
Ⅰ.有机酸醋酸
(1)CH3COOH 的电离方程式是___________。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
A. c (CH3COO ) + B. c (H )
C. c (OH ) D. CH3COOH 电离平衡常数
c (CH COO 1 3 )
(3)将0.1mol L CH3COOH 溶液加水稀释, 的比值将________(填“变大”、“不变”或
c (CH3COOH )
“变小”)。
Ⅱ.对比弱酸酸性相对强弱
(4)某些弱酸在 25℃时的电离常数如下:
化学式 CH3COOH HSCN HCN HClO H2CO3
K1 = 4.4 10
7
电离常数 1.8 10 5 1.3 10 1 4.9 10 10 3.0 10 8
K2 = 4.7 10
11
①CH3COOH 和 NaOH 溶液反应的离子方程式是________。
②下列反应可以发生的是________(填字母)。
A.CH3COOH + Na2CO3 = NaHCO3 +CH3COONa
B.CH3COOH + NaCN = CH3COONa +HCN
C.CO2 +H2O + 2NaClO = Na2CO3 + 2HClO
D. NaHCO3 +HCN = NaCN +H2O +CO 2
18. 回收利用CO2 是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,其物质转化如图:
第5页/共10页
反应 A:CO2 (g)+ 4H2 (g) CH4 (g)+ 2H2O (g) ΔH 0,是回收利用CO2 的关键步骤。
(1)将原料气按 n (CO2 ) : n (H2 ) =1: 4置于恒容密闭容器中发生反应 A,在相同时间内测得H2O 的物
质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
①理论上,能提高CO2 平衡转化率的措施有___________(写出一条即可)。
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2 的转化效率,原因是
___________。
(2)下列关于空间站内物质和能量变化的说法中,不正确的是___________(填字母)。
a.反应 B 的能量变化是电能→化学能,或是光能→化学能
b.物质转化中 O、H 原子的利用率均为 100%
c.不用 Na2O2 作供氧剂的原因可能是 Na2O2 不易实现循环利用
(3)用CO2 (g)+ 2H2 (g) C (s)+ 2H2O (g)代替反应 A,可实现氢、氧元素完全循环利用,缺点是
使用一段时间后催化剂的催化效果会明显下降,其原因是___________。
19. 二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,
通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3 (s) MnO (s)+CO2 (g ) H1 = +a kJ mol
1
ii. 2MnO (s)+O2 (g ) 2MnO2 (s) H = +b kJ mol
1
2
①反应 i 的化学平衡常数表达式 K = ___________。
②焙烧MnCO3制取MnO2 的热化学方程式是_________________。
(2)焙烧(装置如图 1)时持续通入空气,并不断抽气的目的是________________。
第6页/共10页
(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图 2、图 3所
示。
①图 2 是在常压(0.1 MPa )下的研究结果,请在图 2中用虚线画出10 MPa 下MnCO3转化率与反应温
度的关系图______。
②常压下,要提高MnCO3的转化率,应选择的生产条件是____________焙烧6 8 h 。
③图 3 中,焙烧8 h 时,MnCO3的转化率:干空气<湿空气,原因是______________。
20. AlN 新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
物质 熔点/℃ 沸点/℃ 与 N2 反应温度 /℃ 相应化合物分解温度/℃
AlN :>2000(>1400 升华)
Al 660 2467 >800
AlCl3:(>181 升华)
Mg 649 1090 >300 Mg3N2 :>800
(1)AlN 的制备。
①化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和 NH3为原料制备AlN ,反应的化学方程式是______。
Ⅱ.上述反应适宜的温度范围是________℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
Al 与 N2 可直接化合为AlN 固体,AlN 能将Al 包裹,反应难以继续进行。控制温度,在Al 粉中均匀掺
入适量Mg 粉,可使Al 几乎全部转化为AlN 固体。该过程发生的反应有:___________、___________和
800 1400℃
2Al+ N2 2AlN 。
③碳热还原法。
以Al2O3 、C(石墨)和 N2 为原料,在高温下制备AlN 。
已知:i.2Al2O3 (s) 4Al(g)+3O (g) ΔH = +3351kJ mol
1
2 1
第7页/共10页
2C(石墨,s)+O (g) = 2CO (g) ΔH = 221kJ mol 1ii. 2 2
iii.2Al(g)+ N2 (g) = 2AlN (s) ΔH3 = 318kJ mol
1
运用平衡移动原理分析反应 ii 对反应 i 的可能影响:___________。
(2)AlN 的性质。AlN 粉末可发生水解的化学方程式是AlN + 4H2O = Al(OH)3 + NH3 H2O 。相同条
件下,不同粒径的AlN 粉末水解时溶液 pH 的变化如图所示。
解释 t1 t2 时间内两条曲线差异的可能原因:___________。
(3)AlN 含量检测。向 ag AlN样品中加入足量浓 NaOH 溶液,然后通入水蒸气将 NH3 全部蒸出,将
NH 13用过量的 v mL c mol L H SO 溶液吸收完全,剩余的H2SO1 1 2 4 4 用 v2mL c2mol L
1NaOH 溶液恰好
中和,则样品中AlN 的质量分数是___________。
第8页/共10页
参考答案
第一部分 选择题(共 42 分)
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一
项。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D A D A A A B C C D D D B B
第二部分 非选择题(共 58 分)
15. ①. 20 ②. 2.5 ③. Ⅲ ④. 实验Ⅲ中出现浑浊所需时间最短
16.(1) ①. ②. 水的电离是吸热的,温度升高,平衡正向移动,Kw 增大
(2)10 11mol / L
(3)>
17.(1)CH3COOH CH3COO
+H+ (2)B
(3)变大 (4) ①. CH3COOH +OH
= CH3COO
+H2O ②. AB
18.(1) ①. 加压、降温、提高原料气中H2 的比例等 ②. 前段加热,有利于加快反应速率;后段冷却,
有利于平衡正向移动,增大CO2 的转化率
(2)b (3)生成物碳颗粒附着在催化剂表面影响了催化效果(或催化剂中毒)
19. ①. c (CO2 )
②. 2MnCO3 (s)+O2 (g ) 2MnO2 (s)+ 2CO2 (g ) H = + (2a +b) kJ mol
1
③. 保持O2 的浓度,降低CO2 的浓度,使平衡正向移动,提高碳酸锰的转化率
④.
⑤. 湿空气中,3500C 左右 ⑥. 干空气中没有催化剂,反应速率比湿空气中慢,8h时未达到平衡。
一定温度 300 800℃
20.(1) ①. AlCl3 + NH3 AlN +3HCl ②. b ③. 3Mg + N2 Mg3N2 ④.
800℃
Mg3N2 3Mg +N2 ⑤. 反应 ii 能降低氧气浓度,有利于反应 i 正向移动
(2)粒径较小的AlN 表面积大,水解反应速率较大
第9页/共10页
4.1 10 2 (2c v c 3
(3) 1 1 2
v2 )10
a
第10页/共10页
同课章节目录
