5.3 课时2 新型无机非金属材料 课件(共28张PPT)
文档属性
| 名称 | 5.3 课时2 新型无机非金属材料 课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 30.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-14 08:26:07 | ||
图片预览








文档简介
(共28张PPT)
新型无机非金属材料
第五章 化工生产中的重要非金属元素
1. 通过学习,了解二氧化硅、新型陶瓷、碳纳米材料的性能和用途,感受新型无机非金属材料的奇特性能及其在高科技领域所发挥的重要作用,激发学生学习化学的兴趣。
2.结合身边的生活用品、电子产品、建筑物等用到的无机非金属材料,感受化学材料的作用巨大,提高学生努力学习化学、投身国家建设的社会责任感
SiO2存在形式
结晶形
无定形——硅藻土
石英、水晶、玛瑙、沙子
玛瑙
水晶
根据CO2与H2CO3的性质,推测SiO2与H2SiO3的性质,并写出相应的方程式。
已知(1)CO2可以溶于水并生成H2CO3,作为酸性氧化物,可以与碱和碱性氧化物反应;
(2)H2CO3是一种二元弱酸,能使紫色石蕊溶液变红,不稳定,受热易分解。
Si
SiO2
H2SiO3
Na2SiO3
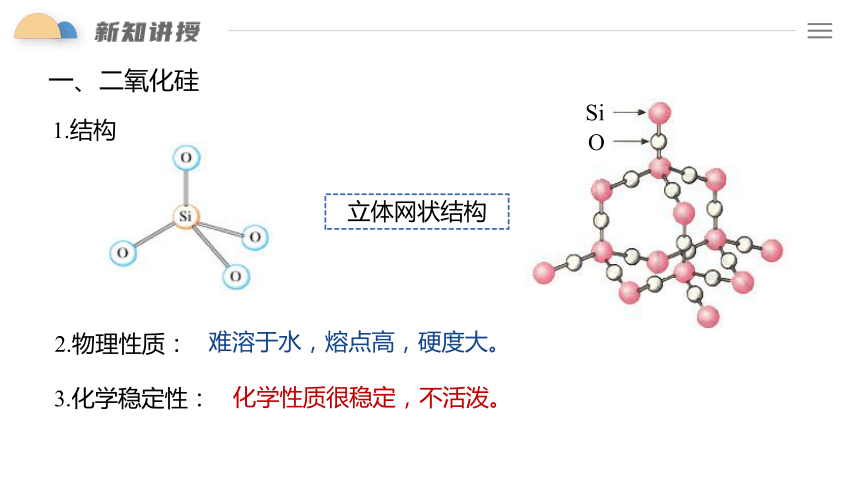
一、二氧化硅
难溶于水,熔点高,硬度大。
3.化学稳定性:
化学性质很稳定,不活泼。
1.结构
O
Si
立体网状结构
2.物理性质:
×
1.不能与水反应生成硅酸
2.具有酸性氧化物的性质
SiO2+2NaOH=Na2SiO3+H2O
SiO2+4HF=SiF4↑+2H2O
3.特性
SiO2+CaO CaSiO3
高温
SiO2+CaCO3 CaSiO3+CO2 ↑
高温
SiO2+Na2CO3 Na2SiO3+CO2↑
高温
3.SiO2的化学性质:
Si
SiO2
H2SiO3
Na2SiO3
雕刻玻璃
实验室不用玻璃瓶盛装氢氟酸!
SiO2+4HF=SiF4↑+2H2O
二氧化碳 二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2 + 2NaOH = Na2SiO3 +H2O
SiO2+CaO===CaSiO3
高温
HF
SiO2+4HF=SiF4↑+2H2O
不反应
SiO2+Na2CO3 ==== Na2SiO3+CO2↑
高温
SiO2+CaCO3==CaSiO3+CO2↑
高温
碳
CO2+C==2CO
SiO2+2C ==== Si+2CO↑
高温
碳酸盐
}制取玻璃原理
CO2 +H2O+Na2CO3 =2NaHCO3
4.二氧化硅的用途
SiO2的网状结构决定了它具有优良的物理和化学性质,加上SiO2在自然界的广泛存在,从古到今都被人类广泛地应用着。
光导纤维(通信)
水晶、玛瑙
玻璃仪器
精美瓷器
二、硅酸
1.白色胶状固体,不溶于水。
2.弱酸性:酸性比碳酸弱,不能使紫色石蕊溶液变红。
3.不稳定性:受热易分解,H2SiO3 SiO2 + H2O(工业制硅胶)。
4.制备(强酸制弱酸):
Na2SiO3 + 2HCl === 2NaCl + H2SiO3 ↓
Na2SiO3 + CO2 + H2O === H2SiO3 ↓ + Na2CO3
△
催化剂的载体
干燥剂
5.硅胶的用途
硅酸干凝胶 “硅胶”SiO2 nH2O
硅酸溶胶→硅酸凝胶→硅酸干凝胶即为 “硅胶”( H2SiO3 和SiO2的混合物 )
1、实验室盛NaOH溶液的试剂瓶为什么用橡胶塞不用玻璃塞?
2、某同学根据SiO2既可与碱反应,也能与氢氟酸反应,能否推断SiO2为两性氧化物
不正确。
二氧化硅不属于两性氧化物,但是属于酸性氧化物。
NaOH溶液能与玻璃中的SiO2反应生成 Na2SiO3,硅酸钠水溶液有粘性,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O
硅酸的制备
如何通过实验来证明硅酸的酸性比碳酸弱?
CaCO3
盐酸
饱和Na2SiO3溶液
CO2(HCl)
排除干扰
酸性: H2CO3>H2SiO3
饱和 NaHCO3 溶液
饱和Na2SiO3溶液
CaCO3
盐酸
CO2(HCl)
CO2
Na2SiO3 + CO2+H2O = H2SiO3 ↓ + 2NaCl
如何通过实验来证明硅酸的酸性比碳酸弱?
H2O+CO2/HCl
Si
Na2SiO3
SiO2
H2SiO3
O2 /△
F2
Na2O、NaOH
NaOH
物质类别
化
合
价
单质
氧化物
盐
含氧酸
0
+4
酸碱转化
氧化还原转化
Na2CO3
C/高温
SiF4
HF
HF
NaOH
SiCl4
Cl2
H2
氯化物
△
硅元素的价类图
SiHCl3
HCl
H2
+2
新型无机非金属材料的发展
新型材料 成分 性能 主要应用
金刚砂 ___________ 磨料、耐高温结构材料、耐高温半导体材料
高温结构陶瓷 碳化硅、氮化硅、金属氧化物 用于火箭发动机、汽车发动机和高温电极材料等
压电陶瓷 钛酸盐、锆酸盐等 用于滤波器、扬声器、超声波探伤器和点火器等
透明陶瓷 氧化铝、氧化钇等透明陶瓷; 用于高压钠灯、激光器、高温探测窗等
超导陶瓷 — 用于电力、交通、医疗等领域
碳化硅(SiC)
硬度大、耐高温、
抗氧化
耐高温、抗氧化、
耐腐蚀
能实现机械能和电能
的相互转化
具有优异的光学性能、
耐高温、绝缘性好
临界温度下具有超导性
碳纳米材料
主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广阔的应用前景。
碳纳米管可看成由石墨片层卷成的管状物,具有纳米尺度的直径。
比表面积大,有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
碳纳米管可看成由石墨片层卷成的管状物,具有纳米尺度的直径。
比表面积大,有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
石墨烯是只有一个碳原子直径厚度的单层石墨,其独特的结构使其电阻率低、热导率高,具有很高的强度。其在光电器件、超级电容器、电池和复合材料等方面的应用研究正在不断深入
1.有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列有关硅的说法中,不正确的是( )
A.高纯度的硅广泛用于制作计算机芯片
B.硅是人类将太阳能转换为电能的常用材料
C.常温下,硅与水、空气和酸不反应,但能与氢氟酸和氢氧化钠反应
D.由于硅的化学性质不活泼,自然界中存在大量的单质硅
D
2.下列说法中,正确的是( )
A.二氧化硅和二氧化碳都是酸性氧化物,所以二氧化硅能和水反应生成硅酸
B.泡花碱属于盐类,水溶液俗称水玻璃,可用于生产黏合剂和防火剂;硅胶可做干燥剂
C. SiO2可与氢氟酸反应,所以也能与盐酸反应
D. Si和SiO2都用于制造光导纤维
B
3.C、Si、S都是自然界中含量丰富的非金属元素,下列有关说法中正确的是( )
A.三种元素在自然界中既有游离态又有化合态
B.元素的+4价氧化物都属于酸性氧化物,都能与碱反应而不能与任何酸反应
C.最低价的气态氢化物都具有还原性,易与O2发生反应
D.其最高价氧化物对应的水化物的酸性强弱:H2SO4>H2SiO3>H2CO3
C
4.由下列实验事实得出的结论正确的是( )
A. 因为Na2CO3+SiO2 === Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.由SiO2+2C === Si+2CO↑,可知碳的非金属性大于硅
C.CO2通入Na2SiO3溶液产生白色胶状沉淀,可知酸性H2CO3>H2SiO3
D.实验室盛放氢氧化钠溶液的试剂瓶应使用橡胶塞而不是玻璃塞,可以用氢氟酸溶液蚀玻璃生产磨砂或雕花玻璃,因此可以推出:SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物
高温
高温
C
5.高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C=== Si+CO2↑
B.步骤①②③中每生成或反应28 g Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
D
高温
6.SiO2是一种化工原料,可以制备一系列物质(如图)。下列说法错误的是( )
A.图所含反应都不属于氧化还原反应
B.纯净的二氧化硅和单晶硅都是信息产业的重要基础材料
C.用盐酸可除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.高炉炼铁时用石灰石将铁矿石中的脉石转化为易熔的炉渣
A
7.习主席在2020年新年贺词中强调“5G商用加速推出,凝结着新时代奋斗者的心血和汗水,彰显了不同凡响的中国风采、中国力量”,而制造芯片用到高纯硅,用SiHCl3(沸点:31.85℃,SiHCl3遇水会剧烈反应,除生成H2SiO3、HCl外,还生成一种气体a)与过量H2在1100~1200 ℃反应制备高纯硅的装置如下图所示(夹持装置和尾气处理装置略去),下列说法错误的是( )
A.实验时,先打开装有稀硫酸仪器的活塞,收集尾气验纯,再预热装置Ⅳ石英管
B.装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、温度高于32℃的温水
C.Ⅰ装置可用于二氧化锰固体与浓盐酸反应制备氯气
D.a气体为H2
C
8.已知Si能与HF溶液和NaOH溶液反应:Si+4HF= SiF4↑+2H2,Si+2NaOH+H2O= Na2SiO3+2H2↑。又知硅及其化合物间存在如下图所示的关系:其中A是制造芯片和光电池的主要原料;B是含硅化合物中的一种气体; D是一种黏合剂,能将磨砂玻璃黏合在一起;E是一种比H2CO3酸性还弱的酸。
(1)写出A、C、D的化学式:A________ C_______ D_______。
(2)①~⑦反应中,属于氧化还原反应的是_______。
(3)写出反应⑤的离子方程式_____________________。
(1)Si;SiO2;Na2SiO3
(2)①③④
(3)2OH-+SiO2=SiO32-+H2O
新型无机非金属材料
第五章 化工生产中的重要非金属元素
1. 通过学习,了解二氧化硅、新型陶瓷、碳纳米材料的性能和用途,感受新型无机非金属材料的奇特性能及其在高科技领域所发挥的重要作用,激发学生学习化学的兴趣。
2.结合身边的生活用品、电子产品、建筑物等用到的无机非金属材料,感受化学材料的作用巨大,提高学生努力学习化学、投身国家建设的社会责任感
SiO2存在形式
结晶形
无定形——硅藻土
石英、水晶、玛瑙、沙子
玛瑙
水晶
根据CO2与H2CO3的性质,推测SiO2与H2SiO3的性质,并写出相应的方程式。
已知(1)CO2可以溶于水并生成H2CO3,作为酸性氧化物,可以与碱和碱性氧化物反应;
(2)H2CO3是一种二元弱酸,能使紫色石蕊溶液变红,不稳定,受热易分解。
Si
SiO2
H2SiO3
Na2SiO3
一、二氧化硅
难溶于水,熔点高,硬度大。
3.化学稳定性:
化学性质很稳定,不活泼。
1.结构
O
Si
立体网状结构
2.物理性质:
×
1.不能与水反应生成硅酸
2.具有酸性氧化物的性质
SiO2+2NaOH=Na2SiO3+H2O
SiO2+4HF=SiF4↑+2H2O
3.特性
SiO2+CaO CaSiO3
高温
SiO2+CaCO3 CaSiO3+CO2 ↑
高温
SiO2+Na2CO3 Na2SiO3+CO2↑
高温
3.SiO2的化学性质:
Si
SiO2
H2SiO3
Na2SiO3
雕刻玻璃
实验室不用玻璃瓶盛装氢氟酸!
SiO2+4HF=SiF4↑+2H2O
二氧化碳 二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2 + 2NaOH = Na2SiO3 +H2O
SiO2+CaO===CaSiO3
高温
HF
SiO2+4HF=SiF4↑+2H2O
不反应
SiO2+Na2CO3 ==== Na2SiO3+CO2↑
高温
SiO2+CaCO3==CaSiO3+CO2↑
高温
碳
CO2+C==2CO
SiO2+2C ==== Si+2CO↑
高温
碳酸盐
}制取玻璃原理
CO2 +H2O+Na2CO3 =2NaHCO3
4.二氧化硅的用途
SiO2的网状结构决定了它具有优良的物理和化学性质,加上SiO2在自然界的广泛存在,从古到今都被人类广泛地应用着。
光导纤维(通信)
水晶、玛瑙
玻璃仪器
精美瓷器
二、硅酸
1.白色胶状固体,不溶于水。
2.弱酸性:酸性比碳酸弱,不能使紫色石蕊溶液变红。
3.不稳定性:受热易分解,H2SiO3 SiO2 + H2O(工业制硅胶)。
4.制备(强酸制弱酸):
Na2SiO3 + 2HCl === 2NaCl + H2SiO3 ↓
Na2SiO3 + CO2 + H2O === H2SiO3 ↓ + Na2CO3
△
催化剂的载体
干燥剂
5.硅胶的用途
硅酸干凝胶 “硅胶”SiO2 nH2O
硅酸溶胶→硅酸凝胶→硅酸干凝胶即为 “硅胶”( H2SiO3 和SiO2的混合物 )
1、实验室盛NaOH溶液的试剂瓶为什么用橡胶塞不用玻璃塞?
2、某同学根据SiO2既可与碱反应,也能与氢氟酸反应,能否推断SiO2为两性氧化物
不正确。
二氧化硅不属于两性氧化物,但是属于酸性氧化物。
NaOH溶液能与玻璃中的SiO2反应生成 Na2SiO3,硅酸钠水溶液有粘性,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O
硅酸的制备
如何通过实验来证明硅酸的酸性比碳酸弱?
CaCO3
盐酸
饱和Na2SiO3溶液
CO2(HCl)
排除干扰
酸性: H2CO3>H2SiO3
饱和 NaHCO3 溶液
饱和Na2SiO3溶液
CaCO3
盐酸
CO2(HCl)
CO2
Na2SiO3 + CO2+H2O = H2SiO3 ↓ + 2NaCl
如何通过实验来证明硅酸的酸性比碳酸弱?
H2O+CO2/HCl
Si
Na2SiO3
SiO2
H2SiO3
O2 /△
F2
Na2O、NaOH
NaOH
物质类别
化
合
价
单质
氧化物
盐
含氧酸
0
+4
酸碱转化
氧化还原转化
Na2CO3
C/高温
SiF4
HF
HF
NaOH
SiCl4
Cl2
H2
氯化物
△
硅元素的价类图
SiHCl3
HCl
H2
+2
新型无机非金属材料的发展
新型材料 成分 性能 主要应用
金刚砂 ___________ 磨料、耐高温结构材料、耐高温半导体材料
高温结构陶瓷 碳化硅、氮化硅、金属氧化物 用于火箭发动机、汽车发动机和高温电极材料等
压电陶瓷 钛酸盐、锆酸盐等 用于滤波器、扬声器、超声波探伤器和点火器等
透明陶瓷 氧化铝、氧化钇等透明陶瓷; 用于高压钠灯、激光器、高温探测窗等
超导陶瓷 — 用于电力、交通、医疗等领域
碳化硅(SiC)
硬度大、耐高温、
抗氧化
耐高温、抗氧化、
耐腐蚀
能实现机械能和电能
的相互转化
具有优异的光学性能、
耐高温、绝缘性好
临界温度下具有超导性
碳纳米材料
主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广阔的应用前景。
碳纳米管可看成由石墨片层卷成的管状物,具有纳米尺度的直径。
比表面积大,有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
碳纳米管可看成由石墨片层卷成的管状物,具有纳米尺度的直径。
比表面积大,有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
石墨烯是只有一个碳原子直径厚度的单层石墨,其独特的结构使其电阻率低、热导率高,具有很高的强度。其在光电器件、超级电容器、电池和复合材料等方面的应用研究正在不断深入
1.有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列有关硅的说法中,不正确的是( )
A.高纯度的硅广泛用于制作计算机芯片
B.硅是人类将太阳能转换为电能的常用材料
C.常温下,硅与水、空气和酸不反应,但能与氢氟酸和氢氧化钠反应
D.由于硅的化学性质不活泼,自然界中存在大量的单质硅
D
2.下列说法中,正确的是( )
A.二氧化硅和二氧化碳都是酸性氧化物,所以二氧化硅能和水反应生成硅酸
B.泡花碱属于盐类,水溶液俗称水玻璃,可用于生产黏合剂和防火剂;硅胶可做干燥剂
C. SiO2可与氢氟酸反应,所以也能与盐酸反应
D. Si和SiO2都用于制造光导纤维
B
3.C、Si、S都是自然界中含量丰富的非金属元素,下列有关说法中正确的是( )
A.三种元素在自然界中既有游离态又有化合态
B.元素的+4价氧化物都属于酸性氧化物,都能与碱反应而不能与任何酸反应
C.最低价的气态氢化物都具有还原性,易与O2发生反应
D.其最高价氧化物对应的水化物的酸性强弱:H2SO4>H2SiO3>H2CO3
C
4.由下列实验事实得出的结论正确的是( )
A. 因为Na2CO3+SiO2 === Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.由SiO2+2C === Si+2CO↑,可知碳的非金属性大于硅
C.CO2通入Na2SiO3溶液产生白色胶状沉淀,可知酸性H2CO3>H2SiO3
D.实验室盛放氢氧化钠溶液的试剂瓶应使用橡胶塞而不是玻璃塞,可以用氢氟酸溶液蚀玻璃生产磨砂或雕花玻璃,因此可以推出:SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物
高温
高温
C
5.高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C=== Si+CO2↑
B.步骤①②③中每生成或反应28 g Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
D
高温
6.SiO2是一种化工原料,可以制备一系列物质(如图)。下列说法错误的是( )
A.图所含反应都不属于氧化还原反应
B.纯净的二氧化硅和单晶硅都是信息产业的重要基础材料
C.用盐酸可除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.高炉炼铁时用石灰石将铁矿石中的脉石转化为易熔的炉渣
A
7.习主席在2020年新年贺词中强调“5G商用加速推出,凝结着新时代奋斗者的心血和汗水,彰显了不同凡响的中国风采、中国力量”,而制造芯片用到高纯硅,用SiHCl3(沸点:31.85℃,SiHCl3遇水会剧烈反应,除生成H2SiO3、HCl外,还生成一种气体a)与过量H2在1100~1200 ℃反应制备高纯硅的装置如下图所示(夹持装置和尾气处理装置略去),下列说法错误的是( )
A.实验时,先打开装有稀硫酸仪器的活塞,收集尾气验纯,再预热装置Ⅳ石英管
B.装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、温度高于32℃的温水
C.Ⅰ装置可用于二氧化锰固体与浓盐酸反应制备氯气
D.a气体为H2
C
8.已知Si能与HF溶液和NaOH溶液反应:Si+4HF= SiF4↑+2H2,Si+2NaOH+H2O= Na2SiO3+2H2↑。又知硅及其化合物间存在如下图所示的关系:其中A是制造芯片和光电池的主要原料;B是含硅化合物中的一种气体; D是一种黏合剂,能将磨砂玻璃黏合在一起;E是一种比H2CO3酸性还弱的酸。
(1)写出A、C、D的化学式:A________ C_______ D_______。
(2)①~⑦反应中,属于氧化还原反应的是_______。
(3)写出反应⑤的离子方程式_____________________。
(1)Si;SiO2;Na2SiO3
(2)①③④
(3)2OH-+SiO2=SiO32-+H2O
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
