5.3 课时1 硅酸盐材料 课件(共27张PPT)
文档属性
| 名称 | 5.3 课时1 硅酸盐材料 课件(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 67.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-14 08:27:38 | ||
图片预览








文档简介
(共27张PPT)
硅酸盐材料
第五章 化工生产中的重要非金属元素
1、通过阅读和讨论,了解陶瓷、玻璃、水泥等传统硅酸盐材料的生产原料、性能和主要用途,知道玻璃的主要成分,感受传统硅酸盐材料在城乡建设中发挥的重要作用
2、了解晶体硅、性能和用途,感受其在高科技领域所发挥的重要作用
人类使用的无机非金属材料
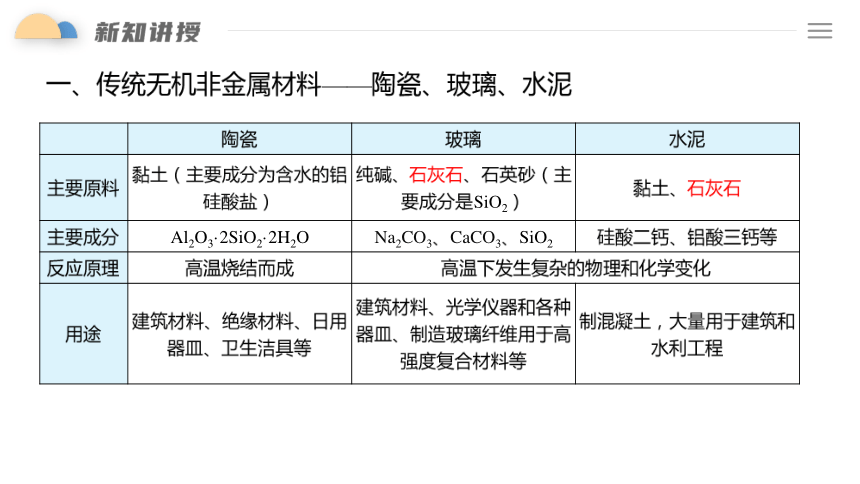
一、传统无机非金属材料——陶瓷、玻璃、水泥
陶瓷 玻璃 水泥
主要原料 黏土(主要成分为含水的铝硅酸盐) 纯碱、石灰石、石英砂(主要成分是SiO2) 黏土、石灰石
主要成分 Al2O3·2SiO2·2H2O Na2CO3、CaCO3、SiO2 硅酸二钙、铝酸三钙等
反应原理 高温烧结而成 高温下发生复杂的物理和化学变化 用途 建筑材料、绝缘材料、日用器皿、卫生洁具等 建筑材料、光学仪器和各种器皿、制造玻璃纤维用于高强度复合材料等 制混凝土,大量用于建筑和水利工程
一、传统无机非金属材料——陶瓷、玻璃、水泥
玻璃
原料:
工业设备:
应用:
纯碱、石灰石和石英砂(主要成分SiO2)
玻璃窑
主要成分:
生产建筑材料、光学仪器、各种器皿,制造玻璃纤维用于高强度复合材料等。
反应条件:
高温熔融
反应方程式:
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
Na2SiO3 、CaSiO3、SiO2
加入元素或物质 玻璃特性 用途
含铅原料 光学玻璃:透光性好,折射率高 制造眼镜、照相机和光学仪器的透镜
硼酸盐 耐化学腐蚀、耐温度急剧变化 制造可用于实验室使用的玻璃仪器
金属氧化物或盐 彩色玻璃 用于建筑和装饰
特种玻璃
(Co2O3、CuO)
水泥
原料:
工业设备:
黏土、石灰石、石膏
水泥回转窑
混凝土:
水泥、沙子和碎石等与水混合
石膏的作用:
条件:
高温煅烧
调节水泥硬化速率
水泥是一种非常重要的建筑材料。万丈高楼平地起,穿针引线是水泥。
关于水泥的认识
(1)水泥具有吸水性,在空气中吸水发生复杂的物理、化学变化而失去了原有的性质,因而变硬的水泥不能使用。
(2)水泥不能抗酸的腐蚀是因为水泥的成分中有碳酸盐,碳酸盐与酸反应会放出CO2。
长江三峡大坝使用了大量的水泥
二、硅酸盐的概念、结构与特点
1.概念:由硅元素、氧元素和金属元素组成的化合物。
2.结构:
Si 和 O 构成了硅氧四面体
每个 Si 结合 4 个 O, Si 在中心,O 在四面体的 4 个顶角
许多四面体通过顶角的O相互连接
每个 O 为两个四面体所共有,与 2 个 Si 相结合
3.特点:
大多硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等
二、硅酸盐的概念、结构与特点
最简单的硅酸盐—Na2SiO3
1.物理性质
易溶于水,其水溶液俗称水玻璃,又称泡花碱,是一种无色黏稠的液体,黏性很强。
硅酸钠水溶液呈碱性,易吸收空气中CO2而变质
Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3
3.具体应用
① Na2SiO3溶液(水玻璃)——木材防火、黏胶剂等
②制备硅酸:
2.化学性质
阻燃材料Na2SiO3
硅酸盐矿物的成分复杂,多用氧化物的形式表示它们的组成,如:
硅酸钠(Na2SiO3)→ Na2O·SiO2
高岭石(Al2H4Si2O9)→Al2O3·2SiO2·2H2O
资料卡片——硅酸盐的表示方法
顺序:活泼金属氧化物·较活泼金属氧化物·非金属氧化物·水
Ca(Al2Si3O10) ·3H2O
Mg2SiO4
Al2(Si2O5)(OH)4
K(Al3Si3O10)(OH)2
CaO ·Al2O3 ·3SiO2·3H2O
2MgO ·SiO2
K2O·3Al2O3·6SiO2·2H2O
Al2O3·2SiO2·2H2O
将下列硅酸盐改写为氧化物
氧化物之间用小点隔开,若出现分数,需要化为整数。
《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”“凡坯既成,干燥之后,则堆积窖中燃薪举火”“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是( )
A.“燃薪举火”使黏土发生了复杂的物理化学变化
B.沙子和黏土的主要成分为硅酸盐
C.烧制后自然冷却成红瓦,浇水冷却成青瓦
D.黏土是制作砖瓦和陶瓷的主要原料
B
小明参观了举世瞩目的北京大兴国际机场,该机场建设时应用了许多先进技术,其中之一是“重载水泥混凝土铺面技术”。下列原料可用于制造普通水泥的是( )
A.胆矾 B.纯碱 C.石膏 D.小苏打
C
玻璃
水泥
你了解生活中含硅及其化合物的物品吗?
陶瓷
通讯材料——光导纤维(SiO2)
硅太阳能电池(Si)
芯片的基础材料——硅晶片(Si)
怎么认识硅及其化合物的性质?
【类比思考】根据硅的原子结构示意图以及在元素周期表的位置,找出硅及其化合物并推测对应的性质
Si
SiO2
H2SiO3
Na2SiO3
C
CO2
H2CO3
Na2CO3
自然界中的碳元素既有游离态(石墨、金刚石、C60等),又有化合态;碳的最外层都是4个电子,位于元素周期表的第IV A族,不容易失也不容易得电子,通常化学性质稳定,但在一定条件下也能与许多物质发生化学反应。
硬度高、熔点高、难溶于水,化学性质稳定
2CuO+C 2Cu+CO2↑
石墨
金刚石
C+O2(少量) 2CO
点燃
C+O2(足量) CO2
点燃
C+H2O(g) CO+H2
C + CO2 2CO
高温
高温
高温
硅在自然界以什么形式存在?硅单质具有哪些性质?
水晶
主要成分SiO2
玛瑙
主要成分SiO2
Na2SiO3泡花碱
水溶液俗称水玻璃
主要成分:
3MgO·2siO2·2H2O
蛇纹石石棉
(1)存在:硅元素含量在地壳中居第二位。
硅是亲氧元素,在自然界中没有游离态,主要以硅酸盐和氧化物的形式存在。
三、硅单质的性质
硅单质主要有无定型硅和晶体硅两大类
1.物理性质:晶体硅为灰黑色固体,有金属光泽、硬度大、熔点高。
晶体硅的结构
晶体硅
晶体硅产品
2.化学性质:化学性质稳定,在常温下只能与氟气(F2)、HF、NaOH反应,不能与H2、O2、Cl2、硫酸、硝酸等氧化剂反应,加热时能与氧气、氯气反应。
Si+2NaOH+H2O=Na2SiO3+2H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
硅处于金属元素和非金属元素过渡位置,单质用作半导体材料。
三、硅单质的性质
1.与氧气反应:
2.与非金属的反应:
3.与碱的反应:
4.与酸的反应(唯一):
△
Si+O2 == SiO2
Si+2F2 == SiF4
△
Si+Cl2 == SiCl4
高温
Si+C == SiC(金刚砂)
Si+2NaOH+H2O == Na2SiO3+2H2↑
Si+4HF == SiF4↑+2H2↑
三、硅单质的性质
小结:化学性质
3.硅的制备
制备原理
制备流程
反应 方程式
用焦炭还原石英砂,得到含少量杂质的粗硅,
然后转化为三氯硅烷,再经氢气还原。
若C过量: SiO2+3C == SiC + 2CO ↑
高温
碳化硅(俗名:金刚砂)
工业上利用焦炭与SiO2在高温下反应制备粗硅,由此能否说明碳的还原性大于硅?
提示:氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
提纯
硅晶片是生产芯片的基础材料
硅太阳能电池
①良好的半导体材料
②太阳能电池
③计算机芯片
4.硅的用途
Si导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料
价值5元的沙子
SiO2
Si
价值5000元的芯片
点沙 成金
从沙滩到用户
4.硅的用途
硅酸盐材料
第五章 化工生产中的重要非金属元素
1、通过阅读和讨论,了解陶瓷、玻璃、水泥等传统硅酸盐材料的生产原料、性能和主要用途,知道玻璃的主要成分,感受传统硅酸盐材料在城乡建设中发挥的重要作用
2、了解晶体硅、性能和用途,感受其在高科技领域所发挥的重要作用
人类使用的无机非金属材料
一、传统无机非金属材料——陶瓷、玻璃、水泥
陶瓷 玻璃 水泥
主要原料 黏土(主要成分为含水的铝硅酸盐) 纯碱、石灰石、石英砂(主要成分是SiO2) 黏土、石灰石
主要成分 Al2O3·2SiO2·2H2O Na2CO3、CaCO3、SiO2 硅酸二钙、铝酸三钙等
反应原理 高温烧结而成 高温下发生复杂的物理和化学变化 用途 建筑材料、绝缘材料、日用器皿、卫生洁具等 建筑材料、光学仪器和各种器皿、制造玻璃纤维用于高强度复合材料等 制混凝土,大量用于建筑和水利工程
一、传统无机非金属材料——陶瓷、玻璃、水泥
玻璃
原料:
工业设备:
应用:
纯碱、石灰石和石英砂(主要成分SiO2)
玻璃窑
主要成分:
生产建筑材料、光学仪器、各种器皿,制造玻璃纤维用于高强度复合材料等。
反应条件:
高温熔融
反应方程式:
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
Na2SiO3 、CaSiO3、SiO2
加入元素或物质 玻璃特性 用途
含铅原料 光学玻璃:透光性好,折射率高 制造眼镜、照相机和光学仪器的透镜
硼酸盐 耐化学腐蚀、耐温度急剧变化 制造可用于实验室使用的玻璃仪器
金属氧化物或盐 彩色玻璃 用于建筑和装饰
特种玻璃
(Co2O3、CuO)
水泥
原料:
工业设备:
黏土、石灰石、石膏
水泥回转窑
混凝土:
水泥、沙子和碎石等与水混合
石膏的作用:
条件:
高温煅烧
调节水泥硬化速率
水泥是一种非常重要的建筑材料。万丈高楼平地起,穿针引线是水泥。
关于水泥的认识
(1)水泥具有吸水性,在空气中吸水发生复杂的物理、化学变化而失去了原有的性质,因而变硬的水泥不能使用。
(2)水泥不能抗酸的腐蚀是因为水泥的成分中有碳酸盐,碳酸盐与酸反应会放出CO2。
长江三峡大坝使用了大量的水泥
二、硅酸盐的概念、结构与特点
1.概念:由硅元素、氧元素和金属元素组成的化合物。
2.结构:
Si 和 O 构成了硅氧四面体
每个 Si 结合 4 个 O, Si 在中心,O 在四面体的 4 个顶角
许多四面体通过顶角的O相互连接
每个 O 为两个四面体所共有,与 2 个 Si 相结合
3.特点:
大多硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等
二、硅酸盐的概念、结构与特点
最简单的硅酸盐—Na2SiO3
1.物理性质
易溶于水,其水溶液俗称水玻璃,又称泡花碱,是一种无色黏稠的液体,黏性很强。
硅酸钠水溶液呈碱性,易吸收空气中CO2而变质
Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3
3.具体应用
① Na2SiO3溶液(水玻璃)——木材防火、黏胶剂等
②制备硅酸:
2.化学性质
阻燃材料Na2SiO3
硅酸盐矿物的成分复杂,多用氧化物的形式表示它们的组成,如:
硅酸钠(Na2SiO3)→ Na2O·SiO2
高岭石(Al2H4Si2O9)→Al2O3·2SiO2·2H2O
资料卡片——硅酸盐的表示方法
顺序:活泼金属氧化物·较活泼金属氧化物·非金属氧化物·水
Ca(Al2Si3O10) ·3H2O
Mg2SiO4
Al2(Si2O5)(OH)4
K(Al3Si3O10)(OH)2
CaO ·Al2O3 ·3SiO2·3H2O
2MgO ·SiO2
K2O·3Al2O3·6SiO2·2H2O
Al2O3·2SiO2·2H2O
将下列硅酸盐改写为氧化物
氧化物之间用小点隔开,若出现分数,需要化为整数。
《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”“凡坯既成,干燥之后,则堆积窖中燃薪举火”“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是( )
A.“燃薪举火”使黏土发生了复杂的物理化学变化
B.沙子和黏土的主要成分为硅酸盐
C.烧制后自然冷却成红瓦,浇水冷却成青瓦
D.黏土是制作砖瓦和陶瓷的主要原料
B
小明参观了举世瞩目的北京大兴国际机场,该机场建设时应用了许多先进技术,其中之一是“重载水泥混凝土铺面技术”。下列原料可用于制造普通水泥的是( )
A.胆矾 B.纯碱 C.石膏 D.小苏打
C
玻璃
水泥
你了解生活中含硅及其化合物的物品吗?
陶瓷
通讯材料——光导纤维(SiO2)
硅太阳能电池(Si)
芯片的基础材料——硅晶片(Si)
怎么认识硅及其化合物的性质?
【类比思考】根据硅的原子结构示意图以及在元素周期表的位置,找出硅及其化合物并推测对应的性质
Si
SiO2
H2SiO3
Na2SiO3
C
CO2
H2CO3
Na2CO3
自然界中的碳元素既有游离态(石墨、金刚石、C60等),又有化合态;碳的最外层都是4个电子,位于元素周期表的第IV A族,不容易失也不容易得电子,通常化学性质稳定,但在一定条件下也能与许多物质发生化学反应。
硬度高、熔点高、难溶于水,化学性质稳定
2CuO+C 2Cu+CO2↑
石墨
金刚石
C+O2(少量) 2CO
点燃
C+O2(足量) CO2
点燃
C+H2O(g) CO+H2
C + CO2 2CO
高温
高温
高温
硅在自然界以什么形式存在?硅单质具有哪些性质?
水晶
主要成分SiO2
玛瑙
主要成分SiO2
Na2SiO3泡花碱
水溶液俗称水玻璃
主要成分:
3MgO·2siO2·2H2O
蛇纹石石棉
(1)存在:硅元素含量在地壳中居第二位。
硅是亲氧元素,在自然界中没有游离态,主要以硅酸盐和氧化物的形式存在。
三、硅单质的性质
硅单质主要有无定型硅和晶体硅两大类
1.物理性质:晶体硅为灰黑色固体,有金属光泽、硬度大、熔点高。
晶体硅的结构
晶体硅
晶体硅产品
2.化学性质:化学性质稳定,在常温下只能与氟气(F2)、HF、NaOH反应,不能与H2、O2、Cl2、硫酸、硝酸等氧化剂反应,加热时能与氧气、氯气反应。
Si+2NaOH+H2O=Na2SiO3+2H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
硅处于金属元素和非金属元素过渡位置,单质用作半导体材料。
三、硅单质的性质
1.与氧气反应:
2.与非金属的反应:
3.与碱的反应:
4.与酸的反应(唯一):
△
Si+O2 == SiO2
Si+2F2 == SiF4
△
Si+Cl2 == SiCl4
高温
Si+C == SiC(金刚砂)
Si+2NaOH+H2O == Na2SiO3+2H2↑
Si+4HF == SiF4↑+2H2↑
三、硅单质的性质
小结:化学性质
3.硅的制备
制备原理
制备流程
反应 方程式
用焦炭还原石英砂,得到含少量杂质的粗硅,
然后转化为三氯硅烷,再经氢气还原。
若C过量: SiO2+3C == SiC + 2CO ↑
高温
碳化硅(俗名:金刚砂)
工业上利用焦炭与SiO2在高温下反应制备粗硅,由此能否说明碳的还原性大于硅?
提示:氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
提纯
硅晶片是生产芯片的基础材料
硅太阳能电池
①良好的半导体材料
②太阳能电池
③计算机芯片
4.硅的用途
Si导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料
价值5元的沙子
SiO2
Si
价值5000元的芯片
点沙 成金
从沙滩到用户
4.硅的用途
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
