2025届高三化学二轮专题训练 物质结构与性质综合(含解析)
文档属性
| 名称 | 2025届高三化学二轮专题训练 物质结构与性质综合(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-15 08:52:37 | ||
图片预览


文档简介
物质结构与性质综合
1.(10分)(2024·浙江强基联盟联考)由钛(Ti)、锗(Ge)、碳(C)组成的晶体X是一种潜在的新型防紫外线涂层材料。请回答:
(1)(1分)基态Ge原子的电子排布式为[Ar] 。
(2)(2分)下列说法正确的是 。
A.碳原子的第一电离能低于其相邻的同周期元素
B.当碳原子电子排布为1s22s12p3时,能量最低
C.共价键的极性:TiCl4>CCl4
D.二氯化锗中锗原子为sp2杂化
(3)(2分)某链状不饱和烃CnHm分子,σ键数目比π键数目多 个(用含n、m的式子表示)。
(4)(1分)C、O两个原子间的共价键键长:Ti(CO)4 CO(选填“<”“>”或“=”)。
(5)(4分)以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在X晶胞坐标系中,顶角的钛原子坐标为(0,0,0),棱心的钛原子坐标为(0,0,),部分原子的位置坐标如图所示。
①与Ge最近且等距离的Ti有 个。
②X晶体中粒子个数比N(Ti)∶N(Ge)∶N(C)= 。
2.(10分)(2024·浙江强基联盟联考)铜是人类最早发现并广泛使用的金属,铜及其化合物具有许多用途。请回答:
(1)(1分)基态Cu原子的M层电子排布式为 。
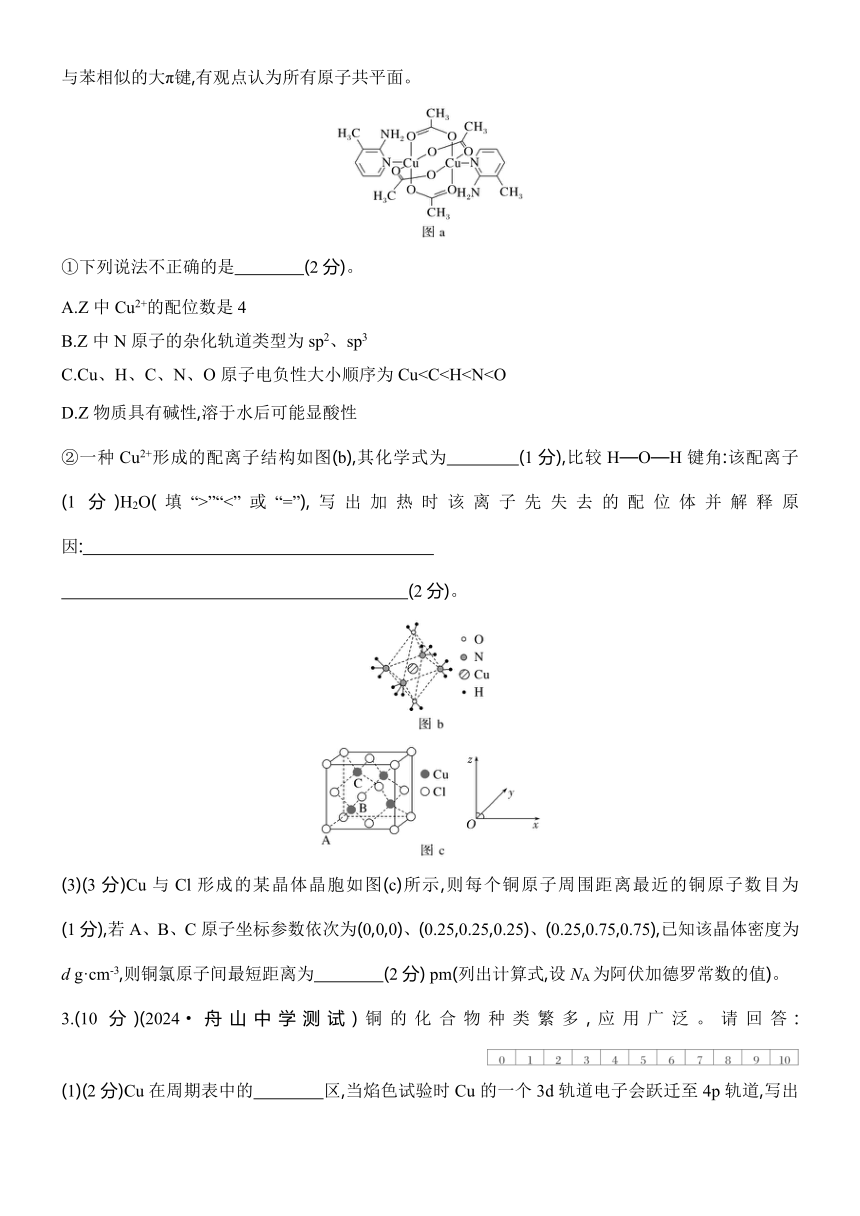
(2)(6分)2 氨基吡啶类双核铜配合物Z的结构简式如图(a)所示,已知:吡啶()、苯胺()含有与苯相似的大π键,有观点认为所有原子共平面。
①下列说法不正确的是 (2分)。
A.Z中Cu2+的配位数是4
B.Z中N原子的杂化轨道类型为sp2、sp3
C.Cu、H、C、N、O原子电负性大小顺序为CuD.Z物质具有碱性,溶于水后可能显酸性
②一种Cu2+形成的配离子结构如图(b),其化学式为 (1分),比较H—O—H键角:该配离子 (1分)H2O(填“>”“<”或“=”),写出加热时该离子先失去的配位体并解释原因:
(2分)。
(3)(3分)Cu与Cl形成的某晶体晶胞如图(c)所示,则每个铜原子周围距离最近的铜原子数目为 (1分),若A、B、C原子坐标参数依次为(0,0,0)、(0.25,0.25,0.25)、(0.25,0.75,0.75),已知该晶体密度为d g·cm-3,则铜氯原子间最短距离为 (2分) pm(列出计算式,设NA为阿伏加德罗常数的值)。
3.(10分)(2024·舟山中学测试)铜的化合物种类繁多,应用广泛。请回答:
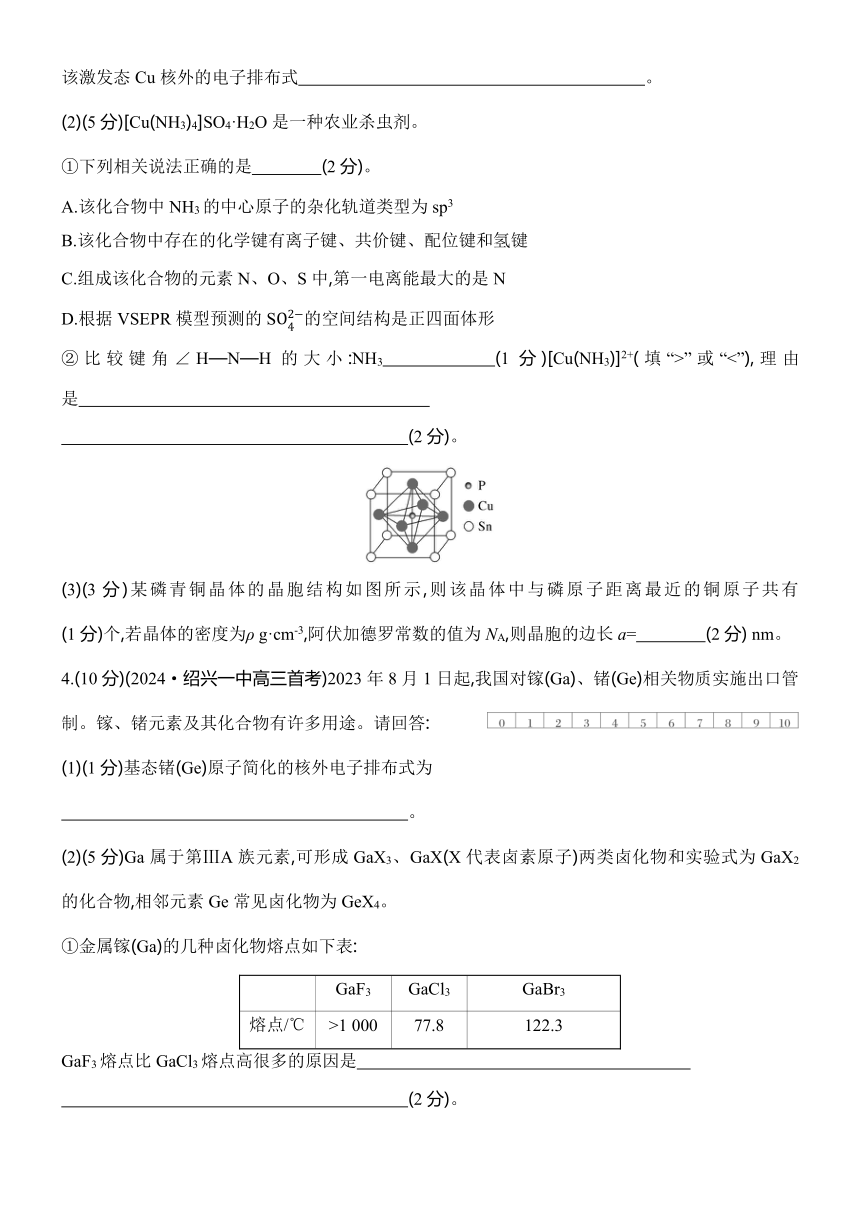
(1)(2分)Cu在周期表中的 区,当焰色试验时Cu的一个3d轨道电子会跃迁至4p轨道,写出该激发态Cu核外的电子排布式 。
(2)(5分)[Cu(NH3)4]SO4·H2O是一种农业杀虫剂。
①下列相关说法正确的是 (2分)。
A.该化合物中NH3的中心原子的杂化轨道类型为sp3
B.该化合物中存在的化学键有离子键、共价键、配位键和氢键
C.组成该化合物的元素N、O、S中,第一电离能最大的是N
D.根据VSEPR模型预测的S的空间结构是正四面体形
②比较键角∠H—N—H的大小:NH3 (1分)[Cu(NH3)]2+(填“>”或“<”),理由是
(2分)。
(3)(3分)某磷青铜晶体的晶胞结构如图所示,则该晶体中与磷原子距离最近的铜原子共有 (1分)个,若晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞的边长a= (2分) nm。
4.(10分)(2024·绍兴一中高三首考)2023年8月1日起,我国对镓(Ga)、锗(Ge)相关物质实施出口管制。镓、锗元素及其化合物有许多用途。请回答:
(1)(1分)基态锗(Ge)原子简化的核外电子排布式为
。
(2)(5分)Ga属于第ⅢA族元素,可形成GaX3、GaX(X代表卤素原子)两类卤化物和实验式为GaX2的化合物,相邻元素Ge常见卤化物为GeX4。
①金属镓(Ga)的几种卤化物熔点如下表:
GaF3 GaCl3 GaBr3
熔点/℃ >1 000 77.8 122.3
GaF3熔点比GaCl3熔点高很多的原因是
(2分)。
②比较GaCl3、GeCl4的键角:Cl—Ga—Cl (1分)Cl—Ge—Cl(填“>”“<”或“=”)。
③资料显示:Ga不存在+Ⅳ价,请用化学式表示实验式为GaCl2化合物可能的组成形态: (2分)[用罗马字符标明Ga在化合物中的价态:如Ga(Ⅲ)Cl3]。
(3)(4分)砷化镓是一种重要的半导体材料。砷化镓的晶胞如图1所示,Ga原子做面心立方密堆积,As原子填充在一半由Ga原子构成的四面体空隙中。沿晶胞对角线A→B方向观察得到的投影图如2所示。请回答:
①Ga原子的半径为a pm,As原子的半径为b pm,最近的两个Ga原子的距离为 pm(用含a、b的式子表示)。
②请在图2中将沿晶胞对角线A→B方向投影图中的As原子所在的位置涂黑。
5.(10分)含氮族元素的物质种类繁多,应用广泛。回答下列问题:
(1)(1分)基态As原子的简化电子排布式为 。
(2)(2分)下列说法正确的是 。
A.基态P原子核外电子的空间运动状态有9种
B.键角大小:N33
C.水溶液中的碱性:CH3NH2>NH3>NF3
D.甘氨酸(H2N—CH2—COOH)可分别与水、乙醇形成分子间氢键,故甘氨酸在水、乙醇中均可溶解
(3)(2分)磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则该酸的分子式为 。
(4)(2分)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 。
(5)(3分)我国科学家制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。分别用、表示H2P和K+,KH2PO4晶体的四方晶胞(晶胞为长方体)如图(a)所示,图(b)、图(c)分别显示的是H2P、K+在晶胞xz面、yz面上的位置。
与K+紧邻的H2P数目为 (1分)。
②若晶胞底边的边长均为a nm、高为c nm,NA为阿伏加德罗常数的值,则晶胞的密度ρ= (2分) g·cm-3(写出表达式)。
物质结构与性质综合
1.(1)3d104s24p2 (2)CD (3) (4)> (5)①2 ②3∶1∶2
解析 (1)Ge位于第四周期第ⅣA族,故电子排布式为[Ar]3d104s24p2。(2)根据元素周期律,第一电离能:BCCl4,C项正确。GeCl2的Ge的价层电子对数为3,所以锗原子为sp2杂化,D项正确。(3)由链状烃分子结构可知,CnHm中的σ键分C—H、C—C,总数为m+n-1。π键数即为双键数,总数为,所以两者相差。(4)Ti(CO)4分子中含配位键,C原子的孤电子对给予Ti原子后,造成C原子周围的电子云密度下降,进而降低了C原子与O原子间的电子云密度,故键长变大,所以键长Ti(CO)4>CO。(5)①由晶胞图可知,与Ge最近且等距离的Ti位于同一棱上,故只有2个。②结合原子坐标可知,Ti原子:8个位于顶角,4个在棱心,4个在体内,故共6个Ti原子。8个Ge原子位于棱上,故共有2个Ge。C原子位于体内,共4个。N(Ti)∶N(Ge)∶N(C)=3∶1∶2。
2.(1)3s23p63d10 (2)①ABC ②[Cu(NH3)4(H2O)2]2+ > H2O,O的电负性强于N元素,H2O的孤电子对相对不易给出,H2O与Cu2+形成的配位键更弱,加热时更易失去
(3)12 ×1010
解析 (1)基态Cu原子的M层电子排布式为3s23p63d10。(2)①Z中Cu2+的配位数是5,A项错误;由已知苯胺所有原子共平面,则其中N原子为sp2杂化,故Z中N原子的杂化轨道类型均为sp2,B项错误;Cu、H、C、N、O原子电负性大小顺序为Cu3.(1)ds 1s22s22p63s23p63d94s14p1
(2)①ACD ②< NH3分子中心原子氮原子有孤电子对,孤电子对排斥力大,使键角变小,[Cu(NH3)]2+中N原子上的孤对电子与铜形成配位键,NH3分子的氮原子没有孤电子对,N-H成键电子对受到排斥力小,使键角∠H—N—H变大
(3)6 ×107
解析 (1)铜在周期表中位于第四周期第ⅠB族,属于ds区;Cu的一个3d轨道跃迁至4p轨道,该激发态Cu核外的电子排布式1s22s22p63s23p63d94s14p1;(2)①该化合物中NH3的中心原子价层电子对为4对,杂化轨道类型为sp3,A正确;氢键不是化学键,B错误;组成该化合物的元素N、O、S中,第一电离能N>O>S,C正确;S离子中中心S原子的成键电子对为4对,孤电子对为=0,价层电子对为4对,VSEPR模型预测的S的空间结构是正四面体形,D正确;②NH3分子中心原子氮原子有孤电子对,孤电子对排斥力大,使键角变小,[Cu(NH3)]2+中N原子上的孤对电子与铜形成配位键,NH3分子的氮原子没有孤电子对,N—H成键电子对受到排斥力小,使键角∠H—N—H变大;(3)晶体中P原子位于立方体的体心,Cu原子位于的面心,与磷原子距离最近的铜原子共有6个;晶胞结构中有1个P原子位于体心,Sn原子位于立方体的顶角,晶胞中有8×=1个Sn原子,Cu原子位于立方体的面心,晶胞中有6×=3个Cu原子,晶胞的质量= g,晶胞的体积= cm3,晶胞的边长a=×107 nm。
4.(1)[Ar]3d104s24p2 (2)①GaF3是离子晶体,GaCl3是分子晶体,离子晶体的熔点高于分子晶体 ②> ③Ga(Ⅰ)[Ga(Ⅲ)Cl4]
(3)① ②
解析 (1)锗元素的原子序数为32,基态原子的简化核外电子排布式为[Ar]3d104s24p2;(2)①由熔点可知,氟化锗为离子晶体,氯化锗为分子晶体,离子晶体的熔点高于分子晶体,所以氟化锗的熔点比氯化锗高很多;②三氯化镓分子中镓原子的价层电子对数为3、孤电子对数为0,分子的空间构型为平面三角形,四氯化锗分子中锗原子的价层电子对数为4、孤电子对数为0,分子的空间构型为正四面体形,所以键角Cl—Ga—Cl大于Cl—Ge—Cl;③由镓元素不存在+Ⅳ价可知,二氯化镓中镓元素的化合价为+Ⅰ价和+Ⅲ价,其中+Ⅲ价镓元素与氯元素形成四氯合镓离子,四氯合镓离子与镓离子形成离子化合物,则二氯化镓的组成形态为Ga(Ⅰ)[Ga(Ⅲ)Cl4];(3)①设晶胞的边长为c pm,由晶胞结构可知,晶胞中位于顶点的镓原子与位于体对角线上的砷原子距离最近,则体对角线的距离为4(a+b) pm,晶胞的边长c= pm,晶胞中位于顶点的镓原子与位于面心的镓原子距离最近,则最近的两个镓原子的距离为 pm;②沿晶胞对角线A→B方向进行投影可得如下投影图:,其中黑球为位于晶胞体内的砷原子。
5.(1)[Ar]3d104s24p3 (2)AC (3)HnPnO3n
(4) (5)①8 ②×1021
解析 (1)As为33号元素,为第四周期第ⅤA族元素,基态As原子的简化电子排布式为[Ar]3d104s24p3;(2)A.把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;基态P原子核外电子排布为1s22s22p63s23p3,则基态P原子核外电子的空间运动状态有9种,A正确;B.PH3、NH3中心原子均为sp3杂化,由于氮的电负性更大、原子半径更小,成键电子对之间的斥力更大,故NH3中键角大于PH3;PH3、NH3中心原子存在1个孤电子对、N中心原子为sp3杂化且存在2个孤电子对,N中心原子为sp3杂化且无孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,故N中键角最大,B错误;C.甲基为推电子基团、F为吸电子基团,故使得结合水中氢离子的能力,CH3NH2>NH3>NF3,在水溶液中的碱性:CH3NH2>NH3>NF3,C正确;D.甘氨酸(H2N—CH2—COOH)可与水形成分子间氢键,故甘氨酸易溶于水;甘氨酸极性较弱、而乙醇为极性溶剂,故甘氨酸几乎不溶于酒精,D错误;(3)据题中信息可知,相邻2个磷酸分子间脱水结合成链状或环状,n个磷酸分子间脱水形成环状的多磷酸中的每个P原子只有1个羟基和2个O原子,则分子式为(HPO3)n,则相应的酸可写为HnPnO3n;(4)已知KH2PO2是次磷酸的正盐,说明其中的2个H原子不是羟基H原子,而直接与P原子形成共价键,则H3PO2的结构式为;(5)①由晶胞结构可知,以底面钾离子为例,与K+紧邻的H2P同层4个、上下层各2个,故数目共为8;②由晶胞结构可知,白球8个在顶点、4个在侧面上和1个在体心,则晶胞中白球个数为8×+1=4个,黑球4个在垂直于底面的4条棱的棱心、上下面心各1个、4个侧面上各有1个,则晶胞中黑球个数为4×=4个K+,即晶胞中含有4个KH2PO4,则晶体密度为21×1021 g·cm-3。
1.(10分)(2024·浙江强基联盟联考)由钛(Ti)、锗(Ge)、碳(C)组成的晶体X是一种潜在的新型防紫外线涂层材料。请回答:
(1)(1分)基态Ge原子的电子排布式为[Ar] 。
(2)(2分)下列说法正确的是 。
A.碳原子的第一电离能低于其相邻的同周期元素
B.当碳原子电子排布为1s22s12p3时,能量最低
C.共价键的极性:TiCl4>CCl4
D.二氯化锗中锗原子为sp2杂化
(3)(2分)某链状不饱和烃CnHm分子,σ键数目比π键数目多 个(用含n、m的式子表示)。
(4)(1分)C、O两个原子间的共价键键长:Ti(CO)4 CO(选填“<”“>”或“=”)。
(5)(4分)以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在X晶胞坐标系中,顶角的钛原子坐标为(0,0,0),棱心的钛原子坐标为(0,0,),部分原子的位置坐标如图所示。
①与Ge最近且等距离的Ti有 个。
②X晶体中粒子个数比N(Ti)∶N(Ge)∶N(C)= 。
2.(10分)(2024·浙江强基联盟联考)铜是人类最早发现并广泛使用的金属,铜及其化合物具有许多用途。请回答:
(1)(1分)基态Cu原子的M层电子排布式为 。
(2)(6分)2 氨基吡啶类双核铜配合物Z的结构简式如图(a)所示,已知:吡啶()、苯胺()含有与苯相似的大π键,有观点认为所有原子共平面。
①下列说法不正确的是 (2分)。
A.Z中Cu2+的配位数是4
B.Z中N原子的杂化轨道类型为sp2、sp3
C.Cu、H、C、N、O原子电负性大小顺序为Cu
②一种Cu2+形成的配离子结构如图(b),其化学式为 (1分),比较H—O—H键角:该配离子 (1分)H2O(填“>”“<”或“=”),写出加热时该离子先失去的配位体并解释原因:
(2分)。
(3)(3分)Cu与Cl形成的某晶体晶胞如图(c)所示,则每个铜原子周围距离最近的铜原子数目为 (1分),若A、B、C原子坐标参数依次为(0,0,0)、(0.25,0.25,0.25)、(0.25,0.75,0.75),已知该晶体密度为d g·cm-3,则铜氯原子间最短距离为 (2分) pm(列出计算式,设NA为阿伏加德罗常数的值)。
3.(10分)(2024·舟山中学测试)铜的化合物种类繁多,应用广泛。请回答:
(1)(2分)Cu在周期表中的 区,当焰色试验时Cu的一个3d轨道电子会跃迁至4p轨道,写出该激发态Cu核外的电子排布式 。
(2)(5分)[Cu(NH3)4]SO4·H2O是一种农业杀虫剂。
①下列相关说法正确的是 (2分)。
A.该化合物中NH3的中心原子的杂化轨道类型为sp3
B.该化合物中存在的化学键有离子键、共价键、配位键和氢键
C.组成该化合物的元素N、O、S中,第一电离能最大的是N
D.根据VSEPR模型预测的S的空间结构是正四面体形
②比较键角∠H—N—H的大小:NH3 (1分)[Cu(NH3)]2+(填“>”或“<”),理由是
(2分)。
(3)(3分)某磷青铜晶体的晶胞结构如图所示,则该晶体中与磷原子距离最近的铜原子共有 (1分)个,若晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞的边长a= (2分) nm。
4.(10分)(2024·绍兴一中高三首考)2023年8月1日起,我国对镓(Ga)、锗(Ge)相关物质实施出口管制。镓、锗元素及其化合物有许多用途。请回答:
(1)(1分)基态锗(Ge)原子简化的核外电子排布式为
。
(2)(5分)Ga属于第ⅢA族元素,可形成GaX3、GaX(X代表卤素原子)两类卤化物和实验式为GaX2的化合物,相邻元素Ge常见卤化物为GeX4。
①金属镓(Ga)的几种卤化物熔点如下表:
GaF3 GaCl3 GaBr3
熔点/℃ >1 000 77.8 122.3
GaF3熔点比GaCl3熔点高很多的原因是
(2分)。
②比较GaCl3、GeCl4的键角:Cl—Ga—Cl (1分)Cl—Ge—Cl(填“>”“<”或“=”)。
③资料显示:Ga不存在+Ⅳ价,请用化学式表示实验式为GaCl2化合物可能的组成形态: (2分)[用罗马字符标明Ga在化合物中的价态:如Ga(Ⅲ)Cl3]。
(3)(4分)砷化镓是一种重要的半导体材料。砷化镓的晶胞如图1所示,Ga原子做面心立方密堆积,As原子填充在一半由Ga原子构成的四面体空隙中。沿晶胞对角线A→B方向观察得到的投影图如2所示。请回答:
①Ga原子的半径为a pm,As原子的半径为b pm,最近的两个Ga原子的距离为 pm(用含a、b的式子表示)。
②请在图2中将沿晶胞对角线A→B方向投影图中的As原子所在的位置涂黑。
5.(10分)含氮族元素的物质种类繁多,应用广泛。回答下列问题:
(1)(1分)基态As原子的简化电子排布式为 。
(2)(2分)下列说法正确的是 。
A.基态P原子核外电子的空间运动状态有9种
B.键角大小:N33
C.水溶液中的碱性:CH3NH2>NH3>NF3
D.甘氨酸(H2N—CH2—COOH)可分别与水、乙醇形成分子间氢键,故甘氨酸在水、乙醇中均可溶解
(3)(2分)磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则该酸的分子式为 。
(4)(2分)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 。
(5)(3分)我国科学家制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。分别用、表示H2P和K+,KH2PO4晶体的四方晶胞(晶胞为长方体)如图(a)所示,图(b)、图(c)分别显示的是H2P、K+在晶胞xz面、yz面上的位置。
与K+紧邻的H2P数目为 (1分)。
②若晶胞底边的边长均为a nm、高为c nm,NA为阿伏加德罗常数的值,则晶胞的密度ρ= (2分) g·cm-3(写出表达式)。
物质结构与性质综合
1.(1)3d104s24p2 (2)CD (3) (4)> (5)①2 ②3∶1∶2
解析 (1)Ge位于第四周期第ⅣA族,故电子排布式为[Ar]3d104s24p2。(2)根据元素周期律,第一电离能:B
2.(1)3s23p63d10 (2)①ABC ②[Cu(NH3)4(H2O)2]2+ > H2O,O的电负性强于N元素,H2O的孤电子对相对不易给出,H2O与Cu2+形成的配位键更弱,加热时更易失去
(3)12 ×1010
解析 (1)基态Cu原子的M层电子排布式为3s23p63d10。(2)①Z中Cu2+的配位数是5,A项错误;由已知苯胺所有原子共平面,则其中N原子为sp2杂化,故Z中N原子的杂化轨道类型均为sp2,B项错误;Cu、H、C、N、O原子电负性大小顺序为Cu
(2)①ACD ②< NH3分子中心原子氮原子有孤电子对,孤电子对排斥力大,使键角变小,[Cu(NH3)]2+中N原子上的孤对电子与铜形成配位键,NH3分子的氮原子没有孤电子对,N-H成键电子对受到排斥力小,使键角∠H—N—H变大
(3)6 ×107
解析 (1)铜在周期表中位于第四周期第ⅠB族,属于ds区;Cu的一个3d轨道跃迁至4p轨道,该激发态Cu核外的电子排布式1s22s22p63s23p63d94s14p1;(2)①该化合物中NH3的中心原子价层电子对为4对,杂化轨道类型为sp3,A正确;氢键不是化学键,B错误;组成该化合物的元素N、O、S中,第一电离能N>O>S,C正确;S离子中中心S原子的成键电子对为4对,孤电子对为=0,价层电子对为4对,VSEPR模型预测的S的空间结构是正四面体形,D正确;②NH3分子中心原子氮原子有孤电子对,孤电子对排斥力大,使键角变小,[Cu(NH3)]2+中N原子上的孤对电子与铜形成配位键,NH3分子的氮原子没有孤电子对,N—H成键电子对受到排斥力小,使键角∠H—N—H变大;(3)晶体中P原子位于立方体的体心,Cu原子位于的面心,与磷原子距离最近的铜原子共有6个;晶胞结构中有1个P原子位于体心,Sn原子位于立方体的顶角,晶胞中有8×=1个Sn原子,Cu原子位于立方体的面心,晶胞中有6×=3个Cu原子,晶胞的质量= g,晶胞的体积= cm3,晶胞的边长a=×107 nm。
4.(1)[Ar]3d104s24p2 (2)①GaF3是离子晶体,GaCl3是分子晶体,离子晶体的熔点高于分子晶体 ②> ③Ga(Ⅰ)[Ga(Ⅲ)Cl4]
(3)① ②
解析 (1)锗元素的原子序数为32,基态原子的简化核外电子排布式为[Ar]3d104s24p2;(2)①由熔点可知,氟化锗为离子晶体,氯化锗为分子晶体,离子晶体的熔点高于分子晶体,所以氟化锗的熔点比氯化锗高很多;②三氯化镓分子中镓原子的价层电子对数为3、孤电子对数为0,分子的空间构型为平面三角形,四氯化锗分子中锗原子的价层电子对数为4、孤电子对数为0,分子的空间构型为正四面体形,所以键角Cl—Ga—Cl大于Cl—Ge—Cl;③由镓元素不存在+Ⅳ价可知,二氯化镓中镓元素的化合价为+Ⅰ价和+Ⅲ价,其中+Ⅲ价镓元素与氯元素形成四氯合镓离子,四氯合镓离子与镓离子形成离子化合物,则二氯化镓的组成形态为Ga(Ⅰ)[Ga(Ⅲ)Cl4];(3)①设晶胞的边长为c pm,由晶胞结构可知,晶胞中位于顶点的镓原子与位于体对角线上的砷原子距离最近,则体对角线的距离为4(a+b) pm,晶胞的边长c= pm,晶胞中位于顶点的镓原子与位于面心的镓原子距离最近,则最近的两个镓原子的距离为 pm;②沿晶胞对角线A→B方向进行投影可得如下投影图:,其中黑球为位于晶胞体内的砷原子。
5.(1)[Ar]3d104s24p3 (2)AC (3)HnPnO3n
(4) (5)①8 ②×1021
解析 (1)As为33号元素,为第四周期第ⅤA族元素,基态As原子的简化电子排布式为[Ar]3d104s24p3;(2)A.把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;基态P原子核外电子排布为1s22s22p63s23p3,则基态P原子核外电子的空间运动状态有9种,A正确;B.PH3、NH3中心原子均为sp3杂化,由于氮的电负性更大、原子半径更小,成键电子对之间的斥力更大,故NH3中键角大于PH3;PH3、NH3中心原子存在1个孤电子对、N中心原子为sp3杂化且存在2个孤电子对,N中心原子为sp3杂化且无孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,故N中键角最大,B错误;C.甲基为推电子基团、F为吸电子基团,故使得结合水中氢离子的能力,CH3NH2>NH3>NF3,在水溶液中的碱性:CH3NH2>NH3>NF3,C正确;D.甘氨酸(H2N—CH2—COOH)可与水形成分子间氢键,故甘氨酸易溶于水;甘氨酸极性较弱、而乙醇为极性溶剂,故甘氨酸几乎不溶于酒精,D错误;(3)据题中信息可知,相邻2个磷酸分子间脱水结合成链状或环状,n个磷酸分子间脱水形成环状的多磷酸中的每个P原子只有1个羟基和2个O原子,则分子式为(HPO3)n,则相应的酸可写为HnPnO3n;(4)已知KH2PO2是次磷酸的正盐,说明其中的2个H原子不是羟基H原子,而直接与P原子形成共价键,则H3PO2的结构式为;(5)①由晶胞结构可知,以底面钾离子为例,与K+紧邻的H2P同层4个、上下层各2个,故数目共为8;②由晶胞结构可知,白球8个在顶点、4个在侧面上和1个在体心,则晶胞中白球个数为8×+1=4个,黑球4个在垂直于底面的4条棱的棱心、上下面心各1个、4个侧面上各有1个,则晶胞中黑球个数为4×=4个K+,即晶胞中含有4个KH2PO4,则晶体密度为21×1021 g·cm-3。
同课章节目录
