2025届高三化学二轮专题训练 物质转化与推断综合训练(含解析)
文档属性
| 名称 | 2025届高三化学二轮专题训练 物质转化与推断综合训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 968.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-15 08:49:44 | ||
图片预览



文档简介
物质转化与推断综合训练
1.(10分)(2024·宁波第一学期模拟)工业上氮氧化物(NOx:NO和NO2混合气)废气吸收利用的某流程如下:
已知:氧化度α=;吸收液含有的产物有NaNO2和NaNO3;NH2OH在碱性条件下受热分解产物之一为N2。
请回答:
(1)(2分)过程Ⅳ以“肼合成酶”催化NH2OH与NH3转化为肼(NH2NH2)的反应历程如下所示:
该反应历程中Fe元素的化合价 (填“变化”或“不变”)。若将NH2OH替换为ND2OD,反应制得的肼的结构简式为 。
(2)(2分)写出过程Ⅰ中α=时反应的离子方程式
。
(3)(2分)下列说法正确的是 。
A.过程Ⅰ采用气、液逆流的方式可提高NOx的吸收效率
B.SO2的键角小于SCl2
C.NH2OH可作为配体,与Zn2+等金属离子形成配合物
D.NH2OH的水溶液显弱碱性,且Kb(NH2OH)>Kb(NH3·H2O)
(4)(2分)NH3OHCl是一种理想还原剂,氧化产物对环境友好,写出NH3OHCl还原FeCl3的化学方程式
。
(5)(2分)设计实验证明NH2OH中存在N元素
。
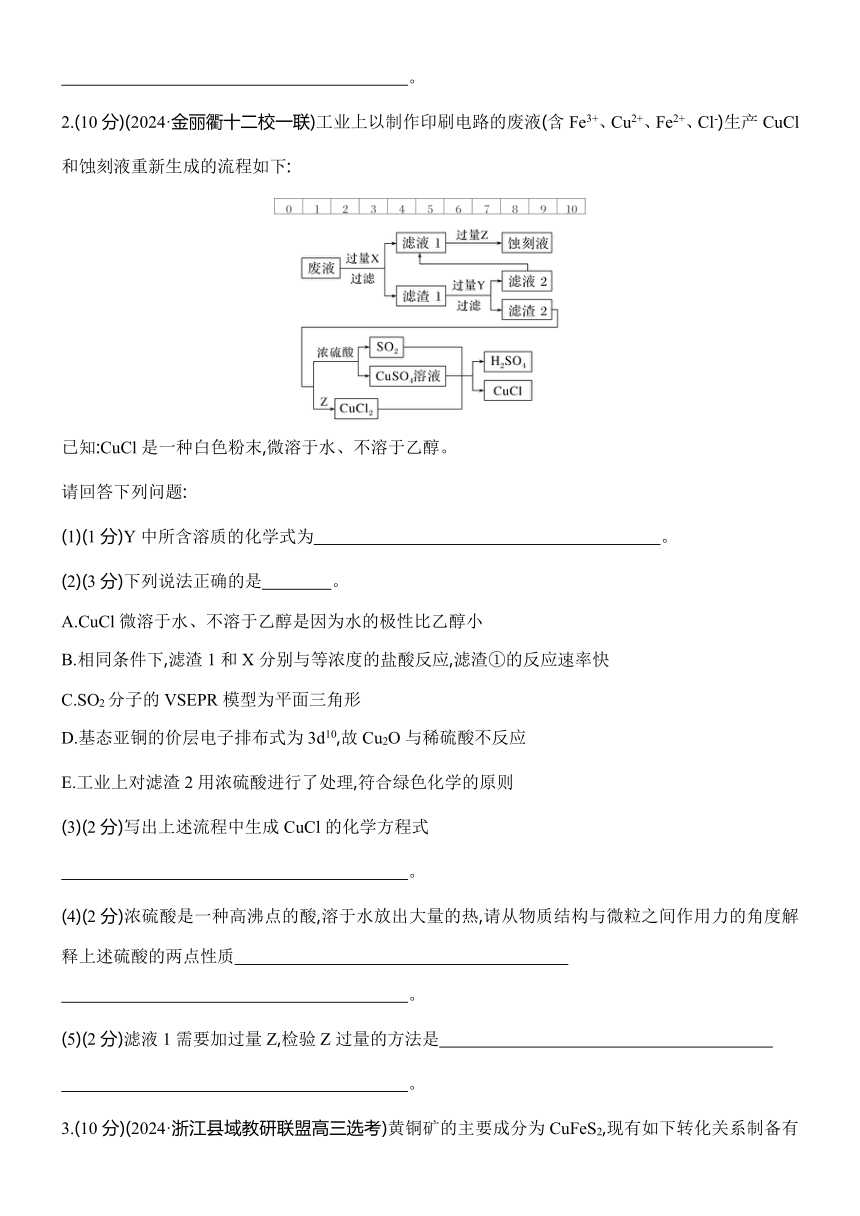
2.(10分)(2024·金丽衢十二校一联)工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl和蚀刻液重新生成的流程如下:
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇。
请回答下列问题:
(1)(1分)Y中所含溶质的化学式为 。
(2)(3分)下列说法正确的是 。
A.CuCl微溶于水、不溶于乙醇是因为水的极性比乙醇小
B.相同条件下,滤渣1和X分别与等浓度的盐酸反应,滤渣①的反应速率快
C.SO2分子的VSEPR模型为平面三角形
D.基态亚铜的价层电子排布式为3d10,故Cu2O与稀硫酸不反应
E.工业上对滤渣2用浓硫酸进行了处理,符合绿色化学的原则
(3)(2分)写出上述流程中生成CuCl的化学方程式
。
(4)(2分)浓硫酸是一种高沸点的酸,溶于水放出大量的热,请从物质结构与微粒之间作用力的角度解释上述硫酸的两点性质
。
(5)(2分)滤液1需要加过量Z,检验Z过量的方法是
。
3.(10分)(2024·浙江县域教研联盟高三选考)黄铜矿的主要成分为CuFeS2,现有如下转化关系制备有关物质。
已知:沉淀D的摩尔质量为99.5 g·mol-1。请回答:
(1)(2分)尾气中SO2经过充分综合利用可以得到石膏,请写出石膏的化学式: 。
(2)(4分)煅烧含硫量高的矿物得到高浓度的SO2,干燥的SO2气体与氯气在活性炭催化下可生成一种用于有机合成的常见物质A,该物质水解时发生非氧化还原反应得到两种强酸。
①写出物质A分子的结构式: 。
②一定压强下,化合物A的沸点低于硫酸的原因是
。
(3)(2分)生成沉淀D的离子反应方程式
。
(4)(2分)请设计实验检验溶液C中的阳离子
。
4.(10分)(2024·浙江浙南名校联盟高三联考)如图所示可以分离并回收废旧芯片中的几种贵金属。
已知:①HAuCl4是一种强酸;②Pd(NH3)2Cl2难溶。
请回答:
(1)(2分)含金固体可溶于HNO3和NaCl的混合溶液,并产生NO,请写出反应的离子方程式:
。
(2)(5分)金的分离还可以加王水,银钯的分离可重复利用某些溶液。
①下列说法正确的是 (2分)。
A.芯片中的金是芯片连接的绝佳材料,只是利用其物理性质
B.溶液X可以是NaCl溶液
C.溶液Z的主要成分是[Ag(NH3)2]Cl,是一种盐
D.N2H4不直接还原固体Y可能的原因是得到的Ag纯度更高
②加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,则该条件下配位能力:Cl- (1分)NH3(填“>”或“<”)。
③“加入盐酸,调pH≈1”能将[Pd(NH3)4]2+转化为Pd(NH3)2Cl2的原因
(2分)。
(3)(3分)溶液Z中加NaCl溶液是否有沉淀 (1分)(填“有”或“没有”)。设计实验验证溶液Z中银元素的存在
(2分)。
5.(10分)(2023·衢州、丽水、湖州高三质检)硝基乙烷可用作硝化纤维、染料等的溶剂和火箭的燃料,也可用于合成农药、医药等。硫酸二乙酯硝化法是合成硝基乙烷的重要方法,工艺流程示意图如下:
已知:硫酸结构简式为
请回答:
(1)(2分)步骤①的化学方程式
。
(2)(2分)下列有关说法不正确的是 。
A.硫酸氢乙酯具有酸性
B.相同温度下,硫酸二乙酯在水中的溶解性大于硫酸
C.NaNO2具有一定毒性,不能作为食品添加剂使用
D.若③中硫酸二乙酯和NaNO2等物质的量反应,则A化学式为CH3CH2OSO2ONa
(3)(2分)硫酸氢乙酯沸点为280 ℃,硫酸二乙酯的沸点为208 ℃,试从结构角度分析硫酸氢乙酯沸点高于硫酸二乙酯的原因
。
(4)(4分)设计实验验证固体NaNO2有还原性(可供选择的试剂有:酸性KMnO4溶液、KI溶液、H2O2溶液、FeSO4溶液) ;
写出实验过程中涉及的离子反应方程式
。
物质转化与推断综合训练
1.(1)变化 ND2NH2
(2)4NO2+2NO+3C+3CO2 (3)AC
(4)2NH3OHCl+2FeCl3N2↑+2FeCl2+2H2O+4HCl
(5)取少量NH2OH溶液于试管中,加入足量NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,证明NH2OH中有N元素
解析 (1)由反应历程可知,反应过程中Fe2+先失去电子发生氧化反应生成Fe3+,后面又得到电子被还原成Fe2+,该反应历程中Fe元素的化合价发生变化;由反应历程可知,NH2NH2有两个H原子来源于NH3,另外两个H原子来源于NH2OH,所以若将NH2OH替换为ND2OD,反应制得的肼的结构简式为ND2NH2;(2)若过程Ⅰ中α=,则反应物中n(NO2)∶n(NO)=2∶1,该反应为氧化还原反应,生成硝酸根和亚硝酸根,根据氧化还原反应规律配平可得:4NO2+2NO+3C+3CO2;(3)采用气、液逆流的方式可增大反应物的接触面积,增大反应速率,提高NOx的吸收效率,A项正确;SO2中的硫原子为sp2杂化,SCl2的硫原子为sp3杂化,所以SO2的键角大于SCl2,B项错误;NH2OH中的N原子有孤电子对,可作为配体,与Zn2+等金属离子形成配合物,C项正确;羟基的吸电子能力大于氢原子,所以NH2OH碱性应弱于NH3·H2O,即Kb(NH2OH)2.(1)HCl (2)BC (3)CuCl2+CuSO4+SO2+2H2O2CuCl↓+2H2SO4 (4)浓硫酸分子之间有氢键,故其沸点高;硫酸分子和水分子之间形成氢键,水合的时候放出大量的热 (5)取蚀刻液少量于试管中,加入KBr溶液和少量四氯化碳,如下层液体呈橙色,说明氯气已过量
解析 废液中加入过量铁粉,发生反应:Fe+2Fe3+3Fe2+、Fe+Cu2+Fe2++Cu,原溶液中的Fe3+、Cu2+被除去,过滤所得的滤液1中含有Fe2+、Cl-,在滤液中通入过量的氯气,可以将Fe2+氧化成FeCl3,即得到FeCl3蚀刻液,实现蚀刻液的再生。滤渣1为铜单质和剩余的铁单质,加入过量的稀盐酸,铜与稀盐酸不反应,因此滤液2也为FeCl2溶液,滤渣2为铜,铜和氯气反应生成CuCl2,Z为Cl2。(1)Y中所含溶质的化学式为HCl。(2)A.根据相似相溶原理,CuCl是极性分子,CuCl微溶于水、不溶于乙醇是因为水的极性比乙醇大,故A错误;B.由分析可知,滤渣1为铜单质和剩余的铁单质,X为Fe粉,分别与等浓度的盐酸反应,滤渣1形成原电池,反应速率更快,故B正确;C.SO2分子中心S原子价层电子对数为2+(6-4)=3,VSEPR模型为平面三角形,故C正确;D.基态亚铜的价层电子排布式为3d10,Cu2O能与稀硫酸发生如下反应:Cu2O+H2SO4Cu+CuSO4+H2O,故D错误;E.滤渣2为铜,铜与浓硫酸反应生成硫酸铜、二氧化硫和水,有污染性气体生成,不符合绿色化学的原则,故E错误;(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒得到产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O2CuCl↓+2H2SO4。(4)浓硫酸是一种高沸点的酸,溶于水放出大量的热,从物质结构与微粒之间作用力的角度解释上述硫酸的两点性质为浓硫酸分子之间有氢键,故其沸点高;硫酸分子和水分子之间形成氢键,水合的时候放出大量的热。(5)Z为Cl2,检验Cl2过量的方法为取蚀刻液少量于试管中,加入KBr溶液和少量四氯化碳,如下层液体呈橙色,说明氯气已过量。
3.(1)CaSO4·2H2O (2)① ②硫酸能形成分子间氢键,SO2Cl2没有分子间氢键
(3)2Cu2++2Cl-+SO2+2H2O2CuCl↓+S+4H+
(4)取少量溶液C于一支试管,加入石蕊试液(或pH试纸)若溶液显红色(pH试纸变红),则有H+;,另取少量溶液于试管中,加入K3[Fe(CN)6]溶液,若出现蓝色沉淀,则有Fe2+
解析 黄铜矿(CuFeS2)在足量空气中煅烧生成二氧化硫、氧化铁和氧化铜固体,固体加入盐酸反应生成氯化铁和氯化铜混合溶液,通入足量二氧化硫,发生氧化还原反应生成硫酸亚铁、硫酸和氯化亚铜沉淀,二氧化硫气体和氯气在活性炭催化作用下反应生成SO2Cl2。(1)石膏的化学式:CaSO4·2H2O;(2)①干燥的SO2气体与氯气在活性炭催化下可生成一种用于有机合成的常见物质A,则A为SO2Cl2,该物质(SO2Cl2)水解时发生非氧化还原反应得到两种强酸,即硫酸和盐酸,则物质A分子为SO2Cl2,其结构式:;②一定压强下,化合物A的沸点低于硫酸的原因是硫酸能形成分子间氢键,SO2Cl2没有分子间氢键;(3)根据沉淀D的摩尔质量为99.5 g·mol-1,说明D为氯化亚铜,则是铜离子和二氧化硫发生氧化还原反应生成硫酸根和亚铜离子,亚铜离子和氯离子反应生成CuCl,则生成沉淀D的离子反应方程式2Cu2++2Cl-+SO2+2H2O2CuCl↓+S+4H+。(4)根据前面分析,溶液C中含有氢离子和亚铁离子,检验氢离子常用紫色石蕊试液,检验亚铁离子常用K3[Fe(CN)6]溶液,因此实验检验溶液C中的阳离子方法是取少量溶液C于一支试管,加入石蕊试液(或pH试纸)溶液显红色(pH试纸变红),则有H+;另取少量溶液于试管中,加入K3[Fe(CN)6]溶液,若出现蓝色沉淀,则有Fe2+。
4.(1)Au+N+4Cl-+4H+[AuCl4]-+NO↑+2H2O
(2)①BD ②< ③调pH≈1,使部分NH3转化为N,能使可溶性配离子转化为难溶性的Pd(NH3)2Cl2;但若pH过小,c(H+)过大,NH3全部转化为N,则可能会完全转化成[PdCl4]2-
(3)没有 取少量Z溶液于试管,加入过量的盐酸,产生白色沉淀,加稀硝酸不溶,则证明有Ag元素
解析 废旧芯片中含有贵金属单质Au、Ag和Pd,在硝酸中酸浸,Au不发生反应,Ag、Pd发生反应转化为Ag+、Pd2+;含Au固体用王水溶解转化为HAuCl4溶液;向含有Ag+、Pd2-溶液中加入NaCl生成AgCl固体和[PdCl4]2-溶液;AgCl固体用氨水溶解得到银氨溶液,再向银氨溶液中加入肼得到Ag;向含[PdCl4]2-溶液中加入氨水得到含[Pd(NH3)4]2+溶液,再加入盐酸调pH得到Pd(NH3)2Cl2。(1)含金固体可溶于HNO3和NaCl的混合溶液,生成HAuCl4,并产生NO,根据氧化还原反应配平可得该反应的离子方程式为Au+N+4Cl-+4H+[AuCl4]-+NO↑+2H2O;(2)①芯片中的金是芯片连接的绝佳材料,不只是利用其物理性质,还因为金的化学性质不活泼,A项错误;生成的固体Y为氯化银,所以溶液X可以是NaCl溶液,B项正确;溶液Z是氯化银溶于氨水生成的[Ag(NH3)2]Cl溶液,C项错误;N2H4不直接还原固体AgCl可能的原因是碱性条件下水合肼的还原性增强,将固体AgCl溶解为银氨离子,能提高反应速率,同时避免生成的银单质中混有AgCl杂质,得到的Ag纯度更高,D项正确;故选BD;②加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,说明该条件下配位能力Cl-小于NH3;③Pd(NH3)2Cl2为难溶物,调pH≈1,使部分NH3转化为N,能使可溶性配离子转化为难溶性的Pd(NH3)2Cl2;但若pH过小,c(H+)过大,NH3全部转化为N,则可能会完全转化成可溶性的[PdCl4]2-;(3)Z溶液是银氨溶液,溶液中是银氨离子,不会和氯离子产生沉淀;若想验证银元素,应先将银氨离子转化为银离子,再检验银离子的存在,方法为取少量Z溶液于试管,加入过量的盐酸,产生白色沉淀,加稀硝酸不溶,则证明有Ag元素。
5.(1)H2SO4+CH3CH2OHCH3CH2OSO3H+H2O (2)BC
(3)硫酸氢乙酯可形成分子间氢键
(4)取NaNO2固体于试管中,加适量水溶解,逐滴加入少量酸性KMnO4溶液,溶液不出现紫红色,则NaNO2有还原性 5N+2++3H2O
解析 (1)步骤①的化学方程式为H2SO4+CH3CH2OHCH3CH2OSO3H+H2O;(2)A.生成硫酸氢乙酯只取代了硫酸中一个羟基,还剩下一个羟基可以电离出H+,故硫酸氢乙酯具有酸性,故A正确;B.相同温度下,硫酸中有羟基可以与水形成氢键,故硫酸在水中的溶解性大于硫酸二乙酯,故B错误;C.NaNO2具有一定毒性,但NaNO2具有还原性,可用作食品防腐剂,故C错误;D.若③中硫酸二乙酯和NaNO2等物质的量反应,硝基只能与1 mol乙基结合,则A化学式为CH3CH2OSO2ONa,故D正确;(3)硫酸氢乙酯中含有羟基,可以形成分子间氢键,故硫酸氢乙酯沸点高于硫酸二乙酯;(4)固体NaNO2有还原性,选择有颜色的氧化剂试验现象明显,故可以选取KMnO4溶液试验,取NaNO2固体于试管中,加适量水溶解,逐滴加入少量酸性KMnO4溶液,溶液不出现紫红色,则NaNO2有还原性。
1.(10分)(2024·宁波第一学期模拟)工业上氮氧化物(NOx:NO和NO2混合气)废气吸收利用的某流程如下:
已知:氧化度α=;吸收液含有的产物有NaNO2和NaNO3;NH2OH在碱性条件下受热分解产物之一为N2。
请回答:
(1)(2分)过程Ⅳ以“肼合成酶”催化NH2OH与NH3转化为肼(NH2NH2)的反应历程如下所示:
该反应历程中Fe元素的化合价 (填“变化”或“不变”)。若将NH2OH替换为ND2OD,反应制得的肼的结构简式为 。
(2)(2分)写出过程Ⅰ中α=时反应的离子方程式
。
(3)(2分)下列说法正确的是 。
A.过程Ⅰ采用气、液逆流的方式可提高NOx的吸收效率
B.SO2的键角小于SCl2
C.NH2OH可作为配体,与Zn2+等金属离子形成配合物
D.NH2OH的水溶液显弱碱性,且Kb(NH2OH)>Kb(NH3·H2O)
(4)(2分)NH3OHCl是一种理想还原剂,氧化产物对环境友好,写出NH3OHCl还原FeCl3的化学方程式
。
(5)(2分)设计实验证明NH2OH中存在N元素
。
2.(10分)(2024·金丽衢十二校一联)工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl和蚀刻液重新生成的流程如下:
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇。
请回答下列问题:
(1)(1分)Y中所含溶质的化学式为 。
(2)(3分)下列说法正确的是 。
A.CuCl微溶于水、不溶于乙醇是因为水的极性比乙醇小
B.相同条件下,滤渣1和X分别与等浓度的盐酸反应,滤渣①的反应速率快
C.SO2分子的VSEPR模型为平面三角形
D.基态亚铜的价层电子排布式为3d10,故Cu2O与稀硫酸不反应
E.工业上对滤渣2用浓硫酸进行了处理,符合绿色化学的原则
(3)(2分)写出上述流程中生成CuCl的化学方程式
。
(4)(2分)浓硫酸是一种高沸点的酸,溶于水放出大量的热,请从物质结构与微粒之间作用力的角度解释上述硫酸的两点性质
。
(5)(2分)滤液1需要加过量Z,检验Z过量的方法是
。
3.(10分)(2024·浙江县域教研联盟高三选考)黄铜矿的主要成分为CuFeS2,现有如下转化关系制备有关物质。
已知:沉淀D的摩尔质量为99.5 g·mol-1。请回答:
(1)(2分)尾气中SO2经过充分综合利用可以得到石膏,请写出石膏的化学式: 。
(2)(4分)煅烧含硫量高的矿物得到高浓度的SO2,干燥的SO2气体与氯气在活性炭催化下可生成一种用于有机合成的常见物质A,该物质水解时发生非氧化还原反应得到两种强酸。
①写出物质A分子的结构式: 。
②一定压强下,化合物A的沸点低于硫酸的原因是
。
(3)(2分)生成沉淀D的离子反应方程式
。
(4)(2分)请设计实验检验溶液C中的阳离子
。
4.(10分)(2024·浙江浙南名校联盟高三联考)如图所示可以分离并回收废旧芯片中的几种贵金属。
已知:①HAuCl4是一种强酸;②Pd(NH3)2Cl2难溶。
请回答:
(1)(2分)含金固体可溶于HNO3和NaCl的混合溶液,并产生NO,请写出反应的离子方程式:
。
(2)(5分)金的分离还可以加王水,银钯的分离可重复利用某些溶液。
①下列说法正确的是 (2分)。
A.芯片中的金是芯片连接的绝佳材料,只是利用其物理性质
B.溶液X可以是NaCl溶液
C.溶液Z的主要成分是[Ag(NH3)2]Cl,是一种盐
D.N2H4不直接还原固体Y可能的原因是得到的Ag纯度更高
②加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,则该条件下配位能力:Cl- (1分)NH3(填“>”或“<”)。
③“加入盐酸,调pH≈1”能将[Pd(NH3)4]2+转化为Pd(NH3)2Cl2的原因
(2分)。
(3)(3分)溶液Z中加NaCl溶液是否有沉淀 (1分)(填“有”或“没有”)。设计实验验证溶液Z中银元素的存在
(2分)。
5.(10分)(2023·衢州、丽水、湖州高三质检)硝基乙烷可用作硝化纤维、染料等的溶剂和火箭的燃料,也可用于合成农药、医药等。硫酸二乙酯硝化法是合成硝基乙烷的重要方法,工艺流程示意图如下:
已知:硫酸结构简式为
请回答:
(1)(2分)步骤①的化学方程式
。
(2)(2分)下列有关说法不正确的是 。
A.硫酸氢乙酯具有酸性
B.相同温度下,硫酸二乙酯在水中的溶解性大于硫酸
C.NaNO2具有一定毒性,不能作为食品添加剂使用
D.若③中硫酸二乙酯和NaNO2等物质的量反应,则A化学式为CH3CH2OSO2ONa
(3)(2分)硫酸氢乙酯沸点为280 ℃,硫酸二乙酯的沸点为208 ℃,试从结构角度分析硫酸氢乙酯沸点高于硫酸二乙酯的原因
。
(4)(4分)设计实验验证固体NaNO2有还原性(可供选择的试剂有:酸性KMnO4溶液、KI溶液、H2O2溶液、FeSO4溶液) ;
写出实验过程中涉及的离子反应方程式
。
物质转化与推断综合训练
1.(1)变化 ND2NH2
(2)4NO2+2NO+3C+3CO2 (3)AC
(4)2NH3OHCl+2FeCl3N2↑+2FeCl2+2H2O+4HCl
(5)取少量NH2OH溶液于试管中,加入足量NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,证明NH2OH中有N元素
解析 (1)由反应历程可知,反应过程中Fe2+先失去电子发生氧化反应生成Fe3+,后面又得到电子被还原成Fe2+,该反应历程中Fe元素的化合价发生变化;由反应历程可知,NH2NH2有两个H原子来源于NH3,另外两个H原子来源于NH2OH,所以若将NH2OH替换为ND2OD,反应制得的肼的结构简式为ND2NH2;(2)若过程Ⅰ中α=,则反应物中n(NO2)∶n(NO)=2∶1,该反应为氧化还原反应,生成硝酸根和亚硝酸根,根据氧化还原反应规律配平可得:4NO2+2NO+3C+3CO2;(3)采用气、液逆流的方式可增大反应物的接触面积,增大反应速率,提高NOx的吸收效率,A项正确;SO2中的硫原子为sp2杂化,SCl2的硫原子为sp3杂化,所以SO2的键角大于SCl2,B项错误;NH2OH中的N原子有孤电子对,可作为配体,与Zn2+等金属离子形成配合物,C项正确;羟基的吸电子能力大于氢原子,所以NH2OH碱性应弱于NH3·H2O,即Kb(NH2OH)
解析 废液中加入过量铁粉,发生反应:Fe+2Fe3+3Fe2+、Fe+Cu2+Fe2++Cu,原溶液中的Fe3+、Cu2+被除去,过滤所得的滤液1中含有Fe2+、Cl-,在滤液中通入过量的氯气,可以将Fe2+氧化成FeCl3,即得到FeCl3蚀刻液,实现蚀刻液的再生。滤渣1为铜单质和剩余的铁单质,加入过量的稀盐酸,铜与稀盐酸不反应,因此滤液2也为FeCl2溶液,滤渣2为铜,铜和氯气反应生成CuCl2,Z为Cl2。(1)Y中所含溶质的化学式为HCl。(2)A.根据相似相溶原理,CuCl是极性分子,CuCl微溶于水、不溶于乙醇是因为水的极性比乙醇大,故A错误;B.由分析可知,滤渣1为铜单质和剩余的铁单质,X为Fe粉,分别与等浓度的盐酸反应,滤渣1形成原电池,反应速率更快,故B正确;C.SO2分子中心S原子价层电子对数为2+(6-4)=3,VSEPR模型为平面三角形,故C正确;D.基态亚铜的价层电子排布式为3d10,Cu2O能与稀硫酸发生如下反应:Cu2O+H2SO4Cu+CuSO4+H2O,故D错误;E.滤渣2为铜,铜与浓硫酸反应生成硫酸铜、二氧化硫和水,有污染性气体生成,不符合绿色化学的原则,故E错误;(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒得到产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O2CuCl↓+2H2SO4。(4)浓硫酸是一种高沸点的酸,溶于水放出大量的热,从物质结构与微粒之间作用力的角度解释上述硫酸的两点性质为浓硫酸分子之间有氢键,故其沸点高;硫酸分子和水分子之间形成氢键,水合的时候放出大量的热。(5)Z为Cl2,检验Cl2过量的方法为取蚀刻液少量于试管中,加入KBr溶液和少量四氯化碳,如下层液体呈橙色,说明氯气已过量。
3.(1)CaSO4·2H2O (2)① ②硫酸能形成分子间氢键,SO2Cl2没有分子间氢键
(3)2Cu2++2Cl-+SO2+2H2O2CuCl↓+S+4H+
(4)取少量溶液C于一支试管,加入石蕊试液(或pH试纸)若溶液显红色(pH试纸变红),则有H+;,另取少量溶液于试管中,加入K3[Fe(CN)6]溶液,若出现蓝色沉淀,则有Fe2+
解析 黄铜矿(CuFeS2)在足量空气中煅烧生成二氧化硫、氧化铁和氧化铜固体,固体加入盐酸反应生成氯化铁和氯化铜混合溶液,通入足量二氧化硫,发生氧化还原反应生成硫酸亚铁、硫酸和氯化亚铜沉淀,二氧化硫气体和氯气在活性炭催化作用下反应生成SO2Cl2。(1)石膏的化学式:CaSO4·2H2O;(2)①干燥的SO2气体与氯气在活性炭催化下可生成一种用于有机合成的常见物质A,则A为SO2Cl2,该物质(SO2Cl2)水解时发生非氧化还原反应得到两种强酸,即硫酸和盐酸,则物质A分子为SO2Cl2,其结构式:;②一定压强下,化合物A的沸点低于硫酸的原因是硫酸能形成分子间氢键,SO2Cl2没有分子间氢键;(3)根据沉淀D的摩尔质量为99.5 g·mol-1,说明D为氯化亚铜,则是铜离子和二氧化硫发生氧化还原反应生成硫酸根和亚铜离子,亚铜离子和氯离子反应生成CuCl,则生成沉淀D的离子反应方程式2Cu2++2Cl-+SO2+2H2O2CuCl↓+S+4H+。(4)根据前面分析,溶液C中含有氢离子和亚铁离子,检验氢离子常用紫色石蕊试液,检验亚铁离子常用K3[Fe(CN)6]溶液,因此实验检验溶液C中的阳离子方法是取少量溶液C于一支试管,加入石蕊试液(或pH试纸)溶液显红色(pH试纸变红),则有H+;另取少量溶液于试管中,加入K3[Fe(CN)6]溶液,若出现蓝色沉淀,则有Fe2+。
4.(1)Au+N+4Cl-+4H+[AuCl4]-+NO↑+2H2O
(2)①BD ②< ③调pH≈1,使部分NH3转化为N,能使可溶性配离子转化为难溶性的Pd(NH3)2Cl2;但若pH过小,c(H+)过大,NH3全部转化为N,则可能会完全转化成[PdCl4]2-
(3)没有 取少量Z溶液于试管,加入过量的盐酸,产生白色沉淀,加稀硝酸不溶,则证明有Ag元素
解析 废旧芯片中含有贵金属单质Au、Ag和Pd,在硝酸中酸浸,Au不发生反应,Ag、Pd发生反应转化为Ag+、Pd2+;含Au固体用王水溶解转化为HAuCl4溶液;向含有Ag+、Pd2-溶液中加入NaCl生成AgCl固体和[PdCl4]2-溶液;AgCl固体用氨水溶解得到银氨溶液,再向银氨溶液中加入肼得到Ag;向含[PdCl4]2-溶液中加入氨水得到含[Pd(NH3)4]2+溶液,再加入盐酸调pH得到Pd(NH3)2Cl2。(1)含金固体可溶于HNO3和NaCl的混合溶液,生成HAuCl4,并产生NO,根据氧化还原反应配平可得该反应的离子方程式为Au+N+4Cl-+4H+[AuCl4]-+NO↑+2H2O;(2)①芯片中的金是芯片连接的绝佳材料,不只是利用其物理性质,还因为金的化学性质不活泼,A项错误;生成的固体Y为氯化银,所以溶液X可以是NaCl溶液,B项正确;溶液Z是氯化银溶于氨水生成的[Ag(NH3)2]Cl溶液,C项错误;N2H4不直接还原固体AgCl可能的原因是碱性条件下水合肼的还原性增强,将固体AgCl溶解为银氨离子,能提高反应速率,同时避免生成的银单质中混有AgCl杂质,得到的Ag纯度更高,D项正确;故选BD;②加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,说明该条件下配位能力Cl-小于NH3;③Pd(NH3)2Cl2为难溶物,调pH≈1,使部分NH3转化为N,能使可溶性配离子转化为难溶性的Pd(NH3)2Cl2;但若pH过小,c(H+)过大,NH3全部转化为N,则可能会完全转化成可溶性的[PdCl4]2-;(3)Z溶液是银氨溶液,溶液中是银氨离子,不会和氯离子产生沉淀;若想验证银元素,应先将银氨离子转化为银离子,再检验银离子的存在,方法为取少量Z溶液于试管,加入过量的盐酸,产生白色沉淀,加稀硝酸不溶,则证明有Ag元素。
5.(1)H2SO4+CH3CH2OHCH3CH2OSO3H+H2O (2)BC
(3)硫酸氢乙酯可形成分子间氢键
(4)取NaNO2固体于试管中,加适量水溶解,逐滴加入少量酸性KMnO4溶液,溶液不出现紫红色,则NaNO2有还原性 5N+2++3H2O
解析 (1)步骤①的化学方程式为H2SO4+CH3CH2OHCH3CH2OSO3H+H2O;(2)A.生成硫酸氢乙酯只取代了硫酸中一个羟基,还剩下一个羟基可以电离出H+,故硫酸氢乙酯具有酸性,故A正确;B.相同温度下,硫酸中有羟基可以与水形成氢键,故硫酸在水中的溶解性大于硫酸二乙酯,故B错误;C.NaNO2具有一定毒性,但NaNO2具有还原性,可用作食品防腐剂,故C错误;D.若③中硫酸二乙酯和NaNO2等物质的量反应,硝基只能与1 mol乙基结合,则A化学式为CH3CH2OSO2ONa,故D正确;(3)硫酸氢乙酯中含有羟基,可以形成分子间氢键,故硫酸氢乙酯沸点高于硫酸二乙酯;(4)固体NaNO2有还原性,选择有颜色的氧化剂试验现象明显,故可以选取KMnO4溶液试验,取NaNO2固体于试管中,加适量水溶解,逐滴加入少量酸性KMnO4溶液,溶液不出现紫红色,则NaNO2有还原性。
同课章节目录
