2025中考科学备考集训31:元素的化合价与化学式(含解析)
文档属性
| 名称 | 2025中考科学备考集训31:元素的化合价与化学式(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 299.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-01-15 00:00:00 | ||
图片预览




文档简介
2025中考科学备考集训31:元素的化合价与化学式
一.选择题(共15小题)
1.人体吸入的O2有2%转化为活性氧,它能加速人体衰老,被称为“夺命杀手”,我国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3中Se元素的化合价是( )
A.+2 B.+4 C.+6 D.﹣2
2.用作漂白剂的过二硫酸钾(K2S2O8)在高于100℃的条件下能发生反应:2K2S2O82K2SO4+2SO3↑+O2↑。下列说法正确的是( )
A.K2S2O8中的硫元素显+7价
B.该反应属于化合反应
C.生成物K2SO4属于氧化物
D.反应前后固体中的硫元素质量不变
3.如图是铜元素和硫元素常见的化合价坐标图,C点表示的化合物的化学式是( )
A.CuS B.Cu2S C.CuS2 D.Cu2S2
4.敦煌莫高窟享有世界“东方美术馆”之美誉。科学研究表明,壁画所用颜料大部分取自天然矿物,下列壁画颜料所含主要物质中,加点的元素化合价标注正确的是( )
A.白垩:CaO3 B.赫石:2O3
C.炭黑: D.密陀僧:O
5.在化学王国里,数字被赋予了丰富的内涵.对下列化学用语中数字“2”的说法正确的是( )
①2H ②2NH3 ③SO2 ④O ⑤Mg2+ ⑥2OH﹣ ⑦H2O.
A.表示离子个数的是⑤
B.表示离子所带电荷数的是④⑤
C.表示分子中原子个数的是③⑦
D.表示分子个数的是①②
6.关于维生素C(化学式为C6H8O6),下列说法正确的是( )
A.属于氧化物
B.由碳、氢、氧三种元素组成
C.氢元素质量分数最大
D.分子中碳、氢、氧的原子个数比为1:2:1
7.如图是四位同学对某化学式意义的描述,他们描述的化学式是( )
A.Zn B.CO C.H2O D.N2
8.如图是铁元素和氧元素常见化合价的坐标图,试判断b点上形成化合物的化学式为( )
A.Fe B.FeO C.Fe2O3 D.Fe3O4
9.英雄航天员王亚平在“太空课堂”用实验药品乙酸钠(CH3COONa)演示了神奇的“冰雪”实验。下列关于乙酸钠的说法正确的是( )
A.由C、H、O、Na四种元素组成
B.相对分子质量是82g
C.氧、钠元素的质量比为2:1
D.氢元素的质量分数最大
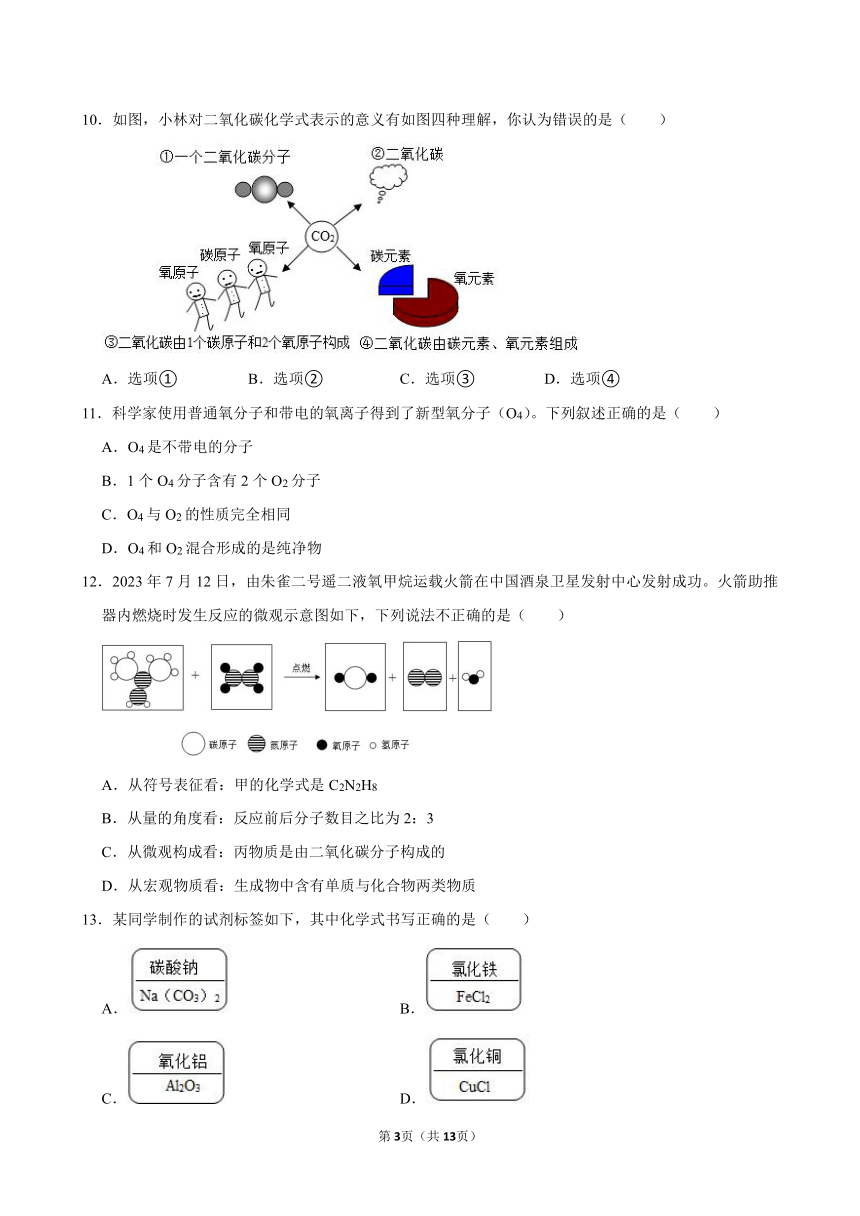
10.如图,小林对二氧化碳化学式表示的意义有如图四种理解,你认为错误的是( )
A.选项① B.选项② C.选项③ D.选项④
11.科学家使用普通氧分子和带电的氧离子得到了新型氧分子(O4)。下列叙述正确的是( )
A.O4是不带电的分子
B.1个O4分子含有2个O2分子
C.O4与O2的性质完全相同
D.O4和O2混合形成的是纯净物
12.2023年7月12日,由朱雀二号遥二液氧甲烷运载火箭在中国酒泉卫星发射中心发射成功。火箭助推器内燃烧时发生反应的微观示意图如下,下列说法不正确的是( )
A.从符号表征看:甲的化学式是C2N2H8
B.从量的角度看:反应前后分子数目之比为2:3
C.从微观构成看:丙物质是由二氧化碳分子构成的
D.从宏观物质看:生成物中含有单质与化合物两类物质
13.某同学制作的试剂标签如下,其中化学式书写正确的是( )
A. B.
C. D.
14.运动时,身体可以产生多巴胺,让人心情舒畅,提高身体免疫力。多巴胺的化学式为C8H11NO2,下列说法正确的是( )
A.一个多巴胺分子中含有一个氧分子
B.保持多巴胺化学性质的微粒是多巴胺分子
C.多巴胺中氢元素的质量分数最大
D.多巴胺是由碳原子、氢原子、氮原子、氧原子构成
15.运载火箭中推进剂偏二甲肼与四氧化二氮反应的微观示意图如图。下列说法正确的是( )
A.反应前后原子的种类不变而数目变少
B.反应生成的氮气和水的质量比为3:4
C.N2O4与NO2中氮元素化合价相同
D.一个N2O4分子含有一个氮气分子
二.填空题(共7小题)
16.请用恰当的化学用语填空:
(1)地壳中含量最高的金属元素: ;标出氧化镁中镁元素的化合价: 。
(2)保持二氧化硫化学性质的最小粒子是 。构成氯化钠的微粒是 。
17.化学用语可准确、简洁表达化学信息,请用化学用语填空。
(1)3个钾原子 。
(2)空气含量最多的元素 。
(3)4个铵根离子 。
(4)氢氧化镁 。
(5)氧化铁中铁元素化合价 。
(6)碘蒸气 。
(7)构成食盐的微粒是 。
(8)地壳中含量最多的元素和含量最多的金属元素所形成的化合物是 。
18.根据所学知识进行计算。
(1)某三价金属氧化物中氧元素的质量分数为30%,则该金属元素的相对原子质量为 。
(2)化合物SO3中S元素的化合价为 价。
19.某科学实验室能以低浓铀溶液生产具有广泛应用的钼(Mo),Na2MoO4是钼元素的重要化合物。
(1)Na2MoO4中铜元素(Mo)的化合价是 。
(2)组成Na2MoO4的元素中,在元素周期表内,位于其所在周期靠近尾部位置的元素是 。
(3)钼元素在化合物中有多种化合价,请写出+2价钼元素氧化物的化学式 。
20.微观示意图可形象地表示微粒发生的变化,如图是NH3在纯氧中燃烧的微观示意图,据图回答问题。
(1)反应的NH3和O2的分子个数比是 。
(2)左边第一个方框中的物质属于 (填“单质”、“化合物”或“混合物”)。
(3)下列说法正确的有 (填字母)。
A.该反应中分子发生了改变
B.该反应中原子可以再分
C.在该反应中分子是保持物质化学性质的最小微粒
21.我国民间有端午节挂艾草的习俗。艾草含有丰富的黄酮素(化学式为:C15H10O2),有很高的药用价值。请回答:
(1)黄酮素的相对分子质量为 。
(2)黄酮素中碳、氢元素的质量比为 (填最简比)。
(3)11.1g黄酮素中含碳元素的质量为 g。
22.硝酸羟胺(H4N2O4)是我国新一代载人飞船的绿色推进剂,在催化剂作用下可完全分解为氮气、氧气和水,其微观示意如图所示。
(1)一个硝酸羟胺(H4N2O4)分子中H、N、O原子个数比为 。
(2)据图分析,“”代表物质的化学式是 。
(3)物质的性质决定用途,如硝酸羟胺分解会释放大量能量,可用作飞船的绿色推进剂。请在上述生成物中任选一种举例说明性质决定用途: 。
(4)硝酸羟胺目前主要应用于航天领域,有人建议在民用方面将其推广,如汽车燃料、厨房然气等,但也有人持反对意见。下列观点属于反对将硝酸羟胺在民用领域进行推广的有 。(可多选)
A.硝酸羟胺有剧毒,挥发后对皮肤和眼睛等损伤较大
B.等质量的硝酸羟胺完全燃烧释放的热量比普通汽油大得多
C.硝酸羟胺熔点低、易泄漏,对储存设备的密封性要求较高
D.硝酸羟胺完全分解后产物无污染,绿色环保
E.在研发硝酸羟胺的使用及其安全性等方面投入成本过高
三.解答题(共3小题)
23.花青素(化学式为C15H11O6)的营养价值很高,主要存在于蔬菜和水果里面,是人体必不可少的营养成分。
(1)花青素的相对分子质量为 。
(2)花青素中碳、氢、氧三种元素的质量比为 。
(3)28.7g花青素中含有 g碳元素。
24.人体缺乏维生素C(简写“Vc”)就会患坏血病.如图为某种“维生素C”的说明书的一部分,试分析回答:
(1)“Vc”的相对分子质量是 ;“Vc”中碳、氢、氧元素的质量比是 .
(2)若正常成年人每天最低需要补充“Vc”60mg.
①当“Vc”完全由图中“维生素C”来补充时,则每次至少服用 片;
②当“Vc”完全由某种蔬菜(每100g这种蔬菜含“Vc”15mg) 来补充时,则每天至少应该食用这种蔬菜 g.
25.钙元素对于人体的健康非常重要,钙是人体的骨库,骨骼系统主要由钙所组成。现有某品牌钙片的部分信息:①钙片的主要成分为碳酸钙(CaCO3)②每片钙片的质量为1.5克。③使用方法:1天1次,每次2片。
(1)碳酸钙相对分子质量为 。
(2)碳酸钙中钙元素的质量分数?
(3)按说明书服用钙片,成年人每天的补钙量为500毫克。请问每片钙片中碳酸钙的质量为多少?
参考答案与试题解析
题号 1 2 3 4 5 6 7 8 9 10 11
答案 B A B D C B D C A C A
题号 12 13 14 15
答案 B C B C
一.选择题(共15小题)
1.【解答】解:设Na2SeO3中硒元素的化合价为x。
(+1)×2+x+(﹣2)×3=0
x=+4
故选:B。
2.【解答】解:A、K2S2O8中,钾元素化合价是+1,氧元素化合价是﹣2,设硫元素的化合价为x,根据化合物中元素化合价代数和为零可知:(+1)×2+2x+(﹣2)×8=0,x=+7,选项说法正确;
B、该反应是由一种物质生成三种新物质,符合“一变多”的特点,属于分解反应,选项说法错误;
C、氧化物是由两种元素组成,且其中有一种元素是氧元素的化合物,因此K2SO4不属于氧化物,选项说法错误;
D、反应物是一种固体,生成物中的三氧化硫是一种气体,其中含有硫元素,因此反应前后固体中的硫元素质量减少,选项说法错误。
故选:A。
3.【解答】解:C点上物质铜元素的化合价为+1价,硫元素显﹣2价,则C点上形成化合物的化学式为Cu2S。
故选:B。
4.【解答】解:A、碳酸钙中氧元素化合价为﹣2价,钙元素化合价为+2价,设碳酸钙中碳元素化合价为x,根据化合物中元素化合价代数和为零,则有:(+2)+x+(﹣2)×3=0,x=+4,故A错误;
B、化合物中元素化合价代数和为零,氧化铁中氧元素化合价为﹣2价,则铁元素化合价为+3,故B错误;
C、单质中元素化合价为0,C表示碳单质,其元素化合价为零,故C错误;
D、化合物中元素化合价代数和为零,PbO中氧元素化合价为﹣2价,则Pb化合价为+2,故D正确;
故选:D。
5.【解答】解:①2H中的2表示氢原子的个数为2个;
②2NH3的2表示氨气分子的个数为2个;
③SO2中的2表示一个二氧化硫分子中含有2个氧原子;
④O中的2表示氧化铜中铜元素的化合价为+2;
⑤Mg2+中的2表示一个镁离带有2个单位的正电荷;
⑥2OH﹣中的2表示氢氧根离子的个数为2个;
⑦H2O中的2表示一个水分子中含有2个氢原子;
A、表示离子个数的是⑥,错误;
B、表示离子所带电荷数的是⑤,错误;
C、表示分子中原子个数的是③⑦,正确;
D、表示分子个数的是②,错误;
故选:C。
6.【解答】解:A、氧化物是由两种元素组成的化合物,且一种元素为氧元素,维生素C是由碳、氢、氧三种元素,不属于氧化物,故A错误;
B、根据维生素C的化学式可知,维生素C是由碳、氢、氧三种元素组成的,故B正确;
C、维生素C中碳、氢、氧三种元素质量比(12×6):(1×8):(16×6)=72:8:96,故氢元素质量分数最小,故C错误;
D、根据维生素C的化学式可知,1个维生素C分子是由6个碳原子、8个氢原子和6个氧原子构成的,则分子中碳、氢、氧的原子个数比为6:8:6=3:4:3,故D错误;
故选:B。
7.【解答】解:根据题意,该物质由同种元素组成,1个分子由2个原子构成。
A、Zn是由一种元素组成的,且是由原子直接构成的,故A错误。
B、CO是由两种元素组成的,故B错误。
C、H2O是由两种元素组成的,且1个分子由3个原子构成,故C错误。
D、N2是由一种元素组成的,且1个分子由2个原子构成,故D正确。
故选:D。
8.【解答】解:b点上物质铁元素的化合价为+3价,氧元素显﹣2价,则b点上形成化合物的化学式为Fe2O3。
故选:C。
9.【解答】解:A、乙酸钠由C、H、O、Na四种元素组成,故选项说法正确。
B、相对分子质量单位是“1”,不是“g”,常常省略不写,故选项说法错误。
C、氧、钠元素的质量比为(16×2):(23×1)≠2:1,故选项说法错误。
D、乙酸钠中C、H、O、Na四种元素的质量比为(12×2):(1×3):(16×2):23=24:3:32:23,则氧元素的质量分数最大,故选项说法错误。
故选:A。
10.【解答】解:A.CO2微观可以表示一个二氧化碳分子,故描述正确;
B.CO2宏观可以表示二氧化碳这种物质,故描述正确;
C.二氧化碳是由二氧化碳分子构成的,一个二氧化碳分子由一个碳原子和2个氧原子构成,故描述错误;
D.二氧化碳由碳元素和氧元素组成,故描述正确。
故选:C。
11.【解答】解:A.1个O4分子由4个氧原子构成,原子不显电性,则O4是不带电的分子,故选项说法正确。
B、分子是由原子构成的,1个O4分子含有4个氧原子,不含有O2分子,故选项说法错误。
C、O4与O2分子的构成不同,性质不完全相同,故选项说法错误。
D、O4和O2是氧元素形成的两种不同的单质,O4和O2混合形成的是混合物,故选项说法错误。
故选:A。
12.【解答】解:由微观示意图可知,偏二甲肼与四氧化二氮在点燃的条件下反应生成水、二氧化碳和氮气,反应的化学方程式是:C2H8N2+2N2O43N2↑+2CO2↑+4H2O。
A、由分子结构模型可知,甲的化学式是C2N2H8,选项说法正确,不符合题意;
B、该反应方程式为C2H8N2+2N2O43N2↑+2CO2↑+4H2O,反应前后分子数目之比为2:8,选项说法不正确,符合题意;
C、丙物质为二氧化碳,是由二氧化碳分子构成的,选项说法正确,不符合题意;
D、生成物中含有单质与化合物两类物质,选项说法正确,不符合题意;
故选:B。
13.【解答】解:A、碳酸钠中钠元素显+1价,碳酸根显﹣2价,其化学式为:Na2CO3,化学式书写错误,故选项错误。
B、氯化铁的化学式为FeCl3,化学式书写错误,故选项错误。
C、氧化铝中铝元素显+3价,氧元素显﹣2价,其化学式为:Al2O3,化学式书写正确,故选项正确。
D、氯化铜的化学式为CuCl2,化学式书写错误,故选项错误。
故选:C。
14.【解答】解:A、一个多巴胺分子中含有2个氧原子,故A错误;
B、分子是保持物质化学性质的最小微粒,所以保持多巴胺化学性质的微粒是多巴胺分子,故B正确;
C、根据多巴胺中碳、氢、氧、氮的元素质量比为(12×8):(11×1):(16×2):(14×1)=96:11:32:14,所以多巴胺中碳元素的质量分数最大,故C错误;
D、多巴胺分子是由碳原子、氢原子、氮原子、氧原子构成,故D错误。
故选:B。
15.【解答】解:由反应的微观示意如图可知,偏二甲肼在一定条件下的条件下与四氧化二氮反应,生成水、二氧化碳和氮气,化学方程式为C2H8N2+2N2O43N2+4H2O+2CO2↑;
A、由质量守恒定律可知,反应前后原子的种类不变,原子的数目也不变,选项说法错误;
B、由化学方程式可知,反应生成的氮气和水的质量比为(28×3):(18×4)≠3:4,选项说法错误;
C、四氧化二氮(N2O4)中氧元素是﹣2价,设其中氮元素的化合价为x,依据化合物中各元素的化合价代数和为0,则:x×2+(﹣2)×4=0,解得x=+4;NO2中氧元素的化合价为﹣2价,设其中氮元素的化合价为y,依据化合物中各元素的化合价代数和为0,则:y+(﹣2)×2=0,y=+4,选项说法正确;
D、分子是由原子构成的,一个N2O4分子含有2个氮原子,不含氮气分子,选项说法错误。
故选:C。
二.填空题(共7小题)
16.【解答】解:(1)地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,地壳中含量最高的金属元素表示为:Al;元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,标出氧化镁中镁元素的化合价表示为:O。
(2)保持二氧化硫化学性质的最小粒子是二氧化硫分子,表示为:SO2。构成氯化钠的微粒是钠离子和氯离子,表示为:Na+、Cl﹣。
故答案为:(1)Al;O;
(2)SO2;Na+、Cl﹣。
17.【解答】解:(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以3个钾原子,就可表示为:3K;
(2)空气中含量最多的物质是氮气,氮气是由氮元素组成的,表示为:N;
(3)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故4个铵根离子表示为4;
(4)化学式书写的一般规律是:正前负后,然后利用十字交叉法书写;氢氧化镁中镁元素+2价,氢氧根﹣1价,表示为Mg(OH)2;
(5)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化铁中铁元素的化合价为+3,故可表示为:2O3;
(6)碘蒸气是碘单质,碘单质化学式为I2;
(7)构成食盐的微粒是钠离子和氯离子,表示为Na+、Cl﹣;
(8)地壳中含量最多的元素是氧元素,含量最多的金属元素是铝元素,所形成化合物是氧化铝,氧化铝中铝元素显+3价,氧元素显﹣2价,化学式为:Al2O3。
故答案为:(1)3K;
(2)N;
(3)4;
(4)Mg(OH)2;
(5)2O3;
(6)I2;
(7)Na+、Cl﹣;
(8)Al2O3。
18.【解答】解:(1)设金属元素的符号为X,某三价金属氧化物中金属元素显+3价,氧元素显﹣2价,其化学式为X2O3;某三价金属氧化物中氧元素的质量分数为30%,则金属元素的质量分数为1﹣30%=70%,金属元素和氧元素的质量比为70%:30%=7:3;设该金属元素的相对原子质量为y,2y:(16×3)=7:3,y=56。
(2)SO3中氧元素显﹣2价,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(﹣2)×3=0,则x=+6价。
故答案为:
(1)56;
(2)+6。
19.【解答】解:(1)Na2MoO4中钠元素显+1价,氧元素显﹣2价,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(﹣2)×4=0,则x=+6价。
(2)元素周期表每一周期的元素,从金属元素开始逐渐过渡到非金属元素,最终以稀有气体元素结束,则组成Na2MoO4的元素中,在元素周期表内,位于其所在周期靠近尾部位置的元素是氧。
(3)钼元素的氧化物中钼元素显+2价,氧元素显﹣2价,其化学式为MoO。
故答案为:
(1)+6;
(2)氧;
(3)MoO。
20.【解答】解:由NH3在纯氧中燃烧的微观示意图可知,氨气燃烧生成了氮气和水,反应的方程式是:4NH3+3O22N2+6H2O。
(1)由方程式的意义可知,反应的NH3和O2的分子个数比是4:3。
(2)左边第一个方框中的物质是由一种分子构成的,分子又是由不同种原子构成的,属于化合物。
(3)A、由微粒的变化可知,该反应中分子发生了改变,故A说法正确;
B、由微粒的变化可知,该反应中原子没有再分,只是发生了重新组合,故B说法不正确;
C、由分子的定义可知,分子是保持物质化学性质的最小微粒,故C说法正确。
故答案为:(1)4:3;
(2)化合物;
(3)AC。
21.【解答】解:(1)黄酮素的相对分子质量为12×15+1×10+16×2=222。
(2)黄酮素中碳、氢元素的质量比为(12×15):(1×10)=18:1。
(3)11.1g黄酮素中含碳元素的质量为11.1g100%=9g。
故答案为:(1)222;(2)18:1;(3)9。
22.【解答】解:(1)一个硝酸羟胺(H4N2O4)分子中H、N、O原子个数比为4:2:4=2:1:2;故答案为:2:1:2;
(2)由分子结构模型可知,“”是由两个氮原子构成的氮分子,代表物质的化学式是N2;故答案为:N2;
(3)由分子结构模型可知,生成物为氮气、氧气和水,氮气的化学性质较稳定,可用作保护气,氧气具有助燃性,可用于炼钢,水能溶解多种物质,可用作溶剂;故答案为:氧气具有助燃性,可用于炼钢(其他合理答案);
(4)A.硝酸羟胺有剧毒,挥发后对皮肤和眼睛等损伤较大,符合题意;
B.等质量的硝酸羟胺完全燃烧释放的热量比普通汽油大得多,不合题意;
C.硝酸羟胺熔点低、易泄漏,对储存设备的密封性要求较高,符合题意;
D.硝酸羟胺完全分解后产物无污染,绿色环保,不合题意;
E.在研发硝酸羟胺的使用及其安全性等方面投入成本过高,符合题意。
故答案为:ACE。
三.解答题(共3小题)
23.【解答】解:(1)花青素的相对分子质量是12×15+1×11+16×6=287;
(2)花青素中碳、氢、氧三种元素的质量比为(12×15):(1×11):(16×6)=180:11:96;
(3)28.7g花青素中含有碳元素的质量为28.7g18g。
故答案为:(1)287;(2)180:11:96;(3)18。
24.【解答】解:(1)Vc的相对分子质量为12×6+1×8+16×6=176,故答案为:176;
“Vc”中碳、氢、氧元素的质量比是(12×6):8:(16×6)=9:1:12,故答案为:9:1:12;
(2)由标签可知,每片维生素C100mg中至少含有Vc10%,即每片维生素C中至少含10mgVc,若成年人每天最少补充60mgVc,而且①Vc完全由维生素C片补充,则每天至少服用6片,而每天是三次,所以每次是2片.故答案为:2.
②若Vc完全由蔬菜来补充,则每天需要的蔬菜为400g,故答案为:400.
25.【解答】解:(1)碳酸钙的相对分子质量是40+12+16×3=100;故答案为:100;
(2)碳酸钙中钙元素的质量分数为40%
答:碳酸钙中钙元素的质量分数为40%;
(3)设每片钙片中碳酸钙的质量为x,则:
2x×40%=500mg
x=625mg
答:每片钙片中碳酸钙的质量为625mg。
第1页(共1页)
一.选择题(共15小题)
1.人体吸入的O2有2%转化为活性氧,它能加速人体衰老,被称为“夺命杀手”,我国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3中Se元素的化合价是( )
A.+2 B.+4 C.+6 D.﹣2
2.用作漂白剂的过二硫酸钾(K2S2O8)在高于100℃的条件下能发生反应:2K2S2O82K2SO4+2SO3↑+O2↑。下列说法正确的是( )
A.K2S2O8中的硫元素显+7价
B.该反应属于化合反应
C.生成物K2SO4属于氧化物
D.反应前后固体中的硫元素质量不变
3.如图是铜元素和硫元素常见的化合价坐标图,C点表示的化合物的化学式是( )
A.CuS B.Cu2S C.CuS2 D.Cu2S2
4.敦煌莫高窟享有世界“东方美术馆”之美誉。科学研究表明,壁画所用颜料大部分取自天然矿物,下列壁画颜料所含主要物质中,加点的元素化合价标注正确的是( )
A.白垩:CaO3 B.赫石:2O3
C.炭黑: D.密陀僧:O
5.在化学王国里,数字被赋予了丰富的内涵.对下列化学用语中数字“2”的说法正确的是( )
①2H ②2NH3 ③SO2 ④O ⑤Mg2+ ⑥2OH﹣ ⑦H2O.
A.表示离子个数的是⑤
B.表示离子所带电荷数的是④⑤
C.表示分子中原子个数的是③⑦
D.表示分子个数的是①②
6.关于维生素C(化学式为C6H8O6),下列说法正确的是( )
A.属于氧化物
B.由碳、氢、氧三种元素组成
C.氢元素质量分数最大
D.分子中碳、氢、氧的原子个数比为1:2:1
7.如图是四位同学对某化学式意义的描述,他们描述的化学式是( )
A.Zn B.CO C.H2O D.N2
8.如图是铁元素和氧元素常见化合价的坐标图,试判断b点上形成化合物的化学式为( )
A.Fe B.FeO C.Fe2O3 D.Fe3O4
9.英雄航天员王亚平在“太空课堂”用实验药品乙酸钠(CH3COONa)演示了神奇的“冰雪”实验。下列关于乙酸钠的说法正确的是( )
A.由C、H、O、Na四种元素组成
B.相对分子质量是82g
C.氧、钠元素的质量比为2:1
D.氢元素的质量分数最大
10.如图,小林对二氧化碳化学式表示的意义有如图四种理解,你认为错误的是( )
A.选项① B.选项② C.选项③ D.选项④
11.科学家使用普通氧分子和带电的氧离子得到了新型氧分子(O4)。下列叙述正确的是( )
A.O4是不带电的分子
B.1个O4分子含有2个O2分子
C.O4与O2的性质完全相同
D.O4和O2混合形成的是纯净物
12.2023年7月12日,由朱雀二号遥二液氧甲烷运载火箭在中国酒泉卫星发射中心发射成功。火箭助推器内燃烧时发生反应的微观示意图如下,下列说法不正确的是( )
A.从符号表征看:甲的化学式是C2N2H8
B.从量的角度看:反应前后分子数目之比为2:3
C.从微观构成看:丙物质是由二氧化碳分子构成的
D.从宏观物质看:生成物中含有单质与化合物两类物质
13.某同学制作的试剂标签如下,其中化学式书写正确的是( )
A. B.
C. D.
14.运动时,身体可以产生多巴胺,让人心情舒畅,提高身体免疫力。多巴胺的化学式为C8H11NO2,下列说法正确的是( )
A.一个多巴胺分子中含有一个氧分子
B.保持多巴胺化学性质的微粒是多巴胺分子
C.多巴胺中氢元素的质量分数最大
D.多巴胺是由碳原子、氢原子、氮原子、氧原子构成
15.运载火箭中推进剂偏二甲肼与四氧化二氮反应的微观示意图如图。下列说法正确的是( )
A.反应前后原子的种类不变而数目变少
B.反应生成的氮气和水的质量比为3:4
C.N2O4与NO2中氮元素化合价相同
D.一个N2O4分子含有一个氮气分子
二.填空题(共7小题)
16.请用恰当的化学用语填空:
(1)地壳中含量最高的金属元素: ;标出氧化镁中镁元素的化合价: 。
(2)保持二氧化硫化学性质的最小粒子是 。构成氯化钠的微粒是 。
17.化学用语可准确、简洁表达化学信息,请用化学用语填空。
(1)3个钾原子 。
(2)空气含量最多的元素 。
(3)4个铵根离子 。
(4)氢氧化镁 。
(5)氧化铁中铁元素化合价 。
(6)碘蒸气 。
(7)构成食盐的微粒是 。
(8)地壳中含量最多的元素和含量最多的金属元素所形成的化合物是 。
18.根据所学知识进行计算。
(1)某三价金属氧化物中氧元素的质量分数为30%,则该金属元素的相对原子质量为 。
(2)化合物SO3中S元素的化合价为 价。
19.某科学实验室能以低浓铀溶液生产具有广泛应用的钼(Mo),Na2MoO4是钼元素的重要化合物。
(1)Na2MoO4中铜元素(Mo)的化合价是 。
(2)组成Na2MoO4的元素中,在元素周期表内,位于其所在周期靠近尾部位置的元素是 。
(3)钼元素在化合物中有多种化合价,请写出+2价钼元素氧化物的化学式 。
20.微观示意图可形象地表示微粒发生的变化,如图是NH3在纯氧中燃烧的微观示意图,据图回答问题。
(1)反应的NH3和O2的分子个数比是 。
(2)左边第一个方框中的物质属于 (填“单质”、“化合物”或“混合物”)。
(3)下列说法正确的有 (填字母)。
A.该反应中分子发生了改变
B.该反应中原子可以再分
C.在该反应中分子是保持物质化学性质的最小微粒
21.我国民间有端午节挂艾草的习俗。艾草含有丰富的黄酮素(化学式为:C15H10O2),有很高的药用价值。请回答:
(1)黄酮素的相对分子质量为 。
(2)黄酮素中碳、氢元素的质量比为 (填最简比)。
(3)11.1g黄酮素中含碳元素的质量为 g。
22.硝酸羟胺(H4N2O4)是我国新一代载人飞船的绿色推进剂,在催化剂作用下可完全分解为氮气、氧气和水,其微观示意如图所示。
(1)一个硝酸羟胺(H4N2O4)分子中H、N、O原子个数比为 。
(2)据图分析,“”代表物质的化学式是 。
(3)物质的性质决定用途,如硝酸羟胺分解会释放大量能量,可用作飞船的绿色推进剂。请在上述生成物中任选一种举例说明性质决定用途: 。
(4)硝酸羟胺目前主要应用于航天领域,有人建议在民用方面将其推广,如汽车燃料、厨房然气等,但也有人持反对意见。下列观点属于反对将硝酸羟胺在民用领域进行推广的有 。(可多选)
A.硝酸羟胺有剧毒,挥发后对皮肤和眼睛等损伤较大
B.等质量的硝酸羟胺完全燃烧释放的热量比普通汽油大得多
C.硝酸羟胺熔点低、易泄漏,对储存设备的密封性要求较高
D.硝酸羟胺完全分解后产物无污染,绿色环保
E.在研发硝酸羟胺的使用及其安全性等方面投入成本过高
三.解答题(共3小题)
23.花青素(化学式为C15H11O6)的营养价值很高,主要存在于蔬菜和水果里面,是人体必不可少的营养成分。
(1)花青素的相对分子质量为 。
(2)花青素中碳、氢、氧三种元素的质量比为 。
(3)28.7g花青素中含有 g碳元素。
24.人体缺乏维生素C(简写“Vc”)就会患坏血病.如图为某种“维生素C”的说明书的一部分,试分析回答:
(1)“Vc”的相对分子质量是 ;“Vc”中碳、氢、氧元素的质量比是 .
(2)若正常成年人每天最低需要补充“Vc”60mg.
①当“Vc”完全由图中“维生素C”来补充时,则每次至少服用 片;
②当“Vc”完全由某种蔬菜(每100g这种蔬菜含“Vc”15mg) 来补充时,则每天至少应该食用这种蔬菜 g.
25.钙元素对于人体的健康非常重要,钙是人体的骨库,骨骼系统主要由钙所组成。现有某品牌钙片的部分信息:①钙片的主要成分为碳酸钙(CaCO3)②每片钙片的质量为1.5克。③使用方法:1天1次,每次2片。
(1)碳酸钙相对分子质量为 。
(2)碳酸钙中钙元素的质量分数?
(3)按说明书服用钙片,成年人每天的补钙量为500毫克。请问每片钙片中碳酸钙的质量为多少?
参考答案与试题解析
题号 1 2 3 4 5 6 7 8 9 10 11
答案 B A B D C B D C A C A
题号 12 13 14 15
答案 B C B C
一.选择题(共15小题)
1.【解答】解:设Na2SeO3中硒元素的化合价为x。
(+1)×2+x+(﹣2)×3=0
x=+4
故选:B。
2.【解答】解:A、K2S2O8中,钾元素化合价是+1,氧元素化合价是﹣2,设硫元素的化合价为x,根据化合物中元素化合价代数和为零可知:(+1)×2+2x+(﹣2)×8=0,x=+7,选项说法正确;
B、该反应是由一种物质生成三种新物质,符合“一变多”的特点,属于分解反应,选项说法错误;
C、氧化物是由两种元素组成,且其中有一种元素是氧元素的化合物,因此K2SO4不属于氧化物,选项说法错误;
D、反应物是一种固体,生成物中的三氧化硫是一种气体,其中含有硫元素,因此反应前后固体中的硫元素质量减少,选项说法错误。
故选:A。
3.【解答】解:C点上物质铜元素的化合价为+1价,硫元素显﹣2价,则C点上形成化合物的化学式为Cu2S。
故选:B。
4.【解答】解:A、碳酸钙中氧元素化合价为﹣2价,钙元素化合价为+2价,设碳酸钙中碳元素化合价为x,根据化合物中元素化合价代数和为零,则有:(+2)+x+(﹣2)×3=0,x=+4,故A错误;
B、化合物中元素化合价代数和为零,氧化铁中氧元素化合价为﹣2价,则铁元素化合价为+3,故B错误;
C、单质中元素化合价为0,C表示碳单质,其元素化合价为零,故C错误;
D、化合物中元素化合价代数和为零,PbO中氧元素化合价为﹣2价,则Pb化合价为+2,故D正确;
故选:D。
5.【解答】解:①2H中的2表示氢原子的个数为2个;
②2NH3的2表示氨气分子的个数为2个;
③SO2中的2表示一个二氧化硫分子中含有2个氧原子;
④O中的2表示氧化铜中铜元素的化合价为+2;
⑤Mg2+中的2表示一个镁离带有2个单位的正电荷;
⑥2OH﹣中的2表示氢氧根离子的个数为2个;
⑦H2O中的2表示一个水分子中含有2个氢原子;
A、表示离子个数的是⑥,错误;
B、表示离子所带电荷数的是⑤,错误;
C、表示分子中原子个数的是③⑦,正确;
D、表示分子个数的是②,错误;
故选:C。
6.【解答】解:A、氧化物是由两种元素组成的化合物,且一种元素为氧元素,维生素C是由碳、氢、氧三种元素,不属于氧化物,故A错误;
B、根据维生素C的化学式可知,维生素C是由碳、氢、氧三种元素组成的,故B正确;
C、维生素C中碳、氢、氧三种元素质量比(12×6):(1×8):(16×6)=72:8:96,故氢元素质量分数最小,故C错误;
D、根据维生素C的化学式可知,1个维生素C分子是由6个碳原子、8个氢原子和6个氧原子构成的,则分子中碳、氢、氧的原子个数比为6:8:6=3:4:3,故D错误;
故选:B。
7.【解答】解:根据题意,该物质由同种元素组成,1个分子由2个原子构成。
A、Zn是由一种元素组成的,且是由原子直接构成的,故A错误。
B、CO是由两种元素组成的,故B错误。
C、H2O是由两种元素组成的,且1个分子由3个原子构成,故C错误。
D、N2是由一种元素组成的,且1个分子由2个原子构成,故D正确。
故选:D。
8.【解答】解:b点上物质铁元素的化合价为+3价,氧元素显﹣2价,则b点上形成化合物的化学式为Fe2O3。
故选:C。
9.【解答】解:A、乙酸钠由C、H、O、Na四种元素组成,故选项说法正确。
B、相对分子质量单位是“1”,不是“g”,常常省略不写,故选项说法错误。
C、氧、钠元素的质量比为(16×2):(23×1)≠2:1,故选项说法错误。
D、乙酸钠中C、H、O、Na四种元素的质量比为(12×2):(1×3):(16×2):23=24:3:32:23,则氧元素的质量分数最大,故选项说法错误。
故选:A。
10.【解答】解:A.CO2微观可以表示一个二氧化碳分子,故描述正确;
B.CO2宏观可以表示二氧化碳这种物质,故描述正确;
C.二氧化碳是由二氧化碳分子构成的,一个二氧化碳分子由一个碳原子和2个氧原子构成,故描述错误;
D.二氧化碳由碳元素和氧元素组成,故描述正确。
故选:C。
11.【解答】解:A.1个O4分子由4个氧原子构成,原子不显电性,则O4是不带电的分子,故选项说法正确。
B、分子是由原子构成的,1个O4分子含有4个氧原子,不含有O2分子,故选项说法错误。
C、O4与O2分子的构成不同,性质不完全相同,故选项说法错误。
D、O4和O2是氧元素形成的两种不同的单质,O4和O2混合形成的是混合物,故选项说法错误。
故选:A。
12.【解答】解:由微观示意图可知,偏二甲肼与四氧化二氮在点燃的条件下反应生成水、二氧化碳和氮气,反应的化学方程式是:C2H8N2+2N2O43N2↑+2CO2↑+4H2O。
A、由分子结构模型可知,甲的化学式是C2N2H8,选项说法正确,不符合题意;
B、该反应方程式为C2H8N2+2N2O43N2↑+2CO2↑+4H2O,反应前后分子数目之比为2:8,选项说法不正确,符合题意;
C、丙物质为二氧化碳,是由二氧化碳分子构成的,选项说法正确,不符合题意;
D、生成物中含有单质与化合物两类物质,选项说法正确,不符合题意;
故选:B。
13.【解答】解:A、碳酸钠中钠元素显+1价,碳酸根显﹣2价,其化学式为:Na2CO3,化学式书写错误,故选项错误。
B、氯化铁的化学式为FeCl3,化学式书写错误,故选项错误。
C、氧化铝中铝元素显+3价,氧元素显﹣2价,其化学式为:Al2O3,化学式书写正确,故选项正确。
D、氯化铜的化学式为CuCl2,化学式书写错误,故选项错误。
故选:C。
14.【解答】解:A、一个多巴胺分子中含有2个氧原子,故A错误;
B、分子是保持物质化学性质的最小微粒,所以保持多巴胺化学性质的微粒是多巴胺分子,故B正确;
C、根据多巴胺中碳、氢、氧、氮的元素质量比为(12×8):(11×1):(16×2):(14×1)=96:11:32:14,所以多巴胺中碳元素的质量分数最大,故C错误;
D、多巴胺分子是由碳原子、氢原子、氮原子、氧原子构成,故D错误。
故选:B。
15.【解答】解:由反应的微观示意如图可知,偏二甲肼在一定条件下的条件下与四氧化二氮反应,生成水、二氧化碳和氮气,化学方程式为C2H8N2+2N2O43N2+4H2O+2CO2↑;
A、由质量守恒定律可知,反应前后原子的种类不变,原子的数目也不变,选项说法错误;
B、由化学方程式可知,反应生成的氮气和水的质量比为(28×3):(18×4)≠3:4,选项说法错误;
C、四氧化二氮(N2O4)中氧元素是﹣2价,设其中氮元素的化合价为x,依据化合物中各元素的化合价代数和为0,则:x×2+(﹣2)×4=0,解得x=+4;NO2中氧元素的化合价为﹣2价,设其中氮元素的化合价为y,依据化合物中各元素的化合价代数和为0,则:y+(﹣2)×2=0,y=+4,选项说法正确;
D、分子是由原子构成的,一个N2O4分子含有2个氮原子,不含氮气分子,选项说法错误。
故选:C。
二.填空题(共7小题)
16.【解答】解:(1)地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,地壳中含量最高的金属元素表示为:Al;元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,标出氧化镁中镁元素的化合价表示为:O。
(2)保持二氧化硫化学性质的最小粒子是二氧化硫分子,表示为:SO2。构成氯化钠的微粒是钠离子和氯离子,表示为:Na+、Cl﹣。
故答案为:(1)Al;O;
(2)SO2;Na+、Cl﹣。
17.【解答】解:(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以3个钾原子,就可表示为:3K;
(2)空气中含量最多的物质是氮气,氮气是由氮元素组成的,表示为:N;
(3)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故4个铵根离子表示为4;
(4)化学式书写的一般规律是:正前负后,然后利用十字交叉法书写;氢氧化镁中镁元素+2价,氢氧根﹣1价,表示为Mg(OH)2;
(5)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化铁中铁元素的化合价为+3,故可表示为:2O3;
(6)碘蒸气是碘单质,碘单质化学式为I2;
(7)构成食盐的微粒是钠离子和氯离子,表示为Na+、Cl﹣;
(8)地壳中含量最多的元素是氧元素,含量最多的金属元素是铝元素,所形成化合物是氧化铝,氧化铝中铝元素显+3价,氧元素显﹣2价,化学式为:Al2O3。
故答案为:(1)3K;
(2)N;
(3)4;
(4)Mg(OH)2;
(5)2O3;
(6)I2;
(7)Na+、Cl﹣;
(8)Al2O3。
18.【解答】解:(1)设金属元素的符号为X,某三价金属氧化物中金属元素显+3价,氧元素显﹣2价,其化学式为X2O3;某三价金属氧化物中氧元素的质量分数为30%,则金属元素的质量分数为1﹣30%=70%,金属元素和氧元素的质量比为70%:30%=7:3;设该金属元素的相对原子质量为y,2y:(16×3)=7:3,y=56。
(2)SO3中氧元素显﹣2价,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(﹣2)×3=0,则x=+6价。
故答案为:
(1)56;
(2)+6。
19.【解答】解:(1)Na2MoO4中钠元素显+1价,氧元素显﹣2价,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(﹣2)×4=0,则x=+6价。
(2)元素周期表每一周期的元素,从金属元素开始逐渐过渡到非金属元素,最终以稀有气体元素结束,则组成Na2MoO4的元素中,在元素周期表内,位于其所在周期靠近尾部位置的元素是氧。
(3)钼元素的氧化物中钼元素显+2价,氧元素显﹣2价,其化学式为MoO。
故答案为:
(1)+6;
(2)氧;
(3)MoO。
20.【解答】解:由NH3在纯氧中燃烧的微观示意图可知,氨气燃烧生成了氮气和水,反应的方程式是:4NH3+3O22N2+6H2O。
(1)由方程式的意义可知,反应的NH3和O2的分子个数比是4:3。
(2)左边第一个方框中的物质是由一种分子构成的,分子又是由不同种原子构成的,属于化合物。
(3)A、由微粒的变化可知,该反应中分子发生了改变,故A说法正确;
B、由微粒的变化可知,该反应中原子没有再分,只是发生了重新组合,故B说法不正确;
C、由分子的定义可知,分子是保持物质化学性质的最小微粒,故C说法正确。
故答案为:(1)4:3;
(2)化合物;
(3)AC。
21.【解答】解:(1)黄酮素的相对分子质量为12×15+1×10+16×2=222。
(2)黄酮素中碳、氢元素的质量比为(12×15):(1×10)=18:1。
(3)11.1g黄酮素中含碳元素的质量为11.1g100%=9g。
故答案为:(1)222;(2)18:1;(3)9。
22.【解答】解:(1)一个硝酸羟胺(H4N2O4)分子中H、N、O原子个数比为4:2:4=2:1:2;故答案为:2:1:2;
(2)由分子结构模型可知,“”是由两个氮原子构成的氮分子,代表物质的化学式是N2;故答案为:N2;
(3)由分子结构模型可知,生成物为氮气、氧气和水,氮气的化学性质较稳定,可用作保护气,氧气具有助燃性,可用于炼钢,水能溶解多种物质,可用作溶剂;故答案为:氧气具有助燃性,可用于炼钢(其他合理答案);
(4)A.硝酸羟胺有剧毒,挥发后对皮肤和眼睛等损伤较大,符合题意;
B.等质量的硝酸羟胺完全燃烧释放的热量比普通汽油大得多,不合题意;
C.硝酸羟胺熔点低、易泄漏,对储存设备的密封性要求较高,符合题意;
D.硝酸羟胺完全分解后产物无污染,绿色环保,不合题意;
E.在研发硝酸羟胺的使用及其安全性等方面投入成本过高,符合题意。
故答案为:ACE。
三.解答题(共3小题)
23.【解答】解:(1)花青素的相对分子质量是12×15+1×11+16×6=287;
(2)花青素中碳、氢、氧三种元素的质量比为(12×15):(1×11):(16×6)=180:11:96;
(3)28.7g花青素中含有碳元素的质量为28.7g18g。
故答案为:(1)287;(2)180:11:96;(3)18。
24.【解答】解:(1)Vc的相对分子质量为12×6+1×8+16×6=176,故答案为:176;
“Vc”中碳、氢、氧元素的质量比是(12×6):8:(16×6)=9:1:12,故答案为:9:1:12;
(2)由标签可知,每片维生素C100mg中至少含有Vc10%,即每片维生素C中至少含10mgVc,若成年人每天最少补充60mgVc,而且①Vc完全由维生素C片补充,则每天至少服用6片,而每天是三次,所以每次是2片.故答案为:2.
②若Vc完全由蔬菜来补充,则每天需要的蔬菜为400g,故答案为:400.
25.【解答】解:(1)碳酸钙的相对分子质量是40+12+16×3=100;故答案为:100;
(2)碳酸钙中钙元素的质量分数为40%
答:碳酸钙中钙元素的质量分数为40%;
(3)设每片钙片中碳酸钙的质量为x,则:
2x×40%=500mg
x=625mg
答:每片钙片中碳酸钙的质量为625mg。
第1页(共1页)
同课章节目录
