浙江省嘉兴市2024~2025学年度第一学期期末测试高一化学试题卷(图片版,含答案)
文档属性
| 名称 | 浙江省嘉兴市2024~2025学年度第一学期期末测试高一化学试题卷(图片版,含答案) |  | |
| 格式 | |||
| 文件大小 | 10.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-16 09:13:53 | ||
图片预览



文档简介
嘉兴市2024~2025学年度第一学期期末测试
高一化学 试题卷 (2025/01)
考生须知:
1.本试卷共6页,满分100分,考试时间90分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 0-16 Na-23 Mg-24 Al-27 S-32
Cl-35.5 K-39 Ca-40 Fe-56 Cu-64 Mn-55
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个选项中只有
一个是符合要求的,不选、多选、错选均不得分)
1.下列物质属于碱性氧化物的是
A. KOH B. MgO C. CIO D.H O
2.下列仪器能直接加热的是
骨
A. B. C. D.
3.下列物质属于非电解质的是
A.盐酸 B. NaClO C. CO D.I
4.下列分散系不能产生“丁达尔效应”的是
A.有色玻璃 B. Fe(OH) 胶体 C.云 D.漂白液
5.下列行为符合实验安全要求的是
A.实验剩余的钠不可放回原试剂瓶,应投入废液缸
B.新制氯水应保存在棕色广口试剂瓶中
C.应戴护目镜观察氢气在氯气中燃烧
D.浓NaOH溶液不慎沾到皮肤上,应立即用大量水冲洗,然后涂上小苏打溶液
6.下列有关物质性质和用途对应关系不正确的是
A.Na O 具有漂白性,可在呼吸面具中作为氧气的来源
B.硬铝密度小强度高,常用于制造飞机的零部件
C. FeCl 溶液具有氧化性,可用于蚀刻铜电路板
D.次氯酸钙具有强氧化性,可以作棉、麻的漂白剂
7.下列有关化学用语的表示方法正确的是
A.中子数为10的氧原子: l8o
B.甲烷的分子结构模型:
c.' N的原子结构示意图: ④产
D. NaCl形成过程:Na+·Cl:Na:CI:
高一期末测试 化学 试题卷 第1页(共6页)
8.关于反应H O +Cl =2HCI+O ,下列说法不正确的是
A.氧化剂是Cl B.每生成1mol O 需转移4 mol电子
C.还原性:H O 大于HCI D.氧化产物和还原产物物质的量之比为1:2
9.下列说法中正确的是
A.23U与的23U是同种核素 B. O 与'8O 互称为同位素
c. ' N和"C中子数不同 D.C 0和石墨互为同素异形体
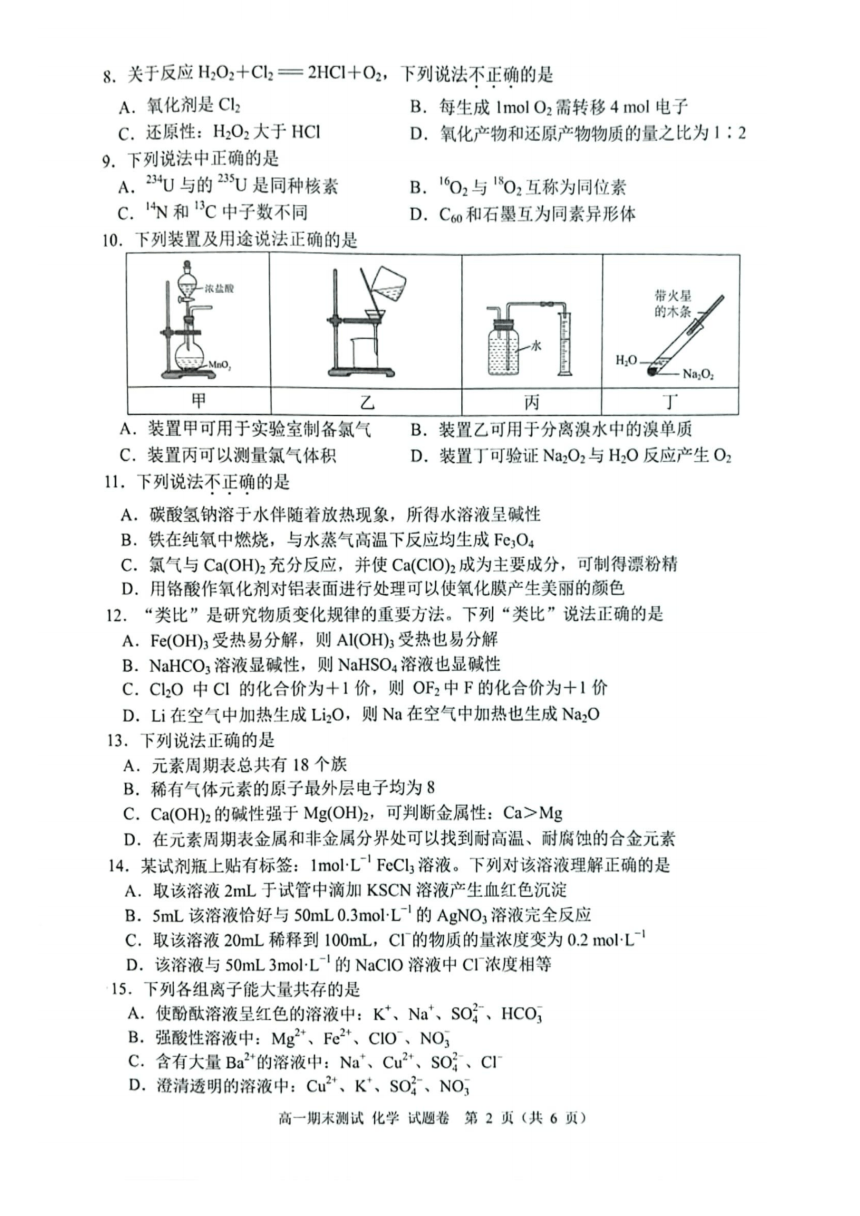
10.下列装置及用途说法正确的是
是
一浓盐酸 带火星
的木条
水
MnO, H O Na O
甲 乙 丙 丁
A.装置甲可用于实验室制备氯气 B.装置乙可用于分离溴水中的溴单质
C.装置丙可以测量氯气体积 D.装置丁可验证Na O 与H O反应产生O
11.下列说法不正确的是
A.碳酸氢钠溶于水伴随着放热现象,所得水溶液呈碱性
B.铁在纯氧中燃烧,与水蒸气高温下反应均生成Fe O
C.氯气与Ca(OH) 充分反应,并使Ca(CIO) 成为主要成分,可制得漂粉精
D.用铬酸作氧化剂对铝表面进行处理可以使氧化膜产生美丽的颜色
12.“类比”是研究物质变化规律的重要方法。下列“类比”说法正确的是
A.Fe(OH) 受热易分解,则Al(OH) 受热也易分解
B. NaHCO 溶液显碱性,则NaHSO 溶液也显碱性
C.Cl O中Cl的化合价为+1价,则OF 中F的化合价为+1价
D.Li在空气中加热生成Li O,则Na在空气中加热也生成Na O
13.下列说法正确的是
A.元素周期表总共有18个族
B.稀有气体元素的原子最外层电子均为8
C. Ca(OH) 的碱性强于Mg(OH) ,可判断金属性:Ca>Mg
D.在元素周期表金属和非金属分界处可以找到耐高温、耐腐蚀的合金元素
14.某试剂瓶上贴有标签:1mol-L 'FeCl 溶液。下列对该溶液理解正确的是
A.取该溶液2mL于试管中滴加 KSCN溶液产生血红色沉淀
B.5mL该溶液恰好与50mL0.3mol·L1的AgNO 溶液完全反应
C.取该溶液20mL稀释到100mL,CI的物质的量浓度变为0.2 mol·L 1
D.该溶液与50mL 3mol-L 1的NaCIO溶液中CI浓度相等
15.下列各组离子能大量共存的是
A.使酚酞溶液呈红色的溶液中:K*、Na*、so2、HCO
B.强酸性溶液中:Mg2 、Fe2 、CIO、NO
C.含有大量Ba2的溶液中:Na*、Cu2+、so 、CI
D.澄清透明的溶液中:Cu2 、K*、so2、NO
高一期末测试 化学 试题卷 第2页(共6页)
16.下列离子方程式书写正确的是
A.用食醋处理水垢中的Mg(OH) :Mg(OH) +2H =Mg2 +2H O
B.把Na放入水中:2Na+2H O=2Na*+2OH+H 1
C.向NaOH溶液中通入过量CO :20H+CO =Co}+H O
D.氯水和氯化亚铁溶液混合:Fe2 +Cl =Fe3 +2CI
17.下列除去杂质的方法,正确的是
选项 物质(括号内为杂质) 除杂方法
A Fe粉(Fe O 粉末) 用磁铁吸引
B Cl (HC1) 通入装有饱和碳酸氢钠溶液的洗气瓶洗气
C CuO固体(Al O ) 加入足量氢氧化钠溶液反应充分后过滤
D NaCl溶液(Na CO ) 加入适量稀硫酸
18.实验室用36.5 浓盐酸(密度为1.2g:cm3)配制100mL Imol-L1的稀盐酸,下列说
法正确的是 浓盐酸
A.需用10mL的量筒量取36.5 浓盐酸8.3mL
1
B.按右图操作将浓盐酸转移到容量瓶中
C.其他操作正确,定容时仰视容量瓶刻度线会使所配溶液浓度偏高
D.标况下,将2.24LHCI溶于100mL水也可配得1mol-L'的稀盐酸
19.下列说法不正确的是
A. CaCl 晶体中只存在离子键
B.HCl溶于水破坏了H*和CI之间的离子键
C.根据HF的热稳定性比HCl好,可以判断F的非金属性比Cl强
D. CO 和N 分子中所有原子的最外层都达到8电子稳定结构
20.短周期元素X、Y、Z、M在元素周期表中的相对位置如图所示,M的原子序数是Y
的质子数的2倍。则下列说法不正确的是
A.原子半径大小:Z>X>Y
X Y
B.X的一种核素可对文物进行年代测定和研究
C.Y、Z、M可形成既含离子键,又含共价键的化合物 Z M
D.简单氢化物的沸点:M>Y
21.在一定的温度下,用一可自由滑动的隔板将密闭容器分成左右两部分,向两边分别充
入等质量的CH 和O ,隔板处于如图位置。下列说法不正确的是
A.左侧充入的气体是CH
B.左右两侧的体积比是2:1
C.左右两侧的气体密度比是1:2
D.左右两侧的原子个数之比是5:2
22.设NA是阿伏加德罗常数的值,下列有关说法正确的是
A.14g CO和N 的混合物含有的原子数为2NA
B.在25℃和101kPa下,24.5LN 含有的分子数约为NA
C.IL0.1 mol-L 1硫酸钠溶液中含有的氧原子数为0.4NA
D.11g的2H 0中含有的质子数与中子数均为5NA
高一期末测试 化学 试题卷 第3页(共6页)
23.为探究H O 的性质,某同学做了如下三个实验:
实验1:向H O 溶液中滴加酸性KMnO 溶液,有大量气体放出,KMnO 溶液紫色褪去:
实验2:向H O 溶液中滴加FeSO 溶液,溶液迅速变黄,稍后有少许气体放出;
实验3:向MnO 中滴加H O ,有大量气体放出
下列说法不正确的是
A.三个实验中,放出的气体都是O
B.实验1中H O 做还原剂,实验2中溶液迅速变黄的过程中H O 做氧化剂
C.实验3中,当有112mL气体生成时,理论上需要0.34g H O
D.通过实验可以得出氧化性强弱:MnO >H O >Fe3
24.为测定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,某同学设计的实验装置示意
图如下:
mg样品 a
X 区
冰水 碱石灰
A B C
下列说法不正确的是
A.a中应该装碱石灰,防止空气中CO 和H O干扰
B.装置B中冰水的作用是冷凝反应生成的水
C. X为空气,反应开始前先通空气,停止加热后,应再通一段时间空气
D.装置B、C之间缺少CO 的干燥装置,使测得碳酸钠的质量分数偏低
25.下列方案设计、现象和结论都正确的是
实验方案 现象 结论
向沸水中滴加FeCl 饱和溶液煮
与光束平行方向可以看
A 沸至液体呈红褐色,用激光笔 制得了Fe(OH) 胶体
到一条光亮的“通路”
照射
用洁净的铁丝蘸取溶液于酒精 透过蓝色钴玻璃观察到 该溶液含有钾元素,可能
B
灯外焰上灼烧 火焰呈紫色 含有钠元素
向氯水中滴加少量NaBr溶液,
溶液先变为橙黄色,再滴
C 观察颜色变化;再滴加淀粉-KI 非金属性:Cl>Br>I
加淀粉-KI溶液变为蓝色
溶液,观察现象
D 向AICl 溶液中滴加氨水至过量 先产生沉淀后又溶解 Al(OH) 是两性氢氧化物
二、填空题(本大题共5小题,共46分)
26.(6分)按要求回答下列问题。
(1)实验室中要把钠保存▲中。
(2)NH HCO 在水溶液中的电离方程式▲。
(3)写出用化合反应得到氢氧化铁的化学方程式▲。
高一期末测试 化学 试题卷 第4页(共6页)
27.(10分)氯气及含氯化合物相互转化关系如下图所示:
L
(1)上述转化关系图中的含氯物质属于电解质的是▲。
(2)下列说法正确的是▲。
A. Cl 和H 在暗处能剧烈化合并发生爆炸
B.氯气有漂白性,可以使干燥的有色布条褪色
C.反应I中,Cl 与KOH的物质的量之比为1:2
D.氯气与碱反应,条件不同,产物也不同
(3)已知反应Ⅱ有黄绿色单质气体产生,请写出反应Ⅱ的离子方程▲。
(4)CIO 是一种高效消毒剂,其氧化能力是以“有效氯”的含量为标志。有效氯的含量
是指与HI作用生成相同量的I ,所需Cl 的质量与指定化合物的质量之比,以百分数表示。
CIO 的有效氯含量▲(已知Cl 和CIO 均被还原为CIT)。
(5)KClO 广泛应用于炸药、烟花、医药等相关领域。请设计实验方案检验KCIO 固体中
氯元素▲(已知AgClO 易溶于水)。
28.(10分)氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。
(1)下列变化中,与氧化还原反应有关的是▲(填字母)。
A.储氢合金吸收氢气 B.高炉炼铁 C.电解质电离 D.钢铁的腐蚀
(2)古代炼丹术中用的铅丹(X)与浓盐酸反应可以制备氯气:X+8HCl=3PbCl +Cl
+4H O,则铅丹的化学式▲,其中+2价的Pb和+4价的Pb含量之比为:▲。
(3)电弧法合成碳纳米管时,常伴有大量碳纳米颗粒生成,这种碳纳米颗粒可用氧化气化法
提纯,其反应的化学方程式为3C+2K Cr O +8H SO =3CO 1+2Cr (SO ) +8H O
①用单线桥法标明该反应电子转移的方向和数目▲。
②根据化合价推测,能与Cr O}反应的微粒是▲(填字母)。
a.Fe2+ b. HNO c. Na S d.CO}
29.(10分)①、②、③、④、⑤、⑥是短周期主族元素,请根据下列相关信息,回答有
关问题:
① ② ③ ④ ⑤ ⑥
原子半径/nm 0.186 0.143 0.074 0.099
主要化合价 -4,+4 -2 -1,+7
该元素的一
阳离子 种单质是自 短周期主族 地壳中含
其他 核外无 然界中天然 元素中原子 量最多的
电子 存在最硬的 半径最大 金属元素
物质
高一期末测试 化学 试题卷 第5页(共6页)
(1)元素②在元素周期表中的位置是▲,其最高价氧化物的结构式为▲。
(2)以上六种元素中其最高价氧化物的水化物酸性最强的是▲(用化学式表示)。
(3)③元素的最高价氧化物的水化物与④元素的最高价氧化物反应的离子方程式是▲。
(4)①与⑤两种元素组成含18个电子的化合物所含的化学键有▲。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(5)门捷列夫认为在元素④的下方有一个与其类似的元素。关于该元素的说法正确的是
▲。
A.最低化合价为-5价
B.简单阳离子的核外电子排布与氩相同
C.其氢氧化物具有两性,可溶于强酸和强碱
D.其单质可与盐酸反应生成氢气
30.(10分)某课外活动小组设计实验测定芹菜中铁元素的含量。
已知:芹菜中铁元素主要以草酸亚铁(FeC O )的形式存在,草酸亚铁难溶于水;
草酸是一种二元有机弱酸,具有还原性。
I.芹菜的预处理
灼烧」 稀硫酸,过滤 双氧水
400g新鲜芹菜 芹菜灰 滤液 500mL待测液
(1)“过滤”需要用到的玻璃仪器有烧杯、▲。
(2)写出草酸亚铁溶于足量稀硫酸的离子方程式▲。
(3)对“滤液”进行检验发现其中含有Fe3 ,Fe3产生的原因是▲。
(4)“滤液”中加入H O 的作用是▲(用离子方程式表示)。
Ⅱ.铁元素的含量测定
(5)比色法:利用色度传感器测得不同浓度Fe3标准液的吸收率如下图:
0.4
吸收率 0.3
0.22 a
0.2
0.1
0 2 468 10
c(Fe3)/10 molL
再用色度传感器测得待测液的吸收率为0.22,则该芹菜中铁元素的含量为▲mg/kg。
三、计算题(4分)
31.将20.8g铁铜合金投入300mL ImolL Fe SO ) 溶液中,充分反应后,剩余固体3.2g。
(1)上述反应中转移的电子的物质的量是▲mol。
(2)混合物中铁和铜的物质的量之比是▲。
高一期末测试 化学 试题卷 第6页(共6页)
嘉兴市2024~2025学年度第一学期期末测试
高一化学 参考答案 (2025/01)
一、选择题(每空2分,共50分)
1 2 3 4 5 6 7 8 9 10
B D C D C A B B D D
11 12 13 14 15 16 17 18 19 20
A A C B D B C A B D
21 22 23 24 25
D B C C B
二、填空题(本大题共5小题,共46分)
26.(6分)
(1)煤油或石蜡油(2分)。
(2)NH HCO =NH:+HCO (2分)。
(3)4Fe(OH) +O +2H O=4Fe(OH)3(2分)。
27(10分)
(1)KCl,KCIO (2分)。
(2)CD(2分)。
(3)2CIO +4H*+2Cl-=2CIO +Cl +2H O(2分)。
(4)263 分)。
(5)取KCIO 固体加少量二氧化锰,加热反应充分,冷却后将剩余固体溶解,静置,取
上层清液少量加入试管,向其中滴入稀硝酸酸化,再滴加硝酸银溶液,有白色沉淀生成即
可证明有氯元素(2分)。
28.(10分)
(1)ABD(2分)。
(2)Pb O (2分),2:1(2分)。
(3)①3c+kco+8SO-sco:t+2CSO 3+8H O)(2 分)。②ac(2分)。
29.(10分)
(1)第二周期第IVA族(2分),O=C=0(1分)。
(2)HCIO (1分)。
(3)Al O +2OH-+3H O=2[Al(OH)4](2分)。
(4)BC(2分)。
(5)CD(2分)。
30.(10分)
(1)玻璃棒、漏斗(2分)。
(2)FeC O +2H+=Fe2++H C O (2分)。
高一期末测试 化学 试题卷 第1页(共 2页)
(3)部分Fe2+被空气中O 氧化(2分)。
(4)2Fe2++H O +2H+=2Fe3++2H O(2分)。
(5)28(2分)。
三、计算题(4分)
(1)0.6(2分)。
(2)4:3(2分)。
高一期末测试 化学 试题卷 第2页(共2页)
高一化学 试题卷 (2025/01)
考生须知:
1.本试卷共6页,满分100分,考试时间90分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 0-16 Na-23 Mg-24 Al-27 S-32
Cl-35.5 K-39 Ca-40 Fe-56 Cu-64 Mn-55
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个选项中只有
一个是符合要求的,不选、多选、错选均不得分)
1.下列物质属于碱性氧化物的是
A. KOH B. MgO C. CIO D.H O
2.下列仪器能直接加热的是
骨
A. B. C. D.
3.下列物质属于非电解质的是
A.盐酸 B. NaClO C. CO D.I
4.下列分散系不能产生“丁达尔效应”的是
A.有色玻璃 B. Fe(OH) 胶体 C.云 D.漂白液
5.下列行为符合实验安全要求的是
A.实验剩余的钠不可放回原试剂瓶,应投入废液缸
B.新制氯水应保存在棕色广口试剂瓶中
C.应戴护目镜观察氢气在氯气中燃烧
D.浓NaOH溶液不慎沾到皮肤上,应立即用大量水冲洗,然后涂上小苏打溶液
6.下列有关物质性质和用途对应关系不正确的是
A.Na O 具有漂白性,可在呼吸面具中作为氧气的来源
B.硬铝密度小强度高,常用于制造飞机的零部件
C. FeCl 溶液具有氧化性,可用于蚀刻铜电路板
D.次氯酸钙具有强氧化性,可以作棉、麻的漂白剂
7.下列有关化学用语的表示方法正确的是
A.中子数为10的氧原子: l8o
B.甲烷的分子结构模型:
c.' N的原子结构示意图: ④产
D. NaCl形成过程:Na+·Cl:Na:CI:
高一期末测试 化学 试题卷 第1页(共6页)
8.关于反应H O +Cl =2HCI+O ,下列说法不正确的是
A.氧化剂是Cl B.每生成1mol O 需转移4 mol电子
C.还原性:H O 大于HCI D.氧化产物和还原产物物质的量之比为1:2
9.下列说法中正确的是
A.23U与的23U是同种核素 B. O 与'8O 互称为同位素
c. ' N和"C中子数不同 D.C 0和石墨互为同素异形体
10.下列装置及用途说法正确的是
是
一浓盐酸 带火星
的木条
水
MnO, H O Na O
甲 乙 丙 丁
A.装置甲可用于实验室制备氯气 B.装置乙可用于分离溴水中的溴单质
C.装置丙可以测量氯气体积 D.装置丁可验证Na O 与H O反应产生O
11.下列说法不正确的是
A.碳酸氢钠溶于水伴随着放热现象,所得水溶液呈碱性
B.铁在纯氧中燃烧,与水蒸气高温下反应均生成Fe O
C.氯气与Ca(OH) 充分反应,并使Ca(CIO) 成为主要成分,可制得漂粉精
D.用铬酸作氧化剂对铝表面进行处理可以使氧化膜产生美丽的颜色
12.“类比”是研究物质变化规律的重要方法。下列“类比”说法正确的是
A.Fe(OH) 受热易分解,则Al(OH) 受热也易分解
B. NaHCO 溶液显碱性,则NaHSO 溶液也显碱性
C.Cl O中Cl的化合价为+1价,则OF 中F的化合价为+1价
D.Li在空气中加热生成Li O,则Na在空气中加热也生成Na O
13.下列说法正确的是
A.元素周期表总共有18个族
B.稀有气体元素的原子最外层电子均为8
C. Ca(OH) 的碱性强于Mg(OH) ,可判断金属性:Ca>Mg
D.在元素周期表金属和非金属分界处可以找到耐高温、耐腐蚀的合金元素
14.某试剂瓶上贴有标签:1mol-L 'FeCl 溶液。下列对该溶液理解正确的是
A.取该溶液2mL于试管中滴加 KSCN溶液产生血红色沉淀
B.5mL该溶液恰好与50mL0.3mol·L1的AgNO 溶液完全反应
C.取该溶液20mL稀释到100mL,CI的物质的量浓度变为0.2 mol·L 1
D.该溶液与50mL 3mol-L 1的NaCIO溶液中CI浓度相等
15.下列各组离子能大量共存的是
A.使酚酞溶液呈红色的溶液中:K*、Na*、so2、HCO
B.强酸性溶液中:Mg2 、Fe2 、CIO、NO
C.含有大量Ba2的溶液中:Na*、Cu2+、so 、CI
D.澄清透明的溶液中:Cu2 、K*、so2、NO
高一期末测试 化学 试题卷 第2页(共6页)
16.下列离子方程式书写正确的是
A.用食醋处理水垢中的Mg(OH) :Mg(OH) +2H =Mg2 +2H O
B.把Na放入水中:2Na+2H O=2Na*+2OH+H 1
C.向NaOH溶液中通入过量CO :20H+CO =Co}+H O
D.氯水和氯化亚铁溶液混合:Fe2 +Cl =Fe3 +2CI
17.下列除去杂质的方法,正确的是
选项 物质(括号内为杂质) 除杂方法
A Fe粉(Fe O 粉末) 用磁铁吸引
B Cl (HC1) 通入装有饱和碳酸氢钠溶液的洗气瓶洗气
C CuO固体(Al O ) 加入足量氢氧化钠溶液反应充分后过滤
D NaCl溶液(Na CO ) 加入适量稀硫酸
18.实验室用36.5 浓盐酸(密度为1.2g:cm3)配制100mL Imol-L1的稀盐酸,下列说
法正确的是 浓盐酸
A.需用10mL的量筒量取36.5 浓盐酸8.3mL
1
B.按右图操作将浓盐酸转移到容量瓶中
C.其他操作正确,定容时仰视容量瓶刻度线会使所配溶液浓度偏高
D.标况下,将2.24LHCI溶于100mL水也可配得1mol-L'的稀盐酸
19.下列说法不正确的是
A. CaCl 晶体中只存在离子键
B.HCl溶于水破坏了H*和CI之间的离子键
C.根据HF的热稳定性比HCl好,可以判断F的非金属性比Cl强
D. CO 和N 分子中所有原子的最外层都达到8电子稳定结构
20.短周期元素X、Y、Z、M在元素周期表中的相对位置如图所示,M的原子序数是Y
的质子数的2倍。则下列说法不正确的是
A.原子半径大小:Z>X>Y
X Y
B.X的一种核素可对文物进行年代测定和研究
C.Y、Z、M可形成既含离子键,又含共价键的化合物 Z M
D.简单氢化物的沸点:M>Y
21.在一定的温度下,用一可自由滑动的隔板将密闭容器分成左右两部分,向两边分别充
入等质量的CH 和O ,隔板处于如图位置。下列说法不正确的是
A.左侧充入的气体是CH
B.左右两侧的体积比是2:1
C.左右两侧的气体密度比是1:2
D.左右两侧的原子个数之比是5:2
22.设NA是阿伏加德罗常数的值,下列有关说法正确的是
A.14g CO和N 的混合物含有的原子数为2NA
B.在25℃和101kPa下,24.5LN 含有的分子数约为NA
C.IL0.1 mol-L 1硫酸钠溶液中含有的氧原子数为0.4NA
D.11g的2H 0中含有的质子数与中子数均为5NA
高一期末测试 化学 试题卷 第3页(共6页)
23.为探究H O 的性质,某同学做了如下三个实验:
实验1:向H O 溶液中滴加酸性KMnO 溶液,有大量气体放出,KMnO 溶液紫色褪去:
实验2:向H O 溶液中滴加FeSO 溶液,溶液迅速变黄,稍后有少许气体放出;
实验3:向MnO 中滴加H O ,有大量气体放出
下列说法不正确的是
A.三个实验中,放出的气体都是O
B.实验1中H O 做还原剂,实验2中溶液迅速变黄的过程中H O 做氧化剂
C.实验3中,当有112mL气体生成时,理论上需要0.34g H O
D.通过实验可以得出氧化性强弱:MnO >H O >Fe3
24.为测定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,某同学设计的实验装置示意
图如下:
mg样品 a
X 区
冰水 碱石灰
A B C
下列说法不正确的是
A.a中应该装碱石灰,防止空气中CO 和H O干扰
B.装置B中冰水的作用是冷凝反应生成的水
C. X为空气,反应开始前先通空气,停止加热后,应再通一段时间空气
D.装置B、C之间缺少CO 的干燥装置,使测得碳酸钠的质量分数偏低
25.下列方案设计、现象和结论都正确的是
实验方案 现象 结论
向沸水中滴加FeCl 饱和溶液煮
与光束平行方向可以看
A 沸至液体呈红褐色,用激光笔 制得了Fe(OH) 胶体
到一条光亮的“通路”
照射
用洁净的铁丝蘸取溶液于酒精 透过蓝色钴玻璃观察到 该溶液含有钾元素,可能
B
灯外焰上灼烧 火焰呈紫色 含有钠元素
向氯水中滴加少量NaBr溶液,
溶液先变为橙黄色,再滴
C 观察颜色变化;再滴加淀粉-KI 非金属性:Cl>Br>I
加淀粉-KI溶液变为蓝色
溶液,观察现象
D 向AICl 溶液中滴加氨水至过量 先产生沉淀后又溶解 Al(OH) 是两性氢氧化物
二、填空题(本大题共5小题,共46分)
26.(6分)按要求回答下列问题。
(1)实验室中要把钠保存▲中。
(2)NH HCO 在水溶液中的电离方程式▲。
(3)写出用化合反应得到氢氧化铁的化学方程式▲。
高一期末测试 化学 试题卷 第4页(共6页)
27.(10分)氯气及含氯化合物相互转化关系如下图所示:
L
(1)上述转化关系图中的含氯物质属于电解质的是▲。
(2)下列说法正确的是▲。
A. Cl 和H 在暗处能剧烈化合并发生爆炸
B.氯气有漂白性,可以使干燥的有色布条褪色
C.反应I中,Cl 与KOH的物质的量之比为1:2
D.氯气与碱反应,条件不同,产物也不同
(3)已知反应Ⅱ有黄绿色单质气体产生,请写出反应Ⅱ的离子方程▲。
(4)CIO 是一种高效消毒剂,其氧化能力是以“有效氯”的含量为标志。有效氯的含量
是指与HI作用生成相同量的I ,所需Cl 的质量与指定化合物的质量之比,以百分数表示。
CIO 的有效氯含量▲(已知Cl 和CIO 均被还原为CIT)。
(5)KClO 广泛应用于炸药、烟花、医药等相关领域。请设计实验方案检验KCIO 固体中
氯元素▲(已知AgClO 易溶于水)。
28.(10分)氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。
(1)下列变化中,与氧化还原反应有关的是▲(填字母)。
A.储氢合金吸收氢气 B.高炉炼铁 C.电解质电离 D.钢铁的腐蚀
(2)古代炼丹术中用的铅丹(X)与浓盐酸反应可以制备氯气:X+8HCl=3PbCl +Cl
+4H O,则铅丹的化学式▲,其中+2价的Pb和+4价的Pb含量之比为:▲。
(3)电弧法合成碳纳米管时,常伴有大量碳纳米颗粒生成,这种碳纳米颗粒可用氧化气化法
提纯,其反应的化学方程式为3C+2K Cr O +8H SO =3CO 1+2Cr (SO ) +8H O
①用单线桥法标明该反应电子转移的方向和数目▲。
②根据化合价推测,能与Cr O}反应的微粒是▲(填字母)。
a.Fe2+ b. HNO c. Na S d.CO}
29.(10分)①、②、③、④、⑤、⑥是短周期主族元素,请根据下列相关信息,回答有
关问题:
① ② ③ ④ ⑤ ⑥
原子半径/nm 0.186 0.143 0.074 0.099
主要化合价 -4,+4 -2 -1,+7
该元素的一
阳离子 种单质是自 短周期主族 地壳中含
其他 核外无 然界中天然 元素中原子 量最多的
电子 存在最硬的 半径最大 金属元素
物质
高一期末测试 化学 试题卷 第5页(共6页)
(1)元素②在元素周期表中的位置是▲,其最高价氧化物的结构式为▲。
(2)以上六种元素中其最高价氧化物的水化物酸性最强的是▲(用化学式表示)。
(3)③元素的最高价氧化物的水化物与④元素的最高价氧化物反应的离子方程式是▲。
(4)①与⑤两种元素组成含18个电子的化合物所含的化学键有▲。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(5)门捷列夫认为在元素④的下方有一个与其类似的元素。关于该元素的说法正确的是
▲。
A.最低化合价为-5价
B.简单阳离子的核外电子排布与氩相同
C.其氢氧化物具有两性,可溶于强酸和强碱
D.其单质可与盐酸反应生成氢气
30.(10分)某课外活动小组设计实验测定芹菜中铁元素的含量。
已知:芹菜中铁元素主要以草酸亚铁(FeC O )的形式存在,草酸亚铁难溶于水;
草酸是一种二元有机弱酸,具有还原性。
I.芹菜的预处理
灼烧」 稀硫酸,过滤 双氧水
400g新鲜芹菜 芹菜灰 滤液 500mL待测液
(1)“过滤”需要用到的玻璃仪器有烧杯、▲。
(2)写出草酸亚铁溶于足量稀硫酸的离子方程式▲。
(3)对“滤液”进行检验发现其中含有Fe3 ,Fe3产生的原因是▲。
(4)“滤液”中加入H O 的作用是▲(用离子方程式表示)。
Ⅱ.铁元素的含量测定
(5)比色法:利用色度传感器测得不同浓度Fe3标准液的吸收率如下图:
0.4
吸收率 0.3
0.22 a
0.2
0.1
0 2 468 10
c(Fe3)/10 molL
再用色度传感器测得待测液的吸收率为0.22,则该芹菜中铁元素的含量为▲mg/kg。
三、计算题(4分)
31.将20.8g铁铜合金投入300mL ImolL Fe SO ) 溶液中,充分反应后,剩余固体3.2g。
(1)上述反应中转移的电子的物质的量是▲mol。
(2)混合物中铁和铜的物质的量之比是▲。
高一期末测试 化学 试题卷 第6页(共6页)
嘉兴市2024~2025学年度第一学期期末测试
高一化学 参考答案 (2025/01)
一、选择题(每空2分,共50分)
1 2 3 4 5 6 7 8 9 10
B D C D C A B B D D
11 12 13 14 15 16 17 18 19 20
A A C B D B C A B D
21 22 23 24 25
D B C C B
二、填空题(本大题共5小题,共46分)
26.(6分)
(1)煤油或石蜡油(2分)。
(2)NH HCO =NH:+HCO (2分)。
(3)4Fe(OH) +O +2H O=4Fe(OH)3(2分)。
27(10分)
(1)KCl,KCIO (2分)。
(2)CD(2分)。
(3)2CIO +4H*+2Cl-=2CIO +Cl +2H O(2分)。
(4)263 分)。
(5)取KCIO 固体加少量二氧化锰,加热反应充分,冷却后将剩余固体溶解,静置,取
上层清液少量加入试管,向其中滴入稀硝酸酸化,再滴加硝酸银溶液,有白色沉淀生成即
可证明有氯元素(2分)。
28.(10分)
(1)ABD(2分)。
(2)Pb O (2分),2:1(2分)。
(3)①3c+kco+8SO-sco:t+2CSO 3+8H O)(2 分)。②ac(2分)。
29.(10分)
(1)第二周期第IVA族(2分),O=C=0(1分)。
(2)HCIO (1分)。
(3)Al O +2OH-+3H O=2[Al(OH)4](2分)。
(4)BC(2分)。
(5)CD(2分)。
30.(10分)
(1)玻璃棒、漏斗(2分)。
(2)FeC O +2H+=Fe2++H C O (2分)。
高一期末测试 化学 试题卷 第1页(共 2页)
(3)部分Fe2+被空气中O 氧化(2分)。
(4)2Fe2++H O +2H+=2Fe3++2H O(2分)。
(5)28(2分)。
三、计算题(4分)
(1)0.6(2分)。
(2)4:3(2分)。
高一期末测试 化学 试题卷 第2页(共2页)
同课章节目录
