浙江省温州市2024~2025学年第一学期高一期末教学质量统一检测化学试题(B卷)(PDF版,含答案)
文档属性
| 名称 | 浙江省温州市2024~2025学年第一学期高一期末教学质量统一检测化学试题(B卷)(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 674.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-16 09:22:42 | ||
图片预览



文档简介
2024 学年第一学期温州市高一期末教学质量统一检测
化学试题(B 卷)
本试卷分选择题和非选择题两部分,共 7页,满分 100分,考试时间 90分钟。
考生须知:
1.考生答题前,务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔填写在答题卷上。
2.选择题的答案须用 2B铅笔将答题卷上对应题目的答案标号涂黑,如要改动,须将原填涂处
用橡皮擦净。
3.非选择题的答案须用黑色字迹的签字笔或钢笔写在答题卷上相应区域内,作图时可先使用
2B铅笔,确定后须用黑色字迹的签字笔或钢笔描黑,答案写在本试题卷上无效。
4.本卷可能用到的相对原子质量数据:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Ca-40
Fe-56 Cu-64
选择题部分(共 60分)
一、选择题(本题有 15 小题,每小题 2 分,共 30 分。每小题只.有.1 个选项符合题意,不选、
多选、选错均不给分)
1.氯气的分子式是
A.Cl2 B.H2 C.HCl D.O2
2.按物质的组成进行分类,ClO2属于
A.酸 B.碱 C.盐 D.氧化物
3.下列物质属于电解质的是
A.铝 B.盐酸 C.氯化镁 D.硝酸钾溶液
4.下列仪器常用于“过滤”操作的是
A. B. C. D.
5.能示意“实验中会用到明火。要正确使用火源,并束好长发,系紧宽松衣物”的图标是
A. B. C. D.
6.气体摩尔体积的单位是
A.L/mol B.L C.g/mol D.mol
7.下列物质中含有非极性共价键的是
A.NaOH B.MgCl2 C.I2 D.H2S
高一化学试题(B 卷) 第 1 页(共 7 页)
8.反应 2Na+2H2O=2NaOH+H2↑中,氧化剂是
A.Na B.H2O C.NaOH D.H2
9.当光束通过下列分散系时,不.能.观察到一条光亮“通路”的是
A.云 B.NaCl溶液 C.有色玻璃 D.Fe(OH)3胶体
10.在溶液中能大量共存的离子组是
A.NH4+、Ba2+、Br 、CO23 B.Fe2+、Na+、ClO 、H+
C.K+、Na+、SO24 、MnO 4 D.Na+、H+、NO3 、HCO3
11.下列说法不.正.确.的是
A.金属钠常保存在煤油中
B.装有浓硫酸的试剂瓶不可敞口久置
C.硫酸亚铁溶液的保存需加入少量铁粉
D.新制氯水应保存在无色试剂瓶中
12.武夷山大红袍素有茶中之王的美誉。检验茶叶中是否含铁元素的操作方案如图所示,下列
说法不.正.确.的是
A.“操作①”应在烧杯中灼烧
B.“操作②”用热水或搅拌均可加速溶解
C.“操作③”用到的玻璃棒作用是引流
D.“操作④”若检验过程中加 KSCN没有出现血红色溶液,则滤液中不含 Fe3+
13.下列说法不.正.确.的是
A.用 K、L、M、N等符号来表示从内到外的电子层
B.L电子层为次外层时,最多可容纳的电子数为 8
C.主族元素原子的最外层电子数等于该元素所在的族序数
D.第ⅠA族元素叫做碱金属元素,第ⅦA族元素叫做卤族元素
14.下列实验装置使用不.正.确.的是
① ② ③ ④
A.图①装置可用于铜与浓硫酸反应并检验气态产物
B.图②装置可用于实验室收集二氧化硫气体
C.图③装置可用于验证铁与水蒸气能发生反应
D.图④装置可用于检验氯化钠溶液中的氯离子
高一化学试题(B 卷) 第 2 页(共 7 页)
15.化学与职业息息相关,下列职业与职责不.对.应.的是
选项 职业 职责
A 化学科研工作者 研究如何实现物质的人工转化
B 科技考古研究人员 利用 12C衰变测定装置,对文物进行年代测定
C 化学工程师 设计化工生产的工艺流程,并及时解决技术问题
D 水质检测员 对自来水中硫酸根离子、氯离子和有机物等进行检测分析
二、选择题(本题有 10 小题,每小题 3 分,共 30 分。每小题只.有.1 个选项符合题意,不选、
多选、选错均不给分)
35S 35 35 3516. 16 发生 衰变会转变为 17Cl,有关 16S与 17Cl的说法正确的是
A.质子数相同 B.互为同位素 C.质量数相同 D.互为同素异形体
17.下列说法不.正.确.的是
A.用浓硫酸在纸上书写的字迹变黑,体现了浓硫酸的脱水性
B.氯气在氢气中燃烧发出淡蓝色火焰,体现了氯气的可燃性
C.钠在空气中燃烧生成淡黄色固体,体现了钠的还原性
D.氧化亚铁粉末在空气中受热被氧化成四氧化三铁,体现了氧化亚铁的不稳定性
18.下列化学反应与方程式相符的是
A.将铜片插入硝酸银溶液中:Cu + Ag+ = Ag + Cu2+
B.向氯化钙溶液中通入二氧化碳:Ca2++ H2O + CO2 = CaCO3↓+ 2H+
C.向氢氧化钡溶液中加入稀硫酸:Ba2++ OH + H+ + SO24 = BaSO4↓ + H2O
D.将氧化镁与稀盐酸混合:MgO + 2H+ = Mg2++ H2O
19.物质性质决定用途,下列两者对应关系正确的是
A.钠钾合金导热性好,可用作传热介质
B.浓硫酸具有强氧化性,可用作干燥剂
C.铝的金属性强,可用于制作铝金属制品
D.铁的金属活动性强于铜,氯化铁溶液可用于刻蚀覆铜板制印刷电路板
20.设 NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L H2O含有的共用电子对数为 0.2 NA
B.0.1mol·Lˉ1的 NaOH溶液中 Na+的数目为 0.1 NA
C.常温常压下,6.4 g O2中含有原子数为 0.4NA
D.5.6 g铁粉与足量 Cl2充分反应,转移的电子数为 0.2 NA
21.下列说法不.正.确.的是
A.CH4中每个原子最外电子层都具有 8电子稳定结构
B.CO2分子的空间结构是直线形
C.NaCl固体溶于水能产生自由移动的水合钠离子和水合氯离子
D.CaCO3高温受热分解的过程中既破坏了离子键,也破坏了共价键
高一化学试题(B 卷) 第 3 页(共 7 页)
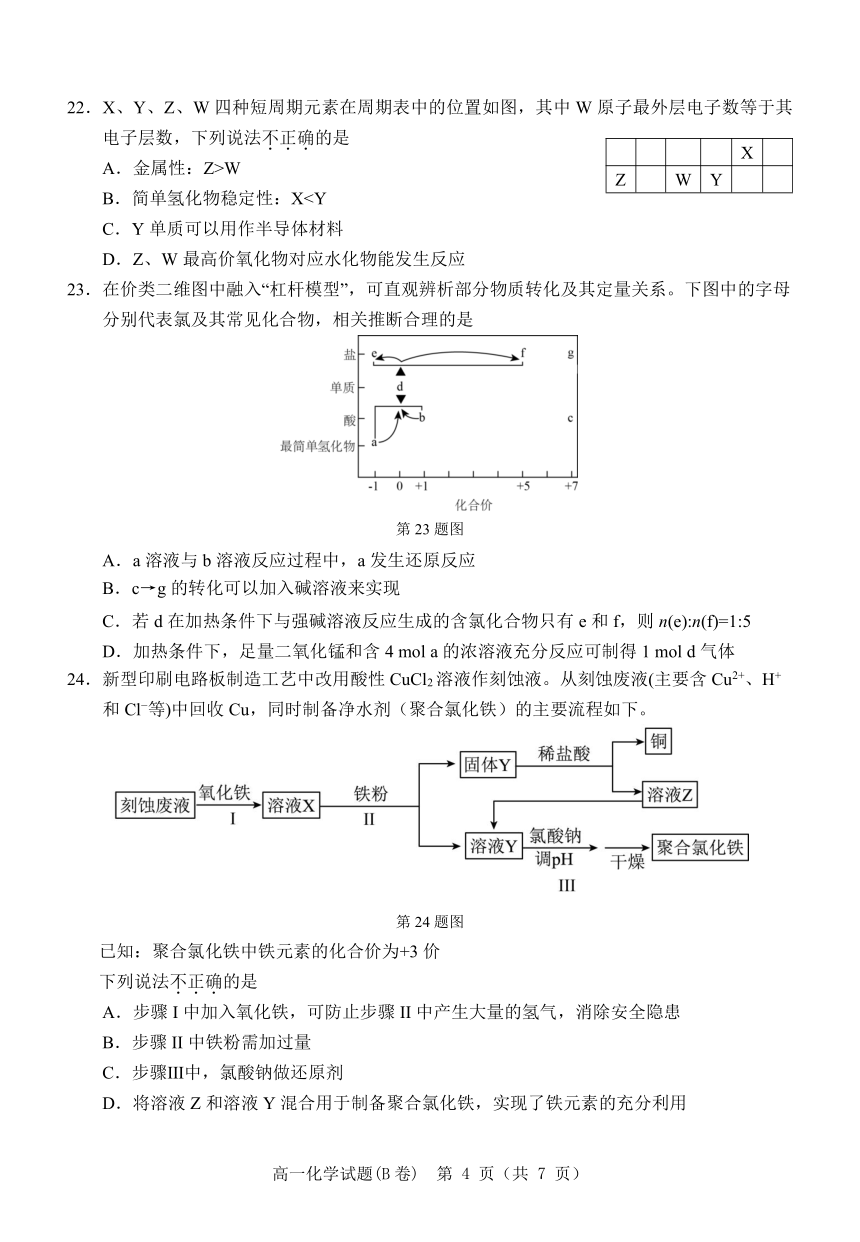
22.X、Y、Z、W四种短周期元素在周期表中的位置如图,其中 W原子最外层电子数等于其
电子层数,下列说法不.正.确.的是 X
A.金属性:Z>W Z W Y
B.简单氢化物稳定性:XC.Y单质可以用作半导体材料
D.Z、W最高价氧化物对应水化物能发生反应
23.在价类二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。下图中的字母
分别代表氯及其常见化合物,相关推断合理的是
第 23题图
A.a溶液与 b溶液反应过程中,a发生还原反应
B.c→g的转化可以加入碱溶液来实现
C.若 d在加热条件下与强碱溶液反应生成的含氯化合物只有 e和 f,则 n(e):n(f)=1:5
D.加热条件下,足量二氧化锰和含 4 mol a的浓溶液充分反应可制得 1 mol d气体
24.新型印刷电路板制造工艺中改用酸性 CuCl2溶液作刻蚀液。从刻蚀废液(主要含 Cu2+、H+
和 Cl 等)中回收 Cu,同时制备净水剂(聚合氯化铁)的主要流程如下。
第 24题图
已知:聚合氯化铁中铁元素的化合价为+3价
下列说法不.正.确.的是
A.步骤 I中加入氧化铁,可防止步骤 II中产生大量的氢气,消除安全隐患
B.步骤 II中铁粉需加过量
C.步骤Ⅲ中,氯酸钠做还原剂
D.将溶液 Z和溶液 Y混合用于制备聚合氯化铁,实现了铁元素的充分利用
高一化学试题(B 卷) 第 4 页(共 7 页)
25.下列实验结论不.正.确.的是
选项 实验目的 方案设计 现象 结论
验证 HClO 光 用pH传感器测定新制氯 HClO光照分解产生了
A 照分解产物 水的 pH 发现氯水 pH降低 H+
向装有NaOH溶液的①、 ①号试管立即产生
验证铝片表面 ②号试管中,分别加入 气泡
B 铝片表面存在氧化膜存在氧化膜 一小块用砂纸打磨过和 ②号试管一段时间
未打磨过的铝片 后才产生气泡
验证 Fe2+的还 向 1mL FeSO4溶液中滴 观察到 KMnO4溶液
C Fe2+具有还原性原性 加少量酸性 KMnO4溶液 紫色褪去
检验X溶液中 用洁净的铂丝蘸取 X溶 X溶液中一定含有 Na
D 观察到黄色火焰的金属元素 液进行焰色试验 元素,不含有 K元素
非选择题部分
三、非选择题(5 大题,共 40 分)
26.(8分)请回答:
(1)写出钡餐的化学式 ▲ 。
(2)写出 NaCl的电子式 ▲ 。
(3)推测非金属性强弱:Cl ▲ Br(填“<”或“=”或“>”),试用一条化学方程式来
表示判断理由 ▲ 。
27.(8分)1869年俄国化学家门捷列夫制出第一张元素周期表,元素周期表体现了元素位构性
的关系,揭示了元素间的内在联系。几种短周期主族元素在周期表中的位置如下图所示,请
回答下列问题:
① ② ③
④ ⑤ ⑥
第 27题图
请回答:
(1)元素①在周期表中的位置为 ▲ 。画出⑥元素的原子结构示意图 ▲ 。
(2)②、③、④三种元素的简单离子半径由大到小的顺序 ▲ 。(用离子符号表示)
(3)元素②与④加热生成的化合物阴阳离子数之比为 ▲ ,该化合物与 CO2反应的化学
方程式为 ▲ 。
高一化学试题(B 卷) 第 5 页(共 7 页)
(4)下列能比较元素④和⑤金属性强弱的实验事实是(填字母) ▲ 。
A.在化合物中④的化合价比⑤的低
B.④的单质与冷水反应比⑤的单质剧烈
C.④的最高价氧化物的水化物的碱性比⑤的强
D.④单质的熔点比⑤单质的低
28.(8分)工业上常用硫黄或黄铁矿为原料来制备硫酸,工业流程如下。
第 28题图
(1)下列物质可以作为二氧化硫尾气吸收剂的是 ▲ 。
A.浓硫酸 B.硫酸钠溶液 C.氢氧化钠溶液
(2)工业上有用硫酸铁溶液吸收二氧化硫,这体现了二氧化硫具有 ▲ 。(填“氧化性”
或“还原性”)。
(3)步骤②的化学方程式是 ▲ 。
(4)下列说法不.正.确.的是 ▲ 。
A.步骤①粉碎硫黄或黄铁矿可以增大接触面积,加快反应速率
B.可以用点燃法除去尾气中的 SO2
C.步骤③中M为水
D.常温下,浓硫酸可以用铁罐存储运输
29.(10分)碳酸钠是一种重要化工原料,广泛用于生活洗涤、酸类中和以及食品加工等。
(一)用碳酸钠晶体(Na2CO3·10H2O)配制 250 mL 0.100 mol/L的 Na2CO3溶液
(1)准确称取 7.150g碳酸钠晶体需用到 ▲ 。
A.托盘天平 B.分析天平
(2)实验中除需要天平、药匙、量筒、烧杯、玻璃棒、胶头滴管、试剂瓶外,还需要的玻
璃仪器有 ▲ 。
(3)下列关于容量瓶的相关操作,正确的是 ▲ 。
高一化学试题(B 卷) 第 6 页(共 7 页)
(4)下列实验操作会使配制溶液浓度偏高的是 ▲ 。
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去部分结晶水
(二)某小组为鉴别碳酸钠与碳酸氢钠,设计以下实验
(1)小试管中装的固体应是 ▲ 。
(2)证明碳酸钠比碳酸氢钠稳定的实验现象为 ▲ 。
(3)用下列方法可以鉴别碳酸钠与碳酸氢钠的是 ▲ 。
A.分别向装有等量 Na2CO3、NaHCO3固体的两支试管中滴加几滴水
B.分别向装有同浓度 Na2CO3、NaHCO3溶液的两支试管中滴加酚酞溶液
C.分别向装有同浓度 Na2CO3、NaHCO3溶液的两支试管中滴加澄清石灰水
30.(6分)钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的 Fe3O4。某小组为了
研究烤蓝铁片:取 m g烤蓝铁片样品,放入 140.00 mL 1 mol·L-1的盐酸中,恰好完全反应,
生成标准状况下 H2的体积为 1120 mL,向溶液中滴入 KSCN 溶液,无明显现象;将反应后
的溶液稀释至 200 mL。(已知:Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O)
请计算:
(1)H2物质的量是 ▲ mol。
(2)稀释后溶液中 c(Fe2+)= ▲ mol/L。
(3)样品中 n(Fe3O4)= ▲ mol。
高一化学试题(B 卷) 第 7 页(共 7 页)
2024 学年第一学期温州市高一期末教学质量统一检测
化学试题(B 卷)参考答案及评分标准
一、选择题(本题有 15 小题,每小题 2 分,共 30 分。每小题只.有.1 个选项符合题意,不选、
多选、选错均不给分)
题号 1 2 3 4 5 6 7 8 9 10
答案 A D C A C A C B B C
题号 11 12 13 14 15
答案 D A D B B
二、选择题(本题有 10 小题,每小题 3 分,共 30 分。每小题只.有.1 个选项符合题意,不选、
多选、选错均不给分)
题号 16 17 18 19 20 21 22 23 24 25
答案 C B D A C A B B C D
三、非选择题(5大题,给 40分)
26.(8分)
(1)BaSO4(2分,写“硫酸钡”不给分)
(2) (2分,有错不给分)
(3)>(2 分),Cl2+2KBr=2KCl+Br2(2 分,写离子方程式且正确给 2 分,其他答案
Cl2+2NaBr=2NaCl+Br2合理即可给分)
27.(8分)
(1)第二周期第 IVA族 或 第 2周期第 IVA族(1分,写第四主族不给分)
(1分)
(2)O2->F->Na+(2分,未写离子符号,用②③④表示不给分)
(3)1:2 (1分) 2Na2O2+ 2CO2==2Na2CO3 +O2↑(1分)
(4)BC (2分,有错不给分,少选给 1分)
28.(8分)
(1)C(2分,有错不给分)
(2)还原性 (2分)
(3) (2分,条件缺,配平错扣 1分)
(4)BC(2分,有错不给分,少选给 1分)
29.(10分)
(一)(1)B(1分,有错不给分)
(2)250mL容量瓶 (1分,没写 250mL不给分)
高一化学试题(B 卷)参考答案 第 1 页(共 2 页)
(3) ① (2分,有错不给分)
(4)BD (2分,有错不给分,少选给 1分)
(二)(1)NaHCO3 或者 碳酸氢钠 (1分)
(2) B中澄清石灰水变浑浊(1分)
(3) AB (2分,有错不给分,少选给 1分)
30.(6分)(有效数字不作要求)
(1)0.05(2分)
(2)0.35(2分)
(3)0.005(2分)
高一化学试题(B 卷)参考答案 第 2 页(共 2 页)
化学试题(B 卷)
本试卷分选择题和非选择题两部分,共 7页,满分 100分,考试时间 90分钟。
考生须知:
1.考生答题前,务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔填写在答题卷上。
2.选择题的答案须用 2B铅笔将答题卷上对应题目的答案标号涂黑,如要改动,须将原填涂处
用橡皮擦净。
3.非选择题的答案须用黑色字迹的签字笔或钢笔写在答题卷上相应区域内,作图时可先使用
2B铅笔,确定后须用黑色字迹的签字笔或钢笔描黑,答案写在本试题卷上无效。
4.本卷可能用到的相对原子质量数据:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Ca-40
Fe-56 Cu-64
选择题部分(共 60分)
一、选择题(本题有 15 小题,每小题 2 分,共 30 分。每小题只.有.1 个选项符合题意,不选、
多选、选错均不给分)
1.氯气的分子式是
A.Cl2 B.H2 C.HCl D.O2
2.按物质的组成进行分类,ClO2属于
A.酸 B.碱 C.盐 D.氧化物
3.下列物质属于电解质的是
A.铝 B.盐酸 C.氯化镁 D.硝酸钾溶液
4.下列仪器常用于“过滤”操作的是
A. B. C. D.
5.能示意“实验中会用到明火。要正确使用火源,并束好长发,系紧宽松衣物”的图标是
A. B. C. D.
6.气体摩尔体积的单位是
A.L/mol B.L C.g/mol D.mol
7.下列物质中含有非极性共价键的是
A.NaOH B.MgCl2 C.I2 D.H2S
高一化学试题(B 卷) 第 1 页(共 7 页)
8.反应 2Na+2H2O=2NaOH+H2↑中,氧化剂是
A.Na B.H2O C.NaOH D.H2
9.当光束通过下列分散系时,不.能.观察到一条光亮“通路”的是
A.云 B.NaCl溶液 C.有色玻璃 D.Fe(OH)3胶体
10.在溶液中能大量共存的离子组是
A.NH4+、Ba2+、Br 、CO23 B.Fe2+、Na+、ClO 、H+
C.K+、Na+、SO24 、MnO 4 D.Na+、H+、NO3 、HCO3
11.下列说法不.正.确.的是
A.金属钠常保存在煤油中
B.装有浓硫酸的试剂瓶不可敞口久置
C.硫酸亚铁溶液的保存需加入少量铁粉
D.新制氯水应保存在无色试剂瓶中
12.武夷山大红袍素有茶中之王的美誉。检验茶叶中是否含铁元素的操作方案如图所示,下列
说法不.正.确.的是
A.“操作①”应在烧杯中灼烧
B.“操作②”用热水或搅拌均可加速溶解
C.“操作③”用到的玻璃棒作用是引流
D.“操作④”若检验过程中加 KSCN没有出现血红色溶液,则滤液中不含 Fe3+
13.下列说法不.正.确.的是
A.用 K、L、M、N等符号来表示从内到外的电子层
B.L电子层为次外层时,最多可容纳的电子数为 8
C.主族元素原子的最外层电子数等于该元素所在的族序数
D.第ⅠA族元素叫做碱金属元素,第ⅦA族元素叫做卤族元素
14.下列实验装置使用不.正.确.的是
① ② ③ ④
A.图①装置可用于铜与浓硫酸反应并检验气态产物
B.图②装置可用于实验室收集二氧化硫气体
C.图③装置可用于验证铁与水蒸气能发生反应
D.图④装置可用于检验氯化钠溶液中的氯离子
高一化学试题(B 卷) 第 2 页(共 7 页)
15.化学与职业息息相关,下列职业与职责不.对.应.的是
选项 职业 职责
A 化学科研工作者 研究如何实现物质的人工转化
B 科技考古研究人员 利用 12C衰变测定装置,对文物进行年代测定
C 化学工程师 设计化工生产的工艺流程,并及时解决技术问题
D 水质检测员 对自来水中硫酸根离子、氯离子和有机物等进行检测分析
二、选择题(本题有 10 小题,每小题 3 分,共 30 分。每小题只.有.1 个选项符合题意,不选、
多选、选错均不给分)
35S 35 35 3516. 16 发生 衰变会转变为 17Cl,有关 16S与 17Cl的说法正确的是
A.质子数相同 B.互为同位素 C.质量数相同 D.互为同素异形体
17.下列说法不.正.确.的是
A.用浓硫酸在纸上书写的字迹变黑,体现了浓硫酸的脱水性
B.氯气在氢气中燃烧发出淡蓝色火焰,体现了氯气的可燃性
C.钠在空气中燃烧生成淡黄色固体,体现了钠的还原性
D.氧化亚铁粉末在空气中受热被氧化成四氧化三铁,体现了氧化亚铁的不稳定性
18.下列化学反应与方程式相符的是
A.将铜片插入硝酸银溶液中:Cu + Ag+ = Ag + Cu2+
B.向氯化钙溶液中通入二氧化碳:Ca2++ H2O + CO2 = CaCO3↓+ 2H+
C.向氢氧化钡溶液中加入稀硫酸:Ba2++ OH + H+ + SO24 = BaSO4↓ + H2O
D.将氧化镁与稀盐酸混合:MgO + 2H+ = Mg2++ H2O
19.物质性质决定用途,下列两者对应关系正确的是
A.钠钾合金导热性好,可用作传热介质
B.浓硫酸具有强氧化性,可用作干燥剂
C.铝的金属性强,可用于制作铝金属制品
D.铁的金属活动性强于铜,氯化铁溶液可用于刻蚀覆铜板制印刷电路板
20.设 NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L H2O含有的共用电子对数为 0.2 NA
B.0.1mol·Lˉ1的 NaOH溶液中 Na+的数目为 0.1 NA
C.常温常压下,6.4 g O2中含有原子数为 0.4NA
D.5.6 g铁粉与足量 Cl2充分反应,转移的电子数为 0.2 NA
21.下列说法不.正.确.的是
A.CH4中每个原子最外电子层都具有 8电子稳定结构
B.CO2分子的空间结构是直线形
C.NaCl固体溶于水能产生自由移动的水合钠离子和水合氯离子
D.CaCO3高温受热分解的过程中既破坏了离子键,也破坏了共价键
高一化学试题(B 卷) 第 3 页(共 7 页)
22.X、Y、Z、W四种短周期元素在周期表中的位置如图,其中 W原子最外层电子数等于其
电子层数,下列说法不.正.确.的是 X
A.金属性:Z>W Z W Y
B.简单氢化物稳定性:X
D.Z、W最高价氧化物对应水化物能发生反应
23.在价类二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。下图中的字母
分别代表氯及其常见化合物,相关推断合理的是
第 23题图
A.a溶液与 b溶液反应过程中,a发生还原反应
B.c→g的转化可以加入碱溶液来实现
C.若 d在加热条件下与强碱溶液反应生成的含氯化合物只有 e和 f,则 n(e):n(f)=1:5
D.加热条件下,足量二氧化锰和含 4 mol a的浓溶液充分反应可制得 1 mol d气体
24.新型印刷电路板制造工艺中改用酸性 CuCl2溶液作刻蚀液。从刻蚀废液(主要含 Cu2+、H+
和 Cl 等)中回收 Cu,同时制备净水剂(聚合氯化铁)的主要流程如下。
第 24题图
已知:聚合氯化铁中铁元素的化合价为+3价
下列说法不.正.确.的是
A.步骤 I中加入氧化铁,可防止步骤 II中产生大量的氢气,消除安全隐患
B.步骤 II中铁粉需加过量
C.步骤Ⅲ中,氯酸钠做还原剂
D.将溶液 Z和溶液 Y混合用于制备聚合氯化铁,实现了铁元素的充分利用
高一化学试题(B 卷) 第 4 页(共 7 页)
25.下列实验结论不.正.确.的是
选项 实验目的 方案设计 现象 结论
验证 HClO 光 用pH传感器测定新制氯 HClO光照分解产生了
A 照分解产物 水的 pH 发现氯水 pH降低 H+
向装有NaOH溶液的①、 ①号试管立即产生
验证铝片表面 ②号试管中,分别加入 气泡
B 铝片表面存在氧化膜存在氧化膜 一小块用砂纸打磨过和 ②号试管一段时间
未打磨过的铝片 后才产生气泡
验证 Fe2+的还 向 1mL FeSO4溶液中滴 观察到 KMnO4溶液
C Fe2+具有还原性原性 加少量酸性 KMnO4溶液 紫色褪去
检验X溶液中 用洁净的铂丝蘸取 X溶 X溶液中一定含有 Na
D 观察到黄色火焰的金属元素 液进行焰色试验 元素,不含有 K元素
非选择题部分
三、非选择题(5 大题,共 40 分)
26.(8分)请回答:
(1)写出钡餐的化学式 ▲ 。
(2)写出 NaCl的电子式 ▲ 。
(3)推测非金属性强弱:Cl ▲ Br(填“<”或“=”或“>”),试用一条化学方程式来
表示判断理由 ▲ 。
27.(8分)1869年俄国化学家门捷列夫制出第一张元素周期表,元素周期表体现了元素位构性
的关系,揭示了元素间的内在联系。几种短周期主族元素在周期表中的位置如下图所示,请
回答下列问题:
① ② ③
④ ⑤ ⑥
第 27题图
请回答:
(1)元素①在周期表中的位置为 ▲ 。画出⑥元素的原子结构示意图 ▲ 。
(2)②、③、④三种元素的简单离子半径由大到小的顺序 ▲ 。(用离子符号表示)
(3)元素②与④加热生成的化合物阴阳离子数之比为 ▲ ,该化合物与 CO2反应的化学
方程式为 ▲ 。
高一化学试题(B 卷) 第 5 页(共 7 页)
(4)下列能比较元素④和⑤金属性强弱的实验事实是(填字母) ▲ 。
A.在化合物中④的化合价比⑤的低
B.④的单质与冷水反应比⑤的单质剧烈
C.④的最高价氧化物的水化物的碱性比⑤的强
D.④单质的熔点比⑤单质的低
28.(8分)工业上常用硫黄或黄铁矿为原料来制备硫酸,工业流程如下。
第 28题图
(1)下列物质可以作为二氧化硫尾气吸收剂的是 ▲ 。
A.浓硫酸 B.硫酸钠溶液 C.氢氧化钠溶液
(2)工业上有用硫酸铁溶液吸收二氧化硫,这体现了二氧化硫具有 ▲ 。(填“氧化性”
或“还原性”)。
(3)步骤②的化学方程式是 ▲ 。
(4)下列说法不.正.确.的是 ▲ 。
A.步骤①粉碎硫黄或黄铁矿可以增大接触面积,加快反应速率
B.可以用点燃法除去尾气中的 SO2
C.步骤③中M为水
D.常温下,浓硫酸可以用铁罐存储运输
29.(10分)碳酸钠是一种重要化工原料,广泛用于生活洗涤、酸类中和以及食品加工等。
(一)用碳酸钠晶体(Na2CO3·10H2O)配制 250 mL 0.100 mol/L的 Na2CO3溶液
(1)准确称取 7.150g碳酸钠晶体需用到 ▲ 。
A.托盘天平 B.分析天平
(2)实验中除需要天平、药匙、量筒、烧杯、玻璃棒、胶头滴管、试剂瓶外,还需要的玻
璃仪器有 ▲ 。
(3)下列关于容量瓶的相关操作,正确的是 ▲ 。
高一化学试题(B 卷) 第 6 页(共 7 页)
(4)下列实验操作会使配制溶液浓度偏高的是 ▲ 。
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去部分结晶水
(二)某小组为鉴别碳酸钠与碳酸氢钠,设计以下实验
(1)小试管中装的固体应是 ▲ 。
(2)证明碳酸钠比碳酸氢钠稳定的实验现象为 ▲ 。
(3)用下列方法可以鉴别碳酸钠与碳酸氢钠的是 ▲ 。
A.分别向装有等量 Na2CO3、NaHCO3固体的两支试管中滴加几滴水
B.分别向装有同浓度 Na2CO3、NaHCO3溶液的两支试管中滴加酚酞溶液
C.分别向装有同浓度 Na2CO3、NaHCO3溶液的两支试管中滴加澄清石灰水
30.(6分)钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的 Fe3O4。某小组为了
研究烤蓝铁片:取 m g烤蓝铁片样品,放入 140.00 mL 1 mol·L-1的盐酸中,恰好完全反应,
生成标准状况下 H2的体积为 1120 mL,向溶液中滴入 KSCN 溶液,无明显现象;将反应后
的溶液稀释至 200 mL。(已知:Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O)
请计算:
(1)H2物质的量是 ▲ mol。
(2)稀释后溶液中 c(Fe2+)= ▲ mol/L。
(3)样品中 n(Fe3O4)= ▲ mol。
高一化学试题(B 卷) 第 7 页(共 7 页)
2024 学年第一学期温州市高一期末教学质量统一检测
化学试题(B 卷)参考答案及评分标准
一、选择题(本题有 15 小题,每小题 2 分,共 30 分。每小题只.有.1 个选项符合题意,不选、
多选、选错均不给分)
题号 1 2 3 4 5 6 7 8 9 10
答案 A D C A C A C B B C
题号 11 12 13 14 15
答案 D A D B B
二、选择题(本题有 10 小题,每小题 3 分,共 30 分。每小题只.有.1 个选项符合题意,不选、
多选、选错均不给分)
题号 16 17 18 19 20 21 22 23 24 25
答案 C B D A C A B B C D
三、非选择题(5大题,给 40分)
26.(8分)
(1)BaSO4(2分,写“硫酸钡”不给分)
(2) (2分,有错不给分)
(3)>(2 分),Cl2+2KBr=2KCl+Br2(2 分,写离子方程式且正确给 2 分,其他答案
Cl2+2NaBr=2NaCl+Br2合理即可给分)
27.(8分)
(1)第二周期第 IVA族 或 第 2周期第 IVA族(1分,写第四主族不给分)
(1分)
(2)O2->F->Na+(2分,未写离子符号,用②③④表示不给分)
(3)1:2 (1分) 2Na2O2+ 2CO2==2Na2CO3 +O2↑(1分)
(4)BC (2分,有错不给分,少选给 1分)
28.(8分)
(1)C(2分,有错不给分)
(2)还原性 (2分)
(3) (2分,条件缺,配平错扣 1分)
(4)BC(2分,有错不给分,少选给 1分)
29.(10分)
(一)(1)B(1分,有错不给分)
(2)250mL容量瓶 (1分,没写 250mL不给分)
高一化学试题(B 卷)参考答案 第 1 页(共 2 页)
(3) ① (2分,有错不给分)
(4)BD (2分,有错不给分,少选给 1分)
(二)(1)NaHCO3 或者 碳酸氢钠 (1分)
(2) B中澄清石灰水变浑浊(1分)
(3) AB (2分,有错不给分,少选给 1分)
30.(6分)(有效数字不作要求)
(1)0.05(2分)
(2)0.35(2分)
(3)0.005(2分)
高一化学试题(B 卷)参考答案 第 2 页(共 2 页)
同课章节目录
