1.1物质的分类及转化 课件(共19张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1物质的分类及转化 课件(共19张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-17 11:01:49 | ||
图片预览






文档简介
(共19张PPT)
第二章 物质及其变化
第一节 物质的分类及其转化
生活中的分类
生活中的分类
生活中的分类
一、简单分类法及其应用
1、分类法的意义:
对于化学研究而言,对物质进行合理分类便于了解各类物质的共性和各类反应的本质。
对于工作和生活而言,对物质进行合理分类可以为工作和生活提供便利,实现高效。
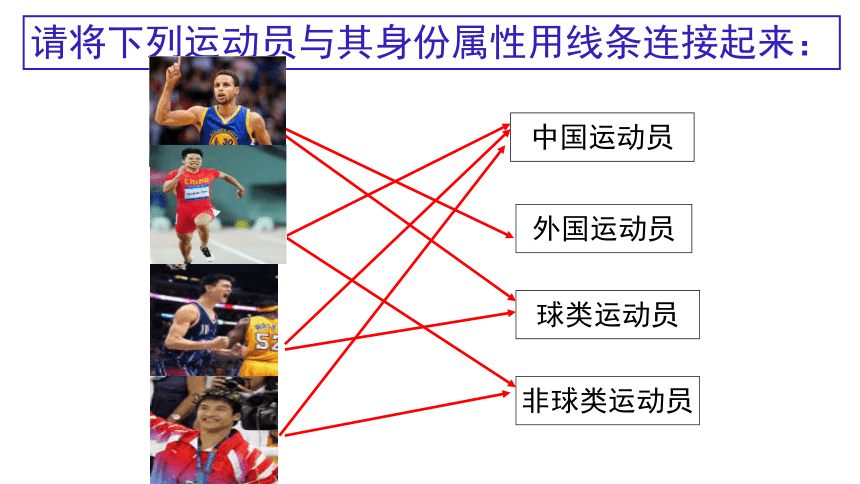
请将下列运动员与其身份属性用线条连接起来:
中国运动员
外国运动员
球类运动员
非球类运动员
2、简单分类法
(1)交叉分类法:
将被分类的对象应用多种不同的标准进行分类的一种方法。
优点:从多角度对物质分类,体现了物质的多种性质,弥补了单一分类方法的不足。
含氧酸
无氧酸
一元酸
二元酸
练习:教材P29第2题
H2SO4
HCl
HNO3
H3PO4
三元酸
H2S
计算机 资源管理器
分类法——树状分类法
物质
纯净物
混合物
单质
化合物
碱
盐
酸
氧化物
树状分类法:对同类事物进行再分类!
树干(主干)
枝干
枝桠
树叶
树根
(2)树状分类法
树状分类法就是对分类后的各类事物再分类的多层次分类方法。
树状分类法的分类原则:同一层次的物质类别间一般是相互独立,没有交叉的。
优点:体现了对事物认识逐渐深入的过程。
请将以下所给物质进行分类,填入教材P25图2—3的相应位置:
中学过的物质NH3、乙醇(C2H5OH),你可以将它放在教材P25图2-3中的哪些位置?
【自检互评】
【拓展迁移】
空气、C、Cu、Ar、CaO、CO2、HCl、溶液、H2SO4、NaOH、泥沙、Ba(OH)2、Na2SO4、NaHCO3
物 质
混合物
纯净物
单质
化合物
非金属单质
金属单质
无机化合物
有机化合物
氧化物
……
盐
酸
碱
氢化物
分类标准:根据物质组成是否单一
教材P25第三题(1)
Ca
CaO
Ca(OH)2
CaCO3
金属单质
碱性氧化物
盐
碱
CaO + H2O Ca(OH)2
2Ca + O2 2CaO
Ca(OH)2+CO2 CaCO3↓+H2O
【实践活动】
C
CO2
H2CO3
CaCO3
C + O2 CO2
CO2 + H2O H2CO3
Ca(OH)2+H2CO3 CaCO3↓+2H2O
点燃
教材P25第三题(2)
【实践活动】
非金属单质
酸性氧化物
盐
酸
下列方程式你能从哪些角度对其进行分类?
①2KClO3 ==== 2KCl + 3O2↑
②H2 + CuO === Cu + H2O
③Fe + H2SO4 = FeSO4 + H2↑
④2H2O2 ==== 2H2O + O2↑
⑤3CO+ Fe2O3 ===2Fe + 3CO2
⑥2Ca + O2 = 2CaO
⑦CaO + H2O = Ca(OH)2
⑧H2CO3 + Ca(OH)2 = CaCO3 + 2H2O
高温
【思考与交流】
讨论探究——化学反应的分类
①2KClO3 = 2KCl + 3O2↑
②H2 + CuO = Cu + H2O
③Fe + H2SO4 = FeSO4 + H2↑
④2H2O2 = 2H2O + O2↑
⑤3CO+ Fe2O3 = 2Fe + 3CO2
⑥2Ca + O2 = 2CaO
⑦CaO + H2O = Ca(OH)2
⑧H2CO3 + Ca(OH)2 = CaCO3 ↓ + 2H2O
置换反应
化合反应
分解反应
分解反应
复分解反应
不属于四大基本反应类型
化学反应的分类
思考回顾:
四大基本反应类型:
分类标准:根据反应物和生成物的类别以及反应前后物质种类的多少
化合反应 A + B —— C
分解反应 AB —— A + B
置换反应 A+BC—— B+AC
复分解反应 AB + CD —— AD + CB
思考回顾:
四大基本反应类型: 化合反应 A + B —— C
分解反应 AB —— A + B
置换反应 A+BC——B+AC
复分解反应 AB + CD —— AD + CB
拓展延伸:
化学反应:离子反应、非离子反应
氧化还原反应
非氧化还原反应
放热反应、吸热反应
分类标准:根据反应物和生成物的类别以及反应前后物质种类的多少
分类标准:根据反应中是否有离子参加
分类标准:根据物质在反应中是否有元素化合价升降
分类标准:根据反应过程中的热效应
化学反应的分类
第二章 物质及其变化
第一节 物质的分类及其转化
生活中的分类
生活中的分类
生活中的分类
一、简单分类法及其应用
1、分类法的意义:
对于化学研究而言,对物质进行合理分类便于了解各类物质的共性和各类反应的本质。
对于工作和生活而言,对物质进行合理分类可以为工作和生活提供便利,实现高效。
请将下列运动员与其身份属性用线条连接起来:
中国运动员
外国运动员
球类运动员
非球类运动员
2、简单分类法
(1)交叉分类法:
将被分类的对象应用多种不同的标准进行分类的一种方法。
优点:从多角度对物质分类,体现了物质的多种性质,弥补了单一分类方法的不足。
含氧酸
无氧酸
一元酸
二元酸
练习:教材P29第2题
H2SO4
HCl
HNO3
H3PO4
三元酸
H2S
计算机 资源管理器
分类法——树状分类法
物质
纯净物
混合物
单质
化合物
碱
盐
酸
氧化物
树状分类法:对同类事物进行再分类!
树干(主干)
枝干
枝桠
树叶
树根
(2)树状分类法
树状分类法就是对分类后的各类事物再分类的多层次分类方法。
树状分类法的分类原则:同一层次的物质类别间一般是相互独立,没有交叉的。
优点:体现了对事物认识逐渐深入的过程。
请将以下所给物质进行分类,填入教材P25图2—3的相应位置:
中学过的物质NH3、乙醇(C2H5OH),你可以将它放在教材P25图2-3中的哪些位置?
【自检互评】
【拓展迁移】
空气、C、Cu、Ar、CaO、CO2、HCl、溶液、H2SO4、NaOH、泥沙、Ba(OH)2、Na2SO4、NaHCO3
物 质
混合物
纯净物
单质
化合物
非金属单质
金属单质
无机化合物
有机化合物
氧化物
……
盐
酸
碱
氢化物
分类标准:根据物质组成是否单一
教材P25第三题(1)
Ca
CaO
Ca(OH)2
CaCO3
金属单质
碱性氧化物
盐
碱
CaO + H2O Ca(OH)2
2Ca + O2 2CaO
Ca(OH)2+CO2 CaCO3↓+H2O
【实践活动】
C
CO2
H2CO3
CaCO3
C + O2 CO2
CO2 + H2O H2CO3
Ca(OH)2+H2CO3 CaCO3↓+2H2O
点燃
教材P25第三题(2)
【实践活动】
非金属单质
酸性氧化物
盐
酸
下列方程式你能从哪些角度对其进行分类?
①2KClO3 ==== 2KCl + 3O2↑
②H2 + CuO === Cu + H2O
③Fe + H2SO4 = FeSO4 + H2↑
④2H2O2 ==== 2H2O + O2↑
⑤3CO+ Fe2O3 ===2Fe + 3CO2
⑥2Ca + O2 = 2CaO
⑦CaO + H2O = Ca(OH)2
⑧H2CO3 + Ca(OH)2 = CaCO3 + 2H2O
高温
【思考与交流】
讨论探究——化学反应的分类
①2KClO3 = 2KCl + 3O2↑
②H2 + CuO = Cu + H2O
③Fe + H2SO4 = FeSO4 + H2↑
④2H2O2 = 2H2O + O2↑
⑤3CO+ Fe2O3 = 2Fe + 3CO2
⑥2Ca + O2 = 2CaO
⑦CaO + H2O = Ca(OH)2
⑧H2CO3 + Ca(OH)2 = CaCO3 ↓ + 2H2O
置换反应
化合反应
分解反应
分解反应
复分解反应
不属于四大基本反应类型
化学反应的分类
思考回顾:
四大基本反应类型:
分类标准:根据反应物和生成物的类别以及反应前后物质种类的多少
化合反应 A + B —— C
分解反应 AB —— A + B
置换反应 A+BC—— B+AC
复分解反应 AB + CD —— AD + CB
思考回顾:
四大基本反应类型: 化合反应 A + B —— C
分解反应 AB —— A + B
置换反应 A+BC——B+AC
复分解反应 AB + CD —— AD + CB
拓展延伸:
化学反应:离子反应、非离子反应
氧化还原反应
非氧化还原反应
放热反应、吸热反应
分类标准:根据反应物和生成物的类别以及反应前后物质种类的多少
分类标准:根据反应中是否有离子参加
分类标准:根据物质在反应中是否有元素化合价升降
分类标准:根据反应过程中的热效应
化学反应的分类
