1.2离子反应 课件(共42张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2离子反应 课件(共42张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 536.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-17 11:06:15 | ||
图片预览









文档简介
(共42张PPT)
第一章 第二节
离子反应
目录
CONTENTS
第一课时 电解质的电离
第二课时 离子反应
学习目标与核心素养
第一课时 电解质的电离
【思考与讨论】
生活常识告诉我们,给电线设备通电时,湿手操作容易发生触电事故。这是为什么呢?
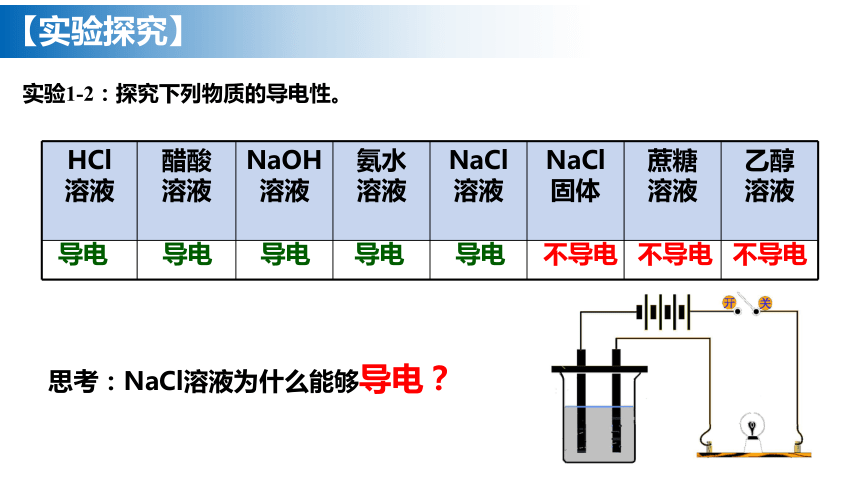
【实验探究】
导电
导电
导电
导电
不导电
不导电
不导电
导电
实验1-2:探究下列物质的导电性。
HCl 溶液 醋酸 溶液 NaOH 溶液 氨水 溶液 NaCl 溶液 NaCl 固体 蔗糖 溶液 乙醇
溶液
思考:NaCl溶液为什么能够导电?
思考:NaCl溶液为什么能够导电?
【实验探究】
由此可见,NaCl溶液能导电的原因是NaCl固体在H2O分子的作用下:
离解出了自由移动的 Na+和 Cl-。
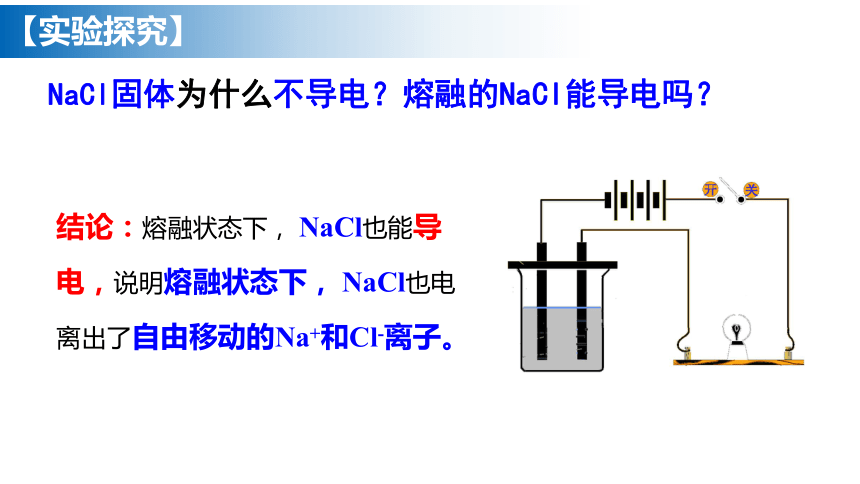
【实验探究】
NaCl固体为什么不导电?熔融的NaCl能导电吗?
结论:熔融状态下, NaCl也能导电,说明熔融状态下, NaCl也电离出了自由移动的Na+和Cl-离子。
【归纳总结】
综上所述,物质能否导电,取决于:
是否存在着自由移动的带电粒子。
人的手长上有汗水(含有NaCl溶液),存在自由移动的离子。因此,湿手直接接触电源容易发生触电事故!
NaCl固体中虽然有Na+和Cl-离子,但是它们按照一定的规则紧密的排列着,不能自由移动,所以固体NaCl不导电。
一、电解质和非电解质
1、电解质:在水溶液里或熔融状态下能够导电的化合物。
2、非电解质:在水溶液里和熔融状态下都不导电的化合物。
酸、 碱、 盐、活泼金属氧化物、水等
非金属氧化物、NH3、绝大多数有机物等
如:HCl、NaOH、K2SO4、Na2O、H2O等
如:CO2、SO2、NH3、蔗糖、乙醇等
根据定义,判断下列说法是否正确?
① 铁能导电,所以铁是电解质;液溴不能导电,它是非电解质。
② CO2的水溶液能导电,所以CO2是电解质。
③ CaCO3难溶于水,是非电解质。
④ MgCl2溶液能导电,所以MgCl2溶液是电解质。
⑤ 盐酸能导电,是电解质。
【课堂练习】
电解质和非电解质都是针对化合物而言
电解质一定是自身能够发生电离
判断化合物是电解质还是非电解质,与其溶解性无关。
要注意区分电解质和电解质溶液
3、注意:
(1)电解质、非电解质都必须是化合物;
(2)电解质是化合物,而电解质溶液是混合物; (如:盐酸是电解质溶液,HCl是电解质)
(3)电解质一定是自身能电离产生离子; 在水溶液里能导电的化合物,不一定是电解质;(如:CO2、SO2、SO3、NH3属于非电解质)
(4)电解质与其溶解性无关;(如: BaSO4、AgCl 等是电解质)
(5)电解质导电需要条件:水溶液或熔融状态下。(如:电解质不一定导电,导电的物质不一定是电解质。)
一、电解质和非电解质
下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液⑧熔融状态的KNO3 ⑨葡萄糖
电解质:
非电解质:
能导电的物质:
⑨
②④⑧
①⑤⑦⑧
【课堂练习】
1、电离及电离方程式的书写
(1) 电离:在溶液中或在熔融状态下产生了自由移动的离子的过程。
水溶液中,NaCl在溶液中是以Na+ 、Cl-的形式存在的。
熔融状态下,克服了离子之间的相互作用,产生了自由移动的Na+和Cl-。
二、电离和电离方程式
(2) 电离方程式:用化学式和离子符号表示电解质电离的式子。
NaCl = Na+ + Cl-
遵守质量守恒和电荷守恒
左边:化学式 右边:离子符号
1、电离及电离方程式的书写
二、电离和电离方程式
写出下列酸的电离方程式:HCl , HNO3 , H2SO4。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
酸:电离时生成的 全部是 的化合物。
阳离子
氢离子
2、酸、碱、盐的定义
二、电离和电离方程式
(1) 写出下列碱的电离方程式:NaOH , KOH , Ba(OH)2 。
NaOH === Na+ + OH-
碱:电离时生成的 全部是 的化合物。
Ba(OH)2 === Ba2+ + 2OH-
KOH === K+ + OH-
阴离子
氢氧根离子
【思考与讨论】
(2) 请结合以上电离方程式,并参考酸的本质,从电离的角度认识碱的本质。
写出下列盐的电离方程式:NaCl , NH4Cl , NaHSO4。
NaCl === Na+ + Cl-
NH4Cl === NH4+ + Cl-
NaHSO4 === Na+ + H+ + SO42-
盐:电离时能生成 (还包括 )和
的化合物。
金属阳离子
铵根离子
酸根阴离子
【思考与讨论】
其实:酸、碱、盐在水溶液中的反应,实际上是
它们电离产生的离子之间的反应。
物质
混和物
纯净物
化合物
单质
电解质
非电解质
不是电解质,也不是非电解质
酸
碱
金属氧化物
乙醇、蔗糖等大部分
有机物
盐(醋酸铅除外)
非金属氧化物
(如CO2、SO2、SO3)
NH3
总结
总结
【方法导引】
电离
【分层作业】
A 组
2、下列状态的物质,既能导电又属于电解质的是( )
A. MgCl2 晶体 B. NaCl 溶液
C. 液态氯化氢 D. 熔融 KOH
1、下列物质属于电解质的是( )
A. 盐酸 B. CO2 C. Fe D. BaSO4
D
D
【分层作业】
B 组
1、下列电解质,溶于水时可以电离,而熔化时难以电离的是( )
A. AgCl B. NaCl C. HCl D. NaOH
2、下列物质的水溶液不能导电的是( )
A. 氯酸钾 B. 酒精 C. 食盐 D. 碳酸氢钙
C
B
第二课时 离子反应
【故事引入】
三国演义“哑泉”
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟获逃至秃龙洞,秃龙洞的毒泉中有一个“哑泉”,“人若饮之,则不能言,不过旬日必死”。不久,蜀军先锋王平率数百军士前来探路,由于天气炎热,人马均争先恐后误喝了哑泉水。军士们个个说不出话来,生命危在旦夕,诸葛亮也毫无办法。原因是什么呢?原因是士兵喝的水中含有 CuSO4 ,造成了重金属中毒。
后经一老叟指点,喝了万安溪安乐泉水后转危为安。原来该泉水中含有较多的碱(一般味苦),在人体误食CuSO4后又大量饮此泉水,其中碱先中和了胃酸,然后多余的碱又会在胃肠中与CuSO4发生离子反应Cu2++2OH-====Cu(OH)2↓。致使原来会使人体吸收的可溶性铜盐变成不溶性的Cu(OH)2沉淀而不再会被吸收,因此,具有解毒作用。
【实验探究】
实验1-3 向盛有2 mL Na2SO4溶液的试管里加入2 mLBaCl2溶液
现 象 分析 Na2SO4和BaCl2的电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
Cl-
Ba2+
Na+
Na+
Na+
Na+
Ba2+
Cl-
Cl-
Cl-
SO42-
SO42-
SO42-
SO42-
Ba2+
Ba2+
BaSO4
BaSO4
【实验探究】
实验1-3 向盛有2 mL Na2SO4溶液的试管里加入2 mLBaCl2溶液
现 象 分析 Na2SO4和BaCl2的电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
本质为:Ba2++SO42-=BaSO4↓
一、离子反应和方程式的书写
1、离子反应
定义:有离子参加或生成的反应叫离子反应。
2、离子方程式
定义:用实际参加反应的离子的符号来表示离子反应的式子叫做离子方程式
怎样书写一个离子反应的离子方程式呢?
3、离子方程式的书写步骤
写:写出正确的化学方程式(基础)
拆:把易溶于水、易电离的物质拆写成离子形式,难溶于水、难电离的物质(如水)以及气体、单质、氧化物等用化学式表示(关键)
一定要注意哦!
一、离子反应和方程式的书写
Na2SO4+BaCl2=2NaCl+BaSO4↓
2Na++SO42-+Ba2++2Cl-=2Na++2Cl-+BaSO4↓
2Na++SO42-+Ba2++2Cl-=2Na++2Cl-+BaSO4↓
删:删去方程式两边不参加反应的离子
查:① 是否符合客观规律
② 原子个数是否守恒
③ 电荷是否守恒
④ 离子的改写是否正确
一、离子反应和方程式的书写
练习:氯化钡和硝酸银反应
【注意事项】
书写离子方程式应注意的问题
(1)凡不是在溶液中进行的反应一般不能写离子方程式。
如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。
2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O
△
(2)离子方程式注意两易、两等、两查
两易:即易溶易电离的物质(包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示。
两等:离子方程式两边的原子个数和电荷总数均对应相等
两查:检查各项是否都有公约数,是否漏写必要的反应条件。
【注意事项】
A 单质、气体、氧化物、水
B 弱酸(HF、H2S、HClO、H2SO3等)
C 弱碱(NH3·H2O)等难电离物质
D 难溶物(如CaCO3、FeS、BaSO4、Fe(OH)3等)
在离子方程式中写成化学式有如下几种情况:
【思考与讨论】
完成下列表中各反应化学方程式和离子方程式,思考两种方程式在表示某一类反应时候,表达的含义有什么不同,并进行讨论
反应物 化学方程式 离子方程式 两种方程式的不同
HCl+NaOH
HCl+KOH
H2SO4+NaOH
H2SO4+KOH
【思考与讨论】
启示:
① 揭示了离子反应的实质
② 不仅可表示一定物质间的某个反应,而且可表示所有同一类型的离子反应。
实质:由酸电离出来的H+与由碱电离出来的OH- 结合生成了H2O
思考:
是否所有的酸碱中和反应都可以写成H++OH-=H2O
结论:H++OH-=H2O这一离子方程式只能表示强酸和强碱生成可溶性盐和水这一类型的中和反应。
二、离子反应的条件
复分解型离子反应发生的条件
(1) 生成沉淀: Ag++Cl-=AgCl↓
(2) 生成气体: 2H+ + CO32- =H2O+CO2↑
(3) 生成水: H++OH-=H2O
思考:Zn和H2SO4置换反应是离子反应吗?离子方程式如何书写?
Zn+2H+ =Zn2++H2↑
二、离子反应的条件
(1)钾钠铵盐、硝酸盐皆可溶;
(2)氯盐不溶银、亚汞(AgCl、Hg2Cl2);
(3)硫酸盐不溶钡和铅(BaSO4、PbSO4);
(4)碳酸盐、磷酸盐只溶钾钠铵;
(5)碱类可溶钾钠铵钡。
溶解性口诀
【总结】
【分层作业】
A 组
1、判断下列物质之间能否进行离子反应
KNO3 + NaCl
Na2CO3 + H2SO4
MgO + HCl
BaCl2 + H2SO4
能
不能
能
能
【分层作业】
A 组
2.下列反应属于离子反应的是 ( )
A.H2和O2反应生成水
B.锌片投入稀硫酸中
C.KClO3加热分解制取O2
D.H2还原 CuO
想一想,什么样的反应才是离子反应呢?
B
【分层作业】
B 组
3、下列离子方程式正确的是( )
A.Cu(OH)2与稀HNO3混合 OH- + H+ = H2O
B.CaCl2与Na2CO3反应 Ca2+ + CO32- =CaCO3 ↓
C. MgO与 HCl反应 O2- + H+ =H2O
D. Ba(OH)2与稀H2SO4反应 Ba2+ + SO42-= BaSO4 ↓
B
感谢您的聆听
练习与应用:3、7、8、9
第一章 第二节
离子反应
目录
CONTENTS
第一课时 电解质的电离
第二课时 离子反应
学习目标与核心素养
第一课时 电解质的电离
【思考与讨论】
生活常识告诉我们,给电线设备通电时,湿手操作容易发生触电事故。这是为什么呢?
【实验探究】
导电
导电
导电
导电
不导电
不导电
不导电
导电
实验1-2:探究下列物质的导电性。
HCl 溶液 醋酸 溶液 NaOH 溶液 氨水 溶液 NaCl 溶液 NaCl 固体 蔗糖 溶液 乙醇
溶液
思考:NaCl溶液为什么能够导电?
思考:NaCl溶液为什么能够导电?
【实验探究】
由此可见,NaCl溶液能导电的原因是NaCl固体在H2O分子的作用下:
离解出了自由移动的 Na+和 Cl-。
【实验探究】
NaCl固体为什么不导电?熔融的NaCl能导电吗?
结论:熔融状态下, NaCl也能导电,说明熔融状态下, NaCl也电离出了自由移动的Na+和Cl-离子。
【归纳总结】
综上所述,物质能否导电,取决于:
是否存在着自由移动的带电粒子。
人的手长上有汗水(含有NaCl溶液),存在自由移动的离子。因此,湿手直接接触电源容易发生触电事故!
NaCl固体中虽然有Na+和Cl-离子,但是它们按照一定的规则紧密的排列着,不能自由移动,所以固体NaCl不导电。
一、电解质和非电解质
1、电解质:在水溶液里或熔融状态下能够导电的化合物。
2、非电解质:在水溶液里和熔融状态下都不导电的化合物。
酸、 碱、 盐、活泼金属氧化物、水等
非金属氧化物、NH3、绝大多数有机物等
如:HCl、NaOH、K2SO4、Na2O、H2O等
如:CO2、SO2、NH3、蔗糖、乙醇等
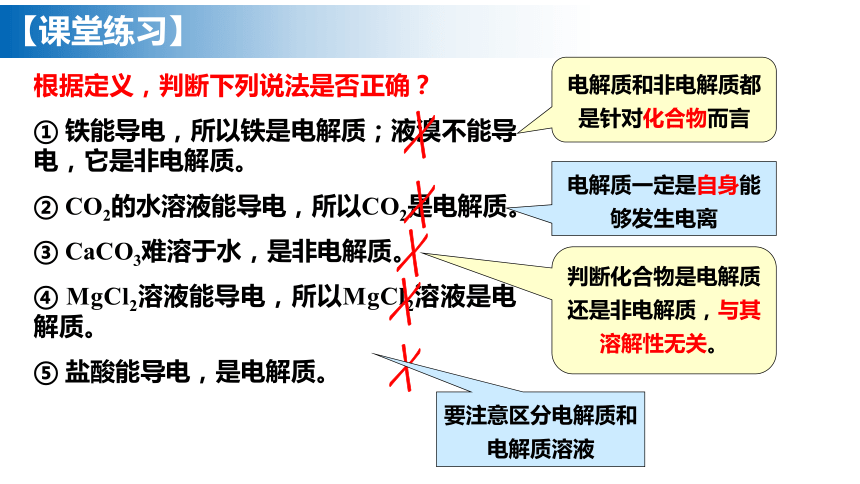
根据定义,判断下列说法是否正确?
① 铁能导电,所以铁是电解质;液溴不能导电,它是非电解质。
② CO2的水溶液能导电,所以CO2是电解质。
③ CaCO3难溶于水,是非电解质。
④ MgCl2溶液能导电,所以MgCl2溶液是电解质。
⑤ 盐酸能导电,是电解质。
【课堂练习】
电解质和非电解质都是针对化合物而言
电解质一定是自身能够发生电离
判断化合物是电解质还是非电解质,与其溶解性无关。
要注意区分电解质和电解质溶液
3、注意:
(1)电解质、非电解质都必须是化合物;
(2)电解质是化合物,而电解质溶液是混合物; (如:盐酸是电解质溶液,HCl是电解质)
(3)电解质一定是自身能电离产生离子; 在水溶液里能导电的化合物,不一定是电解质;(如:CO2、SO2、SO3、NH3属于非电解质)
(4)电解质与其溶解性无关;(如: BaSO4、AgCl 等是电解质)
(5)电解质导电需要条件:水溶液或熔融状态下。(如:电解质不一定导电,导电的物质不一定是电解质。)
一、电解质和非电解质
下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液⑧熔融状态的KNO3 ⑨葡萄糖
电解质:
非电解质:
能导电的物质:
⑨
②④⑧
①⑤⑦⑧
【课堂练习】
1、电离及电离方程式的书写
(1) 电离:在溶液中或在熔融状态下产生了自由移动的离子的过程。
水溶液中,NaCl在溶液中是以Na+ 、Cl-的形式存在的。
熔融状态下,克服了离子之间的相互作用,产生了自由移动的Na+和Cl-。
二、电离和电离方程式
(2) 电离方程式:用化学式和离子符号表示电解质电离的式子。
NaCl = Na+ + Cl-
遵守质量守恒和电荷守恒
左边:化学式 右边:离子符号
1、电离及电离方程式的书写
二、电离和电离方程式
写出下列酸的电离方程式:HCl , HNO3 , H2SO4。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
酸:电离时生成的 全部是 的化合物。
阳离子
氢离子
2、酸、碱、盐的定义
二、电离和电离方程式
(1) 写出下列碱的电离方程式:NaOH , KOH , Ba(OH)2 。
NaOH === Na+ + OH-
碱:电离时生成的 全部是 的化合物。
Ba(OH)2 === Ba2+ + 2OH-
KOH === K+ + OH-
阴离子
氢氧根离子
【思考与讨论】
(2) 请结合以上电离方程式,并参考酸的本质,从电离的角度认识碱的本质。
写出下列盐的电离方程式:NaCl , NH4Cl , NaHSO4。
NaCl === Na+ + Cl-
NH4Cl === NH4+ + Cl-
NaHSO4 === Na+ + H+ + SO42-
盐:电离时能生成 (还包括 )和
的化合物。
金属阳离子
铵根离子
酸根阴离子
【思考与讨论】
其实:酸、碱、盐在水溶液中的反应,实际上是
它们电离产生的离子之间的反应。
物质
混和物
纯净物
化合物
单质
电解质
非电解质
不是电解质,也不是非电解质
酸
碱
金属氧化物
乙醇、蔗糖等大部分
有机物
盐(醋酸铅除外)
非金属氧化物
(如CO2、SO2、SO3)
NH3
总结
总结
【方法导引】
电离
【分层作业】
A 组
2、下列状态的物质,既能导电又属于电解质的是( )
A. MgCl2 晶体 B. NaCl 溶液
C. 液态氯化氢 D. 熔融 KOH
1、下列物质属于电解质的是( )
A. 盐酸 B. CO2 C. Fe D. BaSO4
D
D
【分层作业】
B 组
1、下列电解质,溶于水时可以电离,而熔化时难以电离的是( )
A. AgCl B. NaCl C. HCl D. NaOH
2、下列物质的水溶液不能导电的是( )
A. 氯酸钾 B. 酒精 C. 食盐 D. 碳酸氢钙
C
B
第二课时 离子反应
【故事引入】
三国演义“哑泉”
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟获逃至秃龙洞,秃龙洞的毒泉中有一个“哑泉”,“人若饮之,则不能言,不过旬日必死”。不久,蜀军先锋王平率数百军士前来探路,由于天气炎热,人马均争先恐后误喝了哑泉水。军士们个个说不出话来,生命危在旦夕,诸葛亮也毫无办法。原因是什么呢?原因是士兵喝的水中含有 CuSO4 ,造成了重金属中毒。
后经一老叟指点,喝了万安溪安乐泉水后转危为安。原来该泉水中含有较多的碱(一般味苦),在人体误食CuSO4后又大量饮此泉水,其中碱先中和了胃酸,然后多余的碱又会在胃肠中与CuSO4发生离子反应Cu2++2OH-====Cu(OH)2↓。致使原来会使人体吸收的可溶性铜盐变成不溶性的Cu(OH)2沉淀而不再会被吸收,因此,具有解毒作用。
【实验探究】
实验1-3 向盛有2 mL Na2SO4溶液的试管里加入2 mLBaCl2溶液
现 象 分析 Na2SO4和BaCl2的电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
Cl-
Ba2+
Na+
Na+
Na+
Na+
Ba2+
Cl-
Cl-
Cl-
SO42-
SO42-
SO42-
SO42-
Ba2+
Ba2+
BaSO4
BaSO4
【实验探究】
实验1-3 向盛有2 mL Na2SO4溶液的试管里加入2 mLBaCl2溶液
现 象 分析 Na2SO4和BaCl2的电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
本质为:Ba2++SO42-=BaSO4↓
一、离子反应和方程式的书写
1、离子反应
定义:有离子参加或生成的反应叫离子反应。
2、离子方程式
定义:用实际参加反应的离子的符号来表示离子反应的式子叫做离子方程式
怎样书写一个离子反应的离子方程式呢?
3、离子方程式的书写步骤
写:写出正确的化学方程式(基础)
拆:把易溶于水、易电离的物质拆写成离子形式,难溶于水、难电离的物质(如水)以及气体、单质、氧化物等用化学式表示(关键)
一定要注意哦!
一、离子反应和方程式的书写
Na2SO4+BaCl2=2NaCl+BaSO4↓
2Na++SO42-+Ba2++2Cl-=2Na++2Cl-+BaSO4↓
2Na++SO42-+Ba2++2Cl-=2Na++2Cl-+BaSO4↓
删:删去方程式两边不参加反应的离子
查:① 是否符合客观规律
② 原子个数是否守恒
③ 电荷是否守恒
④ 离子的改写是否正确
一、离子反应和方程式的书写
练习:氯化钡和硝酸银反应
【注意事项】
书写离子方程式应注意的问题
(1)凡不是在溶液中进行的反应一般不能写离子方程式。
如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。
2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O
△
(2)离子方程式注意两易、两等、两查
两易:即易溶易电离的物质(包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示。
两等:离子方程式两边的原子个数和电荷总数均对应相等
两查:检查各项是否都有公约数,是否漏写必要的反应条件。
【注意事项】
A 单质、气体、氧化物、水
B 弱酸(HF、H2S、HClO、H2SO3等)
C 弱碱(NH3·H2O)等难电离物质
D 难溶物(如CaCO3、FeS、BaSO4、Fe(OH)3等)
在离子方程式中写成化学式有如下几种情况:
【思考与讨论】
完成下列表中各反应化学方程式和离子方程式,思考两种方程式在表示某一类反应时候,表达的含义有什么不同,并进行讨论
反应物 化学方程式 离子方程式 两种方程式的不同
HCl+NaOH
HCl+KOH
H2SO4+NaOH
H2SO4+KOH
【思考与讨论】
启示:
① 揭示了离子反应的实质
② 不仅可表示一定物质间的某个反应,而且可表示所有同一类型的离子反应。
实质:由酸电离出来的H+与由碱电离出来的OH- 结合生成了H2O
思考:
是否所有的酸碱中和反应都可以写成H++OH-=H2O
结论:H++OH-=H2O这一离子方程式只能表示强酸和强碱生成可溶性盐和水这一类型的中和反应。
二、离子反应的条件
复分解型离子反应发生的条件
(1) 生成沉淀: Ag++Cl-=AgCl↓
(2) 生成气体: 2H+ + CO32- =H2O+CO2↑
(3) 生成水: H++OH-=H2O
思考:Zn和H2SO4置换反应是离子反应吗?离子方程式如何书写?
Zn+2H+ =Zn2++H2↑
二、离子反应的条件
(1)钾钠铵盐、硝酸盐皆可溶;
(2)氯盐不溶银、亚汞(AgCl、Hg2Cl2);
(3)硫酸盐不溶钡和铅(BaSO4、PbSO4);
(4)碳酸盐、磷酸盐只溶钾钠铵;
(5)碱类可溶钾钠铵钡。
溶解性口诀
【总结】
【分层作业】
A 组
1、判断下列物质之间能否进行离子反应
KNO3 + NaCl
Na2CO3 + H2SO4
MgO + HCl
BaCl2 + H2SO4
能
不能
能
能
【分层作业】
A 组
2.下列反应属于离子反应的是 ( )
A.H2和O2反应生成水
B.锌片投入稀硫酸中
C.KClO3加热分解制取O2
D.H2还原 CuO
想一想,什么样的反应才是离子反应呢?
B
【分层作业】
B 组
3、下列离子方程式正确的是( )
A.Cu(OH)2与稀HNO3混合 OH- + H+ = H2O
B.CaCl2与Na2CO3反应 Ca2+ + CO32- =CaCO3 ↓
C. MgO与 HCl反应 O2- + H+ =H2O
D. Ba(OH)2与稀H2SO4反应 Ba2+ + SO42-= BaSO4 ↓
B
感谢您的聆听
练习与应用:3、7、8、9
