江苏省宿迁市2024-2025学年高三1月第一次调研测试化学试题(PDF版,含答案)
文档属性
| 名称 | 江苏省宿迁市2024-2025学年高三1月第一次调研测试化学试题(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 927.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-17 11:13:12 | ||
图片预览



文档简介
2025 届高三第一次调研测试
化学试题 2025.01
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共 6 页,包含选择题(第 1 题~第 13 题,共 13 题)、非选择题(第 14 题~第
17 题,共 4 题)两部分。本卷满分为 100 分,考试时间为 75 分钟。考试结束后,请
将答题卡或答题纸交回。
2.答题前,请您务必将自己的姓名、考试证号用 05 毫米黑色墨水的签字笔填写在答
题卡或答题纸的规定位置。
3.作答选择题,必须用 2B 铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,
请用橡皮擦干净后,再选涂其它答案。作答非选择题,必须用 0.5 毫米黑色墨水的
签字笔在答题卡或答题纸上的指定位置作答,在其它位置作答一律无效。
4.如需作图,须用 2B 铅笔绘、写清楚,线条、符号等需加黑、加粗。
可能用到的相对原子质量:H-1 Li-7 C-12 O-16 Al-27 Zn-65 In-115
一、单项选择题:共 13 题,每题 3 分,共 39 分。每题只有一个选项最符合题意。
1.材料是人类赖以生存和发展的物质基础,下列材料主要成分属于有机物的是
A.天然橡胶 B.不锈钢 C.足球烯 D.光导纤维
2.“丹砂能化为汞”出自《神农本草经》,该过程涉及化学反应:HgS+O2=Hg+SO2。下
列说法正确的是
A.S2-的结构示意图为 B.O2属于非极性分子
C.HgS 中 S 元素的化合价为-1 D.SO2 的空间构型为直线形
3.实验室进行乙酸乙酯的制备。下列相关原理、装置及操作正确的是
A.用装置甲混合乙醇与浓硫酸 B.用装置乙制备乙酸乙酯
C.用装置丙收集乙酸乙酯 D.用装置丁提纯乙酸乙酯
4.尿素 CO NH2 是一种氮肥。下列说法正确的是2
A.原子半径: r(C) r(O) B.电离能: I1(O) I1(N)
C.沸点:CH4 H2O D.酸性:H2CO3 HNO3
高三化学 第 1 页 共 6 页
阅读下列材料,完成 5~7 题:
铍及其化合物具有重要应用。铍与铝性质相似,铍铝合金可用作航空材料,BeH2是
很好的储氢材料;BeO 用于制造耐火陶瓷,晶胞结构如题 5 图所示; NH4 BeF4 固体加2
热 至 280 ℃ 得 BeF2 分 子 和 两 种 气 态 氢 化 物 ; 气 态 BeCl2 主 要 以 二 聚 体
形式存在,可与 CH3MgCl 在乙醚中制备 Be(CH3)2;Be(NO3)2 在
125°C 分解为 N2O4 和 Be4O(NO3)6 等。
5.下列说法正确的是
A.NH3键角大于 NH 4
B.BeF2为离子化合物
C.BeO -晶胞中 O2 配位数为 4
D.1 mol Be2Cl4 气体含 4mol 键
6.下列化学反应表示不.正.确.的是
A.Be 于 NaOH 溶液:Be 2OH BeO 2 2 H 2
B. BeF NH BeF 280℃2 的制备: 4 4 BeF2 2NH3 2 HF 2
C.电解 BeCl2、NaCl 混合熔融盐阴极反应: 2Cl 2e Cl2
D. Be(NO 125℃3)2的受热分解:8 Be NO3 2Be2 4O NO3 2 N2O4 O2 6
7.下列说法不.正.确.的是
A.铍铝合金低密度高强度 B.BeH2分解产生 H2
C.CH3MgCl 水解生成 CH3OH D.BeO 熔点高
8.以 LiAlCl4 为离子导体的铝一磷酸铁锂电池,该电池放电
Li+时 嵌入 Li1 xFePO4 形成 LiFePO4 ,工作原理如题 8 图所
示,下列关于电池放电时的说法不.正.确.的是
A.化学能转化为电能
B.电极 A1 作负极
C.Li+透过离子交换膜从右向左迁移
D.正极的电极反应:Li1 xFePO4 xe
xLi LiFePO4
9.化合物 Z 是一种药物的中间体,部分合成路线如下:
下列说法正确的是
A.X 分子中所有碳原子共平面 B.1 mol Y 多能与 2molH2 发生加成
C.Z 分子存在 3 个手性碳原子 D.X、Y、Z 能使 Br2 的 CCl4 溶液褪色
高三化学 第 2 页 共 6 页
10.在给定条件下,下列制备过程涉及的物质转化均可实现的是
O
A.工业制硫酸: FeS 2 SO O H O2 2 2 SO3 2 H 催化剂 2
SO4
高温
B CO.侯氏制碱法: NaCl(aq) 2 NaHCO 3
△ Na 2CO 3
C.海水中提取镁:Mg(OH) 稀盐 酸2 MgCl2 (aq)
电 解 Mg
D O O H O.工业制备硝酸: N2 2 NO 2 NO2 2 HNO放电 3
11.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 向饱和 Na2CO3溶液中通入 CO2,溶液变浑浊 NaHCO3 溶解度小于 Na2CO3
B 向等物质的量浓度的 KF 和 KSCN 混合溶液中
Fe + - -结合 3 的能力:F >SCN
滴加几滴 FeCl3溶液,振荡,溶液颜色无明显变化
C 向 AgNO3 溶液和淀粉 KI 液中分别滴加少量新 氯气与水的反应存在化学反
制氯水,前者有白色沉淀,后者溶液变蓝色 应限度
D 向淀粉溶液中加适量 20%H2SO4 溶液,加热,冷却
后加 NaOH 溶液至中性,再滴加少量碘水,溶液 淀粉未水解
变蓝
12.室温下,通过下列实验探究邻苯二甲酸氢钾( ,以 KHA 表示)溶液性质。
实验 1:用 pH 测定 0.05mol L-1KHA 溶液的 pH,测得 pH 为 4.01。
实验 2:向 10.00 mL 0.05mol L-1KHA 溶液中滴加 10.00mL 0.05 mol·L-1KOH 液。
实验 3:向 0.05 mol L-1KHA 溶液中滴加少量澄清石灰水,产生白色沉淀。
下列有关说法正确的是
A.实验 10.05 mol L-1KHA -液中:c(H2A)>c(A2 )
B.实验 2 滴加 KOH 溶液过程中水的电离程度逐渐减小
C.实验 2 所得的溶液中: c H c H2A c HA c OH
D.实验 3 中反应的离子方程式:Ca 2 2OH 2HA CaA A2 2H 2O
13.硫酸工业尾气中 SO2 可用 CO 处理并回收 S,涉及的反应有:
反应 I: SO2 (g) 3CO(g) COS(g) 2CO2 (g) H1 0
反应 I: COS(g) S(g) CO(g) H2
恒压条件下,按 n SO2 : n(CO) 1: 3 充入原料,其中 SO2 的平
衡转化率以及 COS 和 S 的平衡选择性随温度的变化如题 13
图所示。已知曲线 b 表示 COS 的平衡选择性。
生成X的物质的量
(X的平衡选择性 100% ,X 为 COS 或 S)。
转化的SO2的物质的量
下列说法不.正.确.的是
A.曲线 c 表示 S 的平衡选择性
B.△H2>0
C.1400K 下,反应SO2 (g) 2CO(g) S(g) 2CO2 (g) 的平衡常数 K=5.12
D.其它条件不变,增大体系压强 SO2的平衡转化率不变
高三化学 第 3 页 共 6 页
二、非选择题:共 4 题,共 61 分。
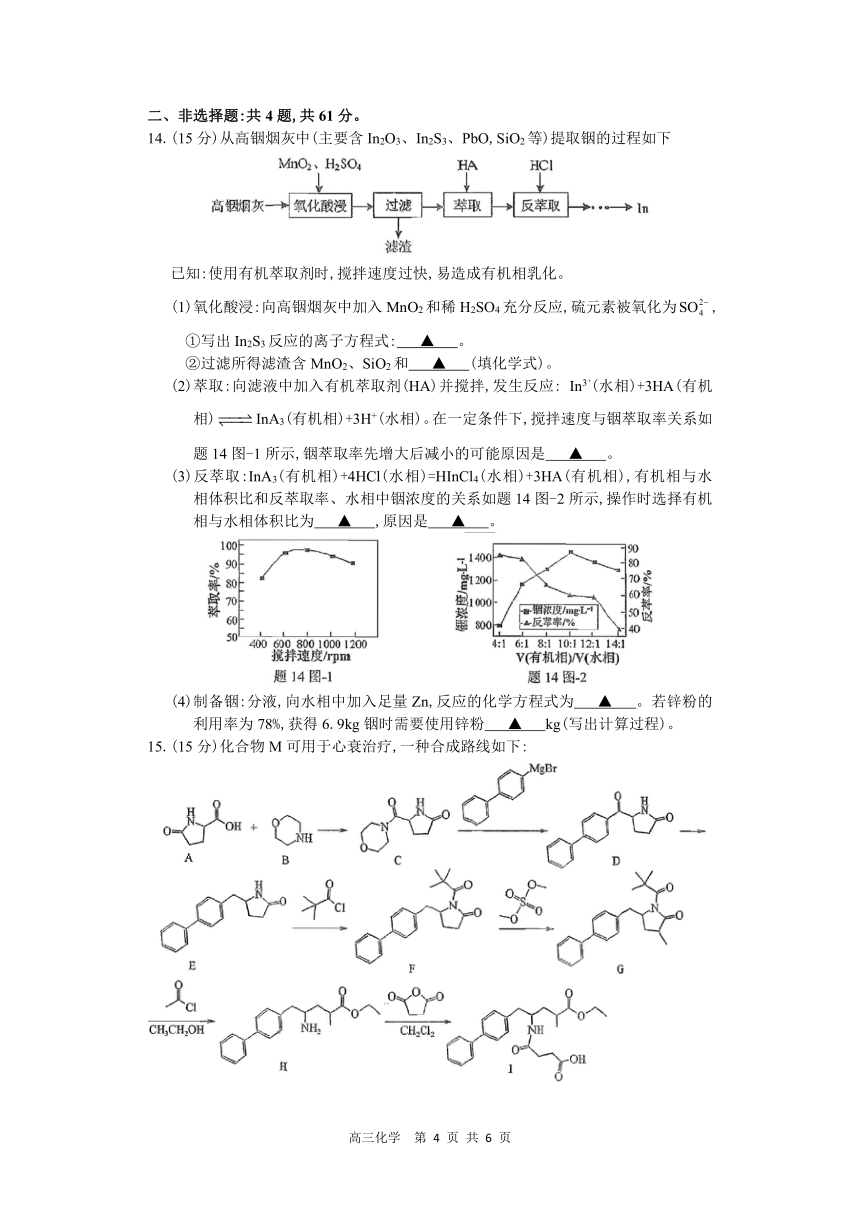
14.(15 分)从高铟烟灰中(主要含 In2O3、In2S3、PbO,SiO2等)提取铟的过程如下
已知:使用有机萃取剂时,搅拌速度过快,易造成有机相乳化。
(1)氧化酸浸:向高铟烟灰中加入 MnO2和稀 H SO 充分反应,硫元素被氧化为SO2 2 4 4 ,
①写出 In2S3 反应的离子方程式: ▲ 。
②过滤所得滤渣含 MnO2、SiO2 和 ▲ (填化学式)。
(2 +)萃取:向滤液中加入有机萃取剂(HA)并搅拌,发生反应: In3 (水相)+3HA(有机
相) InA3(有机相)+3H+(水相)。在一定条件下,搅拌速度与铟萃取率关系如
题 14 图-1 所示,铟萃取率先增大后减小的可能原因是 ▲ 。
(3)反萃取:InA3(有机相)+4HCl(水相)=HInCl4(水相)+3HA(有机相),有机相与水
相体积比和反萃取率、水相中铟浓度的关系如题 14 图-2 所示,操作时选择有机
相与水相体积比为 ▲ ,原因是 ▲ 。
(4)制备铟:分液,向水相中加入足量 Zn,反应的化学方程式为 ▲ 。若锌粉的
利用率为 78%,获得 6.9kg 铟时需要使用锌粉 ▲ kg(写出计算过程)。
15.(15 分)化合物 M 可用于心衰治疗,一种合成路线如下:
高三化学 第 4 页 共 6 页
(1)A 分子中含有的官能团为 ▲ 。
(2)B 分子中采取 sp3杂化的原子数目有 ▲ 个。
(3)E→F 的反应类型为 ▲ 。
(4)F-G 中有副产物 C24H29NO2生成,该副产物的结构简式为 ▲
(5)C 的一种同分异构体同时满足下列条件:能与 FeCl3 溶液发生显色反应,分子中
含有 4 种不同化学环境的氢原子。写出该同分异构体的结构简式: ▲ 。
(6)已知:
写出以 为原料制备 的合成路线流程图(无机试剂和有机
溶剂任用,合成路线流程图示例见本题题干)。
16.(15 分)[Co(NH3)6]Cl2可用于脱除 NO 气体及制备[Co(NH3)6]Cl3。
(1)[Co -(NH3)6]Cl2 溶液制备。在题 16 图-1 所示装置中,用 0.1molL l CoCl2 液与
0 -.1mol·L l氨水反应可制得[Co(NH3)6]Cl2 溶液。
+
①题 16 图-1 中仪器 a 的名称为 ▲ ,基态 Co2 的核外电子排布式为 ▲ 。
2
②反应Co(OH)2 6NH3 Co NH3 2OH
平衡常数 K= ▲ 。
6
2
[己知: Ksp Co(OH)2 10 14.23,Co 2 6NH3 Co NH
.
3 平衡常数 K=105 11]6
+
(2)脱除 NO 气体。已知:[Co(NH3)6]2 对 NO +吸收能力很强,而[Co(NH3)6]3 对 NO
的 吸 收 能 力 极 低 ; 脱 除 NO 气 体 总 反 应 式 为
2 3
4 Co NH3 2NO 2O
6 2
H2O 4 Co NH3 2OH NO3 NO 。6 2
①实验得到 NO 脱除率与温度、时间变化如题 16 图-2 所示;NO 脱除率随温度、
时间变化的原因为 ▲ 。
②钴氨溶液经过多次循环吸收 NO 后,其吸收 NO 的能力会降低,向钴氨溶液中加入
KI 溶液可恢复其吸收 NO 的能力,写出该反应的离子方程式: ▲ 。
(3)[Co(NH3)6]Cl3晶体制备。已知:[Co(NH3)6]Cl3晶体易溶于热水和稀盐酸中,在
冰水、浓盐酸、无水乙醇中溶解度较小。
请补充完整实验方案:在通风橱中将制得的[Co(NH3)6]Cl2液加热至55℃左
右,边搅拌边加入适量 NH4Cl,再加入 ▲ ,低温烘干,得到[Co(NH3)6]Cl3
晶体。(实验中须使用:4%H2O2 溶液、红色石蕊试纸、冰水、浓盐酸、无水乙醇)
高三化学 第 5 页 共 6 页
17.(16 分)CO2 的催化加氢反应可以产生多种高附加值产品,如甲醇、碳氢化合物等。
I.由 CO2制碳氢化合物的过程如题 17 图-1 所示。
(1)涉及部分反应:
CO2(g)+H —2(g)=CO(g)+H2O(g) △H=39.7 KJ mol 1
CO(g)+2H2(g)=-(CH2)-(g)+H2O(g) △H=-164.7 KJ mol—1
2CO(g)+H2(g)=-(CH —2)-(g)+CO2(g) △H= ▲ KJ mol 1
(2)催化剂可使用铁基催化剂。
①方铁矿 Fe1 xO 可用作催化剂,当 x=0.05 时,晶体中 n Fe2 : n Fe3 为
▲ 。
②地球化学研究发现,地幔层(温度 1000℃~1300℃)中磁铁矿与石墨矿会转化为
方铁矿,该反应的化学方程式为 ▲ 。
Ⅱ.电催化 CO2 还原制备碳氢化合物,其装置原理如题 17
图-2 所示。
(3)电池工作过程中,阴极生成 C3H6 的电极反应式为
▲ 。
(4)每转移 2mol 电子,阳极室溶液质量减少 ▲ g。
Ⅲ.把 ZnZrOx 附着在分子筛 SSZ-13 上,可催化 CO、H2生成 CH3OH 及碳氢化合物,
部分反应机理如题 17 图-3 所示。催化剂中 n(Zn)/n(Zr)、CO 转化率、烃的选
择性关系如题 17 图-4 所示。
(5)n(Zn)/n(Zr)大于 1 后,CO 转化率降低的可能原因为 ▲ 。
(6)随 n(Zn)/n(Zr)增加,烯烃选择性减少,烷烃增加的可能原因为 ▲ 。
高三化学 第 6 页 共 6 页
2024~2025 年度高三年级
化学试题参考答案和评分标准
说明:学生解答主观性试题时,使用与本答案不同的其它合理答案的也给分。
单项选择题:共 39 分。每小题 3 分。每小题只有一个选项符合题意。
1.A 2.B 3.B 4.A 5.C 6.C 7.C 8.D 9.D 10.A
11.B 12.D 13.D
非选择题:共 61 分。
14.共 15 分
(1)①In2S3 + 12MnO2 + 24H+= 2In3+ + 12Mn2+ + 3SO42- + 12H2O(3 分)
(化学式 2 分,配平 1 分)
②PbSO4 (2 分)
(2)搅拌速度增大,有机相和水相的接触面积增大,提高萃取率;但搅拌速度过快,
容易造成有机相的乳化,进入有机层的铟离子减少,导致铟的萃取率降低(3
分)
(答对一点给 2 分,全对得 3 分)
(3)4:1(1 分) 反萃取率最高 (2 分)
(4)4Zn + 2HInCl4= 2In + 4ZnCl2 + H2↑ (2 分)
(化学式 1 分,配平 1 分,气体符号暂不扣分)
解:2n(Zn)~n(In)
(1分)
(1 分)(共 2
分)
15.共 15 分
(1)羧基、酰胺基(2 分,错字不得分) (2)6(2 分) (3)取代反应(2 分)
(4) (2 分) (5) 或 (2 分)
(6)
(5 分,一步 1 分,物质错从该步熔断,条件错或者漏写扣 1 分)
或
高三化学 第 7 页 共 6 页
(5 分)
(5 分,一步 1 分,4 步都对得 5 分,物质错从该步熔断,条件错或者漏写扣 1 分;若
有机合成路线都对,其中有条件错或者漏写,则得 3 分)
16.(15 分)
(1) ①分液漏斗(或滴液漏斗)(2 分) [Ar]3d7(2 分)
② 10 9.12(2 分)
(2) ① 温度升高,NO、O2 的溶解度下降,NO 脱除率下降;随着时间的延长
[Co(NH3)6]2+
转化为[Co(NH3)6]3+,而[Co(NH3)6]3+对 NO 的吸收能力极低,NO 脱除率下降。
(3 分)(答对一点给 2 分,全对得 3 分)
②2[Co(NH3)6]3++ 2I = 2[Co(NH3)6]2++ I2(2 分)
(化学式 1 分,配平 1 分)
(3) 4% H2O2 溶液至产生的气体不能使湿润的红色石蕊试纸变蓝(1 分),冰水
浴冷却(1 分),再加入浓盐酸(无水乙醇)至有大量晶体析出(1 分),过
滤,用无水乙醇洗涤 2-3 次(1 分)(共 4 分,其它合理答案也给分)
17.(16 分)
Ⅰ.(1)—204.4(2 分)
(2)①8.5(2 分)(只要计算数值等于 8.5 均得分)
1000~1300℃
② (1-x)Fe3O4 + (1-4x)C ============ 3Fe1-xO + (1-4x)CO (3 分)
(化学式 1 分,配平 1 分,条件 1 分)
Ⅱ.(3)3CO2 + 18H+ + 18e- = C3H6 + 6H2O (3 分,只要有错就不得分)
(4)18(2 分)
Ⅲ.(5)Zr 含量减少,吸附的 CO 量减少,CO 转化率降低(2 分)
(6)随 Zn 的量增多,吸附 H2 的量增多,产生 H+、H 增多,与烯烃反应,
使烷烃量增加,烯烃量减少。(2 分)
高三化学 第 8 页 共 6 页
化学试题 2025.01
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共 6 页,包含选择题(第 1 题~第 13 题,共 13 题)、非选择题(第 14 题~第
17 题,共 4 题)两部分。本卷满分为 100 分,考试时间为 75 分钟。考试结束后,请
将答题卡或答题纸交回。
2.答题前,请您务必将自己的姓名、考试证号用 05 毫米黑色墨水的签字笔填写在答
题卡或答题纸的规定位置。
3.作答选择题,必须用 2B 铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,
请用橡皮擦干净后,再选涂其它答案。作答非选择题,必须用 0.5 毫米黑色墨水的
签字笔在答题卡或答题纸上的指定位置作答,在其它位置作答一律无效。
4.如需作图,须用 2B 铅笔绘、写清楚,线条、符号等需加黑、加粗。
可能用到的相对原子质量:H-1 Li-7 C-12 O-16 Al-27 Zn-65 In-115
一、单项选择题:共 13 题,每题 3 分,共 39 分。每题只有一个选项最符合题意。
1.材料是人类赖以生存和发展的物质基础,下列材料主要成分属于有机物的是
A.天然橡胶 B.不锈钢 C.足球烯 D.光导纤维
2.“丹砂能化为汞”出自《神农本草经》,该过程涉及化学反应:HgS+O2=Hg+SO2。下
列说法正确的是
A.S2-的结构示意图为 B.O2属于非极性分子
C.HgS 中 S 元素的化合价为-1 D.SO2 的空间构型为直线形
3.实验室进行乙酸乙酯的制备。下列相关原理、装置及操作正确的是
A.用装置甲混合乙醇与浓硫酸 B.用装置乙制备乙酸乙酯
C.用装置丙收集乙酸乙酯 D.用装置丁提纯乙酸乙酯
4.尿素 CO NH2 是一种氮肥。下列说法正确的是2
A.原子半径: r(C) r(O) B.电离能: I1(O) I1(N)
C.沸点:CH4 H2O D.酸性:H2CO3 HNO3
高三化学 第 1 页 共 6 页
阅读下列材料,完成 5~7 题:
铍及其化合物具有重要应用。铍与铝性质相似,铍铝合金可用作航空材料,BeH2是
很好的储氢材料;BeO 用于制造耐火陶瓷,晶胞结构如题 5 图所示; NH4 BeF4 固体加2
热 至 280 ℃ 得 BeF2 分 子 和 两 种 气 态 氢 化 物 ; 气 态 BeCl2 主 要 以 二 聚 体
形式存在,可与 CH3MgCl 在乙醚中制备 Be(CH3)2;Be(NO3)2 在
125°C 分解为 N2O4 和 Be4O(NO3)6 等。
5.下列说法正确的是
A.NH3键角大于 NH 4
B.BeF2为离子化合物
C.BeO -晶胞中 O2 配位数为 4
D.1 mol Be2Cl4 气体含 4mol 键
6.下列化学反应表示不.正.确.的是
A.Be 于 NaOH 溶液:Be 2OH BeO 2 2 H 2
B. BeF NH BeF 280℃2 的制备: 4 4 BeF2 2NH3 2 HF 2
C.电解 BeCl2、NaCl 混合熔融盐阴极反应: 2Cl 2e Cl2
D. Be(NO 125℃3)2的受热分解:8 Be NO3 2Be2 4O NO3 2 N2O4 O2 6
7.下列说法不.正.确.的是
A.铍铝合金低密度高强度 B.BeH2分解产生 H2
C.CH3MgCl 水解生成 CH3OH D.BeO 熔点高
8.以 LiAlCl4 为离子导体的铝一磷酸铁锂电池,该电池放电
Li+时 嵌入 Li1 xFePO4 形成 LiFePO4 ,工作原理如题 8 图所
示,下列关于电池放电时的说法不.正.确.的是
A.化学能转化为电能
B.电极 A1 作负极
C.Li+透过离子交换膜从右向左迁移
D.正极的电极反应:Li1 xFePO4 xe
xLi LiFePO4
9.化合物 Z 是一种药物的中间体,部分合成路线如下:
下列说法正确的是
A.X 分子中所有碳原子共平面 B.1 mol Y 多能与 2molH2 发生加成
C.Z 分子存在 3 个手性碳原子 D.X、Y、Z 能使 Br2 的 CCl4 溶液褪色
高三化学 第 2 页 共 6 页
10.在给定条件下,下列制备过程涉及的物质转化均可实现的是
O
A.工业制硫酸: FeS 2 SO O H O2 2 2 SO3 2 H 催化剂 2
SO4
高温
B CO.侯氏制碱法: NaCl(aq) 2 NaHCO 3
△ Na 2CO 3
C.海水中提取镁:Mg(OH) 稀盐 酸2 MgCl2 (aq)
电 解 Mg
D O O H O.工业制备硝酸: N2 2 NO 2 NO2 2 HNO放电 3
11.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 向饱和 Na2CO3溶液中通入 CO2,溶液变浑浊 NaHCO3 溶解度小于 Na2CO3
B 向等物质的量浓度的 KF 和 KSCN 混合溶液中
Fe + - -结合 3 的能力:F >SCN
滴加几滴 FeCl3溶液,振荡,溶液颜色无明显变化
C 向 AgNO3 溶液和淀粉 KI 液中分别滴加少量新 氯气与水的反应存在化学反
制氯水,前者有白色沉淀,后者溶液变蓝色 应限度
D 向淀粉溶液中加适量 20%H2SO4 溶液,加热,冷却
后加 NaOH 溶液至中性,再滴加少量碘水,溶液 淀粉未水解
变蓝
12.室温下,通过下列实验探究邻苯二甲酸氢钾( ,以 KHA 表示)溶液性质。
实验 1:用 pH 测定 0.05mol L-1KHA 溶液的 pH,测得 pH 为 4.01。
实验 2:向 10.00 mL 0.05mol L-1KHA 溶液中滴加 10.00mL 0.05 mol·L-1KOH 液。
实验 3:向 0.05 mol L-1KHA 溶液中滴加少量澄清石灰水,产生白色沉淀。
下列有关说法正确的是
A.实验 10.05 mol L-1KHA -液中:c(H2A)>c(A2 )
B.实验 2 滴加 KOH 溶液过程中水的电离程度逐渐减小
C.实验 2 所得的溶液中: c H c H2A c HA c OH
D.实验 3 中反应的离子方程式:Ca 2 2OH 2HA CaA A2 2H 2O
13.硫酸工业尾气中 SO2 可用 CO 处理并回收 S,涉及的反应有:
反应 I: SO2 (g) 3CO(g) COS(g) 2CO2 (g) H1 0
反应 I: COS(g) S(g) CO(g) H2
恒压条件下,按 n SO2 : n(CO) 1: 3 充入原料,其中 SO2 的平
衡转化率以及 COS 和 S 的平衡选择性随温度的变化如题 13
图所示。已知曲线 b 表示 COS 的平衡选择性。
生成X的物质的量
(X的平衡选择性 100% ,X 为 COS 或 S)。
转化的SO2的物质的量
下列说法不.正.确.的是
A.曲线 c 表示 S 的平衡选择性
B.△H2>0
C.1400K 下,反应SO2 (g) 2CO(g) S(g) 2CO2 (g) 的平衡常数 K=5.12
D.其它条件不变,增大体系压强 SO2的平衡转化率不变
高三化学 第 3 页 共 6 页
二、非选择题:共 4 题,共 61 分。
14.(15 分)从高铟烟灰中(主要含 In2O3、In2S3、PbO,SiO2等)提取铟的过程如下
已知:使用有机萃取剂时,搅拌速度过快,易造成有机相乳化。
(1)氧化酸浸:向高铟烟灰中加入 MnO2和稀 H SO 充分反应,硫元素被氧化为SO2 2 4 4 ,
①写出 In2S3 反应的离子方程式: ▲ 。
②过滤所得滤渣含 MnO2、SiO2 和 ▲ (填化学式)。
(2 +)萃取:向滤液中加入有机萃取剂(HA)并搅拌,发生反应: In3 (水相)+3HA(有机
相) InA3(有机相)+3H+(水相)。在一定条件下,搅拌速度与铟萃取率关系如
题 14 图-1 所示,铟萃取率先增大后减小的可能原因是 ▲ 。
(3)反萃取:InA3(有机相)+4HCl(水相)=HInCl4(水相)+3HA(有机相),有机相与水
相体积比和反萃取率、水相中铟浓度的关系如题 14 图-2 所示,操作时选择有机
相与水相体积比为 ▲ ,原因是 ▲ 。
(4)制备铟:分液,向水相中加入足量 Zn,反应的化学方程式为 ▲ 。若锌粉的
利用率为 78%,获得 6.9kg 铟时需要使用锌粉 ▲ kg(写出计算过程)。
15.(15 分)化合物 M 可用于心衰治疗,一种合成路线如下:
高三化学 第 4 页 共 6 页
(1)A 分子中含有的官能团为 ▲ 。
(2)B 分子中采取 sp3杂化的原子数目有 ▲ 个。
(3)E→F 的反应类型为 ▲ 。
(4)F-G 中有副产物 C24H29NO2生成,该副产物的结构简式为 ▲
(5)C 的一种同分异构体同时满足下列条件:能与 FeCl3 溶液发生显色反应,分子中
含有 4 种不同化学环境的氢原子。写出该同分异构体的结构简式: ▲ 。
(6)已知:
写出以 为原料制备 的合成路线流程图(无机试剂和有机
溶剂任用,合成路线流程图示例见本题题干)。
16.(15 分)[Co(NH3)6]Cl2可用于脱除 NO 气体及制备[Co(NH3)6]Cl3。
(1)[Co -(NH3)6]Cl2 溶液制备。在题 16 图-1 所示装置中,用 0.1molL l CoCl2 液与
0 -.1mol·L l氨水反应可制得[Co(NH3)6]Cl2 溶液。
+
①题 16 图-1 中仪器 a 的名称为 ▲ ,基态 Co2 的核外电子排布式为 ▲ 。
2
②反应Co(OH)2 6NH3 Co NH3 2OH
平衡常数 K= ▲ 。
6
2
[己知: Ksp Co(OH)2 10 14.23,Co 2 6NH3 Co NH
.
3 平衡常数 K=105 11]6
+
(2)脱除 NO 气体。已知:[Co(NH3)6]2 对 NO +吸收能力很强,而[Co(NH3)6]3 对 NO
的 吸 收 能 力 极 低 ; 脱 除 NO 气 体 总 反 应 式 为
2 3
4 Co NH3 2NO 2O
6 2
H2O 4 Co NH3 2OH NO3 NO 。6 2
①实验得到 NO 脱除率与温度、时间变化如题 16 图-2 所示;NO 脱除率随温度、
时间变化的原因为 ▲ 。
②钴氨溶液经过多次循环吸收 NO 后,其吸收 NO 的能力会降低,向钴氨溶液中加入
KI 溶液可恢复其吸收 NO 的能力,写出该反应的离子方程式: ▲ 。
(3)[Co(NH3)6]Cl3晶体制备。已知:[Co(NH3)6]Cl3晶体易溶于热水和稀盐酸中,在
冰水、浓盐酸、无水乙醇中溶解度较小。
请补充完整实验方案:在通风橱中将制得的[Co(NH3)6]Cl2液加热至55℃左
右,边搅拌边加入适量 NH4Cl,再加入 ▲ ,低温烘干,得到[Co(NH3)6]Cl3
晶体。(实验中须使用:4%H2O2 溶液、红色石蕊试纸、冰水、浓盐酸、无水乙醇)
高三化学 第 5 页 共 6 页
17.(16 分)CO2 的催化加氢反应可以产生多种高附加值产品,如甲醇、碳氢化合物等。
I.由 CO2制碳氢化合物的过程如题 17 图-1 所示。
(1)涉及部分反应:
CO2(g)+H —2(g)=CO(g)+H2O(g) △H=39.7 KJ mol 1
CO(g)+2H2(g)=-(CH2)-(g)+H2O(g) △H=-164.7 KJ mol—1
2CO(g)+H2(g)=-(CH —2)-(g)+CO2(g) △H= ▲ KJ mol 1
(2)催化剂可使用铁基催化剂。
①方铁矿 Fe1 xO 可用作催化剂,当 x=0.05 时,晶体中 n Fe2 : n Fe3 为
▲ 。
②地球化学研究发现,地幔层(温度 1000℃~1300℃)中磁铁矿与石墨矿会转化为
方铁矿,该反应的化学方程式为 ▲ 。
Ⅱ.电催化 CO2 还原制备碳氢化合物,其装置原理如题 17
图-2 所示。
(3)电池工作过程中,阴极生成 C3H6 的电极反应式为
▲ 。
(4)每转移 2mol 电子,阳极室溶液质量减少 ▲ g。
Ⅲ.把 ZnZrOx 附着在分子筛 SSZ-13 上,可催化 CO、H2生成 CH3OH 及碳氢化合物,
部分反应机理如题 17 图-3 所示。催化剂中 n(Zn)/n(Zr)、CO 转化率、烃的选
择性关系如题 17 图-4 所示。
(5)n(Zn)/n(Zr)大于 1 后,CO 转化率降低的可能原因为 ▲ 。
(6)随 n(Zn)/n(Zr)增加,烯烃选择性减少,烷烃增加的可能原因为 ▲ 。
高三化学 第 6 页 共 6 页
2024~2025 年度高三年级
化学试题参考答案和评分标准
说明:学生解答主观性试题时,使用与本答案不同的其它合理答案的也给分。
单项选择题:共 39 分。每小题 3 分。每小题只有一个选项符合题意。
1.A 2.B 3.B 4.A 5.C 6.C 7.C 8.D 9.D 10.A
11.B 12.D 13.D
非选择题:共 61 分。
14.共 15 分
(1)①In2S3 + 12MnO2 + 24H+= 2In3+ + 12Mn2+ + 3SO42- + 12H2O(3 分)
(化学式 2 分,配平 1 分)
②PbSO4 (2 分)
(2)搅拌速度增大,有机相和水相的接触面积增大,提高萃取率;但搅拌速度过快,
容易造成有机相的乳化,进入有机层的铟离子减少,导致铟的萃取率降低(3
分)
(答对一点给 2 分,全对得 3 分)
(3)4:1(1 分) 反萃取率最高 (2 分)
(4)4Zn + 2HInCl4= 2In + 4ZnCl2 + H2↑ (2 分)
(化学式 1 分,配平 1 分,气体符号暂不扣分)
解:2n(Zn)~n(In)
(1分)
(1 分)(共 2
分)
15.共 15 分
(1)羧基、酰胺基(2 分,错字不得分) (2)6(2 分) (3)取代反应(2 分)
(4) (2 分) (5) 或 (2 分)
(6)
(5 分,一步 1 分,物质错从该步熔断,条件错或者漏写扣 1 分)
或
高三化学 第 7 页 共 6 页
(5 分)
(5 分,一步 1 分,4 步都对得 5 分,物质错从该步熔断,条件错或者漏写扣 1 分;若
有机合成路线都对,其中有条件错或者漏写,则得 3 分)
16.(15 分)
(1) ①分液漏斗(或滴液漏斗)(2 分) [Ar]3d7(2 分)
② 10 9.12(2 分)
(2) ① 温度升高,NO、O2 的溶解度下降,NO 脱除率下降;随着时间的延长
[Co(NH3)6]2+
转化为[Co(NH3)6]3+,而[Co(NH3)6]3+对 NO 的吸收能力极低,NO 脱除率下降。
(3 分)(答对一点给 2 分,全对得 3 分)
②2[Co(NH3)6]3++ 2I = 2[Co(NH3)6]2++ I2(2 分)
(化学式 1 分,配平 1 分)
(3) 4% H2O2 溶液至产生的气体不能使湿润的红色石蕊试纸变蓝(1 分),冰水
浴冷却(1 分),再加入浓盐酸(无水乙醇)至有大量晶体析出(1 分),过
滤,用无水乙醇洗涤 2-3 次(1 分)(共 4 分,其它合理答案也给分)
17.(16 分)
Ⅰ.(1)—204.4(2 分)
(2)①8.5(2 分)(只要计算数值等于 8.5 均得分)
1000~1300℃
② (1-x)Fe3O4 + (1-4x)C ============ 3Fe1-xO + (1-4x)CO (3 分)
(化学式 1 分,配平 1 分,条件 1 分)
Ⅱ.(3)3CO2 + 18H+ + 18e- = C3H6 + 6H2O (3 分,只要有错就不得分)
(4)18(2 分)
Ⅲ.(5)Zr 含量减少,吸附的 CO 量减少,CO 转化率降低(2 分)
(6)随 Zn 的量增多,吸附 H2 的量增多,产生 H+、H 增多,与烯烃反应,
使烷烃量增加,烯烃量减少。(2 分)
高三化学 第 8 页 共 6 页
同课章节目录
