第三章第四节羧酸第二课时 课件 (共27张PPT) 2024-2025学年人教版(2019)高中化学选择性必修3
文档属性
| 名称 | 第三章第四节羧酸第二课时 课件 (共27张PPT) 2024-2025学年人教版(2019)高中化学选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 32.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-17 16:59:20 | ||
图片预览






文档简介
(共27张PPT)
第三章 烃的衍生物
第四节 羧酸 羧酸衍生物
第二课时 酯
学习目标
1、了解酯类化合物的结构特点,掌握酯类化合物的化学性质。
2、通过探究乙酸乙酯的水解,熟悉控制变量法的应用,体验科学探究的一般过程。
羧酸衍生物是羧酸分子中羧基上的羟基被其他原子或原子团取代后的生成物,如乙酸分子中羧基上的羟基被乙氧基(—OCH2CH3)取代后生成的乙酸乙酯,被氨基(—NH2)取代后生成的乙酰胺。
R-C-
O
=
酰基
R-C-OR
O
=
R-C-X
O
=
R-C-NH2
O
=
酰卤
酯
酰胺
R—C—O—
O
=
C—R
O
=
酸酐
新课引入:
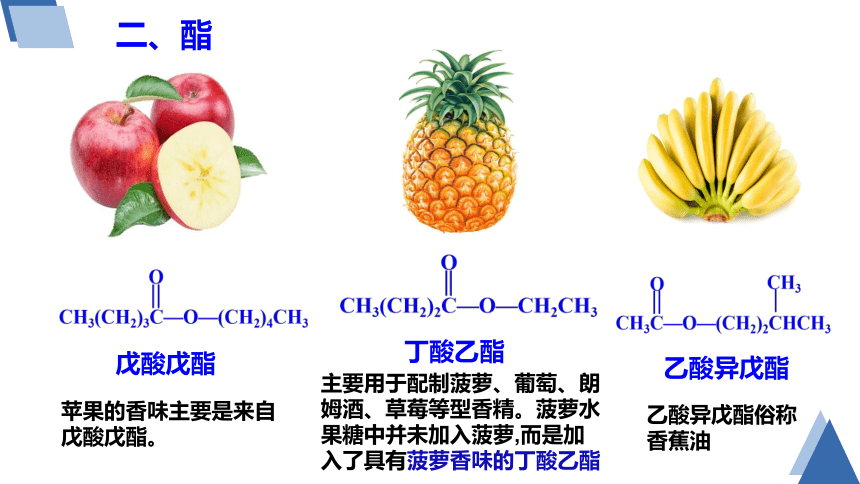
苹果的香味主要是来自戊酸戊酯。
丁酸乙酯
乙酸异戊酯
戊酸戊酯
主要用于配制菠萝、葡萄、朗姆酒、草莓等型香精。菠萝水果糖中并未加入菠萝,而是加入了具有菠萝香味的丁酸乙酯
乙酸异戊酯俗称香蕉油
二、酯
1.酯的组成、结构
(1)定义:酯是羧酸分子羧基中的-OH被-OR ’取代后的产物。
(2)官能团:酯基,符号是—COO—或
饱和一元酯通式:
与碳原子数相同的饱和一元羧酸互为同分异构体
CnH2nO2(n≥2)
(3)饱和一元羧酸和饱和一元醇反应生成饱和一元酯
或R(H)COOR'
OR’
R(H)
羧酸酯可表示为:
其中R和R'可以相同,也可以不同。R'只能是烃基
戊酸戊酯
CH3(CH2)3C—O—(CH2)4CH3
O
丁酸乙酯
CH3(CH2)2C—O—CH2CH3
O
乙酸异戊酯
CH3C—O—(CH2)2CHCH3
O
CH3
2.酯的命名
根据生成酯的酸和醇的名称来命名,称为某酸某酯。
CH3COOC2H5
乙酸乙酯
(1)(CH3)2CHCOOCH3
(2)HCOOCH(CH3)2
异丁酸甲酯
甲酸异丙酯
丙酸乙酯
(3)CH3CH2COOCH2CH3
课堂练习1:写出下列物质的名称:
(4)CH3CH2O—NO2
硝酸乙酯
苯甲酸甲酯
甲酸苯甲酯
COOCH3
(5)
(6)
CH2OOCH
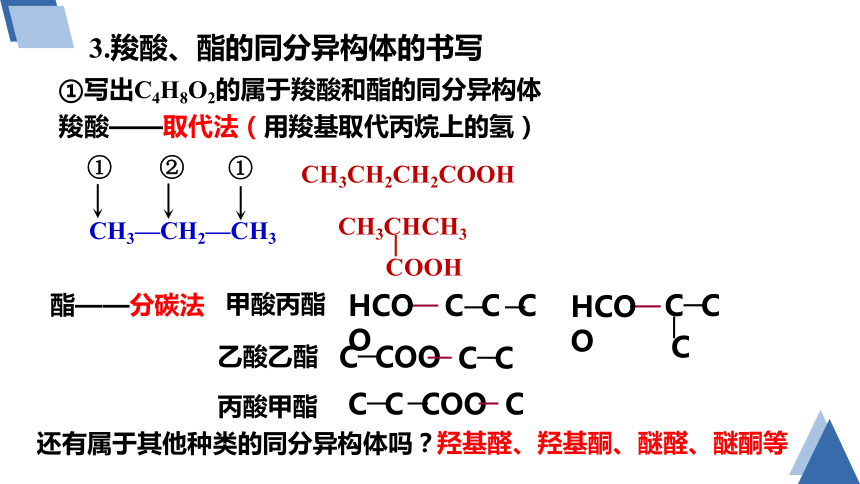
3.羧酸、酯的同分异构体的书写
①写出C4H8O2的属于羧酸和酯的同分异构体
羧酸——取代法(用羧基取代丙烷上的氢)
CH3—CH2—CH3
①
①
②
CH3CH2CH2COOH
CH3CHCH3
COOH
酯——分碳法
甲酸丙酯
乙酸乙酯
丙酸甲酯
HCOO
C C C
HCOO
C C
C
C COO
C C
C C COO
C
还有属于其他种类的同分异构体吗?
羟基醛、羟基酮、醚醛、醚酮等
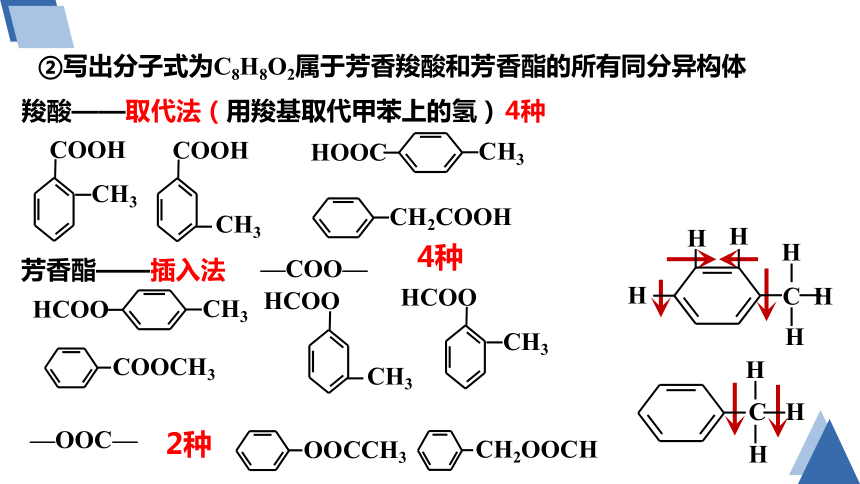
②写出分子式为C8H8O2属于芳香羧酸和芳香酯的所有同分异构体
4种
羧酸——取代法(用羧基取代甲苯上的氢)
芳香酯——插入法
—COO—
—OOC—
4种
2种
C H
H
H
H
H
H
C H
H
H
CH3
HOOC
CH3
COOH
CH3
COOH
CH2COOH
CH3
HCOO
COOCH3
CH3
HCOO
CH3
HCOO
OOCCH3
CH2OOCH
课堂练习2:分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
A. 15种 B. 28种 C. 32种 D.40种
D
HCOO—C4H9(4种)
CH3COO—C3H7
C2H5COO—C2H5
C3H7COO—CH3
C5H10O2的酯
(2种)
(2种)
水解生成5种羧酸和8种醇。
4.物理性质
低级酯(如乙酸乙酯)具有一定的挥发性,有芳香气味的液体。
一般不溶于水,易溶于有机溶剂,密度一般小于水。
5.用途
(1)用作香料,如作饮料、糖果、化妆品等中的香料。
(2)用作有机溶剂,如作指甲油、胶水的溶剂。
6.存在
酯类广泛存在于自然界,低级酯是有芳香气味的液体,存在于各种水果和花草中。
乙酸和乙醇反应生成乙酸乙酯的化学方程式:
7.酯的化学性质
酯的重要化学性质之一是可以发生水解反应,生成相应的酸和醇。
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓硫酸
△
探究 乙酸乙酯的水解
【问题】乙酸乙酯水解的速率与反应条件有着怎样的关系呢?
影响速率的外界条件:浓度、温度、催化剂、溶液的酸碱性。
研究方法——控制变量法
可逆反应
【设计与实验】请你设计实验,探究乙酸乙酯在中性、酸性和碱性溶液中,以及不同温度下的水解速率。(提示:可以通过酯层消失的时间差异来判断乙酸乙酯在不同条件下水解速率的差别。)实验方案与步骤:
实验步骤 a. 分别取6滴乙酸乙酯放入3支试管中,然后向3支试管中分别加入等体积的水、稀硫酸、氢氧化钠溶液
b. 振荡均匀后,把3支试管都放入70~80 ℃的水浴里加热,记录酯层消失和酯香味消失的时间
实验现象
实验结论
①酸碱性对酯的水解的影响:
加水的试管中酯层基本不变
酯层消失时间:加入稀硫酸的试管大于加入氢氧化钠溶液的试管
乙酸乙酯在酸性和碱性条件下发生水解,在碱性条件下水解更快,更彻底
②温度对酯的水解的影响:
实验步骤 a. 分别取6滴乙酸乙酯放入2支试管中,然后向试管中分别加入等量的氢氧化钠溶液
b. 振荡均匀后,把2支试管分别放入50~60 ℃、70~80 ℃的水浴里加热
实验现象
实验结论
温度高的试管酯层消失得更快
温度越高,乙酸乙酯的水解速率越大
⑴酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解; 在强碱的溶液中酯水解趋于完全。
⑵温度越高,酯水解程度越大。
(水解反应是吸热反应)
酯的水解规律:
【讨论】(1)根据化学平衡移动原理,解释乙酸乙酯在碱性条件下发生的水解反应是不可逆的。
(2)控制实验条件是科学研究中的重要方法,通过乙酸乙酯水解条件的探究,你对这一方法有何体会?
乙酸乙酯水解生成乙酸,碱中和乙酸,使生成物浓度减少,促进平衡正向移动,反应趋于完全,所以不可逆。
控制实验条件如增加反应物浓度,使用催化剂、加热等可以加快反应速率;将生成物通过反应转化成其他物质,可以使平衡正向移动,甚至可以使反应进行完全。
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
酯在无机酸或碱存在条件下,均能发生水解反应。在酸性条件下水解是可逆的,
在碱性条件下水解是不可逆的,可完全水解,水解速率较快。
酯+H2O 酸+醇
无机酸
△
酯+H2O 羧酸盐+醇
无机碱
△
7.酯的化学性质——水解反应
8.酯的制备:“形形色色”的酯化反应
(1)生成链状酯
①一元羧酸与一元醇的酯化反应
②一元羧酸与二元醇或二元羧酸与一元醇的酯化反应
2 2
③无机含氧酸和醇的酯化反应
硝化甘油
(2)生成环状酯
①二元羧酸与二元醇的酯化反应
②羟基酸自身分子间酯化反应
③羟基酸分子内脱水生成酯
(3)生成聚酯
①二元羧酸与二元醇的缩聚反应
n HO CH2 CH2 OH + n HOOC COOH
H O CH2 CH2 O C C OH
n
O
O
+ (2n 1) H2O
②羟基酸自身缩聚反应
n CH3 CH COOH
OH
H O CH C OH
n
O
CH3
+ (n 1)H2O
缩聚反应:由单体分子间通过缩合反应生成高分子的反应
课堂练习3:写出在酸或碱存在的条件下的反应方程式
①
CH3COOCH3 +NaOH
CH3COOCH3 +H2O
稀硫酸
△
CH3OH+CH3COOH
CH3OH+CH3COONa
△
稀硫酸
△
COOC2H5
COOC2H5
+ H2O
③
COOH
COOH
+ CH3CH2OH
2
2
CH2OOCCH3
CH2OOCCH3
+ NaOH
△
2
CH2OH
CH2OH
+ CH3COONa
2
②
④
OOCH
+ NaOH
ONa
+ HCOONa+H2O
△
2
酯化反应 酯的水解
反应关系 催化剂
催化剂的其他作用
反应类型
加热类型
酯化反应和酯水解反应的比较
浓H2SO4
稀H2SO4或NaOH溶液
吸水,提高乙酸和乙醇的转化率
NaOH中和酯水解生成的乙酸,提高酯的水解率
酯化反应,取代反应
水解反应,取代反应
酒精灯火焰加热
热水浴加热
课堂练习4:对下列有机物 的叙述不正确的是( )
A.常温下能与Na2CO3反应放出CO2
B. 0.5mol该有机物与NaOH溶液完全反应需消耗4mol NaOH
C.与稀H2SO4共热生成两种有机物
D.该物质的化学式为C14H10O9
C
O
C
HO
HO
HO
OH
COOH
OH
O
课堂练习5:某羧酸酯的分子式为C18H26O5,1 mol该酯完全水解可得到1 mol羧酸和2 mol乙醇,该羧酸的分子式为( )
A.C14H18O5 B.C14H16O4 C.C16H22O5 D.C16H20O5
A
课堂练习6:分子式为C9H18O2的有机物A,在硫酸存在下与水反应,生成B和C,同温同压下,相同质量的B和C的蒸气所占的体积相同,则A的酯类同分异构体共有( )
A. 8种 B. 12种 C. 16种 D. 18种
C
课堂练习7:某课外兴趣小组欲在实验室里制备少量乙酸乙酯,设计了如图所示装置,其中不正确的是( )
D
A.该装置中冷凝水的流向为b进a出
B.加入过量乙醇可提高乙酸的转化率
C.该反应可能生成副产物乙醚
D.收集到的馏分需用饱和NaOH溶液分离杂质
第三章 烃的衍生物
第四节 羧酸 羧酸衍生物
第二课时 酯
学习目标
1、了解酯类化合物的结构特点,掌握酯类化合物的化学性质。
2、通过探究乙酸乙酯的水解,熟悉控制变量法的应用,体验科学探究的一般过程。
羧酸衍生物是羧酸分子中羧基上的羟基被其他原子或原子团取代后的生成物,如乙酸分子中羧基上的羟基被乙氧基(—OCH2CH3)取代后生成的乙酸乙酯,被氨基(—NH2)取代后生成的乙酰胺。
R-C-
O
=
酰基
R-C-OR
O
=
R-C-X
O
=
R-C-NH2
O
=
酰卤
酯
酰胺
R—C—O—
O
=
C—R
O
=
酸酐
新课引入:
苹果的香味主要是来自戊酸戊酯。
丁酸乙酯
乙酸异戊酯
戊酸戊酯
主要用于配制菠萝、葡萄、朗姆酒、草莓等型香精。菠萝水果糖中并未加入菠萝,而是加入了具有菠萝香味的丁酸乙酯
乙酸异戊酯俗称香蕉油
二、酯
1.酯的组成、结构
(1)定义:酯是羧酸分子羧基中的-OH被-OR ’取代后的产物。
(2)官能团:酯基,符号是—COO—或
饱和一元酯通式:
与碳原子数相同的饱和一元羧酸互为同分异构体
CnH2nO2(n≥2)
(3)饱和一元羧酸和饱和一元醇反应生成饱和一元酯
或R(H)COOR'
OR’
R(H)
羧酸酯可表示为:
其中R和R'可以相同,也可以不同。R'只能是烃基
戊酸戊酯
CH3(CH2)3C—O—(CH2)4CH3
O
丁酸乙酯
CH3(CH2)2C—O—CH2CH3
O
乙酸异戊酯
CH3C—O—(CH2)2CHCH3
O
CH3
2.酯的命名
根据生成酯的酸和醇的名称来命名,称为某酸某酯。
CH3COOC2H5
乙酸乙酯
(1)(CH3)2CHCOOCH3
(2)HCOOCH(CH3)2
异丁酸甲酯
甲酸异丙酯
丙酸乙酯
(3)CH3CH2COOCH2CH3
课堂练习1:写出下列物质的名称:
(4)CH3CH2O—NO2
硝酸乙酯
苯甲酸甲酯
甲酸苯甲酯
COOCH3
(5)
(6)
CH2OOCH
3.羧酸、酯的同分异构体的书写
①写出C4H8O2的属于羧酸和酯的同分异构体
羧酸——取代法(用羧基取代丙烷上的氢)
CH3—CH2—CH3
①
①
②
CH3CH2CH2COOH
CH3CHCH3
COOH
酯——分碳法
甲酸丙酯
乙酸乙酯
丙酸甲酯
HCOO
C C C
HCOO
C C
C
C COO
C C
C C COO
C
还有属于其他种类的同分异构体吗?
羟基醛、羟基酮、醚醛、醚酮等
②写出分子式为C8H8O2属于芳香羧酸和芳香酯的所有同分异构体
4种
羧酸——取代法(用羧基取代甲苯上的氢)
芳香酯——插入法
—COO—
—OOC—
4种
2种
C H
H
H
H
H
H
C H
H
H
CH3
HOOC
CH3
COOH
CH3
COOH
CH2COOH
CH3
HCOO
COOCH3
CH3
HCOO
CH3
HCOO
OOCCH3
CH2OOCH
课堂练习2:分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
A. 15种 B. 28种 C. 32种 D.40种
D
HCOO—C4H9(4种)
CH3COO—C3H7
C2H5COO—C2H5
C3H7COO—CH3
C5H10O2的酯
(2种)
(2种)
水解生成5种羧酸和8种醇。
4.物理性质
低级酯(如乙酸乙酯)具有一定的挥发性,有芳香气味的液体。
一般不溶于水,易溶于有机溶剂,密度一般小于水。
5.用途
(1)用作香料,如作饮料、糖果、化妆品等中的香料。
(2)用作有机溶剂,如作指甲油、胶水的溶剂。
6.存在
酯类广泛存在于自然界,低级酯是有芳香气味的液体,存在于各种水果和花草中。
乙酸和乙醇反应生成乙酸乙酯的化学方程式:
7.酯的化学性质
酯的重要化学性质之一是可以发生水解反应,生成相应的酸和醇。
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓硫酸
△
探究 乙酸乙酯的水解
【问题】乙酸乙酯水解的速率与反应条件有着怎样的关系呢?
影响速率的外界条件:浓度、温度、催化剂、溶液的酸碱性。
研究方法——控制变量法
可逆反应
【设计与实验】请你设计实验,探究乙酸乙酯在中性、酸性和碱性溶液中,以及不同温度下的水解速率。(提示:可以通过酯层消失的时间差异来判断乙酸乙酯在不同条件下水解速率的差别。)实验方案与步骤:
实验步骤 a. 分别取6滴乙酸乙酯放入3支试管中,然后向3支试管中分别加入等体积的水、稀硫酸、氢氧化钠溶液
b. 振荡均匀后,把3支试管都放入70~80 ℃的水浴里加热,记录酯层消失和酯香味消失的时间
实验现象
实验结论
①酸碱性对酯的水解的影响:
加水的试管中酯层基本不变
酯层消失时间:加入稀硫酸的试管大于加入氢氧化钠溶液的试管
乙酸乙酯在酸性和碱性条件下发生水解,在碱性条件下水解更快,更彻底
②温度对酯的水解的影响:
实验步骤 a. 分别取6滴乙酸乙酯放入2支试管中,然后向试管中分别加入等量的氢氧化钠溶液
b. 振荡均匀后,把2支试管分别放入50~60 ℃、70~80 ℃的水浴里加热
实验现象
实验结论
温度高的试管酯层消失得更快
温度越高,乙酸乙酯的水解速率越大
⑴酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解; 在强碱的溶液中酯水解趋于完全。
⑵温度越高,酯水解程度越大。
(水解反应是吸热反应)
酯的水解规律:
【讨论】(1)根据化学平衡移动原理,解释乙酸乙酯在碱性条件下发生的水解反应是不可逆的。
(2)控制实验条件是科学研究中的重要方法,通过乙酸乙酯水解条件的探究,你对这一方法有何体会?
乙酸乙酯水解生成乙酸,碱中和乙酸,使生成物浓度减少,促进平衡正向移动,反应趋于完全,所以不可逆。
控制实验条件如增加反应物浓度,使用催化剂、加热等可以加快反应速率;将生成物通过反应转化成其他物质,可以使平衡正向移动,甚至可以使反应进行完全。
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
酯在无机酸或碱存在条件下,均能发生水解反应。在酸性条件下水解是可逆的,
在碱性条件下水解是不可逆的,可完全水解,水解速率较快。
酯+H2O 酸+醇
无机酸
△
酯+H2O 羧酸盐+醇
无机碱
△
7.酯的化学性质——水解反应
8.酯的制备:“形形色色”的酯化反应
(1)生成链状酯
①一元羧酸与一元醇的酯化反应
②一元羧酸与二元醇或二元羧酸与一元醇的酯化反应
2 2
③无机含氧酸和醇的酯化反应
硝化甘油
(2)生成环状酯
①二元羧酸与二元醇的酯化反应
②羟基酸自身分子间酯化反应
③羟基酸分子内脱水生成酯
(3)生成聚酯
①二元羧酸与二元醇的缩聚反应
n HO CH2 CH2 OH + n HOOC COOH
H O CH2 CH2 O C C OH
n
O
O
+ (2n 1) H2O
②羟基酸自身缩聚反应
n CH3 CH COOH
OH
H O CH C OH
n
O
CH3
+ (n 1)H2O
缩聚反应:由单体分子间通过缩合反应生成高分子的反应
课堂练习3:写出在酸或碱存在的条件下的反应方程式
①
CH3COOCH3 +NaOH
CH3COOCH3 +H2O
稀硫酸
△
CH3OH+CH3COOH
CH3OH+CH3COONa
△
稀硫酸
△
COOC2H5
COOC2H5
+ H2O
③
COOH
COOH
+ CH3CH2OH
2
2
CH2OOCCH3
CH2OOCCH3
+ NaOH
△
2
CH2OH
CH2OH
+ CH3COONa
2
②
④
OOCH
+ NaOH
ONa
+ HCOONa+H2O
△
2
酯化反应 酯的水解
反应关系 催化剂
催化剂的其他作用
反应类型
加热类型
酯化反应和酯水解反应的比较
浓H2SO4
稀H2SO4或NaOH溶液
吸水,提高乙酸和乙醇的转化率
NaOH中和酯水解生成的乙酸,提高酯的水解率
酯化反应,取代反应
水解反应,取代反应
酒精灯火焰加热
热水浴加热
课堂练习4:对下列有机物 的叙述不正确的是( )
A.常温下能与Na2CO3反应放出CO2
B. 0.5mol该有机物与NaOH溶液完全反应需消耗4mol NaOH
C.与稀H2SO4共热生成两种有机物
D.该物质的化学式为C14H10O9
C
O
C
HO
HO
HO
OH
COOH
OH
O
课堂练习5:某羧酸酯的分子式为C18H26O5,1 mol该酯完全水解可得到1 mol羧酸和2 mol乙醇,该羧酸的分子式为( )
A.C14H18O5 B.C14H16O4 C.C16H22O5 D.C16H20O5
A
课堂练习6:分子式为C9H18O2的有机物A,在硫酸存在下与水反应,生成B和C,同温同压下,相同质量的B和C的蒸气所占的体积相同,则A的酯类同分异构体共有( )
A. 8种 B. 12种 C. 16种 D. 18种
C
课堂练习7:某课外兴趣小组欲在实验室里制备少量乙酸乙酯,设计了如图所示装置,其中不正确的是( )
D
A.该装置中冷凝水的流向为b进a出
B.加入过量乙醇可提高乙酸的转化率
C.该反应可能生成副产物乙醚
D.收集到的馏分需用饱和NaOH溶液分离杂质
