4.1.1硫及二氧化硫 课件 (共35张PPT)2024-2025学年苏教版(2019)高中化学必修第一册
文档属性
| 名称 | 4.1.1硫及二氧化硫 课件 (共35张PPT)2024-2025学年苏教版(2019)高中化学必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 43.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-17 17:48:43 | ||
图片预览










文档简介
(共35张PPT)
第一节 含硫化合物的性质
课时1 硫及二氧化硫的性质和应用
第四章 硫与环境保护
学习目标
1.知道硫元素在自然界中的存在形式,背诵硫单质的物理性质及化学性质。
2.知道SO2的物理性质;能够从物质类别及化合价的角度预测、分析、解释SO2的化学性质并背诵相关化学方程式。
3.了解SO2在生活、生产中的重要应用,培养科学态度和社会责任的化学核心素养。
4.了解亚硫酸和亚硫酸盐的性质及应用。
——印尼宜珍火山
越美丽越危险
这是一座佩戴了防毒面具才能游览的火山。
夜晚硫磺燃烧形成整片蓝色火焰
火山口的硫磺湖,热气腾腾的蓝绿色湖泊常年弥漫着刺鼻的硫磺烟雾
单质硫
难溶于水,微溶于酒精,易溶于CS2。
俗称硫黄
黄色或淡黄色固体,
质脆,易研成粉末,密度比水大
一、硫的性质
实验结束后,如何清洗内壁附着硫单质的试管?
一、硫的性质
淡蓝色(空气中)
蓝紫色火焰(氧气中)
氧化性:
Cl2 和 O2 S
均大于
1、S与非金属单质
2、S与金属单质
3、S与碱
一、硫的性质
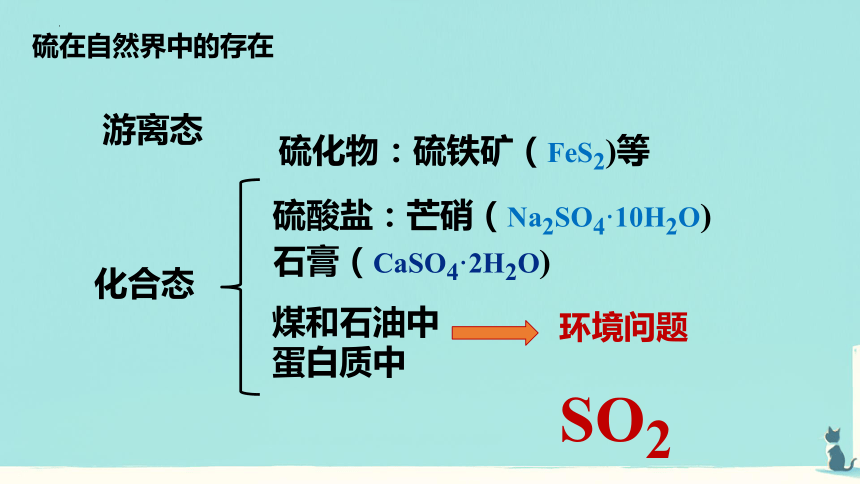
硫化物:硫铁矿(FeS2)等
硫酸盐:芒硝(Na2SO4·10H2O)
石膏(CaSO4·2H2O)
煤和石油中
蛋白质中
化合态
环境问题
SO2
硫在自然界中的存在
游离态
SO2 物理性质
无色气体
有刺激性气味
密度比空气大
SO2易溶于水(1∶40)
二、二氧化硫的性质
谈谈你对SO2的认识?
物质类别
元素价态
二、二氧化硫的性质
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
1、与水反应
2、与碱反应
3、与碱性氧化物反应
探究一:SO2是酸性氧化物
实验1现象
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
-2
0
+4
+6
硫的价态
SO2
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
开始无明显现象,
SO2可被H2O2氧化成H2SO4,
与BaCl2反应生成BaSO4白色沉淀
SO2的水溶液与BaCl2不反应
SO2+H2O2=H2SO4
H2SO4+BaCl2=BaSO4↓+2HCl
亚硫酸酸性弱于盐酸。
资料
后产生白色沉淀
探究二:SO2的强还原性(实验2)
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
探究二:SO2的强还原性
操作:向井穴板中滴加6滴KMnO 溶液,注入1ml SO2水溶液,观察现象。
结论:
SO2具有还原性,可被KMnO 氧化
2KMnO + 5SO + 2H O = 2K2SO + 2MnSO + 2H SO
结论:KMnO 溶液褪色
2MnO - + 5SO + 2H O = 5SO 2- + 2Mn2+ + 4H+
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
SO2具有强还原性,可与KMnO 溶液、双氧水、氯水、溴水等氧化性物质反应。
可用KMnO 溶液吸收SO2
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
探究三:SO2的弱氧化性
SO2+2H2S=3S↓+2H2O
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
3SO2+2Na2S=3S↓+2Na2SO3
操作:
向井穴板中滴加4滴Na2S溶液,注入1ml SO2水溶液,观察现象。
结论:溶液变浑浊,生成黄色固体
探究三:SO2的弱氧化性
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
探究四:SO2的漂白性(实验3)
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
品红是一种化学染料,匀染性好,常用于羊毛、丝绸织物和锦纶织物的染色以及皮革、纸张、肥皂、木材、医药和化妆品的着色,还用于生物着色。
资料
探究四:SO2的漂白性
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
SO2漂白原理
与“有色物质”“化合”成无色物质,是化学变化。
特点:可逆、不持久
注意:
SO2不能漂白石蕊溶液
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
新书与旧书
新草帽与旧草帽
SO2可使某些有色物质(如品红溶液)生成不稳定的无色物质,若加热,可恢复原来的颜色。
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
高锰酸钾溶液褪色是否是SO2的漂白性所致?
如何验证?
思考
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
现象:
褪色
褪色
变红
黄色浑浊
SO2性质:
漂白性
还原性
酸性氧化物
氧化性
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
如何鉴别CO2、SO2混合气体?
检验SO2
除去SO2
检验SO2是否被除尽
检验CO2
褪色
褪色(或变浅)
变浑浊
思考
不褪色
影响气候,无夏之年
3类致癌物,危害人体
形成酸雨,天空死神
危害
三、SO2的危害与用途
抗氧化
防腐
漂白
SO2被称为“化妆品性的食品添加剂”
二氧化硫可以降低溶液的ph值,降低微生物活性,影响微生物代谢。
二氧化硫可与食品中有色物质作用,从而对食品进行漂白。
二氧化硫可破坏酶的氧化系统,阻止氧化作用,使果实中的单宁物质不致被氧化而变成棕褐色,可使果干、果脯等具有美好的外观,尚可保存果实中的维生素C。
四、亚硫酸和亚硫酸盐的性质
无色透明液体
二元弱酸(HCl>H2SO3>H2CO3)
不稳定性,受热易分解。
亚硫酸
是由亚硫酸根离子(SO32- )与其他金属离子(或铵根离子)组成的化合物。
亚硫酸盐
在亚硫酸和亚硫酸盐中,硫的价态为+4。故在氧化还原反应方面,性质与SO2类似,既有氧化性,又有还原性,但主要表现还原性。
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
四、亚硫酸和亚硫酸盐的性质
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
(1)用浓硫酸和亚硫酸钠通过装置A制备SO2,写出装置A中发生的化学方程式:________________________________________。
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
典例解析
SO2的制备
(2)实验过程中,装置B、C中产生的现象分别是 、
_____________,这些现象分别说明SO2具有的性质是______和_______。装置B中发生反应的离子方程式为
____________________________________________。
溶液由紫红色变为无色
出现黄色浑浊
还原性
氧化性
典例解析
2MnO - + 5SO + 2H O = 5SO 2- + 2Mn2+ + 4H+
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
。
待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,无色溶液恢复红色
(4)尾气可采用_______溶液吸收。
NaOH
(5)除去CO2中含有的少量SO2可选择通过_________________
溶液。
饱和的碳酸氢钠
(或酸性高锰酸钾)
典例解析
课堂小结
硫的性质
SO2的危害与用途
物理性质
化学性质
如何清洗内壁附着硫的试管
SO2的性质
物理性质
酸性氧化物
还原性
氧化性
漂白性
鉴别
危害
用途
亚硫酸和亚硫酸盐的性质
亚硫酸亚硫酸盐
随堂练习
1.下列有关说法正确的是( )
A.SO2和SO3均是酸性氧化物
B.SO2的漂白原理和氯水的漂白原理相同
C.在SO2+2H2S===3S↓+2H2O反应中,SO2作氧化剂,其具有很强的氧化性
D.把某气体通入澄清的石灰水中,石灰水变浑浊,该气体一定是SO2
A
2.下列实验中能证明一种气体为SO2的是( )
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液褪色
④通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸
⑤通入溴水中使溴水褪色,再滴加BaCl2溶液有白色沉淀产生
A.都能证明 B.都不能证明
C.③④⑤能证明 D.只有⑤能证明
D
随堂练习
第一节 含硫化合物的性质
课时1 硫及二氧化硫的性质和应用
第四章 硫与环境保护
学习目标
1.知道硫元素在自然界中的存在形式,背诵硫单质的物理性质及化学性质。
2.知道SO2的物理性质;能够从物质类别及化合价的角度预测、分析、解释SO2的化学性质并背诵相关化学方程式。
3.了解SO2在生活、生产中的重要应用,培养科学态度和社会责任的化学核心素养。
4.了解亚硫酸和亚硫酸盐的性质及应用。
——印尼宜珍火山
越美丽越危险
这是一座佩戴了防毒面具才能游览的火山。
夜晚硫磺燃烧形成整片蓝色火焰
火山口的硫磺湖,热气腾腾的蓝绿色湖泊常年弥漫着刺鼻的硫磺烟雾
单质硫
难溶于水,微溶于酒精,易溶于CS2。
俗称硫黄
黄色或淡黄色固体,
质脆,易研成粉末,密度比水大
一、硫的性质
实验结束后,如何清洗内壁附着硫单质的试管?
一、硫的性质
淡蓝色(空气中)
蓝紫色火焰(氧气中)
氧化性:
Cl2 和 O2 S
均大于
1、S与非金属单质
2、S与金属单质
3、S与碱
一、硫的性质
硫化物:硫铁矿(FeS2)等
硫酸盐:芒硝(Na2SO4·10H2O)
石膏(CaSO4·2H2O)
煤和石油中
蛋白质中
化合态
环境问题
SO2
硫在自然界中的存在
游离态
SO2 物理性质
无色气体
有刺激性气味
密度比空气大
SO2易溶于水(1∶40)
二、二氧化硫的性质
谈谈你对SO2的认识?
物质类别
元素价态
二、二氧化硫的性质
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
1、与水反应
2、与碱反应
3、与碱性氧化物反应
探究一:SO2是酸性氧化物
实验1现象
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
-2
0
+4
+6
硫的价态
SO2
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
开始无明显现象,
SO2可被H2O2氧化成H2SO4,
与BaCl2反应生成BaSO4白色沉淀
SO2的水溶液与BaCl2不反应
SO2+H2O2=H2SO4
H2SO4+BaCl2=BaSO4↓+2HCl
亚硫酸酸性弱于盐酸。
资料
后产生白色沉淀
探究二:SO2的强还原性(实验2)
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
探究二:SO2的强还原性
操作:向井穴板中滴加6滴KMnO 溶液,注入1ml SO2水溶液,观察现象。
结论:
SO2具有还原性,可被KMnO 氧化
2KMnO + 5SO + 2H O = 2K2SO + 2MnSO + 2H SO
结论:KMnO 溶液褪色
2MnO - + 5SO + 2H O = 5SO 2- + 2Mn2+ + 4H+
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
SO2具有强还原性,可与KMnO 溶液、双氧水、氯水、溴水等氧化性物质反应。
可用KMnO 溶液吸收SO2
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
探究三:SO2的弱氧化性
SO2+2H2S=3S↓+2H2O
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
3SO2+2Na2S=3S↓+2Na2SO3
操作:
向井穴板中滴加4滴Na2S溶液,注入1ml SO2水溶液,观察现象。
结论:溶液变浑浊,生成黄色固体
探究三:SO2的弱氧化性
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
探究四:SO2的漂白性(实验3)
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
品红是一种化学染料,匀染性好,常用于羊毛、丝绸织物和锦纶织物的染色以及皮革、纸张、肥皂、木材、医药和化妆品的着色,还用于生物着色。
资料
探究四:SO2的漂白性
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
SO2漂白原理
与“有色物质”“化合”成无色物质,是化学变化。
特点:可逆、不持久
注意:
SO2不能漂白石蕊溶液
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
新书与旧书
新草帽与旧草帽
SO2可使某些有色物质(如品红溶液)生成不稳定的无色物质,若加热,可恢复原来的颜色。
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
高锰酸钾溶液褪色是否是SO2的漂白性所致?
如何验证?
思考
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
现象:
褪色
褪色
变红
黄色浑浊
SO2性质:
漂白性
还原性
酸性氧化物
氧化性
二、二氧化硫的性质-酸性氧化物-强还原性-弱氧化性-漂白性
如何鉴别CO2、SO2混合气体?
检验SO2
除去SO2
检验SO2是否被除尽
检验CO2
褪色
褪色(或变浅)
变浑浊
思考
不褪色
影响气候,无夏之年
3类致癌物,危害人体
形成酸雨,天空死神
危害
三、SO2的危害与用途
抗氧化
防腐
漂白
SO2被称为“化妆品性的食品添加剂”
二氧化硫可以降低溶液的ph值,降低微生物活性,影响微生物代谢。
二氧化硫可与食品中有色物质作用,从而对食品进行漂白。
二氧化硫可破坏酶的氧化系统,阻止氧化作用,使果实中的单宁物质不致被氧化而变成棕褐色,可使果干、果脯等具有美好的外观,尚可保存果实中的维生素C。
四、亚硫酸和亚硫酸盐的性质
无色透明液体
二元弱酸(HCl>H2SO3>H2CO3)
不稳定性,受热易分解。
亚硫酸
是由亚硫酸根离子(SO32- )与其他金属离子(或铵根离子)组成的化合物。
亚硫酸盐
在亚硫酸和亚硫酸盐中,硫的价态为+4。故在氧化还原反应方面,性质与SO2类似,既有氧化性,又有还原性,但主要表现还原性。
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
四、亚硫酸和亚硫酸盐的性质
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
(1)用浓硫酸和亚硫酸钠通过装置A制备SO2,写出装置A中发生的化学方程式:________________________________________。
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
典例解析
SO2的制备
(2)实验过程中,装置B、C中产生的现象分别是 、
_____________,这些现象分别说明SO2具有的性质是______和_______。装置B中发生反应的离子方程式为
____________________________________________。
溶液由紫红色变为无色
出现黄色浑浊
还原性
氧化性
典例解析
2MnO - + 5SO + 2H O = 5SO 2- + 2Mn2+ + 4H+
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
。
待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,无色溶液恢复红色
(4)尾气可采用_______溶液吸收。
NaOH
(5)除去CO2中含有的少量SO2可选择通过_________________
溶液。
饱和的碳酸氢钠
(或酸性高锰酸钾)
典例解析
课堂小结
硫的性质
SO2的危害与用途
物理性质
化学性质
如何清洗内壁附着硫的试管
SO2的性质
物理性质
酸性氧化物
还原性
氧化性
漂白性
鉴别
危害
用途
亚硫酸和亚硫酸盐的性质
亚硫酸亚硫酸盐
随堂练习
1.下列有关说法正确的是( )
A.SO2和SO3均是酸性氧化物
B.SO2的漂白原理和氯水的漂白原理相同
C.在SO2+2H2S===3S↓+2H2O反应中,SO2作氧化剂,其具有很强的氧化性
D.把某气体通入澄清的石灰水中,石灰水变浑浊,该气体一定是SO2
A
2.下列实验中能证明一种气体为SO2的是( )
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液褪色
④通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸
⑤通入溴水中使溴水褪色,再滴加BaCl2溶液有白色沉淀产生
A.都能证明 B.都不能证明
C.③④⑤能证明 D.只有⑤能证明
D
随堂练习
