浙江省金华十校2024—2025学年第一学期期末调研考试高一化学试题卷(PDF版,含答案)
文档属性
| 名称 | 浙江省金华十校2024—2025学年第一学期期末调研考试高一化学试题卷(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-17 17:02:10 | ||
图片预览



文档简介
金华十校2024—2025学年第一学期期末调研考试
高一化学试题卷
说明:1.全卷满分100分,考试时间90分钟;
2.请将答案写在答题卷的相应位置上;
3.可能用到的相对原子质量:H1 C12 016 Na 23 Mg 24 Al 27 Cl 35.5
Fe 56 Cu 64 Mn 55
一、选择题(本大题共 25小题,每小题2分,共50分。每小题列出的四个备选项中只有一个是符
合题目要求的,不选、多选、错选均不得分)
1.下列金华博物馆珍藏文物的主要成分属于硅酸盐的是
A.鎏金铜水月观音 B.金代鲤鱼化龙青铜镜
C.宋代褐釉蟠龙瓷壶 D.楠木竹纹花鸟瑞兽千工床
2.下列物质既属于共价化合物又属于电解质的是
A. SO B. CH COOH C. NaOH D. BaSO
3.下列有关实验室安全的说法不正确的是
A.若不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1 硼酸
B.温度计中的水银洒落地面,可用硫粉处理
C.金属钾着火,可用沙子盖灭
D.钠和水反应的实验中,需要标注右图图标:
明火
4.下列化学用语表示不正确的是
A.H O分子结构模型:
B.H O 电子式:H+[:0:0:]2H+
C.电子式表示KCl形成过程:K×+· :→K+[xC:]-
D. Al3 结构示意图: +1328
5.教材中的实验有助于理论知识的学习,下列说法不正确的是
A B C D
NHCl和 还原铁粉
浓H SO, Ca(OH) |浸有碱液 棉花 湿棉花 0
甲 的棉花
C片 z 肥皂水
品红溶液 KBr溶液 KI溶液 KI溶液
燃着的火柴 +氯水 +氯水 +溴水
往铜和浓硫酸反应后 该装置可用于 用肥皂水和燃着的 上图实验结果可以
的试管中加水,溶液变 制取并收集氨 火柴检验氢气的生 说明卤素单质的氧
蓝,证明生成了铜离子 气 成 化性Cl >Br>I
十校高一化学试题卷-1(共8页)
6.下列物质间的转化不能一步实现的是
A.SiO →SiF B.Fe→FeCl C.S→SO D.N →NO
7.物质的性质决定用途,下列两者对应关系不正确的是
A.高铁酸钠(Na FeO )具有强氧化性,是一种新型消毒剂
B.二氧化硫具有漂白性,能使品红溶液褪色
C.熟石膏与水混合成糊状物会很快凝固,重新变成石膏,故石膏可用来制作各种模型
D.CaCl 易吸水,可用来干燥氨气
8.化学是一门理论与应用相结合的科学,下面说法不正确的是
A.Ti-Fe合金是一种储氢合金,它的金属氢化物既容易形成,稍稍加热又容易分解,室温下
吸、放氢的速率快
B.稀土元素又称“冶金工业的维生素”,是一类在科技、生产中有广泛用途的金属元素
C. NaCIO的水溶液在低温下不会分解,比HCIO稳定得多
D.不锈钢是一种铁合金,它的合金元素主要是铬和镍,在空气中有很强的抗腐蚀能力
9.下列说法不正确的是
A. 'H、H、H+和H 是氢元素的四种不同粒子
B.IC、石墨和金刚石互为同素异形体
C.160和18O是不同的核素
D.3Cl和33Cl互为同位素,物理性质不同,但化学性质几乎相同
10.下列说法正确的是
A.过氧化钠能用作造纸、印染等行业的漂白剂,是因为它具有强氧化性
B.SO 、Cl 都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质时,
可增强漂白效果
C.活性炭使有色物质褪色是利用了碳单质的还原性,使有色物质发生了还原反应
D.SO 能使溴水和酸性KMnO 溶液褪色,是因为SO 具有漂白性
11.目前“北京时间”授时以55号Cs原子钟为基准,已知Cs的最外层电子数是1,下列说法
不正确的是
A. Cs是第六周期第IA族元素 B.Cs单质还原性强于K
C. CsOH为强碱 D.133Cs的中子数为133
12.常温下,下列各组离子能在指定溶液中大量共存的是
A.澄清溶液:Cu2+、NH 、SO2、Cl
B.酸性溶液中:Na+、[Al(OH)A]、ClO、SO2
C.含有大量Fe3的溶液:NH、K*、SCN、Cl
D.能与铝反应产生氢气的溶液中:HCO 、Fe2+、NO 、SO2
十校高一化学试题卷—2(共8页)
13.高纯硅是现代信息、半导体和光伏等产业都需要的基础材料。工业提纯有多种路线,其中一
种工艺流程示意图及主要反应如下,
HCl H
石英砂
焦炭 粗硅 SiHCl →高纯硅
电弧炉 流化床反应器 还原炉
下列说法正确的是:
A.电弧炉中反应的化学方程式为:SiO +C毫退si+CO
B.二氧化硅既能与氢氟酸反应,又能与NaOH溶液反应,是两性氧化物
C. SiO 具有导电性,常用作光导纤维
D.流化床反应器和还原炉中均发生置换反应
14.下列方程式正确的是
A.硫化钠溶液在空气中氧化变质:2S2+O +4H*=2S↓+2H O
B.CaH 用作野外生氢剂:CaH +2H O=Ca(OH) +2H ↑
C. NaHCO 溶液中加入少量Ca(OH) :HCO +Ca2+OH=CaCO J+H O
D.用HI溶液溶解Fe(OH) :Fe(OH) +3H =Fe3 +3H O
15.下面关于物质的量及其相关概念的说法正确的是
A.58.5克NaCl晶体中的离子数约为2NA,36.5克HCl气体中的离子数约为2NA
B.含1molCl的NaCl和NH Cl的混合物中,质子数为28NA
C.在298K,101kPa时,体积相等的 CH 和SO 所含原子数之比为5:3,体积相等的H O和
氦气所含原子数之比约为3:1
D.将1mol 铜加入到含2molH SO 的浓硫酸中加热,生成 SO (标准状况下)的体积为22.4L
16.为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是
A. FeCl 溶液(FeCl ):通氯气
B. CO 气体(HC1):通过饱和Na CO 溶液,洗气
C. Fe固体(A1):通过NaOH溶液,充分反应后过滤
D. Na CO 固体(NaHCO ):灼烧
17.超氧化钾(KO )可用作潜水或宇航装置的CO 吸收剂和供氧剂,反应为4KO +2CO =2K CO
+3O ,NA为阿伏加德罗常数。下列说法正确的是
A.该反应中每转移1mol电子,生成O 的数目为1NA
B.氧化剂与还原剂的物质的量之比为1:1
C.1molKO 晶体中离子的数目为3NA
D. KO 在反应中只做氧化剂
十校高一化学试题卷—3(共8页)
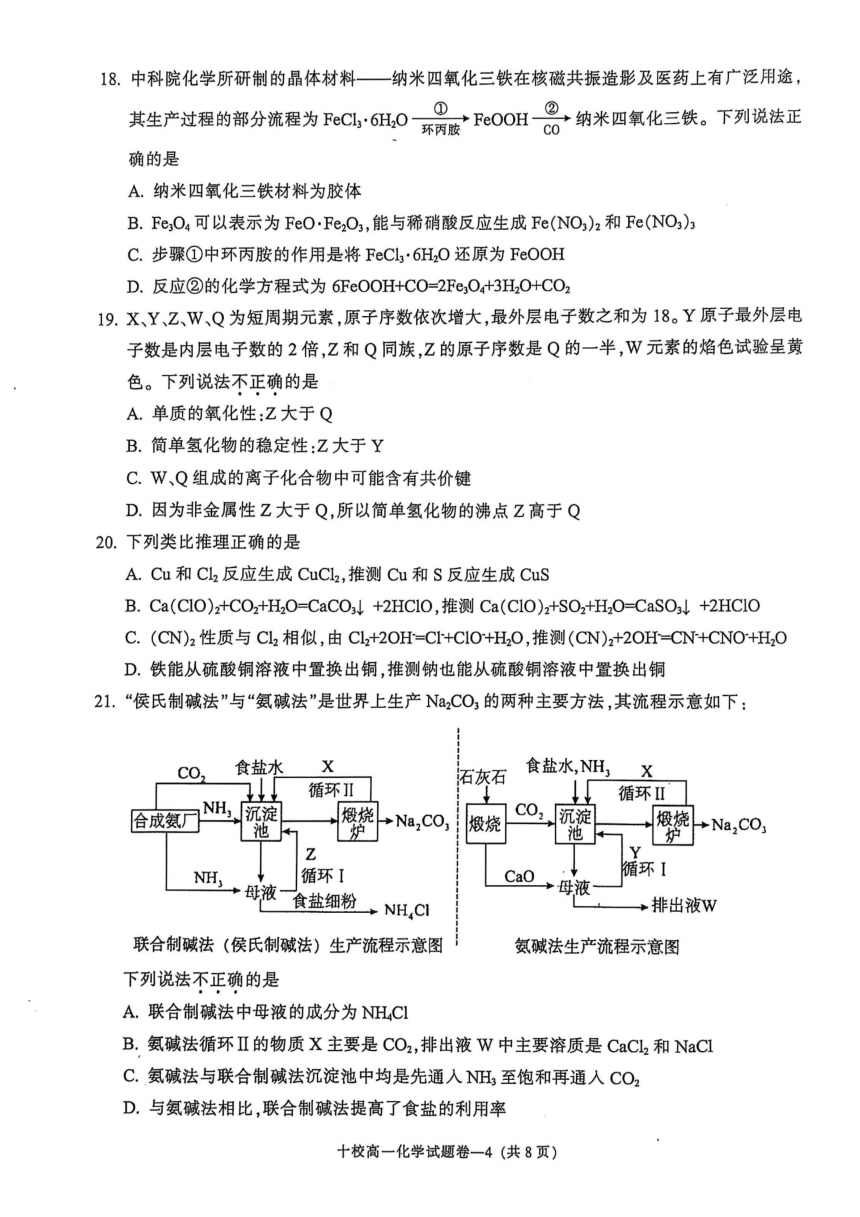
18.中科院化学所研制的晶体材料——纳米四氧化三铁在核磁共振造影及医药上有广泛用途,
其生产过程的部分流程为FeCl :6H O环丙胺FeOOHC纳米四氧化三铁。下列说法正
确的是
A.纳米四氧化三铁材料为胶体
B. Fe O4可以表示为FeO·Fe O ,能与稀硝酸反应生成Fe(NO ) 和Fe(NO )
C.步骤①中环丙胺的作用是将FeCl ·6H O还原为FeOOH
D.反应②的化学方程式为6FeOOH+CO=2Fe O +3H O+CO
19.X、Y、Z、W、Q为短周期元素,原子序数依次增大,最外层电子数之和为18。Y原子最外层电
子数是内层电子数的2倍,Z和Q同族,Z的原子序数是Q的一半,W元素的焰色试验呈黄
色。下列说法不正确的是
A.单质的氧化性:Z大于Q
B.简单氢化物的稳定性:Z大于Y
C.W、Q组成的离子化合物中可能含有共价键
D.因为非金属性Z大于Q,所以简单氢化物的沸点Z高于Q
20.下列类比推理正确的是
A. Cu和Cl 反应生成CuCl ,推测Cu和S反应生成CuS
B. Ca(ClO) +CO +H O=CaCO I+2HClO,推测Ca(CIO) +SO +H O=CaSO I+2HClO
C.(CN) 性质与Cl 相似,由Cl +2OH=Cl+ClO+H O,推测(CN) +2OH=CN+CNO+H O
D.铁能从硫酸铜溶液中置换出铜,推测钠也能从硫酸铜溶液中置换出铜
21.“侯氏制碱法”与“氨碱法”是世界上生产Na CO 的两种主要方法,其流程示意如下:
CO 食盐水 X 石灰石 食盐水,NH X
循环Ⅱ 循环Ⅱ
NH,
合成氨厂 沉淀 煅烧 Na CO co 煅烧 沉淀 煅烧池 炉 池 炉 Na CO
Z Y
NH 循环I CaO 循环I
母液 母液食盐细粉 NH CI 排出液W
联合制碱法(侯氏制碱法)生产流程示意图 氨碱法生产流程示意图
下列说法不正确的是
A.联合制碱法中母液的成分为NH Cl
B.氨碱法循环Ⅱ的物质X主要是CO ,排出液W中主要溶质是CaCl 和NaCl
C.氨碱法与联合制碱法沉淀池中均是先通入NH 至饱和再通入 CO
D.与氨碱法相比,联合制碱法提高了食盐的利用率
十校高一化学试题卷—4(共8页)
22.下列实验操作、现象和结论均正确的是
选项 实验操作和现象 实验结论
用玻璃棒蘸取样品,在酒精灯外焰上灼烧,观察到焰色 样品中一定含有钠元
A
呈黄色 素
B 为检验食品脱氧剂中的还原铁粉是否变质,取少量样品 铁粉未变质
溶于盐酸,再滴加 KSCN溶液,溶液未变红
将绿豆大小的金属钠投入干燥的热坩埚中,继续加热, 钠在空气燃烧生成
C
钠先熔化,然后燃烧发出黄色火焰,生成淡黄色固体。 Na O
D 向某溶液中加入盐酸酸化的BaCl 溶液,产生白色沉淀 溶液中一定含有SO2
23.100mLFeCl 和CuCl 的混合溶液中加入铁粉,其固体质量的变化如图所示,下列说法不正
确的是 m(固体)/g
A.c点溶质为FeCl
12.0 c
B.向b点溶液中滴加NaOH溶液有蓝色沉淀生成
6.4 b
C.a点溶液中存在的金属阳离子有Fe2+和Cu2+
0L a
D.原混合溶液中c(Fe3+):c(Cu2)=2:1 0.1 0.20.3 n(Fe)/mol
24.100 酸吸收SO 生成焦硫酸(分子式为H S O 或H SO ·SO ),下列说法不正确的是
A.焦硫酸具有强氧化性 B.100 酸吸收SO 生成焦硫酸的变化是化学变化
C. Na S O 水溶液呈中性 D.Na S O,可与碱性氧化物反应生成新盐
25.下列选项描述与对应图像相符的是
7.5
氯离子浓度(mg/L)800 5 a600 b400 物质的量/mmol2.5208 50 100 150 1
时间/s 0 25 50 75 100 125 150 v(盐酸)/mL
① ②
个导电能力 导电能力
a
0 V(MgSO4) 滴入溶液的体积
③ ④
A.图①为新制氯水在阳光直射时,溶液中Cl·浓度随着时间变化的曲线
B.图②为Na CO 、NaHCO 混合液中滴加盐酸的图像,则其中a线代表NaHCO 的变化曲
线,且原混合物中Na CO 、NaHCO 的总物质的量为2.5mmol
C.图③为Ba(OH) 溶液中滴加MgSO 溶液的导电性变化图像,导电能力约为0的原因是
两者恰好完全反应且生成物都不是电解质
D.图④为Ba(OH) 溶液中滴加 NaHSO 溶液的导电性变化图像,图中a点的溶质为NaOH
十校高一化学试题卷—5(共8页)
二、填空题(本大题共4小题,共46分)
26.(10分)如图为元素周期表的一部分,请参照①~⑧在表中的位置,回答下列问题:
①
② ③④
⑤ ⑥ ⑦⑧
(1)元素①~⑧形成的单质中,最易与H 化合的是_▲_(填化学式)
(2)最高价氧化物对应水化物酸性最强的是_▲(填化学式)。
(3)元素⑤~⑧形成的简单离子中,离子半径最小的是▲(填离子符号)。
(4)请从原子结构的角度解释元素⑤的金属性比②强的原因__▲。
(5)镓(Ga)位于第四周期,与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化
合物。工业制备镓的流程如图所示:
铝土矿 NaOH 适量 Na[Ga(OH)1 Ga
(Al Oa、 溶液 Na[Al(OH)] CO
Ga O ) Na[Ga(OH]过滤 Al(OH)
元素镓在元素周期表中的位置是▲;写出氧化镓与NaOH溶液反应的离子方
程式__▲。
27.(10分)硫铁矿(含FeS )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其“焙烧
氧化”及产物存在如下转化关系:
硫铁矿 +O A +O B C(酸雨成分之一)
反应I 反应Ⅱ 反应Ⅲ
+H O D +O
反应IV
回答下列问题:
(1)反应I中FeS 体现的化学性质是__▲_
(2)请写出反应Ⅱ的化学方程式_▲_
(3)在实际工业生产中,反应Ⅲ常用_▲_来吸收B气体,其目的是_▲
(4)下列说法不正确的是▲_
A.“A→B→C”与“A→D→C”是形成酸雨的两种常见途径
B.硫铁矿和黄铜矿(CuFeS )中硫的化合价均为-2价
C.在富氧条件下,用氨水吸收SO 可以得到化肥(NH ) SO
D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
(5)已知硫铁矿在“细菌氧化”时转化为硫酸盐,此过程相比“焙烧氧化”的优势是▲_
A.无需控温 B.可减少有害气体产生 C.设备无需耐高温
十校高一化学试题卷—6(共8页)
28.(14分)Cl 、NH 和HNO 都是重要的工业产品
I实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
饱和食盐水 浓硫酸 干燥红布条 湿润红布条 淀粉-KI溶液
A B C D E F G
(1)装置A中用浓盐酸和MnO 反应制取氯气,其化学方程式为▲_
(2)G装置用于尾气处理,则该装置盛装的试剂为_▲
(3)下列有关该实验的说法正确的是_▲
A.装置连接的顺序可以是ABCDEFG或ABFCDEG
B.该实验可验证Cl 具有漂白性
C.若过量的 Cl 与I 反应的方程式为5Cl +I +6H O=10HCl+2HIO ,则F中现象是先变
蓝后褪色
D.8.7g MnO 与足量浓盐酸反应可生成2.24L Cl
Ⅱ下图为合成氨以及氨氧化制硝酸的流程。
N 和H 空气 空气、水
合成塔 氨分离器 NH NO氧化炉 吸收塔 →HNO
(1)在催化剂和加热条件下氧化炉中发生反应的化学方程式是__▲,从氧化炉中出
来的气体,先降温再进入吸收塔,吸收塔中通人空气的作用是__▲。
(2)若要实现NH →N ,从氧化还原反应原理上看,下列试剂可行的是__▲。
A. Fe B.O C. NO D.NH Cl
(3)工业生产中为了盛装大量浓硝酸,可选择▲作为罐体材料
A.铜 B.铂 C.铝 D.镁
(4)氮及其化合物在催化剂a和催化剂b作用下发生转化的过程如图所示,下列分析合理
的是▲_。
OH
●0
N
催化剂a 催化剂b
N NH NO
A.N 与H 反应属于氮的固定过程
B.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
C.催化剂a作用下的转化涉及电子转移,催化剂b作用下的转化不涉及电子转移
十校高一化学试题卷-7(共8页)
29.(12分)黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,
实验方案如下。回答下列问题:
(1)配制标准液。本实验预计要用90mL0.10mol/LK Cr O (M=294g/mol)的溶液:
①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还有_▲。
②计算,称量:需用托盘天平称量_▲__克K Cr O 固体。
③溶解,恢复到室温,转移、洗涤、定容。定容的操作是:继续向容量瓶中加入蒸馏水,直
到液面离刻度线1~2cm时▲,盖好瓶塞,反复上下颠倒,摇匀。
④下列操作会使标准液浓度偏低的是__▲。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未经干燥即用来配制溶液
C.定容时,俯视刻度线
D.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2和Fe3+的形式存在)。
步骤一 取224克黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉
步骤二 过滤,向滤液中加入10mL0.10mol/LK Cr O 酸性溶液(Cr O, 被还原为Cr2),
恰好完全反应
①“步骤一”中加入过量铜粉的目的是__▲。
②请写出步骤二中发生反应的离子反应方程式:▲。
③实验测得黑木耳中铁元素的质量分数为_▲。
三、计算题(本题4分)
30.(4分)达喜是常用的中和胃酸的药物,其化学成分是含结晶水的铝镁碱式盐。取该碱式盐
6.02 g,加入4.00 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO ,加入盐酸至
45.0 mL时恰好反应完全。
(1)计算该碱式盐样品中氢氧根离子与碳酸根离子的物质的量之比_▲。
(2)若达喜中镁、铝元素的物质的量之比为3:1,则该物质的化学式中碳酸根离子和结晶水
个数比为:▲_
十校高一化学试题卷—8(共8页)
金华十校2024-2025学年第一学期期末调研考试
高一化学参考答案
一、选择题(本大题共25小题,每小题2分,共50分)
题号 1 2 3 4 5 6 7 8 9
选项 C B D B A C D C B
题号 10 11 12 13 14 15 16 17 18
选项 A D A D B B B A D
题号 19 20 21 22 23 24 25
选项 D C A C B C D
二、填空题(本大题共4小题,共46分)
26.(10分)
(1)F (1分) (2)HCIO (1分) (3)Al3+(2分)
(4)Na和Li都是第IA族元素,最外层电子数均是1,但是Na原子的半径大,原子核吸引电子能力小,
失电子能力强,故金属性强(2分)
(5)第四周期第IIIA族(2分)Ga O +2OH+3H O=2[Ga(OH)A](2分,物质写对给1分,配平1分)
27.(10分)
(1)还原性(1分)
催化剂
(2)2SO +O 2SO (2分,物质写对给1分,配平、条件1分)
(3)98.3 浓硫酸(1分,写出浓硫酸就给分) 防止形成酸雾,影响吸收效率(2分)
(4)BD(2分,BD给2分,B或D给1分,其他答案不给分)
(5)BC(2分,BC给2分,B或C给1分,其他答案不给分)
28.(14分)
I(1)MnO +4HCI(浓)全MnCl+Cl ↑+2H O(2分,物质写对给1分,配平、条件1分)
(2)氢氧化钠溶液(1分,其他合理答案也给分)
(3)AC(2分,AC给2分,A或C给1分,其他答案不给分)
Ⅱ(1)4NHs+50 化4NO+6H O(2分,物质写对给1分,配平、条件1分)
使NO、NO 完全转化为HNO (1分)
(2)BC(2分,BC给2分,B或C给1分,其他答案不给分)
(3)C(2分)
(4)AB(2分,AB给2分,A或B给1分,其他答案不给分)
29.(12分)
(1)①100mL容量瓶(1分)②2.9(2分)
③改用胶头滴管加水至溶液凹液面最低处与刻度线相切(1分)
④AD(2分,AD给2分,A或D给1分,其他答案不给分)
(2)①将铁离子还原为亚铁离子,测定更准确,减小实验误差(2分)
②6Fe2 +Cr Or2+14H =6Fe3 +2Cr3+7H O(2分,物质写对给1分,配平1分)③0.15 分)
三、计算题(本题4分)
30.(4分)
(1)16:1(2分)(2)1:4(2分)
高一化学试题卷
说明:1.全卷满分100分,考试时间90分钟;
2.请将答案写在答题卷的相应位置上;
3.可能用到的相对原子质量:H1 C12 016 Na 23 Mg 24 Al 27 Cl 35.5
Fe 56 Cu 64 Mn 55
一、选择题(本大题共 25小题,每小题2分,共50分。每小题列出的四个备选项中只有一个是符
合题目要求的,不选、多选、错选均不得分)
1.下列金华博物馆珍藏文物的主要成分属于硅酸盐的是
A.鎏金铜水月观音 B.金代鲤鱼化龙青铜镜
C.宋代褐釉蟠龙瓷壶 D.楠木竹纹花鸟瑞兽千工床
2.下列物质既属于共价化合物又属于电解质的是
A. SO B. CH COOH C. NaOH D. BaSO
3.下列有关实验室安全的说法不正确的是
A.若不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1 硼酸
B.温度计中的水银洒落地面,可用硫粉处理
C.金属钾着火,可用沙子盖灭
D.钠和水反应的实验中,需要标注右图图标:
明火
4.下列化学用语表示不正确的是
A.H O分子结构模型:
B.H O 电子式:H+[:0:0:]2H+
C.电子式表示KCl形成过程:K×+· :→K+[xC:]-
D. Al3 结构示意图: +1328
5.教材中的实验有助于理论知识的学习,下列说法不正确的是
A B C D
NHCl和 还原铁粉
浓H SO, Ca(OH) |浸有碱液 棉花 湿棉花 0
甲 的棉花
C片 z 肥皂水
品红溶液 KBr溶液 KI溶液 KI溶液
燃着的火柴 +氯水 +氯水 +溴水
往铜和浓硫酸反应后 该装置可用于 用肥皂水和燃着的 上图实验结果可以
的试管中加水,溶液变 制取并收集氨 火柴检验氢气的生 说明卤素单质的氧
蓝,证明生成了铜离子 气 成 化性Cl >Br>I
十校高一化学试题卷-1(共8页)
6.下列物质间的转化不能一步实现的是
A.SiO →SiF B.Fe→FeCl C.S→SO D.N →NO
7.物质的性质决定用途,下列两者对应关系不正确的是
A.高铁酸钠(Na FeO )具有强氧化性,是一种新型消毒剂
B.二氧化硫具有漂白性,能使品红溶液褪色
C.熟石膏与水混合成糊状物会很快凝固,重新变成石膏,故石膏可用来制作各种模型
D.CaCl 易吸水,可用来干燥氨气
8.化学是一门理论与应用相结合的科学,下面说法不正确的是
A.Ti-Fe合金是一种储氢合金,它的金属氢化物既容易形成,稍稍加热又容易分解,室温下
吸、放氢的速率快
B.稀土元素又称“冶金工业的维生素”,是一类在科技、生产中有广泛用途的金属元素
C. NaCIO的水溶液在低温下不会分解,比HCIO稳定得多
D.不锈钢是一种铁合金,它的合金元素主要是铬和镍,在空气中有很强的抗腐蚀能力
9.下列说法不正确的是
A. 'H、H、H+和H 是氢元素的四种不同粒子
B.IC、石墨和金刚石互为同素异形体
C.160和18O是不同的核素
D.3Cl和33Cl互为同位素,物理性质不同,但化学性质几乎相同
10.下列说法正确的是
A.过氧化钠能用作造纸、印染等行业的漂白剂,是因为它具有强氧化性
B.SO 、Cl 都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质时,
可增强漂白效果
C.活性炭使有色物质褪色是利用了碳单质的还原性,使有色物质发生了还原反应
D.SO 能使溴水和酸性KMnO 溶液褪色,是因为SO 具有漂白性
11.目前“北京时间”授时以55号Cs原子钟为基准,已知Cs的最外层电子数是1,下列说法
不正确的是
A. Cs是第六周期第IA族元素 B.Cs单质还原性强于K
C. CsOH为强碱 D.133Cs的中子数为133
12.常温下,下列各组离子能在指定溶液中大量共存的是
A.澄清溶液:Cu2+、NH 、SO2、Cl
B.酸性溶液中:Na+、[Al(OH)A]、ClO、SO2
C.含有大量Fe3的溶液:NH、K*、SCN、Cl
D.能与铝反应产生氢气的溶液中:HCO 、Fe2+、NO 、SO2
十校高一化学试题卷—2(共8页)
13.高纯硅是现代信息、半导体和光伏等产业都需要的基础材料。工业提纯有多种路线,其中一
种工艺流程示意图及主要反应如下,
HCl H
石英砂
焦炭 粗硅 SiHCl →高纯硅
电弧炉 流化床反应器 还原炉
下列说法正确的是:
A.电弧炉中反应的化学方程式为:SiO +C毫退si+CO
B.二氧化硅既能与氢氟酸反应,又能与NaOH溶液反应,是两性氧化物
C. SiO 具有导电性,常用作光导纤维
D.流化床反应器和还原炉中均发生置换反应
14.下列方程式正确的是
A.硫化钠溶液在空气中氧化变质:2S2+O +4H*=2S↓+2H O
B.CaH 用作野外生氢剂:CaH +2H O=Ca(OH) +2H ↑
C. NaHCO 溶液中加入少量Ca(OH) :HCO +Ca2+OH=CaCO J+H O
D.用HI溶液溶解Fe(OH) :Fe(OH) +3H =Fe3 +3H O
15.下面关于物质的量及其相关概念的说法正确的是
A.58.5克NaCl晶体中的离子数约为2NA,36.5克HCl气体中的离子数约为2NA
B.含1molCl的NaCl和NH Cl的混合物中,质子数为28NA
C.在298K,101kPa时,体积相等的 CH 和SO 所含原子数之比为5:3,体积相等的H O和
氦气所含原子数之比约为3:1
D.将1mol 铜加入到含2molH SO 的浓硫酸中加热,生成 SO (标准状况下)的体积为22.4L
16.为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是
A. FeCl 溶液(FeCl ):通氯气
B. CO 气体(HC1):通过饱和Na CO 溶液,洗气
C. Fe固体(A1):通过NaOH溶液,充分反应后过滤
D. Na CO 固体(NaHCO ):灼烧
17.超氧化钾(KO )可用作潜水或宇航装置的CO 吸收剂和供氧剂,反应为4KO +2CO =2K CO
+3O ,NA为阿伏加德罗常数。下列说法正确的是
A.该反应中每转移1mol电子,生成O 的数目为1NA
B.氧化剂与还原剂的物质的量之比为1:1
C.1molKO 晶体中离子的数目为3NA
D. KO 在反应中只做氧化剂
十校高一化学试题卷—3(共8页)
18.中科院化学所研制的晶体材料——纳米四氧化三铁在核磁共振造影及医药上有广泛用途,
其生产过程的部分流程为FeCl :6H O环丙胺FeOOHC纳米四氧化三铁。下列说法正
确的是
A.纳米四氧化三铁材料为胶体
B. Fe O4可以表示为FeO·Fe O ,能与稀硝酸反应生成Fe(NO ) 和Fe(NO )
C.步骤①中环丙胺的作用是将FeCl ·6H O还原为FeOOH
D.反应②的化学方程式为6FeOOH+CO=2Fe O +3H O+CO
19.X、Y、Z、W、Q为短周期元素,原子序数依次增大,最外层电子数之和为18。Y原子最外层电
子数是内层电子数的2倍,Z和Q同族,Z的原子序数是Q的一半,W元素的焰色试验呈黄
色。下列说法不正确的是
A.单质的氧化性:Z大于Q
B.简单氢化物的稳定性:Z大于Y
C.W、Q组成的离子化合物中可能含有共价键
D.因为非金属性Z大于Q,所以简单氢化物的沸点Z高于Q
20.下列类比推理正确的是
A. Cu和Cl 反应生成CuCl ,推测Cu和S反应生成CuS
B. Ca(ClO) +CO +H O=CaCO I+2HClO,推测Ca(CIO) +SO +H O=CaSO I+2HClO
C.(CN) 性质与Cl 相似,由Cl +2OH=Cl+ClO+H O,推测(CN) +2OH=CN+CNO+H O
D.铁能从硫酸铜溶液中置换出铜,推测钠也能从硫酸铜溶液中置换出铜
21.“侯氏制碱法”与“氨碱法”是世界上生产Na CO 的两种主要方法,其流程示意如下:
CO 食盐水 X 石灰石 食盐水,NH X
循环Ⅱ 循环Ⅱ
NH,
合成氨厂 沉淀 煅烧 Na CO co 煅烧 沉淀 煅烧池 炉 池 炉 Na CO
Z Y
NH 循环I CaO 循环I
母液 母液食盐细粉 NH CI 排出液W
联合制碱法(侯氏制碱法)生产流程示意图 氨碱法生产流程示意图
下列说法不正确的是
A.联合制碱法中母液的成分为NH Cl
B.氨碱法循环Ⅱ的物质X主要是CO ,排出液W中主要溶质是CaCl 和NaCl
C.氨碱法与联合制碱法沉淀池中均是先通入NH 至饱和再通入 CO
D.与氨碱法相比,联合制碱法提高了食盐的利用率
十校高一化学试题卷—4(共8页)
22.下列实验操作、现象和结论均正确的是
选项 实验操作和现象 实验结论
用玻璃棒蘸取样品,在酒精灯外焰上灼烧,观察到焰色 样品中一定含有钠元
A
呈黄色 素
B 为检验食品脱氧剂中的还原铁粉是否变质,取少量样品 铁粉未变质
溶于盐酸,再滴加 KSCN溶液,溶液未变红
将绿豆大小的金属钠投入干燥的热坩埚中,继续加热, 钠在空气燃烧生成
C
钠先熔化,然后燃烧发出黄色火焰,生成淡黄色固体。 Na O
D 向某溶液中加入盐酸酸化的BaCl 溶液,产生白色沉淀 溶液中一定含有SO2
23.100mLFeCl 和CuCl 的混合溶液中加入铁粉,其固体质量的变化如图所示,下列说法不正
确的是 m(固体)/g
A.c点溶质为FeCl
12.0 c
B.向b点溶液中滴加NaOH溶液有蓝色沉淀生成
6.4 b
C.a点溶液中存在的金属阳离子有Fe2+和Cu2+
0L a
D.原混合溶液中c(Fe3+):c(Cu2)=2:1 0.1 0.20.3 n(Fe)/mol
24.100 酸吸收SO 生成焦硫酸(分子式为H S O 或H SO ·SO ),下列说法不正确的是
A.焦硫酸具有强氧化性 B.100 酸吸收SO 生成焦硫酸的变化是化学变化
C. Na S O 水溶液呈中性 D.Na S O,可与碱性氧化物反应生成新盐
25.下列选项描述与对应图像相符的是
7.5
氯离子浓度(mg/L)800 5 a600 b400 物质的量/mmol2.5208 50 100 150 1
时间/s 0 25 50 75 100 125 150 v(盐酸)/mL
① ②
个导电能力 导电能力
a
0 V(MgSO4) 滴入溶液的体积
③ ④
A.图①为新制氯水在阳光直射时,溶液中Cl·浓度随着时间变化的曲线
B.图②为Na CO 、NaHCO 混合液中滴加盐酸的图像,则其中a线代表NaHCO 的变化曲
线,且原混合物中Na CO 、NaHCO 的总物质的量为2.5mmol
C.图③为Ba(OH) 溶液中滴加MgSO 溶液的导电性变化图像,导电能力约为0的原因是
两者恰好完全反应且生成物都不是电解质
D.图④为Ba(OH) 溶液中滴加 NaHSO 溶液的导电性变化图像,图中a点的溶质为NaOH
十校高一化学试题卷—5(共8页)
二、填空题(本大题共4小题,共46分)
26.(10分)如图为元素周期表的一部分,请参照①~⑧在表中的位置,回答下列问题:
①
② ③④
⑤ ⑥ ⑦⑧
(1)元素①~⑧形成的单质中,最易与H 化合的是_▲_(填化学式)
(2)最高价氧化物对应水化物酸性最强的是_▲(填化学式)。
(3)元素⑤~⑧形成的简单离子中,离子半径最小的是▲(填离子符号)。
(4)请从原子结构的角度解释元素⑤的金属性比②强的原因__▲。
(5)镓(Ga)位于第四周期,与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化
合物。工业制备镓的流程如图所示:
铝土矿 NaOH 适量 Na[Ga(OH)1 Ga
(Al Oa、 溶液 Na[Al(OH)] CO
Ga O ) Na[Ga(OH]过滤 Al(OH)
元素镓在元素周期表中的位置是▲;写出氧化镓与NaOH溶液反应的离子方
程式__▲。
27.(10分)硫铁矿(含FeS )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其“焙烧
氧化”及产物存在如下转化关系:
硫铁矿 +O A +O B C(酸雨成分之一)
反应I 反应Ⅱ 反应Ⅲ
+H O D +O
反应IV
回答下列问题:
(1)反应I中FeS 体现的化学性质是__▲_
(2)请写出反应Ⅱ的化学方程式_▲_
(3)在实际工业生产中,反应Ⅲ常用_▲_来吸收B气体,其目的是_▲
(4)下列说法不正确的是▲_
A.“A→B→C”与“A→D→C”是形成酸雨的两种常见途径
B.硫铁矿和黄铜矿(CuFeS )中硫的化合价均为-2价
C.在富氧条件下,用氨水吸收SO 可以得到化肥(NH ) SO
D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
(5)已知硫铁矿在“细菌氧化”时转化为硫酸盐,此过程相比“焙烧氧化”的优势是▲_
A.无需控温 B.可减少有害气体产生 C.设备无需耐高温
十校高一化学试题卷—6(共8页)
28.(14分)Cl 、NH 和HNO 都是重要的工业产品
I实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
饱和食盐水 浓硫酸 干燥红布条 湿润红布条 淀粉-KI溶液
A B C D E F G
(1)装置A中用浓盐酸和MnO 反应制取氯气,其化学方程式为▲_
(2)G装置用于尾气处理,则该装置盛装的试剂为_▲
(3)下列有关该实验的说法正确的是_▲
A.装置连接的顺序可以是ABCDEFG或ABFCDEG
B.该实验可验证Cl 具有漂白性
C.若过量的 Cl 与I 反应的方程式为5Cl +I +6H O=10HCl+2HIO ,则F中现象是先变
蓝后褪色
D.8.7g MnO 与足量浓盐酸反应可生成2.24L Cl
Ⅱ下图为合成氨以及氨氧化制硝酸的流程。
N 和H 空气 空气、水
合成塔 氨分离器 NH NO氧化炉 吸收塔 →HNO
(1)在催化剂和加热条件下氧化炉中发生反应的化学方程式是__▲,从氧化炉中出
来的气体,先降温再进入吸收塔,吸收塔中通人空气的作用是__▲。
(2)若要实现NH →N ,从氧化还原反应原理上看,下列试剂可行的是__▲。
A. Fe B.O C. NO D.NH Cl
(3)工业生产中为了盛装大量浓硝酸,可选择▲作为罐体材料
A.铜 B.铂 C.铝 D.镁
(4)氮及其化合物在催化剂a和催化剂b作用下发生转化的过程如图所示,下列分析合理
的是▲_。
OH
●0
N
催化剂a 催化剂b
N NH NO
A.N 与H 反应属于氮的固定过程
B.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
C.催化剂a作用下的转化涉及电子转移,催化剂b作用下的转化不涉及电子转移
十校高一化学试题卷-7(共8页)
29.(12分)黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,
实验方案如下。回答下列问题:
(1)配制标准液。本实验预计要用90mL0.10mol/LK Cr O (M=294g/mol)的溶液:
①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还有_▲。
②计算,称量:需用托盘天平称量_▲__克K Cr O 固体。
③溶解,恢复到室温,转移、洗涤、定容。定容的操作是:继续向容量瓶中加入蒸馏水,直
到液面离刻度线1~2cm时▲,盖好瓶塞,反复上下颠倒,摇匀。
④下列操作会使标准液浓度偏低的是__▲。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未经干燥即用来配制溶液
C.定容时,俯视刻度线
D.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2和Fe3+的形式存在)。
步骤一 取224克黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉
步骤二 过滤,向滤液中加入10mL0.10mol/LK Cr O 酸性溶液(Cr O, 被还原为Cr2),
恰好完全反应
①“步骤一”中加入过量铜粉的目的是__▲。
②请写出步骤二中发生反应的离子反应方程式:▲。
③实验测得黑木耳中铁元素的质量分数为_▲。
三、计算题(本题4分)
30.(4分)达喜是常用的中和胃酸的药物,其化学成分是含结晶水的铝镁碱式盐。取该碱式盐
6.02 g,加入4.00 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO ,加入盐酸至
45.0 mL时恰好反应完全。
(1)计算该碱式盐样品中氢氧根离子与碳酸根离子的物质的量之比_▲。
(2)若达喜中镁、铝元素的物质的量之比为3:1,则该物质的化学式中碳酸根离子和结晶水
个数比为:▲_
十校高一化学试题卷—8(共8页)
金华十校2024-2025学年第一学期期末调研考试
高一化学参考答案
一、选择题(本大题共25小题,每小题2分,共50分)
题号 1 2 3 4 5 6 7 8 9
选项 C B D B A C D C B
题号 10 11 12 13 14 15 16 17 18
选项 A D A D B B B A D
题号 19 20 21 22 23 24 25
选项 D C A C B C D
二、填空题(本大题共4小题,共46分)
26.(10分)
(1)F (1分) (2)HCIO (1分) (3)Al3+(2分)
(4)Na和Li都是第IA族元素,最外层电子数均是1,但是Na原子的半径大,原子核吸引电子能力小,
失电子能力强,故金属性强(2分)
(5)第四周期第IIIA族(2分)Ga O +2OH+3H O=2[Ga(OH)A](2分,物质写对给1分,配平1分)
27.(10分)
(1)还原性(1分)
催化剂
(2)2SO +O 2SO (2分,物质写对给1分,配平、条件1分)
(3)98.3 浓硫酸(1分,写出浓硫酸就给分) 防止形成酸雾,影响吸收效率(2分)
(4)BD(2分,BD给2分,B或D给1分,其他答案不给分)
(5)BC(2分,BC给2分,B或C给1分,其他答案不给分)
28.(14分)
I(1)MnO +4HCI(浓)全MnCl+Cl ↑+2H O(2分,物质写对给1分,配平、条件1分)
(2)氢氧化钠溶液(1分,其他合理答案也给分)
(3)AC(2分,AC给2分,A或C给1分,其他答案不给分)
Ⅱ(1)4NHs+50 化4NO+6H O(2分,物质写对给1分,配平、条件1分)
使NO、NO 完全转化为HNO (1分)
(2)BC(2分,BC给2分,B或C给1分,其他答案不给分)
(3)C(2分)
(4)AB(2分,AB给2分,A或B给1分,其他答案不给分)
29.(12分)
(1)①100mL容量瓶(1分)②2.9(2分)
③改用胶头滴管加水至溶液凹液面最低处与刻度线相切(1分)
④AD(2分,AD给2分,A或D给1分,其他答案不给分)
(2)①将铁离子还原为亚铁离子,测定更准确,减小实验误差(2分)
②6Fe2 +Cr Or2+14H =6Fe3 +2Cr3+7H O(2分,物质写对给1分,配平1分)③0.15 分)
三、计算题(本题4分)
30.(4分)
(1)16:1(2分)(2)1:4(2分)
同课章节目录
