2025中考科学备考集训40:化学计算问题(一)(含解析)
文档属性
| 名称 | 2025中考科学备考集训40:化学计算问题(一)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 349.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-01-18 20:12:37 | ||
图片预览



文档简介
2025中考科学备考集训40:化学计算问题(一)
1.20克硫酸铜溶液与10克氢氧化钠溶液混合后恰好完全反应,得到1.96克沉淀,求:
(1)生成硫酸钠的质量。
(2)硫酸铜溶液和氢氧化钠溶液的质量分数。
2.稀HCl和NaOH溶液反应时的溶液酸碱度变化如图所示。请回答:
(1)pH=5时,溶液中的溶质为 ;
(2)当酸和碱恰好完全反应时,生成2.34克NaCl,则有多少克质量分数为10%的NaOH溶液参加反应?
3.将40 g氢氧化钠溶液逐滴加入到20 g溶质质量分数为1.96%的稀硫酸中,边滴加边搅拌。随着氢氧化钠溶液的滴加,溶液的pH变化如图所示,溶液的温度变化如图所示。试回答:
(1)C点对应的溶液中含有的阴离子为 (用符号表示)。
(2)计算氢氧化钠溶液的溶质质量分数。
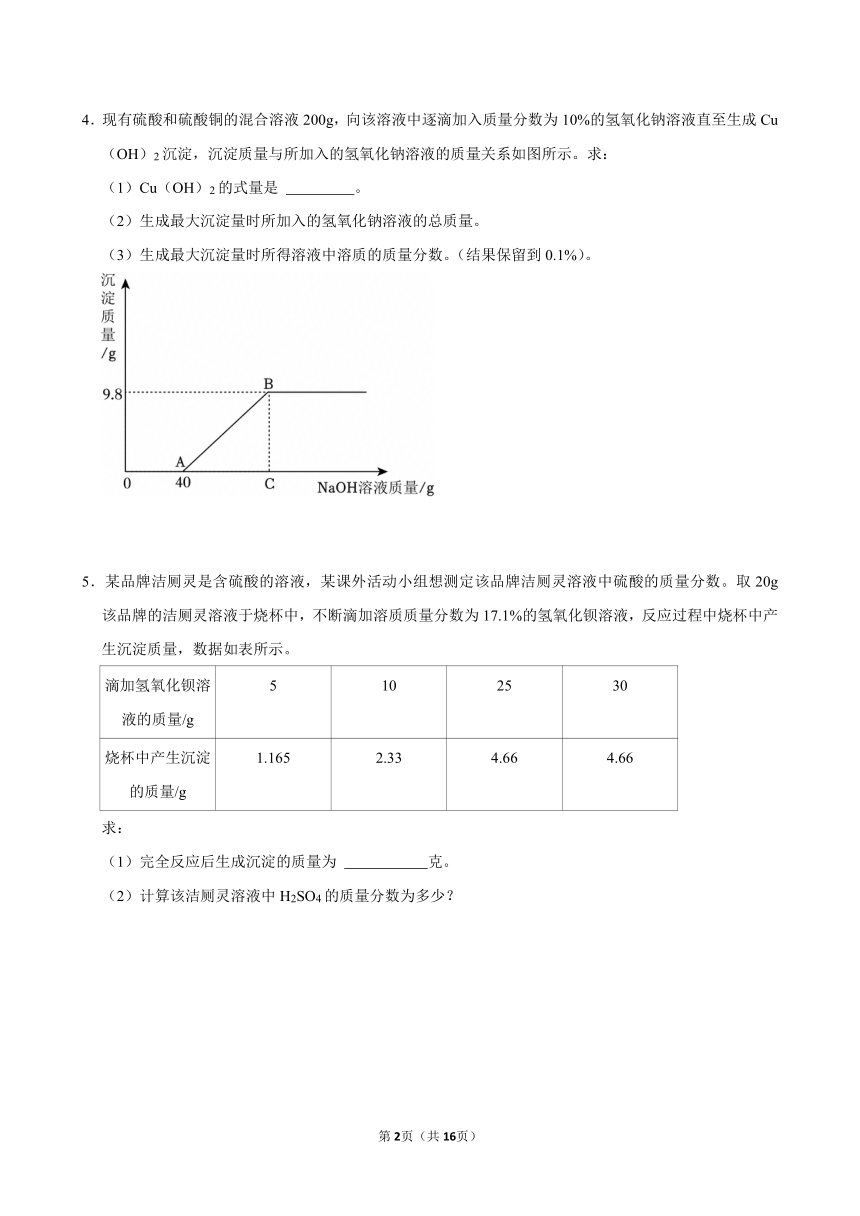
4.现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示。求:
(1)Cu(OH)2的式量是 。
(2)生成最大沉淀量时所加入的氢氧化钠溶液的总质量。
(3)生成最大沉淀量时所得溶液中溶质的质量分数。(结果保留到0.1%)。
5.某品牌洁厕灵是含硫酸的溶液,某课外活动小组想测定该品牌洁厕灵溶液中硫酸的质量分数。取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量,数据如表所示。
滴加氢氧化钡溶液的质量/g 5 10 25 30
烧杯中产生沉淀的质量/g 1.165 2.33 4.66 4.66
求:
(1)完全反应后生成沉淀的质量为 克。
(2)计算该洁厕灵溶液中H2SO4的质量分数为多少?
6.为测定某产品中碳酸钠(只含氯化钠杂质)的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m) 与反应时间(t)关系如图所示。求。
(1)生成CO2的质量为 克。
(2)该纯碱样品中Na2CO3的质量。
(3)求反应后NaCl溶液的质量分数(计算结果精确到 0.1%)。
7.为了更好地培养学生的实验探究能力,加强科学综合性实践活动,某校兴趣小组欲测定金华双龙洞”石笋”中碳酸钙的含量,实验过程如下:取一定量的石笋样品碾碎,放置于烧杯中,加入80g稀盐酸,将烧杯置于电子秤上,在化学反应过程中对烧杯及其剩余物质进行了5次读数,记录数据如表(反应后经测试盐酸仍有剩余,假设反应匀速进行,生成气体全部逸出,杂质不与盐酸反应,烧杯质量为20g):
反应时间/s 20 40 60 80 100
烧杯和药品质量/g 113.8 111.6 m 110.5 110.5
请计算:
(1)称得固体质量为 克。
(2)表中的m值为 。
(3)计算该石笋样品中碳酸钙的质量分数。(结果保留一位小数)。
8.为了测定石灰石中碳酸钙的含量,小叶进行了如下实验;取12.5g石灰石放于烧杯中,向烧杯中滴加稀盐酸,实验测得烧杯中剩余物质的质量与加入稀盐酸的质量之间的关系如图所示。整个过程不考虑稀盐酸的挥发和气体的溶解,石灰石中的杂质也不与稀盐酸反应。求:
(1)产生CO2的总质量。
(2)石灰石中碳酸钙的质量分数(写出计算过程)。
9.某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。请计算:
序号 加入稀盐酸的质量/g 剩余固体的质量/g
第1次 20 11
第2次 20 6
第3次 20 2.8
第4次 20 n
(1)上表中n的数值为 。
(2)样品中碳酸钙的质量分数是 。
(3)求盐酸中溶质的质量分数。
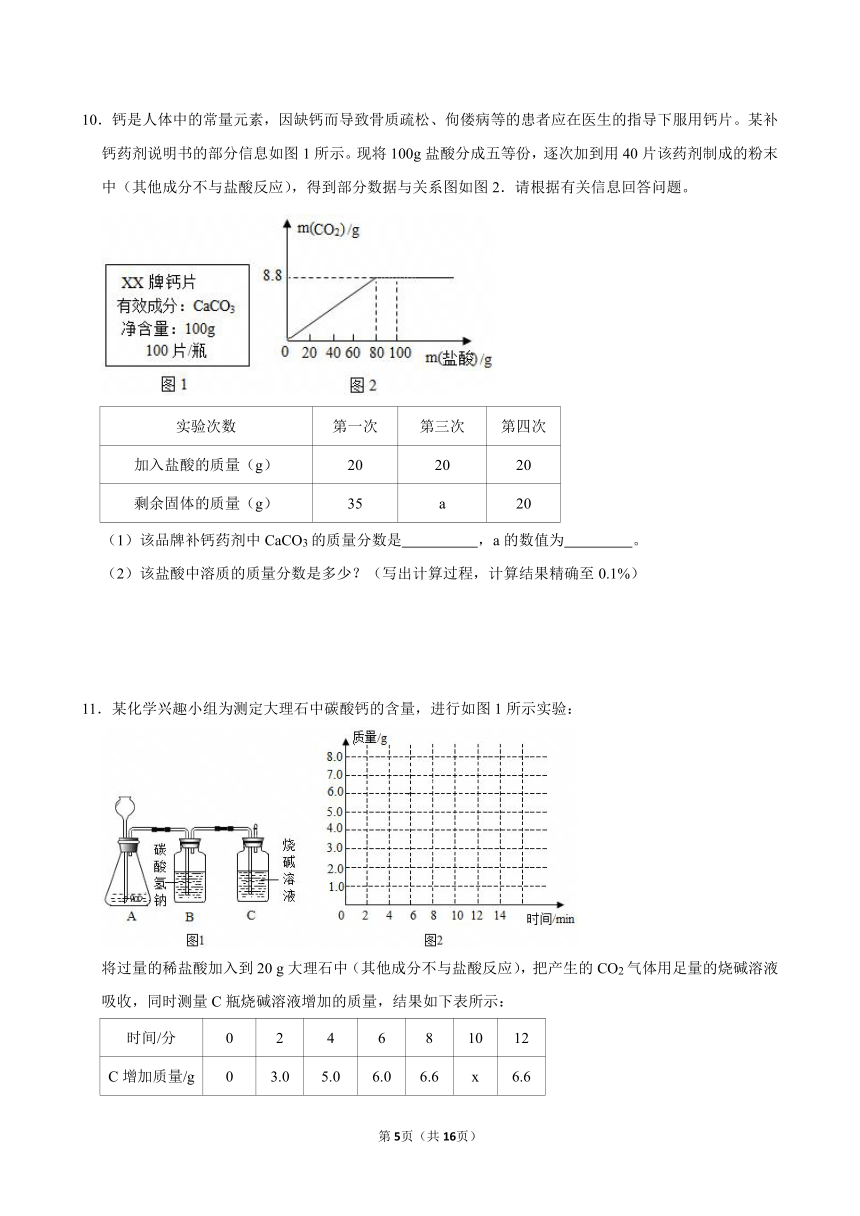
10.钙是人体中的常量元素,因缺钙而导致骨质疏松、佝偻病等的患者应在医生的指导下服用钙片。某补钙药剂说明书的部分信息如图1所示。现将100g盐酸分成五等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与关系图如图2.请根据有关信息回答问题。
实验次数 第一次 第三次 第四次
加入盐酸的质量(g) 20 20 20
剩余固体的质量(g) 35 a 20
(1)该品牌补钙药剂中CaCO3的质量分数是 ,a的数值为 。
(2)该盐酸中溶质的质量分数是多少?(写出计算过程,计算结果精确至0.1%)
11.某化学兴趣小组为测定大理石中碳酸钙的含量,进行如图1所示实验:
将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间/分 0 2 4 6 8 10 12
C增加质量/g 0 3.0 5.0 6.0 6.6 x 6.6
(1)上表中,第10分钟时,x= 。
(2)计算大理石样品中碳酸钙的质量分数。(要写计算过程)
(3)请在如图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线。
(4)B中所装药品为碳酸氢钠溶液,作用是吸收挥发出的HCl气体,该装置使测量结果 (填“偏大”“偏小”或“没有影响”)。
12.铜锌合金又叫黄铜,外观酷似黄金,极易以假乱真。某化学兴趣小组用图I所示装置测定黄铜中锌的含量。将足量的稀硫酸全部加入锥形瓶中,充分反应后天平示数的变化如图Ⅱ所示。请计算:
(1)生成氢气 g。
(2)黄铜样品中锌的质量分数。(写出计算过程)
13.生铁是铁和碳的合金.为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入65.0g稀硫酸,恰好完全反应(假设杂质不参与反应).测得的实验数据如表:
反应前 反应后
烧杯及其中物质的质量 97.0g 96.8g
请你完成有关计算(结果保留一位小数):
(1)反应放出的氢气是多少?
(2)生铁样品中铁的质量分数是多少.
14.某样品为银锌合金,为测定样品中银的含量,小科取部分样品与稀硫酸反应(所用的稀硫酸均从同一试剂瓶倒出),进行了四次实验,测定的实验数据如表所示。
实验次数 一 二 三 四
所取样品质量(g) 20 15 9 15
加入稀硫酸的质量(g) 50 50 50 60
充分反应后剩余固体质量(g) 13.5 8.5 a 8.5
(1)表格中a的数值为 。
(2)第 次实验结束后,酸还有剩余。
(3)所用稀硫酸中溶质的质量分数是多少? 。
15.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,直至充分反应,实验数据如下:
第一次 第二次 第三次 第四次 第五次 第六次
加入H2SO4的质量(g) 10 10 10 10 10 10
剩余固体的质量(g) 9.35 8.7 8.05 7.4 6.95
(1)黄铜样品中锌的质量分数为多少?
(2)所用稀硫酸的质量分数为多少?
2025中考科学备考集训40:化学计算问题(一)
参考答案与试题解析
1.【解答】解:设反应的硫酸铜质量为x,氢氧化钠的质量为y。
则CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 80 98
x y 1.96g
x=3.2g
y=1.6g
硫酸铜溶液的质量分数为100%=16%,
氢氧化钠溶液的质量分数为:100%=16%。
生成硫酸钠的质量为1.6g+3.2g﹣1.96g=2.84g
故答案为:(1)2.84g;
(2)16%;16%。
2.【解答】解:(1)pH=5时溶液是酸性的,此时溶液中的溶质是过量的氯化氢和反应生成的氯化钠,故答案为:HCl、NaCl;
(2)设参加反应的氢氧化钠溶液的质量为x
HCl+NaOH=NaCl+H2O
40 58.5
10%×x 2.34g
x=16g
答:参加反应的氢氧化钠溶液的质量为16g。
3.【解答】解:(1)C点时氢氧化钠过量,则含有的物质是生成的硫酸钠和过量的氢氧化钠及水,故含有的微粒为Na+、SO42﹣、OH﹣、H2O,含有的阴离子为SO42﹣、OH﹣;
(4)设氢氧化钠溶液的溶质质量分数为x。
2NaOH+H2SO4=Na2SO4+2H2O
40 98
40g×x 20g×1.96%
x=0.4%
答:氢氧化钠溶液的溶质质量分数为0.4%。
故答案为:(1)SO42﹣、OH﹣;
(2)0.4%。
4.【解答】解:(1)Cu(OH)2的相对分子质量=64+(16+1)×2=98。
(2)设与CuSO4反应消耗的氢氧化钠质量为x,则
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
80 98
x 9.8g
解得x=8g
则氢氧化钠溶液的总质量=40g+8g÷10%=120g
答:生成最大沉淀量时所加入的氢氧化钠溶液的总质量为120g。
(3)设生成的硫酸钠的质量为y,根据钠元素守恒,则:
2NaOH~Na2SO4
80 142
120g×10% y
解得y=21.3g
则C点时候,溶液中溶质的质量分数为:
答:计算C点时候,溶液中溶质的质量分数6.9%.
故答案为:(1)98;
(2)120g;
(3)6.9%。
5.【解答】解:(1)由表格可以看出,生成的硫酸钡的质量为4.66g,
(2)设该洁厕灵溶液中H2SO4的质量为x,
Ba(OH)2+H2SO4=BaSO4↓+2H2O
98 233
x 4.66g
x=1.96g
该洁厕灵溶液中H2SO4的质量分数为100%=9.8%
答:该洁厕灵溶液中H2SO4的浓度为9.8%。
故答案为:(1)4.66;
(2)9.8%。
6.【解答】解:(1)生成CO2的质量为:172.5g﹣163.7g=8.8g;
故答案为:8.8;
(2)设碳酸钠质量为x,生成氯化钠质量为y。
Na2CO3+2HCl=2NaCl+H2O+CO2↑,
106 117 44
x y 8.8g
x=21.2g y=23.4g
该纯碱样品中Na2CO3的质量分数为:100%=80%,
答:该纯碱样品中Na2CO3的质量分数为80%。
(3)反应后NaCl溶液的质量分数为:100%=17.5%,
答:反应后NaCl溶液的质量分数为17.5%。
7.【解答】解:(1)反应匀速进行,由20s﹣40s可知生成二氧化碳质量是113.8g﹣111.6g=2.2g,称得固体质量为113.8g+2.2g﹣80g﹣20g=16g。
故答案为:16。
(2)40s﹣80s时,生成二氧化碳质量是1.1g,说明60s时,碳酸钙已经完全反应,表中的m值为110.5。
故答案为:110.5。
(3)反应生成二氧化碳质量是116g﹣110.5g=5.5g。
设该石笋样品中碳酸钙的质量分数是x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
16gx 5.5g
x≈78.1%
答:该石笋样品中碳酸钙的质量分数是78.1%。
8.【解答】解:(1)由质量守恒定律和图像可知,生成的二氧化碳的质量为12.5g+150g﹣158.1g=4.4g;
(2)设石灰石中碳酸钙的质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
解得:x=10g
石灰石中碳酸钙的质量分数80%
答:石灰石中碳酸钙的质量分数为80%。
故答案为:(1)4.4g;
(2)80%。
9.【解答】解:(1)根据图表数据可知,第1、2次反应后固体物质减少的质量都为5g,而第3次反应后固体物质减少的质量为3.2g,说明此时碳酸钙已反应完,不再产生气体,故表中n的数值为2.8。
(2)样品中碳酸钙的质量分数100%=82.5%。
(3)由试题分析20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应
解:设第一次参与反应的HCl质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
5g x
解之得:x=3.65g,
盐酸中溶质的质量分数为:100%=18.25%。
故答案为:(1)2.8;(2)82.5%;(3)答:盐酸中溶质的质量分数为18.25%。
10.【解答】解:(1)设40片该药剂中含碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 8.8g
解得:x=20g
该品牌补钙药剂中CaCO3的质量分数是:50%;
由第1次和第4次数据可知20g稀盐酸可消耗5g碳酸钙,则第二次加入20g稀盐酸后,剩余固体为30g,第三次加入20g稀盐酸后,剩余固体为25g,故a的数值为25;
(2)设20g的稀盐酸中溶质的质量为y
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73
5g y
解得:y=3.65g
该盐酸中溶质的质量分数是:18.3%
故答案为:(1)50%,25;(2)该盐酸中溶质的质量分数18.3%。
11.【解答】解:(1)由表可以看出生成二氧化碳的最大量为6.6g,在第8分钟和第12分钟时均为6.6g,则第10分钟也为6.6。
(2)设样品中碳酸钙的质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 6.6g
解得:x=15g
所以样品中碳酸钙的质量分数为100%=75%。
(3)根据表中给出的时间和气体的质量绘制图如下:
(4)由于碳酸氢钠和盐酸反应生成二氧化碳,导致烧碱吸收的二氧化碳大于碳酸钙和盐酸反应所生成的二氧化碳,进而导致测得的碳酸钙的质量分数偏大。
故答案为:(1)6.6;
(2)样品中碳酸钙的质量分数为75%
(3)见上图;(4)偏大
12.【解答】解:根据质量守恒定律可得,生成的氢气的质量为290.2g﹣290.0g=0.2g
设黄铜样品中锌的质量分数为x
Zn+H2SO4=ZnSO4+H2↑
65 2
20.0gx 0.2g
x=32.5%
故答案为:
(1)0.2;
(2)32.5%。
13.【解答】解:根据质量守恒定律可得,生成氢气的质量为97.0g﹣96.8g=0.2g
设参加反应的铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.2g
x=5.6g
则生铁样品中铁的质量分数为100%≈93.3%
答:(1)反应放出的氢气是0.2g.
(2)生铁样品中铁的质量分数是93.3%.
14.【解答】解:(1)根据二、四组数据可知,每15g样品中含铜8.5g、锌6.5g;通过二、三组对照可得,三组中硫酸过量,充分反应后剩余固体质量为铜的质量,则9g样品中含有铜的质量为5.1g,则表格中a的数值为5.1;
(2)根据二、四组数据可知,每15g样品中含铜8.5g、锌6.5g;可知20g样品中含有铜的质量为11.33g,可知第一次中样品有剩余,硫酸不足,并且可得每50g稀硫酸完全反应会消耗锌(即固体质量减少)6g,所以第二次为恰好完全反应,三、四次实验结束后,酸还有剩余;
(3)设50g稀硫酸中溶质的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 98
6.5g x
x=9.8g
则所用稀硫酸中溶质的质量分数是100%=19.6%。
故答案为:(1)5.1;
(2)三、四;
(3)19.6%。
15.【解答】解:(1)由表中的数据可知,每加入10g的稀硫酸消耗固体的质量为0.65g,第五次加入10g的稀硫酸只反应掉的固体是0.45g<0.65g,说明有剩余稀硫酸,剩余的固体是不反应的铜,所以黄铜样品中锌的质量为:10g﹣6.95g=3.05g;
所以黄铜样品中锌的质量分数为:100%=30.5%.
(2)设10g稀硫酸中溶质质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
0.65g x
解得:x=0.98gg
稀硫酸中溶质质量分数为:100%=9.8%
答:(1)黄铜样品中锌的质量分数为30.5%;
(2)所用稀硫酸的质量分数为9.8%.
故答案为:(1)30.5%;
(2)9.8%。
第1页(共1页)
1.20克硫酸铜溶液与10克氢氧化钠溶液混合后恰好完全反应,得到1.96克沉淀,求:
(1)生成硫酸钠的质量。
(2)硫酸铜溶液和氢氧化钠溶液的质量分数。
2.稀HCl和NaOH溶液反应时的溶液酸碱度变化如图所示。请回答:
(1)pH=5时,溶液中的溶质为 ;
(2)当酸和碱恰好完全反应时,生成2.34克NaCl,则有多少克质量分数为10%的NaOH溶液参加反应?
3.将40 g氢氧化钠溶液逐滴加入到20 g溶质质量分数为1.96%的稀硫酸中,边滴加边搅拌。随着氢氧化钠溶液的滴加,溶液的pH变化如图所示,溶液的温度变化如图所示。试回答:
(1)C点对应的溶液中含有的阴离子为 (用符号表示)。
(2)计算氢氧化钠溶液的溶质质量分数。
4.现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示。求:
(1)Cu(OH)2的式量是 。
(2)生成最大沉淀量时所加入的氢氧化钠溶液的总质量。
(3)生成最大沉淀量时所得溶液中溶质的质量分数。(结果保留到0.1%)。
5.某品牌洁厕灵是含硫酸的溶液,某课外活动小组想测定该品牌洁厕灵溶液中硫酸的质量分数。取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量,数据如表所示。
滴加氢氧化钡溶液的质量/g 5 10 25 30
烧杯中产生沉淀的质量/g 1.165 2.33 4.66 4.66
求:
(1)完全反应后生成沉淀的质量为 克。
(2)计算该洁厕灵溶液中H2SO4的质量分数为多少?
6.为测定某产品中碳酸钠(只含氯化钠杂质)的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m) 与反应时间(t)关系如图所示。求。
(1)生成CO2的质量为 克。
(2)该纯碱样品中Na2CO3的质量。
(3)求反应后NaCl溶液的质量分数(计算结果精确到 0.1%)。
7.为了更好地培养学生的实验探究能力,加强科学综合性实践活动,某校兴趣小组欲测定金华双龙洞”石笋”中碳酸钙的含量,实验过程如下:取一定量的石笋样品碾碎,放置于烧杯中,加入80g稀盐酸,将烧杯置于电子秤上,在化学反应过程中对烧杯及其剩余物质进行了5次读数,记录数据如表(反应后经测试盐酸仍有剩余,假设反应匀速进行,生成气体全部逸出,杂质不与盐酸反应,烧杯质量为20g):
反应时间/s 20 40 60 80 100
烧杯和药品质量/g 113.8 111.6 m 110.5 110.5
请计算:
(1)称得固体质量为 克。
(2)表中的m值为 。
(3)计算该石笋样品中碳酸钙的质量分数。(结果保留一位小数)。
8.为了测定石灰石中碳酸钙的含量,小叶进行了如下实验;取12.5g石灰石放于烧杯中,向烧杯中滴加稀盐酸,实验测得烧杯中剩余物质的质量与加入稀盐酸的质量之间的关系如图所示。整个过程不考虑稀盐酸的挥发和气体的溶解,石灰石中的杂质也不与稀盐酸反应。求:
(1)产生CO2的总质量。
(2)石灰石中碳酸钙的质量分数(写出计算过程)。
9.某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。请计算:
序号 加入稀盐酸的质量/g 剩余固体的质量/g
第1次 20 11
第2次 20 6
第3次 20 2.8
第4次 20 n
(1)上表中n的数值为 。
(2)样品中碳酸钙的质量分数是 。
(3)求盐酸中溶质的质量分数。
10.钙是人体中的常量元素,因缺钙而导致骨质疏松、佝偻病等的患者应在医生的指导下服用钙片。某补钙药剂说明书的部分信息如图1所示。现将100g盐酸分成五等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与关系图如图2.请根据有关信息回答问题。
实验次数 第一次 第三次 第四次
加入盐酸的质量(g) 20 20 20
剩余固体的质量(g) 35 a 20
(1)该品牌补钙药剂中CaCO3的质量分数是 ,a的数值为 。
(2)该盐酸中溶质的质量分数是多少?(写出计算过程,计算结果精确至0.1%)
11.某化学兴趣小组为测定大理石中碳酸钙的含量,进行如图1所示实验:
将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间/分 0 2 4 6 8 10 12
C增加质量/g 0 3.0 5.0 6.0 6.6 x 6.6
(1)上表中,第10分钟时,x= 。
(2)计算大理石样品中碳酸钙的质量分数。(要写计算过程)
(3)请在如图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线。
(4)B中所装药品为碳酸氢钠溶液,作用是吸收挥发出的HCl气体,该装置使测量结果 (填“偏大”“偏小”或“没有影响”)。
12.铜锌合金又叫黄铜,外观酷似黄金,极易以假乱真。某化学兴趣小组用图I所示装置测定黄铜中锌的含量。将足量的稀硫酸全部加入锥形瓶中,充分反应后天平示数的变化如图Ⅱ所示。请计算:
(1)生成氢气 g。
(2)黄铜样品中锌的质量分数。(写出计算过程)
13.生铁是铁和碳的合金.为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入65.0g稀硫酸,恰好完全反应(假设杂质不参与反应).测得的实验数据如表:
反应前 反应后
烧杯及其中物质的质量 97.0g 96.8g
请你完成有关计算(结果保留一位小数):
(1)反应放出的氢气是多少?
(2)生铁样品中铁的质量分数是多少.
14.某样品为银锌合金,为测定样品中银的含量,小科取部分样品与稀硫酸反应(所用的稀硫酸均从同一试剂瓶倒出),进行了四次实验,测定的实验数据如表所示。
实验次数 一 二 三 四
所取样品质量(g) 20 15 9 15
加入稀硫酸的质量(g) 50 50 50 60
充分反应后剩余固体质量(g) 13.5 8.5 a 8.5
(1)表格中a的数值为 。
(2)第 次实验结束后,酸还有剩余。
(3)所用稀硫酸中溶质的质量分数是多少? 。
15.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,直至充分反应,实验数据如下:
第一次 第二次 第三次 第四次 第五次 第六次
加入H2SO4的质量(g) 10 10 10 10 10 10
剩余固体的质量(g) 9.35 8.7 8.05 7.4 6.95
(1)黄铜样品中锌的质量分数为多少?
(2)所用稀硫酸的质量分数为多少?
2025中考科学备考集训40:化学计算问题(一)
参考答案与试题解析
1.【解答】解:设反应的硫酸铜质量为x,氢氧化钠的质量为y。
则CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 80 98
x y 1.96g
x=3.2g
y=1.6g
硫酸铜溶液的质量分数为100%=16%,
氢氧化钠溶液的质量分数为:100%=16%。
生成硫酸钠的质量为1.6g+3.2g﹣1.96g=2.84g
故答案为:(1)2.84g;
(2)16%;16%。
2.【解答】解:(1)pH=5时溶液是酸性的,此时溶液中的溶质是过量的氯化氢和反应生成的氯化钠,故答案为:HCl、NaCl;
(2)设参加反应的氢氧化钠溶液的质量为x
HCl+NaOH=NaCl+H2O
40 58.5
10%×x 2.34g
x=16g
答:参加反应的氢氧化钠溶液的质量为16g。
3.【解答】解:(1)C点时氢氧化钠过量,则含有的物质是生成的硫酸钠和过量的氢氧化钠及水,故含有的微粒为Na+、SO42﹣、OH﹣、H2O,含有的阴离子为SO42﹣、OH﹣;
(4)设氢氧化钠溶液的溶质质量分数为x。
2NaOH+H2SO4=Na2SO4+2H2O
40 98
40g×x 20g×1.96%
x=0.4%
答:氢氧化钠溶液的溶质质量分数为0.4%。
故答案为:(1)SO42﹣、OH﹣;
(2)0.4%。
4.【解答】解:(1)Cu(OH)2的相对分子质量=64+(16+1)×2=98。
(2)设与CuSO4反应消耗的氢氧化钠质量为x,则
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
80 98
x 9.8g
解得x=8g
则氢氧化钠溶液的总质量=40g+8g÷10%=120g
答:生成最大沉淀量时所加入的氢氧化钠溶液的总质量为120g。
(3)设生成的硫酸钠的质量为y,根据钠元素守恒,则:
2NaOH~Na2SO4
80 142
120g×10% y
解得y=21.3g
则C点时候,溶液中溶质的质量分数为:
答:计算C点时候,溶液中溶质的质量分数6.9%.
故答案为:(1)98;
(2)120g;
(3)6.9%。
5.【解答】解:(1)由表格可以看出,生成的硫酸钡的质量为4.66g,
(2)设该洁厕灵溶液中H2SO4的质量为x,
Ba(OH)2+H2SO4=BaSO4↓+2H2O
98 233
x 4.66g
x=1.96g
该洁厕灵溶液中H2SO4的质量分数为100%=9.8%
答:该洁厕灵溶液中H2SO4的浓度为9.8%。
故答案为:(1)4.66;
(2)9.8%。
6.【解答】解:(1)生成CO2的质量为:172.5g﹣163.7g=8.8g;
故答案为:8.8;
(2)设碳酸钠质量为x,生成氯化钠质量为y。
Na2CO3+2HCl=2NaCl+H2O+CO2↑,
106 117 44
x y 8.8g
x=21.2g y=23.4g
该纯碱样品中Na2CO3的质量分数为:100%=80%,
答:该纯碱样品中Na2CO3的质量分数为80%。
(3)反应后NaCl溶液的质量分数为:100%=17.5%,
答:反应后NaCl溶液的质量分数为17.5%。
7.【解答】解:(1)反应匀速进行,由20s﹣40s可知生成二氧化碳质量是113.8g﹣111.6g=2.2g,称得固体质量为113.8g+2.2g﹣80g﹣20g=16g。
故答案为:16。
(2)40s﹣80s时,生成二氧化碳质量是1.1g,说明60s时,碳酸钙已经完全反应,表中的m值为110.5。
故答案为:110.5。
(3)反应生成二氧化碳质量是116g﹣110.5g=5.5g。
设该石笋样品中碳酸钙的质量分数是x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
16gx 5.5g
x≈78.1%
答:该石笋样品中碳酸钙的质量分数是78.1%。
8.【解答】解:(1)由质量守恒定律和图像可知,生成的二氧化碳的质量为12.5g+150g﹣158.1g=4.4g;
(2)设石灰石中碳酸钙的质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
解得:x=10g
石灰石中碳酸钙的质量分数80%
答:石灰石中碳酸钙的质量分数为80%。
故答案为:(1)4.4g;
(2)80%。
9.【解答】解:(1)根据图表数据可知,第1、2次反应后固体物质减少的质量都为5g,而第3次反应后固体物质减少的质量为3.2g,说明此时碳酸钙已反应完,不再产生气体,故表中n的数值为2.8。
(2)样品中碳酸钙的质量分数100%=82.5%。
(3)由试题分析20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应
解:设第一次参与反应的HCl质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
5g x
解之得:x=3.65g,
盐酸中溶质的质量分数为:100%=18.25%。
故答案为:(1)2.8;(2)82.5%;(3)答:盐酸中溶质的质量分数为18.25%。
10.【解答】解:(1)设40片该药剂中含碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 8.8g
解得:x=20g
该品牌补钙药剂中CaCO3的质量分数是:50%;
由第1次和第4次数据可知20g稀盐酸可消耗5g碳酸钙,则第二次加入20g稀盐酸后,剩余固体为30g,第三次加入20g稀盐酸后,剩余固体为25g,故a的数值为25;
(2)设20g的稀盐酸中溶质的质量为y
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73
5g y
解得:y=3.65g
该盐酸中溶质的质量分数是:18.3%
故答案为:(1)50%,25;(2)该盐酸中溶质的质量分数18.3%。
11.【解答】解:(1)由表可以看出生成二氧化碳的最大量为6.6g,在第8分钟和第12分钟时均为6.6g,则第10分钟也为6.6。
(2)设样品中碳酸钙的质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 6.6g
解得:x=15g
所以样品中碳酸钙的质量分数为100%=75%。
(3)根据表中给出的时间和气体的质量绘制图如下:
(4)由于碳酸氢钠和盐酸反应生成二氧化碳,导致烧碱吸收的二氧化碳大于碳酸钙和盐酸反应所生成的二氧化碳,进而导致测得的碳酸钙的质量分数偏大。
故答案为:(1)6.6;
(2)样品中碳酸钙的质量分数为75%
(3)见上图;(4)偏大
12.【解答】解:根据质量守恒定律可得,生成的氢气的质量为290.2g﹣290.0g=0.2g
设黄铜样品中锌的质量分数为x
Zn+H2SO4=ZnSO4+H2↑
65 2
20.0gx 0.2g
x=32.5%
故答案为:
(1)0.2;
(2)32.5%。
13.【解答】解:根据质量守恒定律可得,生成氢气的质量为97.0g﹣96.8g=0.2g
设参加反应的铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.2g
x=5.6g
则生铁样品中铁的质量分数为100%≈93.3%
答:(1)反应放出的氢气是0.2g.
(2)生铁样品中铁的质量分数是93.3%.
14.【解答】解:(1)根据二、四组数据可知,每15g样品中含铜8.5g、锌6.5g;通过二、三组对照可得,三组中硫酸过量,充分反应后剩余固体质量为铜的质量,则9g样品中含有铜的质量为5.1g,则表格中a的数值为5.1;
(2)根据二、四组数据可知,每15g样品中含铜8.5g、锌6.5g;可知20g样品中含有铜的质量为11.33g,可知第一次中样品有剩余,硫酸不足,并且可得每50g稀硫酸完全反应会消耗锌(即固体质量减少)6g,所以第二次为恰好完全反应,三、四次实验结束后,酸还有剩余;
(3)设50g稀硫酸中溶质的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 98
6.5g x
x=9.8g
则所用稀硫酸中溶质的质量分数是100%=19.6%。
故答案为:(1)5.1;
(2)三、四;
(3)19.6%。
15.【解答】解:(1)由表中的数据可知,每加入10g的稀硫酸消耗固体的质量为0.65g,第五次加入10g的稀硫酸只反应掉的固体是0.45g<0.65g,说明有剩余稀硫酸,剩余的固体是不反应的铜,所以黄铜样品中锌的质量为:10g﹣6.95g=3.05g;
所以黄铜样品中锌的质量分数为:100%=30.5%.
(2)设10g稀硫酸中溶质质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
0.65g x
解得:x=0.98gg
稀硫酸中溶质质量分数为:100%=9.8%
答:(1)黄铜样品中锌的质量分数为30.5%;
(2)所用稀硫酸的质量分数为9.8%.
故答案为:(1)30.5%;
(2)9.8%。
第1页(共1页)
同课章节目录
