微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用 课件 (共21张PPT) 鲁科版(2019) 必修 第二册
文档属性
| 名称 | 微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用 课件 (共21张PPT) 鲁科版(2019) 必修 第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 633.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-18 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
0
第1章 原子结构
元素周期律
微项目 海带提碘与海水提溴——体验元素性质递变
规律的实际应用
1.以海带提碘和海水提溴为例,体会元素周期律、元素周期表在分析、解决实际问题中的价值。
2.以海带提碘和海水提溴为例,建立物质分离、富集、提取的基本思路。
【项目活动1】 海带提碘
1.从海带中提取碘的实验原理及流程
(1)原理:选取氧化剂将I-氧化为碘单质;
①若选取氯水,离子方程式:___________________。
②若选取溴水,离子方程式: ___________________ 。
Cl2+2I-===I2+2Cl-
Br2+2I-===I2+2Br-
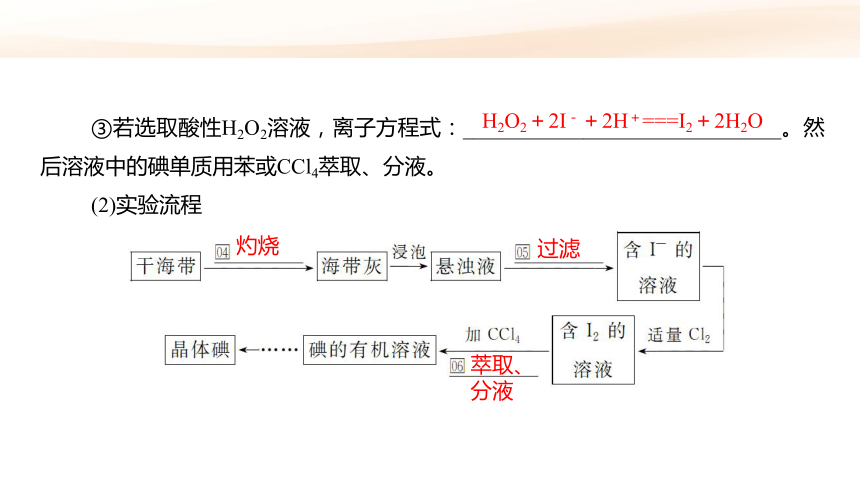
③若选取酸性H2O2溶液,离子方程式:_____________________________。然后溶液中的碘单质用苯或CCl4萃取、分液。
(2)实验流程
H2O2+2I-+2H+===I2+2H2O
灼烧
过滤
萃取、
分液
注意事项
(1)提取碘时海带不能用水洗,以防止洗去海带中的I-,但可用酒精洗;同时海带要干燥,因为湿的海带不易燃烧或燃烧不充分。
(2)灼烧海带温度较高,需在坩埚中进行,不能在烧杯或蒸发皿中进行。
2.萃取、分液的操作方法及注意事项
(1)萃取是利用某种溶质在两种互不相溶的溶剂里_________的不同,用一种溶剂将其从原溶剂提取出来的方法。加入的溶剂称为_______。分液是利用分液漏斗把_________的两种液体分开的操作。分液操作一般与萃取结合使用。
溶解能力
萃取剂
互不相溶
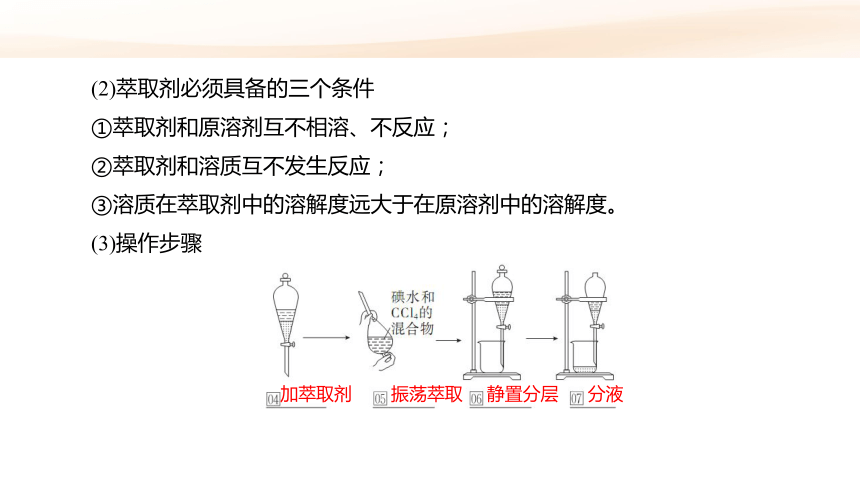
(2)萃取剂必须具备的三个条件
①萃取剂和原溶剂互不相溶、不反应;
②萃取剂和溶质互不发生反应;
③溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
(3)操作步骤
加萃取剂
振荡萃取
静置分层
分液
(4)注意事项
①振荡时,要不时的旋开活塞放气,以防止分液漏斗内压强过大引起危险。
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下,防止液体飞溅。
③分液漏斗在使用前要先查漏和查活塞转动是否灵活,再洗净。
④分液时,下层液体从下端导管口放出,上层液体从上口倒出。
3.从碘的四氯化碳溶液中提取碘
1.下列液体分别与碘水混合,充分振荡,静置后上层液体为紫红色,下层液体为无色的是( )
A.四氯化碳 B.酒精
C.汽油 D.氯化钠溶液
解析 CCl4的密度大于水,与碘不反应,碘在CCl4中的溶解度较大,所以碘水与CCl4混合,充分振荡,上层无色,下层呈现紫红色,故A错误;酒精与水互溶,故B错误;汽油的密度小于水,与碘不反应,碘在汽油中的溶解度较大,所以碘水与汽油混合,充分振荡,上层液体呈现紫红色,下层液体为无色,故C正确;氯化钠溶液与碘水混合,溶液不分层,故D错误。
2.下列关于四氯化碳用于萃取碘水中碘的理由不正确的是( )
A.四氯化碳的密度比水大
B.四氯化碳与水和碘均不反应
C.四氯化碳与原溶剂水互不相溶
D.碘在四氯化碳中的溶解度比在水中大得多
解析 灼烧固体时应在坩埚中进行,A不正确。
分液漏斗
(2)步骤③的实验操作名称是________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是________。
(3)步骤④反应的离子方程式是___________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是_______________________
___________________________________________。
(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:____________________________________________________________________________________________________________________________________。
过滤
蒸馏
2I-+MnO2+4H+===Mn2++I2+2H2O
苯与水互不相溶、不反应,碘与苯不反应,碘在苯中溶解度比在水中的大
取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察如果变蓝,说明有单质碘,否则没有单质碘
解析 (2)物质的分离方法是:固液分离用过滤,液液不互溶用分液,液液互溶且沸点相差较大用蒸馏。
华素片(西地碘片)使用说明书
品名:西地碘片
商品名:华素片
英文名:Gydiodine tablets
华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。
[贮藏]遮光、密闭、在阴凉处保存。
[有效期]二年
5.下面是关于药物华素片(西地碘片)使用说明书的部分内容。
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是________(写分子式)。
I2
②请推断华素片________(填“是”或“不是”)白色的。
(2)某学生为验证华素片中确实含有上述成分,完成实验如下,请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向试管中加入约1.5 mL________(填字母),并用力振荡。
A.酒精 B.四氯化碳
C.氯化钠溶液
②描述加入该液体后可能观察到的现象:_______________________________
___________________________。
不是
B
液体分层,上层几乎无色,下层呈紫红色
(3)请再设计另一种方法,验证华素片中的成分。(注意叙述实验操作方法和实验结论)__________________________________________________________________
______________________________________________________________________。
取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水,使其溶解,向试管中滴几滴淀粉溶液,溶液变蓝,证明有I2
【项目活动2】 海水提溴
1.溴单质的物理性质
常温常压下是有________的________色液体,有刺激性气味; ____溶于水,易溶于乙醇、CCl4等。
2.从海水中提取溴单质
从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤。
挥发性
深红棕
可
(1)浓缩:海水中Br-的含量一般为0.067 g·L-1,而苦卤(海水晒盐后得到的母液)中Br-的含量大得多,可做提取溴的原料。
(2)氧化:向苦卤中通入Cl2,发生反应_______________________。
(3)提取:利用溴的______性,鼓入热空气或水蒸气吹出溴,溴蒸气和吸收剂SO2反应: _________________________________ 。
再用Cl2将HBr氧化得到溴单质: ________________________ 。
Cl2+2Br-===2Cl-+Br2
Br2+SO2+2H2O===2HBr+H2SO4
2HBr+Cl2===2HCl+Br2
挥发
6.目前从海水中提取的溴约占世界溴年产量的三分之一,从海水中提取溴的主要步骤可表示为( )
A.氧化→吸收→吹出→氧化
B.氧化→吹出→吸收→氧化
C.吹出→氧化→吸收→氧化
D.吹出→吸收→氧化→吸收
解析 从海水中提取溴,先用氧化剂将溴离子氧化为溴单质,再用热空气吹出后用SO2吸收,再用氧化剂将HBr氧化为Br2。
7.海水综合利用部分流程如图所示,下列有关说法错误的是( )
A.实验室进行①的操作需用到坩埚、玻璃棒、酒精灯
B.②③④⑤涉及的反应均为氧化还原反应
C.X试剂可选用Na2SO3饱和溶液
D.⑤中离子方程式为2Br-+Cl2===Br2+2Cl-
解析 蒸发需用到蒸发皿,不需要坩埚。
8.海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
请回答下列问题。
(1)将海水浓缩的方法是________________。
(2)步骤①反应的离子方程式是________________________,1 mol Cl2参加反应,转移电子___ mol。
蒸发
Cl2+2Br-===2Cl-+Br2
2
(3)步骤②通入热空气吹出Br2,利用了Br2的________。(填字母)
A.氧化性 B.还原性
C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是________,在工业生产中此步骤应解决的问题是_________________________。
C
Br2
吸收尾气,防止污染空气
0
第1章 原子结构
元素周期律
微项目 海带提碘与海水提溴——体验元素性质递变
规律的实际应用
1.以海带提碘和海水提溴为例,体会元素周期律、元素周期表在分析、解决实际问题中的价值。
2.以海带提碘和海水提溴为例,建立物质分离、富集、提取的基本思路。
【项目活动1】 海带提碘
1.从海带中提取碘的实验原理及流程
(1)原理:选取氧化剂将I-氧化为碘单质;
①若选取氯水,离子方程式:___________________。
②若选取溴水,离子方程式: ___________________ 。
Cl2+2I-===I2+2Cl-
Br2+2I-===I2+2Br-
③若选取酸性H2O2溶液,离子方程式:_____________________________。然后溶液中的碘单质用苯或CCl4萃取、分液。
(2)实验流程
H2O2+2I-+2H+===I2+2H2O
灼烧
过滤
萃取、
分液
注意事项
(1)提取碘时海带不能用水洗,以防止洗去海带中的I-,但可用酒精洗;同时海带要干燥,因为湿的海带不易燃烧或燃烧不充分。
(2)灼烧海带温度较高,需在坩埚中进行,不能在烧杯或蒸发皿中进行。
2.萃取、分液的操作方法及注意事项
(1)萃取是利用某种溶质在两种互不相溶的溶剂里_________的不同,用一种溶剂将其从原溶剂提取出来的方法。加入的溶剂称为_______。分液是利用分液漏斗把_________的两种液体分开的操作。分液操作一般与萃取结合使用。
溶解能力
萃取剂
互不相溶
(2)萃取剂必须具备的三个条件
①萃取剂和原溶剂互不相溶、不反应;
②萃取剂和溶质互不发生反应;
③溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
(3)操作步骤
加萃取剂
振荡萃取
静置分层
分液
(4)注意事项
①振荡时,要不时的旋开活塞放气,以防止分液漏斗内压强过大引起危险。
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下,防止液体飞溅。
③分液漏斗在使用前要先查漏和查活塞转动是否灵活,再洗净。
④分液时,下层液体从下端导管口放出,上层液体从上口倒出。
3.从碘的四氯化碳溶液中提取碘
1.下列液体分别与碘水混合,充分振荡,静置后上层液体为紫红色,下层液体为无色的是( )
A.四氯化碳 B.酒精
C.汽油 D.氯化钠溶液
解析 CCl4的密度大于水,与碘不反应,碘在CCl4中的溶解度较大,所以碘水与CCl4混合,充分振荡,上层无色,下层呈现紫红色,故A错误;酒精与水互溶,故B错误;汽油的密度小于水,与碘不反应,碘在汽油中的溶解度较大,所以碘水与汽油混合,充分振荡,上层液体呈现紫红色,下层液体为无色,故C正确;氯化钠溶液与碘水混合,溶液不分层,故D错误。
2.下列关于四氯化碳用于萃取碘水中碘的理由不正确的是( )
A.四氯化碳的密度比水大
B.四氯化碳与水和碘均不反应
C.四氯化碳与原溶剂水互不相溶
D.碘在四氯化碳中的溶解度比在水中大得多
解析 灼烧固体时应在坩埚中进行,A不正确。
分液漏斗
(2)步骤③的实验操作名称是________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是________。
(3)步骤④反应的离子方程式是___________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是_______________________
___________________________________________。
(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:____________________________________________________________________________________________________________________________________。
过滤
蒸馏
2I-+MnO2+4H+===Mn2++I2+2H2O
苯与水互不相溶、不反应,碘与苯不反应,碘在苯中溶解度比在水中的大
取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察如果变蓝,说明有单质碘,否则没有单质碘
解析 (2)物质的分离方法是:固液分离用过滤,液液不互溶用分液,液液互溶且沸点相差较大用蒸馏。
华素片(西地碘片)使用说明书
品名:西地碘片
商品名:华素片
英文名:Gydiodine tablets
华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。
[贮藏]遮光、密闭、在阴凉处保存。
[有效期]二年
5.下面是关于药物华素片(西地碘片)使用说明书的部分内容。
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是________(写分子式)。
I2
②请推断华素片________(填“是”或“不是”)白色的。
(2)某学生为验证华素片中确实含有上述成分,完成实验如下,请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向试管中加入约1.5 mL________(填字母),并用力振荡。
A.酒精 B.四氯化碳
C.氯化钠溶液
②描述加入该液体后可能观察到的现象:_______________________________
___________________________。
不是
B
液体分层,上层几乎无色,下层呈紫红色
(3)请再设计另一种方法,验证华素片中的成分。(注意叙述实验操作方法和实验结论)__________________________________________________________________
______________________________________________________________________。
取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水,使其溶解,向试管中滴几滴淀粉溶液,溶液变蓝,证明有I2
【项目活动2】 海水提溴
1.溴单质的物理性质
常温常压下是有________的________色液体,有刺激性气味; ____溶于水,易溶于乙醇、CCl4等。
2.从海水中提取溴单质
从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤。
挥发性
深红棕
可
(1)浓缩:海水中Br-的含量一般为0.067 g·L-1,而苦卤(海水晒盐后得到的母液)中Br-的含量大得多,可做提取溴的原料。
(2)氧化:向苦卤中通入Cl2,发生反应_______________________。
(3)提取:利用溴的______性,鼓入热空气或水蒸气吹出溴,溴蒸气和吸收剂SO2反应: _________________________________ 。
再用Cl2将HBr氧化得到溴单质: ________________________ 。
Cl2+2Br-===2Cl-+Br2
Br2+SO2+2H2O===2HBr+H2SO4
2HBr+Cl2===2HCl+Br2
挥发
6.目前从海水中提取的溴约占世界溴年产量的三分之一,从海水中提取溴的主要步骤可表示为( )
A.氧化→吸收→吹出→氧化
B.氧化→吹出→吸收→氧化
C.吹出→氧化→吸收→氧化
D.吹出→吸收→氧化→吸收
解析 从海水中提取溴,先用氧化剂将溴离子氧化为溴单质,再用热空气吹出后用SO2吸收,再用氧化剂将HBr氧化为Br2。
7.海水综合利用部分流程如图所示,下列有关说法错误的是( )
A.实验室进行①的操作需用到坩埚、玻璃棒、酒精灯
B.②③④⑤涉及的反应均为氧化还原反应
C.X试剂可选用Na2SO3饱和溶液
D.⑤中离子方程式为2Br-+Cl2===Br2+2Cl-
解析 蒸发需用到蒸发皿,不需要坩埚。
8.海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
请回答下列问题。
(1)将海水浓缩的方法是________________。
(2)步骤①反应的离子方程式是________________________,1 mol Cl2参加反应,转移电子___ mol。
蒸发
Cl2+2Br-===2Cl-+Br2
2
(3)步骤②通入热空气吹出Br2,利用了Br2的________。(填字母)
A.氧化性 B.还原性
C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是________,在工业生产中此步骤应解决的问题是_________________________。
C
Br2
吸收尾气,防止污染空气
