陕西省2024-2025学年高三上学期1月期末化学试题(含答案)
文档属性
| 名称 | 陕西省2024-2025学年高三上学期1月期末化学试题(含答案) | 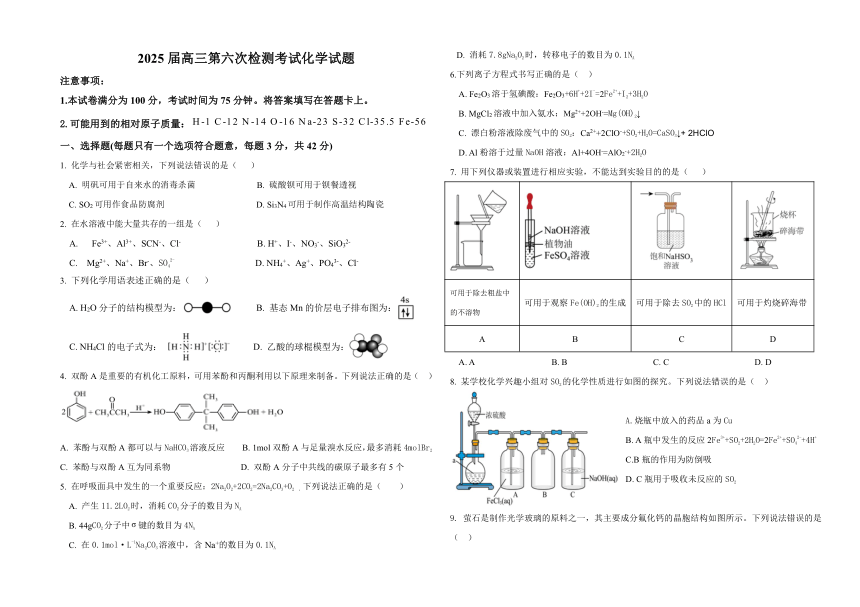 | |
| 格式 | docx | ||
| 文件大小 | 726.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-18 12:57:22 | ||
图片预览


文档简介
2025届高三第六次检测考试化学试题
注意事项:
1.本试卷满分为100分,考试时间为75分钟。将答案填写在答题卡上。
2.可能用到的相对原子质量:
一、选择题(每题只有一个选项符合题意,每题3分,共42分)
1. 化学与社会紧密相关,下列说法错误的是( )
A. 明矾可用于自来水的消毒杀菌 B. 硫酸钡可用于钡餐透视
C. SO2可用作食品防腐剂 D. Si3N4可用于制作高温结构陶瓷
2. 在水溶液中能大量共存的一组是( )
A. Fe3+、Al3+、SCN-、Cl- B. H+、I-、NO3-、SiO32-
C. Mg2+、Na+、Br-、SO42- D. NH4+、Ag+、PO43-、Cl-
3. 下列化学用语表述正确的是( )
A. H2O分子的结构模型为: B. 基态Mn的价层电子排布图为:
C. NH4Cl的电子式为: D. 乙酸的球棍模型为:
4. 双酚A是重要的有机化工原料,可用苯酚和丙酮利用以下原理来制备。下列说法正确的是( )
A. 苯酚与双酚A都可以与NaHCO3溶液反应 B. 1mol双酚A与足量溴水反应,最多消耗4molBr2
C. 苯酚与双酚A互为同系物 D. 双酚A分子中共线的碳原子最多有5个
5. 在呼吸面具中发生的一个重要反应:2Na2O2+2CO2=2Na2CO3+O2 ,下列说法正确的是( )
A. 产生11.2LO2时,消耗CO2分子的数目为NA
B. 44gCO2分子中键的数目为4NA
C. 在0.1mol·L-1Na2CO3溶液中,含Na+的数目为0.1NA
D. 消耗7.8gNa2O2时,转移电子的数目为0.1NA
6.下列离子方程式书写正确的是( )
A. Fe2O3溶于氢碘酸:Fe2O3+6H++2I-=2Fe2++I2+3H2O
B. MgCl2溶液中加入氨水:Mg2++2OH-=Mg(OH)2↓
C. 漂白粉溶液除废气中的SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+ 2HClO
D. Al粉溶于过量NaOH溶液:Al+4OH-=AlO2-+2H2O
7. 用下列仪器或装置进行相应实验,不能达到实验目的的是( )
可用于除去粗盐中的不溶物 可用于观察Fe(OH)2的生成 可用于除去SO2中的HCl 可用于灼烧碎海带
A B C D
A. A B. B C. C D. D
8. 某学校化学兴趣小组对SO2的化学性质进行如图的探究。下列说法错误的是( )
A.烧瓶中放入的药品a为Cu
B. A瓶中发生的反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
C.B瓶的作用为防倒吸
D. C瓶用于吸收未反应的SO2
萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如图所示。下列说法错误的是
( )
A.一个晶胞中有4个Ca2+
B. 每个 Ca2+周围距离最近且等距的F-有8个
C. 氟化钙晶体中只含纯粹的离子键
D. 基态氟原子核外电子的原子轨道有四种取向
10. 下列实验操作及现象和所得的结论均正确的是( )
实验操作及现象 实验结论
A 把分别蘸有浓硫酸和浓氨水玻璃棒靠近,有白烟产生 白烟为(NH4)2SO4
B 室温下,用PH试纸分别测定浓度为0.1mol·L-1的HClO溶液和0.1mol·L-1的HF溶液的PH,前者的PH大于后者 HClO的酸性小于HF
C 向亚硫酸钠试样中滴入盐酸酸化的Ba(NO3)2溶液,生成白色沉淀 试样已氧化变质
D 检验FeCl3溶液中是否含有Fe2+时,可滴入适量酸性KMnO4溶液,溶液紫红色褪去 不能证明溶液中含有Fe2+
A. A B. B C. C D. D
11. X、Y、Z、W是原子序数依次增大的短周期主族元素,X的一种同位素可用于测定文物的年代,其中X与Z同族,Y与X同周期,Y的第一电离能高于同周期的相邻元素,W的原子序数是X原子价电子数的4倍,下列说法正确的是( )
A. 氢化物的沸点:XC. 最高价含氧酸的酸性:W>X>Z D. X、Z形成的单质的晶体类型相同
12. 合成氨及氨氧化制硝酸的流程如图所示,下列说法错误的是( )
A. 从氨分离器中分离出氨,主要利用了其易液化的性质
B. 氧化炉中发生反应的化学方程式为
C. 向吸收塔中通入空气的主要作用是提高氮元素的利用率
D. 酸雨和光化学烟雾的形成均与氮氧化物有关
13. 下列说法中正确的是( )
A. 将0.2mol钠、镁、铝分别投入到200mL 1mol·L-1的盐酸中,标准状况下生成的气体体积比为
B. 足量铝分别与等物质的量的盐酸、氢氧化钠溶液反应,在同温同压下生成的气体一样多
C. 向FeCl3和CuCl2的混合溶液中加入铁粉充分反应后,若有固体剩余,则溶液中一定有Fe2+,可能有Cu2+、Fe3+
D. 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,生成的CO2的质量前者多
14. 某化学学习小组探究FeSO4与“84消毒液的反应过程,向酸化的FeSO4溶液中逐滴滴入“84消毒液,780s时停止滴入;滴加过程中bc、cd段产生刺激性气味的气体。采用pH传感器测得溶液的pH随时间t(s)的变化曲线如图所示。下列说法错误的是( )
A.ab段中有部分Fe2+变成了Fe3+
B. bc段的主要反应为2ClO-+2Fe2++2OH-+2H2O = Cl2↑ + Fe(OH)3↓
C. cd段产生刺激性气味气体的反应为ClO-+Cl-+2H+ = Cl2↑ + H2O
D. de段pH减小的原因是氯气溶于水反应产生酸性物质
二、非选择题(共58分)
15. 铁是人类较早使用的金属之一,铁及其化合物在生产、生活中有重要的用途。回答下列问题。
(1)实验室鉴别胶体与饱和FeCl3溶液的方法是_________________________________。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
①发生反应的离子方程式为____________________________________________。
②为检验FeCl3腐蚀铜后所得溶液中含有Fe2+,应使用的试剂为____________________
③欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液循环利用,现有下列试剂:A.浓硝酸 B.铁粉C.氯气D.烧碱E.浓氨水,需要用到的试剂除盐酸外还需要______________________(选填字母)。
(3)纳米Fe/Ni复合材料,可有效去除酸性废水中的NO3-,其反应过程(Ni不参与反应)如图所示:
①四种元素的电负性从大到小的顺序是_________________________________。
②反应ⅱ的离子方程式为_________________________________。
③假设每步反应都能彻底进行,则反应i和ⅱ中消耗还原剂的质量之比为_________________。
16. 化学创造美好生活。磷酸锌是一种绿色环保涂料,实验室用锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备。(难溶于水)的流程如下,回答下列问题:
已知:①本实验条件下高锰酸钾的还原产物为MnO2。
②。
(1)滤渣I主要成分为___________________。
(2)步骤I的主要目的是除去铁元素,需先将溶液的PH调至5.0,再滴加KMnO4溶液,滴加时的离子方程式为___________________________________________。
(3)步骤Ⅱ的主要目的是除去铜元素,试剂a为___________________(填化学式)。
(4)步骤Ⅲ在加热条件下生成一种温室气体和沉淀,其离子方程式为___________________________________。
(5)步骤IV反应结束后,得到的操作包括___________、___________和干燥。
(6)锌的某种氧化物的立方晶胞结构如下图所示,晶胞参数为。
(晶胞中a为氧,b为锌)
①写出基态Zn原子的价层电子排布式___________________________。
②Zn和O之间最短的距离为___________________________。
17. 氮及其化合物在工农业生产和生活中有着重要作用。有资料显示过量的氨气和氯气在常温下可合成NH4Cl(岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)NH4Cl制备:
①利用装置B制取实验所需的氯气,写出该反应的化学方程式___________________________。
②装置C的名称为___________________________。
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:___________→fe←h←g←___________________(用小写字母和箭头表示,箭头方向与气流方向一致)。
④该实验装置除了D处导管易堵塞外,还存在的不足之处是___________________________。
⑤验证岩脑砂中所含NH4+的操作为___________________________________________。
(2)岩脑砂中元素的定量测定:准确称取岩脑砂,与足量的氧化铜混合加热,发生的反应为,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。
①装置H中盛装的试剂是___________________________________(填试剂名称)。
②已知装置J中也装有碱石灰,其目的是___________________________________。
③若装置I增重,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为),则岩脑砂中___________________________(用含b、V代数式表示,不必化简)。
18. 有机化学中有很多人名反应,德国化学家Beckmann(贝克曼)在研究薄荷酮肟的空间排列时,发现了酮肟在酸性催化剂如硫酸、多聚磷酸等作用下可以重排成酰胺,后来被称之为Beckmann重排反应。
该反应在工业上的一个重要应用是合成己内酰胺(题目中用G表示),从而进一步合成尼龙(锦纶),其反应过程如下:
(1)有机物B的名称_____________________。
(2)写出有机物E的结构简式______________。
(3)B→C和D→E的反应类型分别为______、______。
(4)有机物C转化为D所需的试剂和条件_________________________________。
(5)有机物F有多种同分异构体,写出所有满足以下条件的有机物结构简式___________。
①只含有一个环,且为六元环;②核磁共振氢谱显示有3组峰。
以M( )为原料,利用上述合成路线中的相关信息和试剂,合成有机物N( )。写出制备N的合成路线____________________________________________。(表示苯基,路线中原料和目标有机物用相应的字母M和N表示)。
高三年级第六次检测考试化学答案
一、选择题(每题只有一个选项符合题意,每题3分,共42分)
1.A 2.C 3.C 4.B 5.D 6.A 7.D 8.A 9.C 10.D
11.C 12.B 13.D 14B
二、非选择题(共58分)
15.(12分,每空2分)(1)丁达尔效应
(2) ①. ②. 铁氰化钾溶液或溶液 ③. BC
(3) ①. ②. ③.
16.(共14分,未标注的每空2分)
(1)、 (2)
(3)、(等合理答案也得分)
(4)
(5) ①. 过滤(1分) ②. 洗涤 (1分)
(6) ①. ②.
17.(共18分,每空2分)(1)①. ②. (球形)干燥管 ③. a→d→c ④. j←i←b ⑤. 无尾气处理装置 ⑥. 取少量岩脑砂于试管中,加少量蒸馏水溶解,再加入适量浓溶液并加热,若产生使湿润的红色石蕊试纸变蓝的气体,则含有
(2) ①. 浓硫酸 ②. 防止装置K中的水蒸气进入装置I,影响实验结果
③.
18.(12分,未标注的每空2分)
(1)溴苯 (2)
(3) ①. 加成反应或还原反应 (1分) ②. 氧化反应 (1分)
(4)(氢氧化钠水溶液),加热
(5) 、
(6)
注意事项:
1.本试卷满分为100分,考试时间为75分钟。将答案填写在答题卡上。
2.可能用到的相对原子质量:
一、选择题(每题只有一个选项符合题意,每题3分,共42分)
1. 化学与社会紧密相关,下列说法错误的是( )
A. 明矾可用于自来水的消毒杀菌 B. 硫酸钡可用于钡餐透视
C. SO2可用作食品防腐剂 D. Si3N4可用于制作高温结构陶瓷
2. 在水溶液中能大量共存的一组是( )
A. Fe3+、Al3+、SCN-、Cl- B. H+、I-、NO3-、SiO32-
C. Mg2+、Na+、Br-、SO42- D. NH4+、Ag+、PO43-、Cl-
3. 下列化学用语表述正确的是( )
A. H2O分子的结构模型为: B. 基态Mn的价层电子排布图为:
C. NH4Cl的电子式为: D. 乙酸的球棍模型为:
4. 双酚A是重要的有机化工原料,可用苯酚和丙酮利用以下原理来制备。下列说法正确的是( )
A. 苯酚与双酚A都可以与NaHCO3溶液反应 B. 1mol双酚A与足量溴水反应,最多消耗4molBr2
C. 苯酚与双酚A互为同系物 D. 双酚A分子中共线的碳原子最多有5个
5. 在呼吸面具中发生的一个重要反应:2Na2O2+2CO2=2Na2CO3+O2 ,下列说法正确的是( )
A. 产生11.2LO2时,消耗CO2分子的数目为NA
B. 44gCO2分子中键的数目为4NA
C. 在0.1mol·L-1Na2CO3溶液中,含Na+的数目为0.1NA
D. 消耗7.8gNa2O2时,转移电子的数目为0.1NA
6.下列离子方程式书写正确的是( )
A. Fe2O3溶于氢碘酸:Fe2O3+6H++2I-=2Fe2++I2+3H2O
B. MgCl2溶液中加入氨水:Mg2++2OH-=Mg(OH)2↓
C. 漂白粉溶液除废气中的SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+ 2HClO
D. Al粉溶于过量NaOH溶液:Al+4OH-=AlO2-+2H2O
7. 用下列仪器或装置进行相应实验,不能达到实验目的的是( )
可用于除去粗盐中的不溶物 可用于观察Fe(OH)2的生成 可用于除去SO2中的HCl 可用于灼烧碎海带
A B C D
A. A B. B C. C D. D
8. 某学校化学兴趣小组对SO2的化学性质进行如图的探究。下列说法错误的是( )
A.烧瓶中放入的药品a为Cu
B. A瓶中发生的反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
C.B瓶的作用为防倒吸
D. C瓶用于吸收未反应的SO2
萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如图所示。下列说法错误的是
( )
A.一个晶胞中有4个Ca2+
B. 每个 Ca2+周围距离最近且等距的F-有8个
C. 氟化钙晶体中只含纯粹的离子键
D. 基态氟原子核外电子的原子轨道有四种取向
10. 下列实验操作及现象和所得的结论均正确的是( )
实验操作及现象 实验结论
A 把分别蘸有浓硫酸和浓氨水玻璃棒靠近,有白烟产生 白烟为(NH4)2SO4
B 室温下,用PH试纸分别测定浓度为0.1mol·L-1的HClO溶液和0.1mol·L-1的HF溶液的PH,前者的PH大于后者 HClO的酸性小于HF
C 向亚硫酸钠试样中滴入盐酸酸化的Ba(NO3)2溶液,生成白色沉淀 试样已氧化变质
D 检验FeCl3溶液中是否含有Fe2+时,可滴入适量酸性KMnO4溶液,溶液紫红色褪去 不能证明溶液中含有Fe2+
A. A B. B C. C D. D
11. X、Y、Z、W是原子序数依次增大的短周期主族元素,X的一种同位素可用于测定文物的年代,其中X与Z同族,Y与X同周期,Y的第一电离能高于同周期的相邻元素,W的原子序数是X原子价电子数的4倍,下列说法正确的是( )
A. 氢化物的沸点:X
12. 合成氨及氨氧化制硝酸的流程如图所示,下列说法错误的是( )
A. 从氨分离器中分离出氨,主要利用了其易液化的性质
B. 氧化炉中发生反应的化学方程式为
C. 向吸收塔中通入空气的主要作用是提高氮元素的利用率
D. 酸雨和光化学烟雾的形成均与氮氧化物有关
13. 下列说法中正确的是( )
A. 将0.2mol钠、镁、铝分别投入到200mL 1mol·L-1的盐酸中,标准状况下生成的气体体积比为
B. 足量铝分别与等物质的量的盐酸、氢氧化钠溶液反应,在同温同压下生成的气体一样多
C. 向FeCl3和CuCl2的混合溶液中加入铁粉充分反应后,若有固体剩余,则溶液中一定有Fe2+,可能有Cu2+、Fe3+
D. 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,生成的CO2的质量前者多
14. 某化学学习小组探究FeSO4与“84消毒液的反应过程,向酸化的FeSO4溶液中逐滴滴入“84消毒液,780s时停止滴入;滴加过程中bc、cd段产生刺激性气味的气体。采用pH传感器测得溶液的pH随时间t(s)的变化曲线如图所示。下列说法错误的是( )
A.ab段中有部分Fe2+变成了Fe3+
B. bc段的主要反应为2ClO-+2Fe2++2OH-+2H2O = Cl2↑ + Fe(OH)3↓
C. cd段产生刺激性气味气体的反应为ClO-+Cl-+2H+ = Cl2↑ + H2O
D. de段pH减小的原因是氯气溶于水反应产生酸性物质
二、非选择题(共58分)
15. 铁是人类较早使用的金属之一,铁及其化合物在生产、生活中有重要的用途。回答下列问题。
(1)实验室鉴别胶体与饱和FeCl3溶液的方法是_________________________________。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
①发生反应的离子方程式为____________________________________________。
②为检验FeCl3腐蚀铜后所得溶液中含有Fe2+,应使用的试剂为____________________
③欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液循环利用,现有下列试剂:A.浓硝酸 B.铁粉C.氯气D.烧碱E.浓氨水,需要用到的试剂除盐酸外还需要______________________(选填字母)。
(3)纳米Fe/Ni复合材料,可有效去除酸性废水中的NO3-,其反应过程(Ni不参与反应)如图所示:
①四种元素的电负性从大到小的顺序是_________________________________。
②反应ⅱ的离子方程式为_________________________________。
③假设每步反应都能彻底进行,则反应i和ⅱ中消耗还原剂的质量之比为_________________。
16. 化学创造美好生活。磷酸锌是一种绿色环保涂料,实验室用锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备。(难溶于水)的流程如下,回答下列问题:
已知:①本实验条件下高锰酸钾的还原产物为MnO2。
②。
(1)滤渣I主要成分为___________________。
(2)步骤I的主要目的是除去铁元素,需先将溶液的PH调至5.0,再滴加KMnO4溶液,滴加时的离子方程式为___________________________________________。
(3)步骤Ⅱ的主要目的是除去铜元素,试剂a为___________________(填化学式)。
(4)步骤Ⅲ在加热条件下生成一种温室气体和沉淀,其离子方程式为___________________________________。
(5)步骤IV反应结束后,得到的操作包括___________、___________和干燥。
(6)锌的某种氧化物的立方晶胞结构如下图所示,晶胞参数为。
(晶胞中a为氧,b为锌)
①写出基态Zn原子的价层电子排布式___________________________。
②Zn和O之间最短的距离为___________________________。
17. 氮及其化合物在工农业生产和生活中有着重要作用。有资料显示过量的氨气和氯气在常温下可合成NH4Cl(岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)NH4Cl制备:
①利用装置B制取实验所需的氯气,写出该反应的化学方程式___________________________。
②装置C的名称为___________________________。
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:___________→fe←h←g←___________________(用小写字母和箭头表示,箭头方向与气流方向一致)。
④该实验装置除了D处导管易堵塞外,还存在的不足之处是___________________________。
⑤验证岩脑砂中所含NH4+的操作为___________________________________________。
(2)岩脑砂中元素的定量测定:准确称取岩脑砂,与足量的氧化铜混合加热,发生的反应为,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。
①装置H中盛装的试剂是___________________________________(填试剂名称)。
②已知装置J中也装有碱石灰,其目的是___________________________________。
③若装置I增重,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为),则岩脑砂中___________________________(用含b、V代数式表示,不必化简)。
18. 有机化学中有很多人名反应,德国化学家Beckmann(贝克曼)在研究薄荷酮肟的空间排列时,发现了酮肟在酸性催化剂如硫酸、多聚磷酸等作用下可以重排成酰胺,后来被称之为Beckmann重排反应。
该反应在工业上的一个重要应用是合成己内酰胺(题目中用G表示),从而进一步合成尼龙(锦纶),其反应过程如下:
(1)有机物B的名称_____________________。
(2)写出有机物E的结构简式______________。
(3)B→C和D→E的反应类型分别为______、______。
(4)有机物C转化为D所需的试剂和条件_________________________________。
(5)有机物F有多种同分异构体,写出所有满足以下条件的有机物结构简式___________。
①只含有一个环,且为六元环;②核磁共振氢谱显示有3组峰。
以M( )为原料,利用上述合成路线中的相关信息和试剂,合成有机物N( )。写出制备N的合成路线____________________________________________。(表示苯基,路线中原料和目标有机物用相应的字母M和N表示)。
高三年级第六次检测考试化学答案
一、选择题(每题只有一个选项符合题意,每题3分,共42分)
1.A 2.C 3.C 4.B 5.D 6.A 7.D 8.A 9.C 10.D
11.C 12.B 13.D 14B
二、非选择题(共58分)
15.(12分,每空2分)(1)丁达尔效应
(2) ①. ②. 铁氰化钾溶液或溶液 ③. BC
(3) ①. ②. ③.
16.(共14分,未标注的每空2分)
(1)、 (2)
(3)、(等合理答案也得分)
(4)
(5) ①. 过滤(1分) ②. 洗涤 (1分)
(6) ①. ②.
17.(共18分,每空2分)(1)①. ②. (球形)干燥管 ③. a→d→c ④. j←i←b ⑤. 无尾气处理装置 ⑥. 取少量岩脑砂于试管中,加少量蒸馏水溶解,再加入适量浓溶液并加热,若产生使湿润的红色石蕊试纸变蓝的气体,则含有
(2) ①. 浓硫酸 ②. 防止装置K中的水蒸气进入装置I,影响实验结果
③.
18.(12分,未标注的每空2分)
(1)溴苯 (2)
(3) ①. 加成反应或还原反应 (1分) ②. 氧化反应 (1分)
(4)(氢氧化钠水溶液),加热
(5) 、
(6)
同课章节目录
