2.2.2电池原理的应用(共22张ppt)化学鲁科版(2019)必修第二册
文档属性
| 名称 | 2.2.2电池原理的应用(共22张ppt)化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-19 20:44:07 | ||
图片预览



文档简介
(共22张PPT)
第二章 化学键 化学反应规律
第2课时 电池原理的应用
第二节 化学反应与能量转化
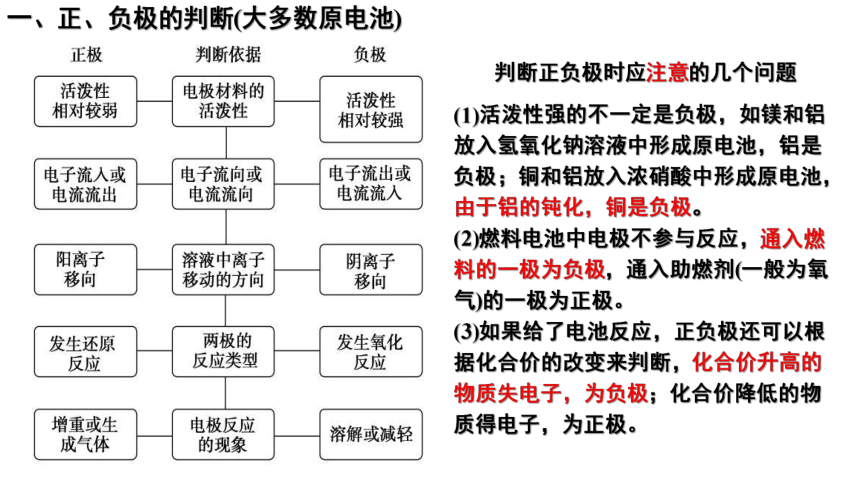
判断正负极时应注意的几个问题
(1)活泼性强的不一定是负极,如镁和铝放入氢氧化钠溶液中形成原电池,铝是负极;铜和铝放入浓硝酸中形成原电池,由于铝的钝化,铜是负极。
(2)燃料电池中电极不参与反应,通入燃料的一极为负极,通入助燃剂(一般为氧气)的一极为正极。
(3)如果给了电池反应,正负极还可以根据化合价的改变来判断,化合价升高的物质失电子,为负极;化合价降低的物质得电子,为正极。
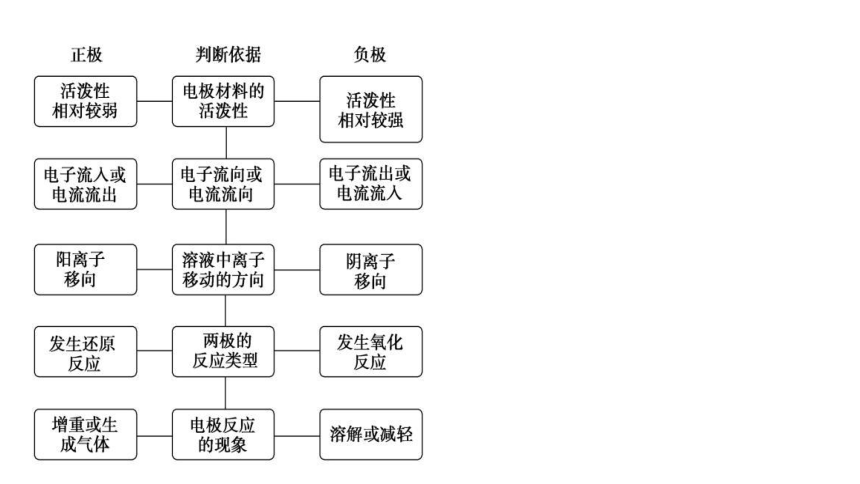
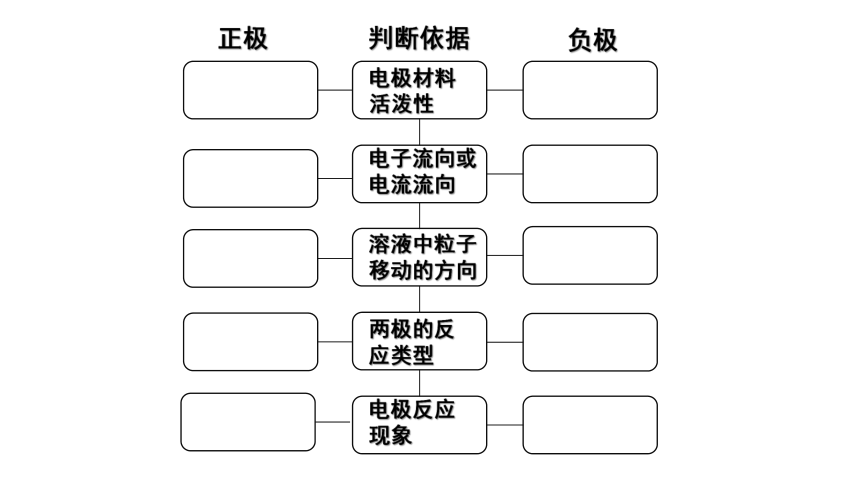
一、正、负极的判断(大多数原电池)
判断依据
电极材料活泼性
电子流向或电流流向
溶液中粒子移动的方向
两极的反应类型
电极反应现象
负极
正极
二、加快反应速率
【实验·探究】
实验内容 实验现象 结论
在试管1、2中加入一定量的锌片和等量的稀盐酸,观察现象;在试管2中滴加几滴硫酸铜溶液,观察实验现象并思考。 [试管1]
[试管2] 试管1锌片溶解,并冒出气泡
试管2在滴入硫酸铜溶液后,气泡产生速率加快。
利用原电池原理可以加快化学反应速率。
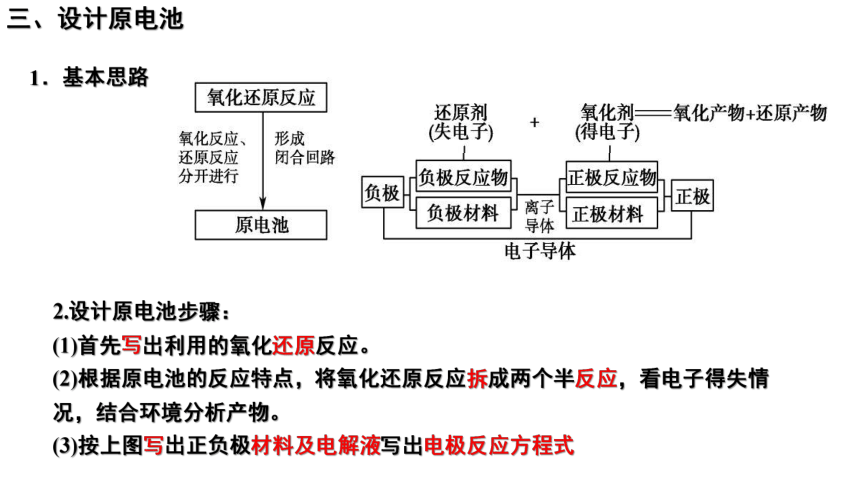
三、设计原电池
1.基本思路
2.设计原电池步骤:
(1)首先写出利用的氧化还原反应。
(2)根据原电池的反应特点,将氧化还原反应拆成两个半反应,看电子得失情况,结合环境分析产物。
(3)按上图写出正负极材料及电解液写出电极反应方程式
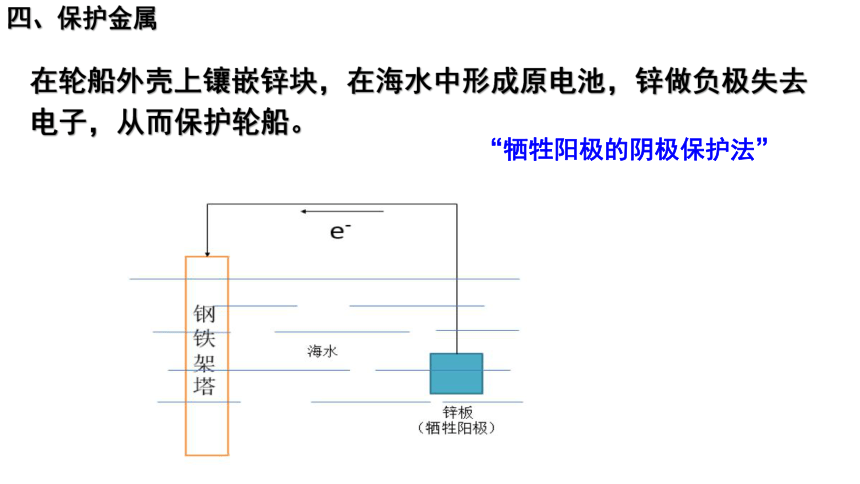
四、保护金属
在轮船外壳上镶嵌锌块,在海水中形成原电池,锌做负极失去电子,从而保护轮船。
“牺牲负极的正极保护法”
“牺牲负极的正极保护法”
“牺牲阳极的阴极保护法”
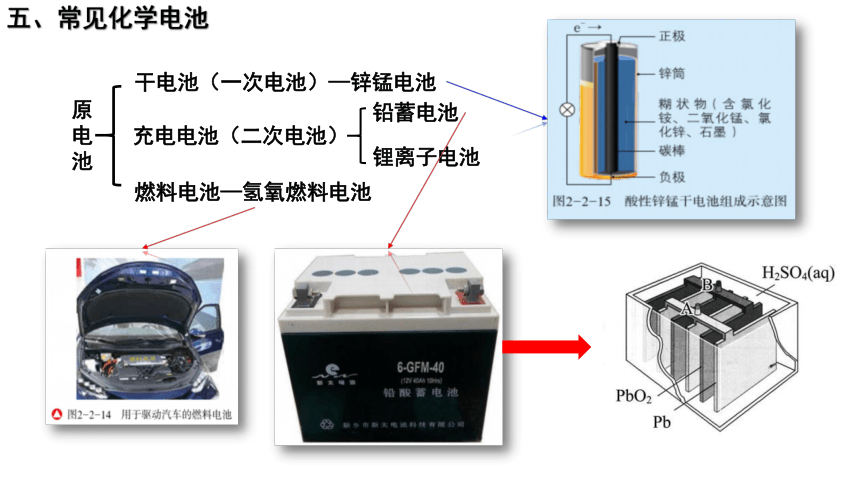
五、常见化学电池
原电池
干电池(一次电池)—锌锰电池
充电电池(二次电池)
燃料电池—氢氧燃料电池
铅蓄电池
锂离子电池
燃料电池是利用燃料(如H2、CO、CH4等)跟氧气反应从而将化学能转化成电能的装置。如图是关于CO空气燃料电池(KOH作电解质)。
a极 为______极 发生_________ 通入_______
b极 为______极 发生_________ 通入_______
内电路中钾离子移动方向 由a极向b极移动 负
氧化反应
H2
正
还原反应
空气
燃料电池的原理
基于燃料电池的电极反应方程式的书写
Ⅰ.氢氧燃料电池
a.电解液为H2SO4
【复习·回顾】
缺项氧化还原反应方程式的配平,缺项常为H2O、H+、OH-
b.电解液为NaOH
c.高温熔融氧化物为电解质
d.熔融碳酸盐为电解质
__MnO4-+ __ C2O42-+____= __ Mn2++ __ CO2+___
__ ClO3-+ __ Fe2++____= __ Cl-+ __ Fe3++___
得失电子守恒→电荷守恒→质量守恒
基于燃料电池的电极反应方程式的书写
Ⅱ.乙醇燃料电池
a.电解液为H2SO4
b.电解液为NaOH
c.高温熔融氧化物为电解质
d.熔融碳酸盐为电解质
Ⅲ.肼(N2H4)燃料电池
a.电解液为H2SO4
b.电解液为NaOH
质子交换膜
五、常见化学电池
充电电池:铅蓄电池
PbO2+Pb+2H2SO4 2PbSO4+2H2O
放电
充电
【思考】
试着写出电极反应方程式
五、常见化学电池
干电池(一次电池)—锌锰电池
1、锌锰干电池
负极(锌筒):
总反应:
Zn + 2MnO2 + 2NH4 + =Zn2+ +Mn2O3+2NH3 ↑ + H2O
Zn -2e Zn2+
=
2MnO2 + 2NH4 + + 2e Mn2O3+2NH3 ↑ + H2O
=
正极(石墨):
2、碱性干电池
电极 :
Zn为负极,碳棒为正极
电解液:
KOH
负极:
Zn + 2OH- - 2e- == Zn(OH)2
2MnO2 + H2O + 2e- == Mn2O3 + 2OH-
Zn + 2MnO2 + H2O == Zn(OH)2 + Mn2O3
总反应:
正极:
碱性干电池的优点:能量和储存时间有所提高,适用于大电流和连续放电;不易发生泄漏
五、常见化学电池
以能力为本!
拓展·创新
质子交换膜
微生物燃料电池工作示意图
微生物燃料电池(microbial fuel cell,缩写MFC),使用自然界细菌及仿真细菌交互作用产生电流。
【思考】
根据示意图试着写出电极反应方程式
拓展·创新
【思考】
根据示意图试着写出电极反应方程式
氮化镓光电池
氮化镓光电池
利用该装置成功地实现了以CO2和H2O为原料来合成CH4
1.把a、b、c、d四块金属片浸入稀疏酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;b、c相连时,c上有大量气泡;b、d相连时,d上有大量气泡产生,则这四种金属的活动顺序由强到弱为( )A.a>b>c>d B.a>c>b>d C.c>a>b>d D.b>d>c>a
A
2.一个原电池总反应为Zn+Cu2+===Zn2++Cu,该电池材料及电解质溶液可能是( )
选项 正极 负极 电解质溶液
A Zn Cu CuCl2
B Cu Zn H2SO4
C Cu Zn CuSO4
D Ag Cu CuSO4
C
3.将等质量的两份锌粉a、b分别加入过量稀硫酸中,同时向a中加少量CuSO4溶液,图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
A
B
C
D
A
4.某活动小组设计原电池装置,你认为设计合理的是( )
A B C D
B
5.下列关于原电池的叙述中错误的是( )A.电子流入的一极为正极 B.一般不活泼的一极为正极C.电子流出的一极为负极 D.发生氧化反应的一极为正极
D
6.氢氧燃料电池可以用在航天飞机上,其反应原理示意图如图所示。下列有关氢氧燃料电池的说法不正确的是 ( )A.该电池工作时化学能转化为电能B.该电池中电极b是正极,发生还原反应C.电流由电极a通过导线流向电极bD.该电池的总反应为2H2+O2===2H2O
C
能源的分类
1、按转换传递过程分类:
(1)一次能源,是指直接取自自然界没有经过加工转换的各种能量和资源。如:煤、石油、天然气、水能、风能、校能、海洋能、生物能。
(2)二次能源,由一次能源经过加工转换以后得到的能源产品如:沼气、汽油、柴油、焦炭、煤气、蒸汽、火、水电、核电、太阳能发电、潮汐发电、波浪发电等。
2、按属性分类:
(1)可再生能源,指具有自然恢复能力,不会随本身的转化或人类的利用而日益减少的能源。如:太阳能、地热、水能、风能、生物能、海洋能。
(2)非可再生能源,则不能自然再生。如:煤、石油、天然气、核能、油页岩。
3、按开发利用状况分类:
(1)常规能源,是指当前被广泛利用的一次能源。如:煤、石油、天然气、水能生物能。
(2)新能源,是目前尚术广泛利用而正在积极研究以便推广利用的一次能源。如:核能、地热、海洋能、太阳能、风能。
4、按是否清洁分
(1)清洁能源:指对环境无污染或污染小的能源。如:太阳能、水能、风能。
(2)非清洁能源:指对环境污染较大的能源。如:煤、石油、天然气。
能源的分类
第二章 化学键 化学反应规律
第2课时 电池原理的应用
第二节 化学反应与能量转化
判断正负极时应注意的几个问题
(1)活泼性强的不一定是负极,如镁和铝放入氢氧化钠溶液中形成原电池,铝是负极;铜和铝放入浓硝酸中形成原电池,由于铝的钝化,铜是负极。
(2)燃料电池中电极不参与反应,通入燃料的一极为负极,通入助燃剂(一般为氧气)的一极为正极。
(3)如果给了电池反应,正负极还可以根据化合价的改变来判断,化合价升高的物质失电子,为负极;化合价降低的物质得电子,为正极。
一、正、负极的判断(大多数原电池)
判断依据
电极材料活泼性
电子流向或电流流向
溶液中粒子移动的方向
两极的反应类型
电极反应现象
负极
正极
二、加快反应速率
【实验·探究】
实验内容 实验现象 结论
在试管1、2中加入一定量的锌片和等量的稀盐酸,观察现象;在试管2中滴加几滴硫酸铜溶液,观察实验现象并思考。 [试管1]
[试管2] 试管1锌片溶解,并冒出气泡
试管2在滴入硫酸铜溶液后,气泡产生速率加快。
利用原电池原理可以加快化学反应速率。
三、设计原电池
1.基本思路
2.设计原电池步骤:
(1)首先写出利用的氧化还原反应。
(2)根据原电池的反应特点,将氧化还原反应拆成两个半反应,看电子得失情况,结合环境分析产物。
(3)按上图写出正负极材料及电解液写出电极反应方程式
四、保护金属
在轮船外壳上镶嵌锌块,在海水中形成原电池,锌做负极失去电子,从而保护轮船。
“牺牲负极的正极保护法”
“牺牲负极的正极保护法”
“牺牲阳极的阴极保护法”
五、常见化学电池
原电池
干电池(一次电池)—锌锰电池
充电电池(二次电池)
燃料电池—氢氧燃料电池
铅蓄电池
锂离子电池
燃料电池是利用燃料(如H2、CO、CH4等)跟氧气反应从而将化学能转化成电能的装置。如图是关于CO空气燃料电池(KOH作电解质)。
a极 为______极 发生_________ 通入_______
b极 为______极 发生_________ 通入_______
内电路中钾离子移动方向 由a极向b极移动 负
氧化反应
H2
正
还原反应
空气
燃料电池的原理
基于燃料电池的电极反应方程式的书写
Ⅰ.氢氧燃料电池
a.电解液为H2SO4
【复习·回顾】
缺项氧化还原反应方程式的配平,缺项常为H2O、H+、OH-
b.电解液为NaOH
c.高温熔融氧化物为电解质
d.熔融碳酸盐为电解质
__MnO4-+ __ C2O42-+____= __ Mn2++ __ CO2+___
__ ClO3-+ __ Fe2++____= __ Cl-+ __ Fe3++___
得失电子守恒→电荷守恒→质量守恒
基于燃料电池的电极反应方程式的书写
Ⅱ.乙醇燃料电池
a.电解液为H2SO4
b.电解液为NaOH
c.高温熔融氧化物为电解质
d.熔融碳酸盐为电解质
Ⅲ.肼(N2H4)燃料电池
a.电解液为H2SO4
b.电解液为NaOH
质子交换膜
五、常见化学电池
充电电池:铅蓄电池
PbO2+Pb+2H2SO4 2PbSO4+2H2O
放电
充电
【思考】
试着写出电极反应方程式
五、常见化学电池
干电池(一次电池)—锌锰电池
1、锌锰干电池
负极(锌筒):
总反应:
Zn + 2MnO2 + 2NH4 + =Zn2+ +Mn2O3+2NH3 ↑ + H2O
Zn -2e Zn2+
=
2MnO2 + 2NH4 + + 2e Mn2O3+2NH3 ↑ + H2O
=
正极(石墨):
2、碱性干电池
电极 :
Zn为负极,碳棒为正极
电解液:
KOH
负极:
Zn + 2OH- - 2e- == Zn(OH)2
2MnO2 + H2O + 2e- == Mn2O3 + 2OH-
Zn + 2MnO2 + H2O == Zn(OH)2 + Mn2O3
总反应:
正极:
碱性干电池的优点:能量和储存时间有所提高,适用于大电流和连续放电;不易发生泄漏
五、常见化学电池
以能力为本!
拓展·创新
质子交换膜
微生物燃料电池工作示意图
微生物燃料电池(microbial fuel cell,缩写MFC),使用自然界细菌及仿真细菌交互作用产生电流。
【思考】
根据示意图试着写出电极反应方程式
拓展·创新
【思考】
根据示意图试着写出电极反应方程式
氮化镓光电池
氮化镓光电池
利用该装置成功地实现了以CO2和H2O为原料来合成CH4
1.把a、b、c、d四块金属片浸入稀疏酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;b、c相连时,c上有大量气泡;b、d相连时,d上有大量气泡产生,则这四种金属的活动顺序由强到弱为( )A.a>b>c>d B.a>c>b>d C.c>a>b>d D.b>d>c>a
A
2.一个原电池总反应为Zn+Cu2+===Zn2++Cu,该电池材料及电解质溶液可能是( )
选项 正极 负极 电解质溶液
A Zn Cu CuCl2
B Cu Zn H2SO4
C Cu Zn CuSO4
D Ag Cu CuSO4
C
3.将等质量的两份锌粉a、b分别加入过量稀硫酸中,同时向a中加少量CuSO4溶液,图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
A
B
C
D
A
4.某活动小组设计原电池装置,你认为设计合理的是( )
A B C D
B
5.下列关于原电池的叙述中错误的是( )A.电子流入的一极为正极 B.一般不活泼的一极为正极C.电子流出的一极为负极 D.发生氧化反应的一极为正极
D
6.氢氧燃料电池可以用在航天飞机上,其反应原理示意图如图所示。下列有关氢氧燃料电池的说法不正确的是 ( )A.该电池工作时化学能转化为电能B.该电池中电极b是正极,发生还原反应C.电流由电极a通过导线流向电极bD.该电池的总反应为2H2+O2===2H2O
C
能源的分类
1、按转换传递过程分类:
(1)一次能源,是指直接取自自然界没有经过加工转换的各种能量和资源。如:煤、石油、天然气、水能、风能、校能、海洋能、生物能。
(2)二次能源,由一次能源经过加工转换以后得到的能源产品如:沼气、汽油、柴油、焦炭、煤气、蒸汽、火、水电、核电、太阳能发电、潮汐发电、波浪发电等。
2、按属性分类:
(1)可再生能源,指具有自然恢复能力,不会随本身的转化或人类的利用而日益减少的能源。如:太阳能、地热、水能、风能、生物能、海洋能。
(2)非可再生能源,则不能自然再生。如:煤、石油、天然气、核能、油页岩。
3、按开发利用状况分类:
(1)常规能源,是指当前被广泛利用的一次能源。如:煤、石油、天然气、水能生物能。
(2)新能源,是目前尚术广泛利用而正在积极研究以便推广利用的一次能源。如:核能、地热、海洋能、太阳能、风能。
4、按是否清洁分
(1)清洁能源:指对环境无污染或污染小的能源。如:太阳能、水能、风能。
(2)非清洁能源:指对环境污染较大的能源。如:煤、石油、天然气。
能源的分类
