5.1 课时4 硫酸根离子的检验(16页)
文档属性
| 名称 | 5.1 课时4 硫酸根离子的检验(16页) |  | |
| 格式 | pptx | ||
| 文件大小 | 949.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-19 09:58:27 | ||
图片预览




文档简介
(共16张PPT)
硫酸根离子的检验
第五章 化工生产中的重要非金属元素
1.掌握硫酸根离子的检验原理和方法及应用
2.通过硫酸根离子的检验方法,结合粗盐提纯的实验操作与步骤安排,进一步体会化学的应用价值。
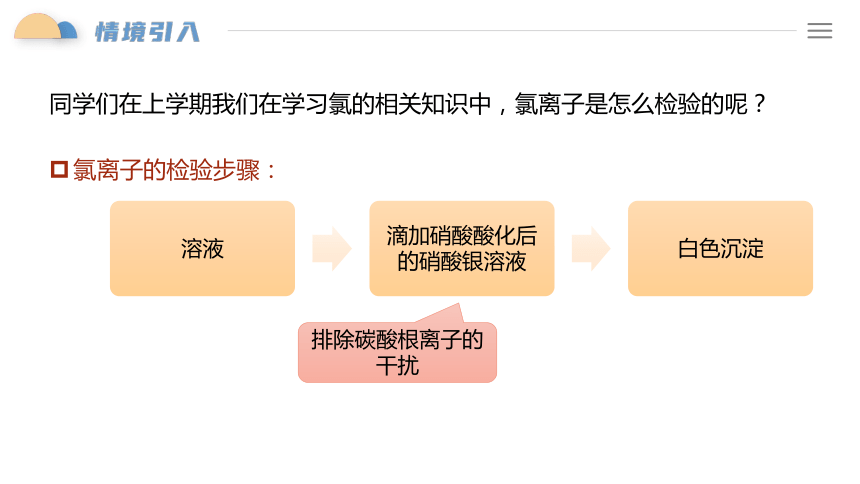
同学们在上学期我们在学习氯的相关知识中,氯离子是怎么检验的呢?
氯离子的检验步骤:
排除碳酸根离子的干扰
在溶液中, SO4 与Ba2+反应,生成不溶于稀盐酸的白色沉淀BaSO4
2-
Ba2+
SO4
2-
+
BaSO4
CO32-、SO32-
稀盐酸
硫酸根离子的检验
未知
溶液
稀盐酸
无明显现象
氯化钡溶液
产生白色沉淀
排除CO32-、SO32- 、Ag+存在的可能
白色沉淀为BaSO4
原溶液中含SO42-
硫酸根离子的检验
操作:先用稀盐酸酸化,无明显现象,然后加入BaCl2溶液,
若出现白色沉淀则证明有SO42- 。
思考与讨论:
经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐及CaCl2、MgCl2等杂质。如果要除去它们,应加入什么试剂?
(1)BaCl2溶液 Ba2+ + SO4===BaSO4
(2)Na2CO3溶液 Ca2+ + CO3===CaCO3
(3)NaOH溶液 Mg2+ + 2OH- ===Mg(OH)2
2-
2-
思考与讨论:
加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法可以除去这些离子?
SO4
Mg2+
Ca2+
Na+
Cl-
2-
BaCl2溶液
(足量)
BaSO4
Mg2+
CaCO3
BaCO3
CO3
Na+
Cl-
Na2CO3溶液
(足量)
BaSO4
Mg2+
Ca2+
Ba2+
Na+
Cl-
2-
BaSO4
Mg2+
CaCO3
BaCO3
CO3
Na+
Cl-
NaOH溶液
(足量)
BaSO4
Mg(OH)2
CaCO3
BaCO3
CO3
OH-
Na+
Cl-
2-
过滤 取滤液
稀盐酸(足量)
H+
Na+
Cl-
蒸发
结晶
NaCl晶体
2-
实验步骤 实验操作
①溶解 用托盘天平称取5 g粗盐放入烧杯中,然后加入20 mL水,用玻璃棒 ,使粗盐溶解,得到粗盐水。
搅拌
②沉淀 向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使_________________完全沉淀析出。
③过滤 将烧杯静置后过滤,除去生成的沉淀和不溶性杂质、过滤中玻璃棒的作用是 ,滤液呈 性
引流
碱
④中和 向滤液中滴加盐酸,用玻璃棒搅拌,直到_____
,并用pH试纸检验,使滤液呈中性或微酸性。
无气
泡冒出
⑤蒸发 将滤液倒入蒸发皿,用酒精灯加热,并用玻璃棒不断 。当蒸发皿中出现 时,停止加热。利用蒸发皿的余热使滤液蒸干。冷却后,得到除去杂质离子的精盐。
搅拌
较多固体
1.过量试剂的除去
(1)过量BaCl2用Na2CO3溶液除去,故Na2CO3溶液要在BaCl2溶液加入之后再加入。
(2)过量NaOH和Na2CO3溶液用盐酸除去,故盐酸必须在最后加入,即向过滤后的滤液中加入适量盐酸。
2.确定试剂的顺序。
(1)BaCl2→NaOH→Na2CO3→HCl
(2)NaOH→BaCl2→Na2CO3→HCl
(3)BaCl2→Na2CO3→NaOH→HCl
思考与讨论:
设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
除去原杂质的同时尽量不引入新杂质
安排好试剂的加入顺序及用量
尽量不减少被提纯的物质
粗盐溶液(SO42-、Mg2+、Ca2+)
BaCl2
Na+、Cl-(Ba2+、OH-、Ca2+)沉淀
Na+、Cl-(Ba2+、Mg2+、Ca2+)沉淀
NaOH
Na+、Cl-(CO32-、OH-)沉淀
Na2CO3
过滤
Na+、Cl-(CO32-、OH-)
盐酸
Na+、Cl-(HCl)
为使杂质离子完全除去,要加入过量的试剂。后续试剂要能够将前面所加过量的试剂除去,由此可知碳酸钠溶液要在氯化钡溶液之后加入。
粗盐精制过程图示分析
1.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,
通过如下几个实验步骤,可制得无杂质的食盐水:
①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液; ④滴入稀盐酸至无气泡产生;
⑤过滤,不正确的操作顺序是( )
A. ⑤③②①⑤④ B. ⑤③①②⑤④
C. ⑤②③①⑤④ D. ⑤②①③⑤④
D
2.在某无色溶液中,加入BaCl2溶液有白色沉淀,再加稀硝酸,沉淀不消失,则下列关于该溶液的判断中正确的是( )
A.一定含有SO42- B.含有SO42-和Ag+
C.可能含有SO42-或Ag+ D.可能含有SO42-或CO32-
C
【特别提醒】检验SO42-时,既要注意试剂的选择,又要注意操作顺序的优化,排除其他离子的干扰,全面考虑,综合分析,正确推断。
检验的误区
(1)只加可溶性钡盐,不酸化。误将CO32-、PO43-、SO32-等干扰离子判断成SO42-。因上述离子会产生BaCO3、Ba3(PO4)2、BaSO3白色沉淀。
(2)误将Ag+、Pb2+判断成SO42-。如向待测液中滴加BaCl2溶液,有白色沉淀便断定含SO42-。
(3)误将SO32-判断成SO42-。如向待测液中滴加用盐酸酸化的Ba(NO3)2溶液生成白色沉淀,便误以为有SO42-,忽视了NO3-在酸性条件下将SO32-氧化为SO42-。
3.(情境应用)材料一:已知BaSO4作为造影剂用于X射线检查,而BaSO3不能。
BaSO4、BaSO3都难溶于水,但BaSO3可溶于稀酸。
材料二:氯化铁与二氧化硫能发生下列反应: 2FeCl3+SO2+2H2O==FeCl2+FeSO4+4HCl。
在含有FeCl3和BaCl2的酸性溶液中通入一定量的SO2,有白色沉淀生成。
(1)此白色沉淀的成分是什么
(2)如何用实验证明氯化铁与二氧化硫发生了反应
(3)如何通过实验验证白色沉淀是否含有BaSO3
由题意知BaSO3不能在酸性溶液中存在,而Fe3+可以将SO2氧化为SO42- ,自身被还原为Fe2+,故沉淀为BaSO4。
取少量反应后的溶出现白色沉淀,则说明反应发生了。
取少量白色沉淀于试管中,加足量盐酸,若白色沉淀不溶解,则说明白色沉淀无BaSO3,若白色沉淀部分或全部溶解且有刺激性气味气体产生,则说明白色沉淀中有BaSO3。
硫酸根离子的检验
第五章 化工生产中的重要非金属元素
1.掌握硫酸根离子的检验原理和方法及应用
2.通过硫酸根离子的检验方法,结合粗盐提纯的实验操作与步骤安排,进一步体会化学的应用价值。
同学们在上学期我们在学习氯的相关知识中,氯离子是怎么检验的呢?
氯离子的检验步骤:
排除碳酸根离子的干扰
在溶液中, SO4 与Ba2+反应,生成不溶于稀盐酸的白色沉淀BaSO4
2-
Ba2+
SO4
2-
+
BaSO4
CO32-、SO32-
稀盐酸
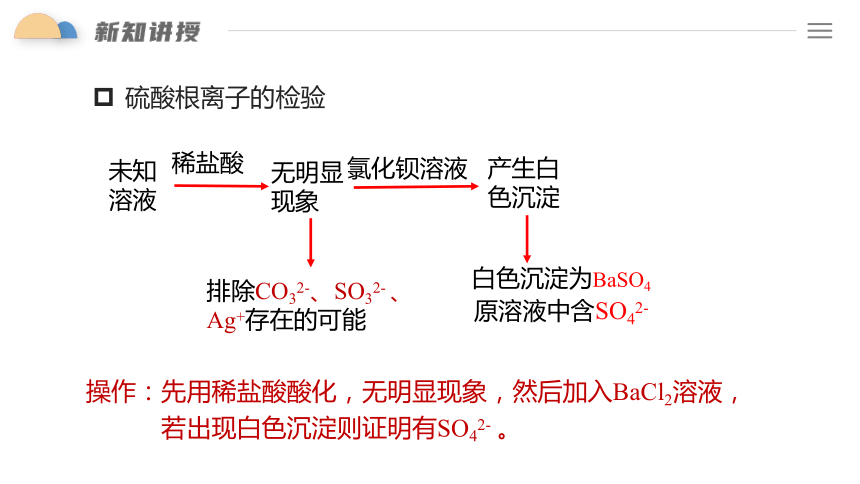
硫酸根离子的检验
未知
溶液
稀盐酸
无明显现象
氯化钡溶液
产生白色沉淀
排除CO32-、SO32- 、Ag+存在的可能
白色沉淀为BaSO4
原溶液中含SO42-
硫酸根离子的检验
操作:先用稀盐酸酸化,无明显现象,然后加入BaCl2溶液,
若出现白色沉淀则证明有SO42- 。
思考与讨论:
经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐及CaCl2、MgCl2等杂质。如果要除去它们,应加入什么试剂?
(1)BaCl2溶液 Ba2+ + SO4===BaSO4
(2)Na2CO3溶液 Ca2+ + CO3===CaCO3
(3)NaOH溶液 Mg2+ + 2OH- ===Mg(OH)2
2-
2-
思考与讨论:
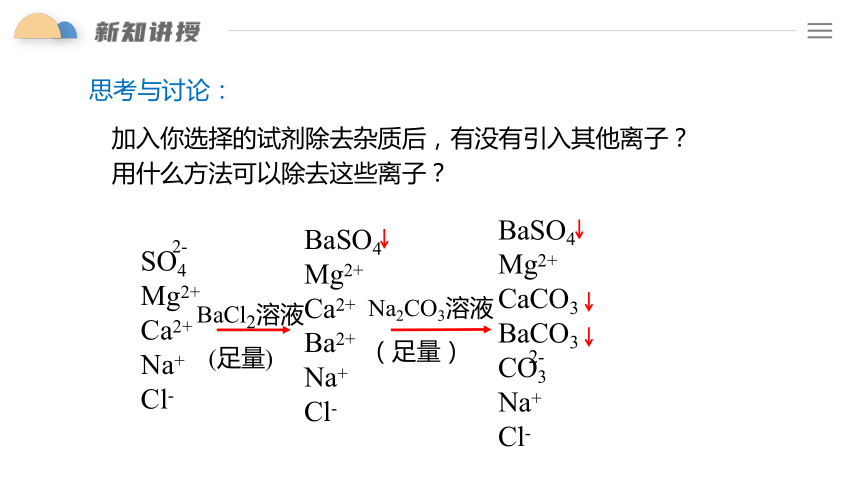
加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法可以除去这些离子?
SO4
Mg2+
Ca2+
Na+
Cl-
2-
BaCl2溶液
(足量)
BaSO4
Mg2+
CaCO3
BaCO3
CO3
Na+
Cl-
Na2CO3溶液
(足量)
BaSO4
Mg2+
Ca2+
Ba2+
Na+
Cl-
2-
BaSO4
Mg2+
CaCO3
BaCO3
CO3
Na+
Cl-
NaOH溶液
(足量)
BaSO4
Mg(OH)2
CaCO3
BaCO3
CO3
OH-
Na+
Cl-
2-
过滤 取滤液
稀盐酸(足量)
H+
Na+
Cl-
蒸发
结晶
NaCl晶体
2-
实验步骤 实验操作
①溶解 用托盘天平称取5 g粗盐放入烧杯中,然后加入20 mL水,用玻璃棒 ,使粗盐溶解,得到粗盐水。
搅拌
②沉淀 向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使_________________完全沉淀析出。
③过滤 将烧杯静置后过滤,除去生成的沉淀和不溶性杂质、过滤中玻璃棒的作用是 ,滤液呈 性
引流
碱
④中和 向滤液中滴加盐酸,用玻璃棒搅拌,直到_____
,并用pH试纸检验,使滤液呈中性或微酸性。
无气
泡冒出
⑤蒸发 将滤液倒入蒸发皿,用酒精灯加热,并用玻璃棒不断 。当蒸发皿中出现 时,停止加热。利用蒸发皿的余热使滤液蒸干。冷却后,得到除去杂质离子的精盐。
搅拌
较多固体
1.过量试剂的除去
(1)过量BaCl2用Na2CO3溶液除去,故Na2CO3溶液要在BaCl2溶液加入之后再加入。
(2)过量NaOH和Na2CO3溶液用盐酸除去,故盐酸必须在最后加入,即向过滤后的滤液中加入适量盐酸。
2.确定试剂的顺序。
(1)BaCl2→NaOH→Na2CO3→HCl
(2)NaOH→BaCl2→Na2CO3→HCl
(3)BaCl2→Na2CO3→NaOH→HCl
思考与讨论:
设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
除去原杂质的同时尽量不引入新杂质
安排好试剂的加入顺序及用量
尽量不减少被提纯的物质
粗盐溶液(SO42-、Mg2+、Ca2+)
BaCl2
Na+、Cl-(Ba2+、OH-、Ca2+)沉淀
Na+、Cl-(Ba2+、Mg2+、Ca2+)沉淀
NaOH
Na+、Cl-(CO32-、OH-)沉淀
Na2CO3
过滤
Na+、Cl-(CO32-、OH-)
盐酸
Na+、Cl-(HCl)
为使杂质离子完全除去,要加入过量的试剂。后续试剂要能够将前面所加过量的试剂除去,由此可知碳酸钠溶液要在氯化钡溶液之后加入。
粗盐精制过程图示分析
1.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,
通过如下几个实验步骤,可制得无杂质的食盐水:
①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液; ④滴入稀盐酸至无气泡产生;
⑤过滤,不正确的操作顺序是( )
A. ⑤③②①⑤④ B. ⑤③①②⑤④
C. ⑤②③①⑤④ D. ⑤②①③⑤④
D
2.在某无色溶液中,加入BaCl2溶液有白色沉淀,再加稀硝酸,沉淀不消失,则下列关于该溶液的判断中正确的是( )
A.一定含有SO42- B.含有SO42-和Ag+
C.可能含有SO42-或Ag+ D.可能含有SO42-或CO32-
C
【特别提醒】检验SO42-时,既要注意试剂的选择,又要注意操作顺序的优化,排除其他离子的干扰,全面考虑,综合分析,正确推断。
检验的误区
(1)只加可溶性钡盐,不酸化。误将CO32-、PO43-、SO32-等干扰离子判断成SO42-。因上述离子会产生BaCO3、Ba3(PO4)2、BaSO3白色沉淀。
(2)误将Ag+、Pb2+判断成SO42-。如向待测液中滴加BaCl2溶液,有白色沉淀便断定含SO42-。
(3)误将SO32-判断成SO42-。如向待测液中滴加用盐酸酸化的Ba(NO3)2溶液生成白色沉淀,便误以为有SO42-,忽视了NO3-在酸性条件下将SO32-氧化为SO42-。
3.(情境应用)材料一:已知BaSO4作为造影剂用于X射线检查,而BaSO3不能。
BaSO4、BaSO3都难溶于水,但BaSO3可溶于稀酸。
材料二:氯化铁与二氧化硫能发生下列反应: 2FeCl3+SO2+2H2O==FeCl2+FeSO4+4HCl。
在含有FeCl3和BaCl2的酸性溶液中通入一定量的SO2,有白色沉淀生成。
(1)此白色沉淀的成分是什么
(2)如何用实验证明氯化铁与二氧化硫发生了反应
(3)如何通过实验验证白色沉淀是否含有BaSO3
由题意知BaSO3不能在酸性溶液中存在,而Fe3+可以将SO2氧化为SO42- ,自身被还原为Fe2+,故沉淀为BaSO4。
取少量反应后的溶出现白色沉淀,则说明反应发生了。
取少量白色沉淀于试管中,加足量盐酸,若白色沉淀不溶解,则说明白色沉淀无BaSO3,若白色沉淀部分或全部溶解且有刺激性气味气体产生,则说明白色沉淀中有BaSO3。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
