5.2 课时2 一氧化氮和二氧化氮(40页)
文档属性
| 名称 | 5.2 课时2 一氧化氮和二氧化氮(40页) |  | |
| 格式 | pptx | ||
| 文件大小 | 28.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-19 10:02:06 | ||
图片预览









文档简介
(共40张PPT)
一氧化氮和二氧化氮
第五章 化工生产中的重要非金属元素
1.通过实验探究,了解一氧化氮与氧气反应、二氧化氮与水反应等性质,感受化学反应变化的奇妙
2.通过对氮氧化物的性质和转化实验,诊断并发展学生的观察、分析推理能力以及概念归纳能力。
情境1 认识雾霾——关注氮氧化物
1、雾霾是指各种源排放的污染物(如SO2、NOx、NH3、 CO、VOCs、PM等),在特定的大气流场条件下,经过一系列物理化学变化过程形成的细粒子,并与水汽相互作用导致的大气消光现象。
2、PM2.5是指直径小于或者等于2.5微米的大气颗粒物的总称。雾霾成分有硫酸盐、硝酸盐、铵盐、有机物、炭黑 以及矿物粉尘等。
汽车尾气所含污染物主要是: CO、碳氢化合物(CnHm) 、氮氧化合物(NO和NO2) 、SO2、颗粒物以及含铅化合物。
汽车尾气中NOx 的产生:
N2+O2 ==== 2NO
高温高压
2NO+O2= 2NO2
情境2 认识汽车尾气——关注氮氧化物
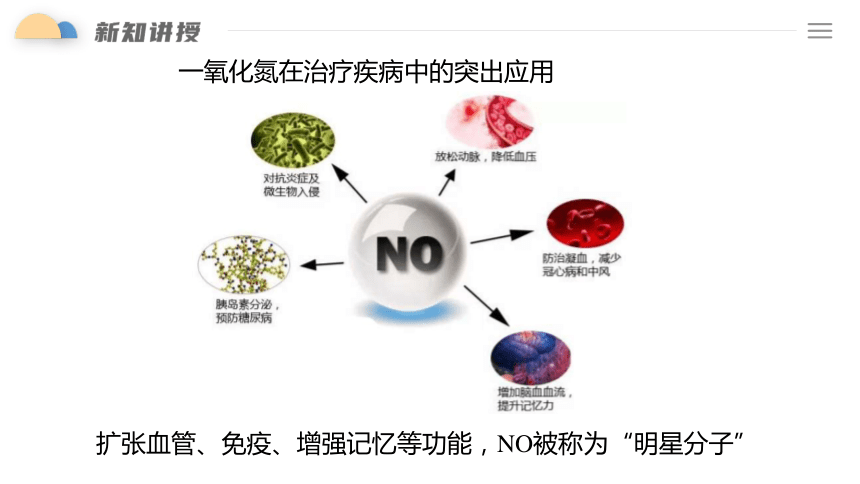
一氧化氮在治疗疾病中的突出应用
扩张血管、免疫、增强记忆等功能,NO被称为“明星分子”
一、一氧化氮的性质
1.物理性质
无色无味气体,不溶于水,密度比空气的略大。
(NO相对分子质量约为30)
2.化学性质
研究物质性质的角度:
物质类别通性角度、氧化还原角度、特性
实验一:NO和O2的反应
化学方程式:2NO+O2===2NO2
收集方法:排水法(NO与O2常温下反应)
现象:气体颜色由无色变为红棕色
还原剂:NO 氧化剂:O2
二、二氧化氮的性质
1.物理性质
红棕色有刺激性气味气体,密度比空气的大,易液化,易溶于水。
2.化学性质
实验二:NO2和H2O的反应
实验现象:液面逐渐上升,气体的红棕色消失,剩余的气体为无色。
化学方程式:3NO2+H2O===NO+2HNO3
(工业制硝酸的原理)
收集方法:向上排空气法
NO2既作氧化剂又作还原剂
NO和NO2的比较
NO NO2
氧化物类别
转化 无色无味气体
红棕色有刺激性气味的气体
不溶于水
易溶于水
排水法
向上排空气法
色、味、态
溶解性
收集方法
2NO+O2 2NO2
3NO2+H2O NO+2HNO3
非酸性氧化物(不成盐氧化物)
非酸性氧化物(不成盐氧化物)
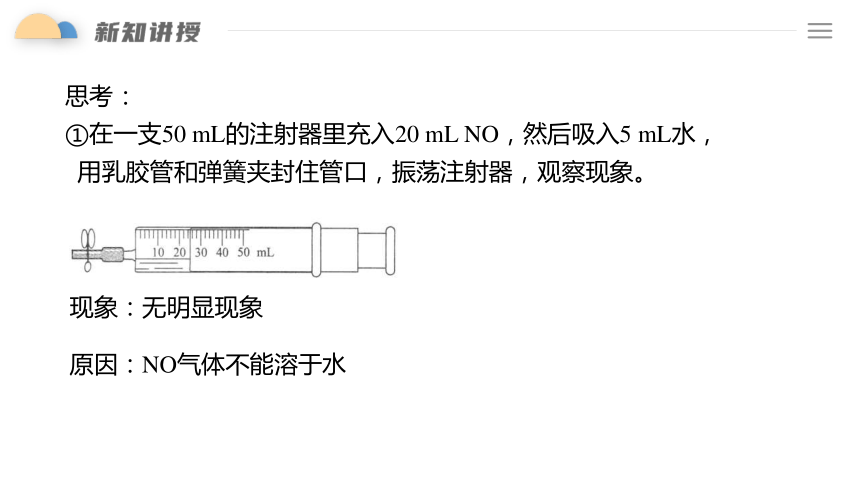
思考:
①在一支50 mL的注射器里充入20 mL NO,然后吸入5 mL水,
用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。
现象:无明显现象
原因:NO气体不能溶于水
现象:吸入空气中气体变为红棕色;再振荡后气体又变为无色,同时注射器的活塞向内移动。
原因:吸入空气后,NO与O2反应生成NO2,气体变为红棕色;
振荡后,NO2溶于水生成HNO3和NO,气体又变为无色,
同时气体的总体积有所减少。
思考:
②快速吸入10 mL空气后夹上弹簧夹,观察现象。振荡注
射器,再观察现象。
NO2化学性质:NO2和H2O的反应
思考:
③如果要将注射器中的NO充分转化,可以采取什么措施?
吸入空气,振荡,重复操作。
2NO+O2 2NO2
3NO2+H2O NO+2HNO3
×2
+
4NO+3O2+2H2O 4HNO3
×3
思考:
④上述实验对工业上生产硝酸有什么启示?
向生产硝酸的尾气中通入氧气,利用氧气将NO氧化为NO2实现循环利用。
4 NO + 2H2O + 3O2 = 4HNO3
三、含氮氧化物
N2O
NO
N2O3
NO2
N2O5
+1
+2
+3
+4
+5
牙科麻醉剂
氧化剂
火箭燃料系统中氧化剂
氮氧化物会严重污染大气,所以实验室必须对含有氮氧化物的废气进行处理。用NaOH溶液可以吸收废气中的氮氧化物,反应方程式如下:
①NO+NO2+2NaOH===2NaNO2+H2O
②2NO2+2NaOH===NaNO2+NaNO3+H2O
(1)在反应①中,参加反应的氧化剂和还原剂的质量之比为________。
(2)在反应②中,氧化产物是________,还原产物是________(填化学式)。
(3)在反应①②中,参加反应的NaOH均为2 mol时,两个反应转移电子数的关系是①________②(填“>”“=”或“<”)。
23∶15
NaNO3 NaNO2
=
请依据本节课的内容,解释‘’雷雨丰庄稼‘’的原理,
并用化学方程式解释
雷电发生时,N2和O2化合生成NO,NO迅速被氧化为NO2,NO2溶于水生成HNO3,HNO3和土壤作用生成硝酸盐,NO3-可被植物吸收
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
N2+O2====2NO
放电
工业制硝酸
N2
H2
NH3
O2
O2
NO
NO2
HNO3
H2O
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
N2+3H2 2NH3
高温、高压催化剂
4NH3+5O2 4NO+6H2O
催化剂
Δ
四、氮氧化物(NOX)的来源、危害和治理
1.氮氧化物(NOX)的来源
主要来源之一:汽车尾气
2.NOX的危害
主要危害:酸雨,光化学烟雾
方法1:SCR(选择性催化还原)
8NH3+6NO2 7N2+12H2O
催化剂
3.NOX的治理——工业“脱硝”
方法2:碱液吸收法
2NO2+2NaOH NaNO3+NaNO2+H2O
方法3:NSR(NOX储存还原)
方法4:汽车尾气催化转化器
2NOx+2xCO 2xCO2+N2
催化剂
一氧化氮
物理性质
无色、有毒、气体,不溶于水
化学性质
与氧气反应
二氧化氮
物理性质
红棕色,有毒,刺激性气味气体
化学性质
与水反应
N2+O2=2NO B. 2NO+O2=2NO2
C. 3NO2+H2O=2HNO3+NO D. 4NH3+5O2 4NO+6H2O
催化剂
△
1.俗话说“雷雨发庄稼”这是因为雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥。下列不属于其中的反应的是( )
放电
D
2.每年春季是疾病、流行性传染病多发的季节。几年前的SARS至今让人心悸。最新的研究表明:一氧化氮吸入治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述不正确的是( )
A.一氧化氮是一种无色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.含等质量氧元素的一氧化氮与一氧化碳的物质的量相等
D.一氧化氮不溶于水,能用排水法收集
B
3.对3NO2+H2O===2HNO3+NO反应的下列说法正确的是( )
A.NO2是氧化剂,H2O是还原剂
B.氧化产物与还原产物的物质的量之比为1∶2
C.氧化剂与还原剂的质量比为1∶2
D.在反应中若有6 mol NO2参与反应时,有3 mol电子发生转移
C
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参与了氮循环
4.下列关于自然界中氮循环(如图)的说法不正确的是( )
A
5.某集气瓶中的气体呈红棕色,加入足量水,盖上玻璃片振荡,得橙色溶液,气体颜色消失。再拿走玻璃片后,瓶中气体又变为红棕色,则该气体可能是下列混合气体中的( )
A.N2、NO2、Br2 B.NO2、NO、N2
C.NO2、NO、O2 D.N2、O2、Br2
A
思考:NO2和Br2蒸汽都是红棕色,请复习相关性质,找出鉴别方法。
相同点;①均具有氧化性;②溶于水均有酸生成;
③均可与碱反应;④均为红棕色
鉴别方法:所以不能用淀粉 -KI试纸、pH试纸、NaOH溶液来鉴别,
可以用下列方法鉴别:①AgNO3溶液;②CCl4溶液;③用水洗法
6.NO中有少量的NO2除去方法为( )
A.通过盛有浓H2SO4的洗气瓶
B.通过盛有无水CaCl2的干燥管
C.先通过盛有浓H2SO4的洗气瓶,然后再通过盛有水的洗气瓶
D.先通过盛有水的洗气瓶,然后再通过盛有浓H2SO4的洗气瓶
D
7.有一充有20 mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12mL无色气体,则原混合气体中NO和NO2体积比为( )
A.3:2 B.2:3 C.1:4 D.4:1
B
差量法
8.在一大试管中装入10 mL NO,倒立于水槽中,然后慢慢地通入10 mL O2,下面有关实验最终状态的描述中,正确的是( )
试管内气体呈红棕色 B. 试管内气体无色,是NO
C. 试管内气体无色,是O2 D. 试管内液面下降
C
温馨提示:氮的氧化物与O2的混合气体溶于水时,剩余的气体可能是O2,也可能是NO,但不可能是NO2,因为NO2会与水反应生成HNO3和NO。
9.将盛有N2和NO2混合气体的试管倒立于水中,经足够长的时间后,试管内气体的体积缩小为原体积的一半,则原混合气体中N2和NO2的体积比( )
A.1∶1 B.1∶2 C.1∶3 D.3∶1
C
10.同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3 > V1>V2
D
11.将容积为50 mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5 mL。则原混合气体中NO2和O2体积比可能是__________或________。
总方程式法
18:7 43:7
12.一定条件下,将6体积的NO2和一定体积的NO与4.5体积的氧气组成的混和气体置于试管中。将试管倒置于水中,充分反应后,剩余1.5体积气体,则原NO体积可能为( )
A.2体积 B.3体积 C.4体积 D.5.5体积
AD
氮氧化物的组成转换及原子守恒
总结:4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,都与N2O5+H2O =2HNO3等效。
13.为了探究几种气态氧化物的性质,某同学设计以下实验。用三只集气瓶收集二氧化硫、二氧化氮气体,倒置在水槽中。然后,分别缓慢通入适量氧气或氯气,如图所示。一段时间,A、B装置中集气瓶充满溶液,C装置中集气瓶里还有气体。
(1)如果装置A中通入氧气恰好使液体充满集气瓶,假设瓶内液体不向外扩散。①写出总反应的化学方程式:________________;该实验对工业上生产硝酸的启示是______________。
②假设实验条件下,气体摩尔体积为a L·mol-1,计算集气瓶里溶液的物质的量浓度为_________。
1/ mol·L-1
4NO2+O2+2H2O=4HNO3
在吸收器里充入足量空气
(2)实验前在C水槽里滴加几滴紫色石蕊溶液,通入氧气后,实验现象可能为________________;发生反应的化学方程式为_________________;
C装置实验可以探究酸雨变化过程。
2SO2+O2+2H2O=2H2SO4
红色由浅变深
13.为了探究几种气态氧化物的性质,某同学设计以下实验。用三只集气瓶收集二氧化硫、二氧化氮气体,倒置在水槽中。然后,分别缓慢通入适量氧气或氯气,如图所示。一段时间,A、B装置中集气瓶充满溶液,C装置中集气瓶里还有气体。
(3)溶液充满集气瓶后,在B水槽里滴加硝酸钡溶液,可能观察到的现象为____________;写出有关离子方程式:_____________________。证明B水槽反应后溶液里有氯离子的操作方法是_____________________。
Cl2+SO2+2H2O=2Cl-+SO42-+4H+、
Ba2++SO42-=BaSO4↓
取少量反应后的溶液于试管中,向试管里加入过量的硝酸钡溶液,待沉淀完全后,静置,取上层清液滴加硝酸银溶液,若产生白色沉淀,则说明原溶液中含有Cl-
13.为了探究几种气态氧化物的性质,某同学设计以下实验。用三只集气瓶收集二氧化硫、二氧化氮气体,倒置在水槽中。然后,分别缓慢通入适量氧气或氯气,如图所示。一段时间,A、B装置中集气瓶充满溶液,C装置中集气瓶里还有气体。
一氧化氮和二氧化氮
第五章 化工生产中的重要非金属元素
1.通过实验探究,了解一氧化氮与氧气反应、二氧化氮与水反应等性质,感受化学反应变化的奇妙
2.通过对氮氧化物的性质和转化实验,诊断并发展学生的观察、分析推理能力以及概念归纳能力。
情境1 认识雾霾——关注氮氧化物
1、雾霾是指各种源排放的污染物(如SO2、NOx、NH3、 CO、VOCs、PM等),在特定的大气流场条件下,经过一系列物理化学变化过程形成的细粒子,并与水汽相互作用导致的大气消光现象。
2、PM2.5是指直径小于或者等于2.5微米的大气颗粒物的总称。雾霾成分有硫酸盐、硝酸盐、铵盐、有机物、炭黑 以及矿物粉尘等。
汽车尾气所含污染物主要是: CO、碳氢化合物(CnHm) 、氮氧化合物(NO和NO2) 、SO2、颗粒物以及含铅化合物。
汽车尾气中NOx 的产生:
N2+O2 ==== 2NO
高温高压
2NO+O2= 2NO2
情境2 认识汽车尾气——关注氮氧化物
一氧化氮在治疗疾病中的突出应用
扩张血管、免疫、增强记忆等功能,NO被称为“明星分子”
一、一氧化氮的性质
1.物理性质
无色无味气体,不溶于水,密度比空气的略大。
(NO相对分子质量约为30)
2.化学性质
研究物质性质的角度:
物质类别通性角度、氧化还原角度、特性
实验一:NO和O2的反应
化学方程式:2NO+O2===2NO2
收集方法:排水法(NO与O2常温下反应)
现象:气体颜色由无色变为红棕色
还原剂:NO 氧化剂:O2
二、二氧化氮的性质
1.物理性质
红棕色有刺激性气味气体,密度比空气的大,易液化,易溶于水。
2.化学性质
实验二:NO2和H2O的反应
实验现象:液面逐渐上升,气体的红棕色消失,剩余的气体为无色。
化学方程式:3NO2+H2O===NO+2HNO3
(工业制硝酸的原理)
收集方法:向上排空气法
NO2既作氧化剂又作还原剂
NO和NO2的比较
NO NO2
氧化物类别
转化 无色无味气体
红棕色有刺激性气味的气体
不溶于水
易溶于水
排水法
向上排空气法
色、味、态
溶解性
收集方法
2NO+O2 2NO2
3NO2+H2O NO+2HNO3
非酸性氧化物(不成盐氧化物)
非酸性氧化物(不成盐氧化物)
思考:
①在一支50 mL的注射器里充入20 mL NO,然后吸入5 mL水,
用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。
现象:无明显现象
原因:NO气体不能溶于水
现象:吸入空气中气体变为红棕色;再振荡后气体又变为无色,同时注射器的活塞向内移动。
原因:吸入空气后,NO与O2反应生成NO2,气体变为红棕色;
振荡后,NO2溶于水生成HNO3和NO,气体又变为无色,
同时气体的总体积有所减少。
思考:
②快速吸入10 mL空气后夹上弹簧夹,观察现象。振荡注
射器,再观察现象。
NO2化学性质:NO2和H2O的反应
思考:
③如果要将注射器中的NO充分转化,可以采取什么措施?
吸入空气,振荡,重复操作。
2NO+O2 2NO2
3NO2+H2O NO+2HNO3
×2
+
4NO+3O2+2H2O 4HNO3
×3
思考:
④上述实验对工业上生产硝酸有什么启示?
向生产硝酸的尾气中通入氧气,利用氧气将NO氧化为NO2实现循环利用。
4 NO + 2H2O + 3O2 = 4HNO3
三、含氮氧化物
N2O
NO
N2O3
NO2
N2O5
+1
+2
+3
+4
+5
牙科麻醉剂
氧化剂
火箭燃料系统中氧化剂
氮氧化物会严重污染大气,所以实验室必须对含有氮氧化物的废气进行处理。用NaOH溶液可以吸收废气中的氮氧化物,反应方程式如下:
①NO+NO2+2NaOH===2NaNO2+H2O
②2NO2+2NaOH===NaNO2+NaNO3+H2O
(1)在反应①中,参加反应的氧化剂和还原剂的质量之比为________。
(2)在反应②中,氧化产物是________,还原产物是________(填化学式)。
(3)在反应①②中,参加反应的NaOH均为2 mol时,两个反应转移电子数的关系是①________②(填“>”“=”或“<”)。
23∶15
NaNO3 NaNO2
=
请依据本节课的内容,解释‘’雷雨丰庄稼‘’的原理,
并用化学方程式解释
雷电发生时,N2和O2化合生成NO,NO迅速被氧化为NO2,NO2溶于水生成HNO3,HNO3和土壤作用生成硝酸盐,NO3-可被植物吸收
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
N2+O2====2NO
放电
工业制硝酸
N2
H2
NH3
O2
O2
NO
NO2
HNO3
H2O
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
N2+3H2 2NH3
高温、高压催化剂
4NH3+5O2 4NO+6H2O
催化剂
Δ
四、氮氧化物(NOX)的来源、危害和治理
1.氮氧化物(NOX)的来源
主要来源之一:汽车尾气
2.NOX的危害
主要危害:酸雨,光化学烟雾
方法1:SCR(选择性催化还原)
8NH3+6NO2 7N2+12H2O
催化剂
3.NOX的治理——工业“脱硝”
方法2:碱液吸收法
2NO2+2NaOH NaNO3+NaNO2+H2O
方法3:NSR(NOX储存还原)
方法4:汽车尾气催化转化器
2NOx+2xCO 2xCO2+N2
催化剂
一氧化氮
物理性质
无色、有毒、气体,不溶于水
化学性质
与氧气反应
二氧化氮
物理性质
红棕色,有毒,刺激性气味气体
化学性质
与水反应
N2+O2=2NO B. 2NO+O2=2NO2
C. 3NO2+H2O=2HNO3+NO D. 4NH3+5O2 4NO+6H2O
催化剂
△
1.俗话说“雷雨发庄稼”这是因为雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥。下列不属于其中的反应的是( )
放电
D
2.每年春季是疾病、流行性传染病多发的季节。几年前的SARS至今让人心悸。最新的研究表明:一氧化氮吸入治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述不正确的是( )
A.一氧化氮是一种无色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.含等质量氧元素的一氧化氮与一氧化碳的物质的量相等
D.一氧化氮不溶于水,能用排水法收集
B
3.对3NO2+H2O===2HNO3+NO反应的下列说法正确的是( )
A.NO2是氧化剂,H2O是还原剂
B.氧化产物与还原产物的物质的量之比为1∶2
C.氧化剂与还原剂的质量比为1∶2
D.在反应中若有6 mol NO2参与反应时,有3 mol电子发生转移
C
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参与了氮循环
4.下列关于自然界中氮循环(如图)的说法不正确的是( )
A
5.某集气瓶中的气体呈红棕色,加入足量水,盖上玻璃片振荡,得橙色溶液,气体颜色消失。再拿走玻璃片后,瓶中气体又变为红棕色,则该气体可能是下列混合气体中的( )
A.N2、NO2、Br2 B.NO2、NO、N2
C.NO2、NO、O2 D.N2、O2、Br2
A
思考:NO2和Br2蒸汽都是红棕色,请复习相关性质,找出鉴别方法。
相同点;①均具有氧化性;②溶于水均有酸生成;
③均可与碱反应;④均为红棕色
鉴别方法:所以不能用淀粉 -KI试纸、pH试纸、NaOH溶液来鉴别,
可以用下列方法鉴别:①AgNO3溶液;②CCl4溶液;③用水洗法
6.NO中有少量的NO2除去方法为( )
A.通过盛有浓H2SO4的洗气瓶
B.通过盛有无水CaCl2的干燥管
C.先通过盛有浓H2SO4的洗气瓶,然后再通过盛有水的洗气瓶
D.先通过盛有水的洗气瓶,然后再通过盛有浓H2SO4的洗气瓶
D
7.有一充有20 mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12mL无色气体,则原混合气体中NO和NO2体积比为( )
A.3:2 B.2:3 C.1:4 D.4:1
B
差量法
8.在一大试管中装入10 mL NO,倒立于水槽中,然后慢慢地通入10 mL O2,下面有关实验最终状态的描述中,正确的是( )
试管内气体呈红棕色 B. 试管内气体无色,是NO
C. 试管内气体无色,是O2 D. 试管内液面下降
C
温馨提示:氮的氧化物与O2的混合气体溶于水时,剩余的气体可能是O2,也可能是NO,但不可能是NO2,因为NO2会与水反应生成HNO3和NO。
9.将盛有N2和NO2混合气体的试管倒立于水中,经足够长的时间后,试管内气体的体积缩小为原体积的一半,则原混合气体中N2和NO2的体积比( )
A.1∶1 B.1∶2 C.1∶3 D.3∶1
C
10.同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3 > V1>V2
D
11.将容积为50 mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5 mL。则原混合气体中NO2和O2体积比可能是__________或________。
总方程式法
18:7 43:7
12.一定条件下,将6体积的NO2和一定体积的NO与4.5体积的氧气组成的混和气体置于试管中。将试管倒置于水中,充分反应后,剩余1.5体积气体,则原NO体积可能为( )
A.2体积 B.3体积 C.4体积 D.5.5体积
AD
氮氧化物的组成转换及原子守恒
总结:4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,都与N2O5+H2O =2HNO3等效。
13.为了探究几种气态氧化物的性质,某同学设计以下实验。用三只集气瓶收集二氧化硫、二氧化氮气体,倒置在水槽中。然后,分别缓慢通入适量氧气或氯气,如图所示。一段时间,A、B装置中集气瓶充满溶液,C装置中集气瓶里还有气体。
(1)如果装置A中通入氧气恰好使液体充满集气瓶,假设瓶内液体不向外扩散。①写出总反应的化学方程式:________________;该实验对工业上生产硝酸的启示是______________。
②假设实验条件下,气体摩尔体积为a L·mol-1,计算集气瓶里溶液的物质的量浓度为_________。
1/ mol·L-1
4NO2+O2+2H2O=4HNO3
在吸收器里充入足量空气
(2)实验前在C水槽里滴加几滴紫色石蕊溶液,通入氧气后,实验现象可能为________________;发生反应的化学方程式为_________________;
C装置实验可以探究酸雨变化过程。
2SO2+O2+2H2O=2H2SO4
红色由浅变深
13.为了探究几种气态氧化物的性质,某同学设计以下实验。用三只集气瓶收集二氧化硫、二氧化氮气体,倒置在水槽中。然后,分别缓慢通入适量氧气或氯气,如图所示。一段时间,A、B装置中集气瓶充满溶液,C装置中集气瓶里还有气体。
(3)溶液充满集气瓶后,在B水槽里滴加硝酸钡溶液,可能观察到的现象为____________;写出有关离子方程式:_____________________。证明B水槽反应后溶液里有氯离子的操作方法是_____________________。
Cl2+SO2+2H2O=2Cl-+SO42-+4H+、
Ba2++SO42-=BaSO4↓
取少量反应后的溶液于试管中,向试管里加入过量的硝酸钡溶液,待沉淀完全后,静置,取上层清液滴加硝酸银溶液,若产生白色沉淀,则说明原溶液中含有Cl-
13.为了探究几种气态氧化物的性质,某同学设计以下实验。用三只集气瓶收集二氧化硫、二氧化氮气体,倒置在水槽中。然后,分别缓慢通入适量氧气或氯气,如图所示。一段时间,A、B装置中集气瓶充满溶液,C装置中集气瓶里还有气体。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
