5.1 课时5 不同价态含硫物质的转化(35页)
文档属性
| 名称 | 5.1 课时5 不同价态含硫物质的转化(35页) |  | |
| 格式 | pptx | ||
| 文件大小 | 111.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-19 10:05:48 | ||
图片预览








文档简介
(共35张PPT)
不同价态含硫物质的转化
第五章 化工生产中的重要非金属元素
1.通过对酸雨形成过程中含硫物质的存在及转化分析,巩固从化合价角度认识物质转化的思路,初步形成转化意识
2.通过设计脱除SO2的反应路径,将转化思路分解、细化,明确转化角度。通过对转化思路的梳理,完善转化思维模型。
3.通过分析实际工业生产中SO2的去除路径,提升基于思维模型分析、解决实际问题的能力。
火山喷口附近或地壳的岩层里
化合态:主要以硫化物和硫酸盐的形式存在
①硫化物形式 黄铁矿:FeS2;黄铜矿:CuFeS2。
②硫酸盐形式 芒硝:Na2SO4·10H2O 石膏:CaSO4·2H2O。
③存在于某些蛋白质中。
一、自然界中硫的存在和转化
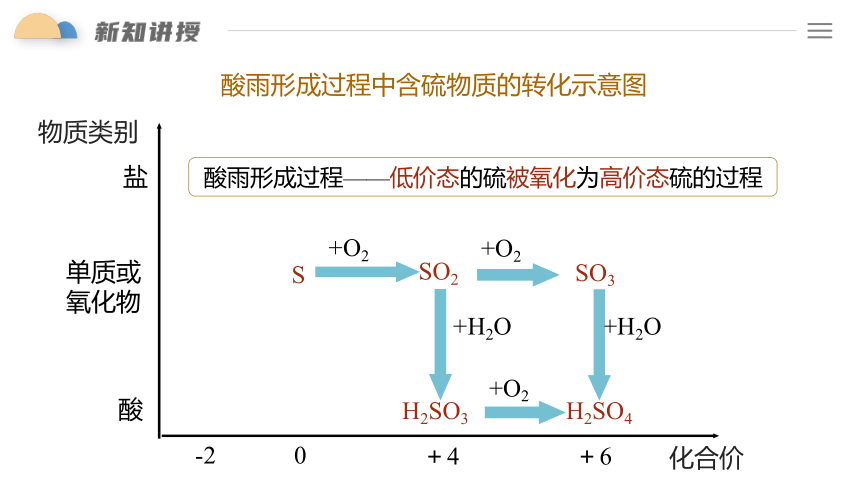
SO2
SO3
H2SO3
H2SO4
+O2
+O2
+H2O
+H2O
S
酸雨形成过程中含硫物质的转化示意图
单质或
氧化物
酸
盐
+O2
-2
0
+4
+6
化合价
物质类别
酸雨形成过程——低价态的硫被氧化为高价态硫的过程
二、防治酸雨,设计转化路径
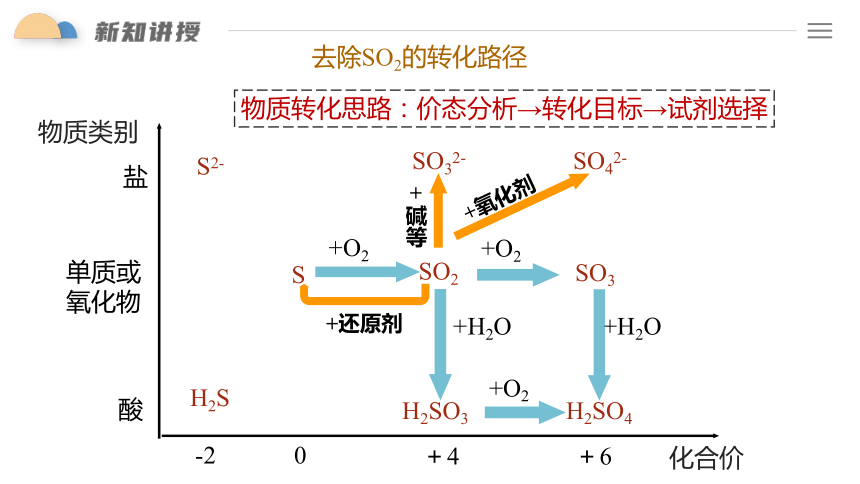
防治酸雨,就要将燃煤烟气中的SO2气体转化为其他对环境无污染或污染较小的含硫物质。那么, 可将SO2转化为哪些含硫物质?
SO32-
SO42-
H2S
S2-
物质转化思路:价态分析→转化目标→试剂选择
+ 碱等
+氧化剂
+还原剂
去除SO2的转化路径
SO2
SO3
H2SO3
H2SO4
+O2
+O2
+H2O
+H2O
S
单质或
氧化物
酸
盐
+O2
-2
0
+4
+6
化合价
物质类别
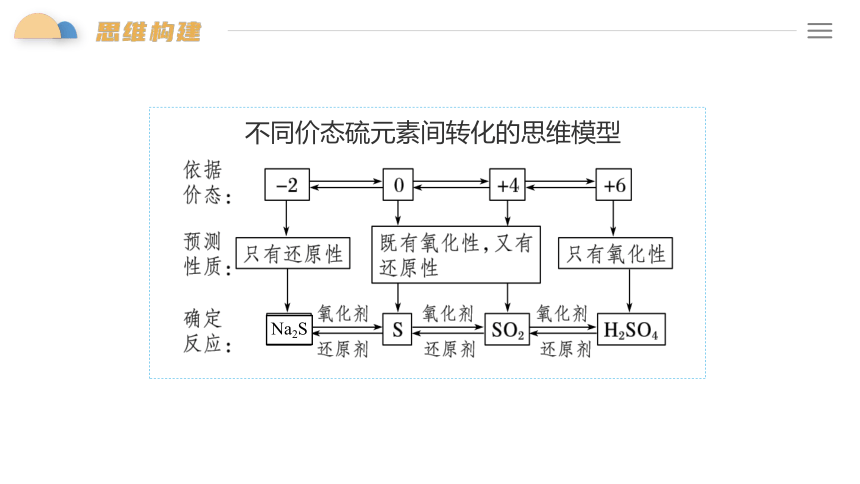
不同价态硫元素间转化的思维模型
Na2S
实验序号 转化目标 (价态变化) 转化前的含硫物质 选择试剂 转化后的含硫物质 预期现象
1 +4 → +6 SO2
2 +4 → +6 SO2
3 +4 → 0 SO2
4 +4 → +4 SO2
H2O2
生成淡黄色固体
反应后滴入BaCl2,产生白色沉淀,加入盐酸后沉淀溶解
反应后滴入稀盐酸,再滴入BaCl2,产生白色沉淀。
酸性KMnO4
SO42-
高锰酸钾溶液褪色
NaOH
S
SO42-
SO32-
Na2S
利用以下试剂,设计实验方案,验证SO2去除过程中发生了上述含硫物质的转化,并填写表格
试剂:SO2、酸性KMnO4溶液、H2O2溶液、Na2S溶液、稀盐酸、BaCl2溶液、NaOH溶液
1、氧化剂能选择浓硫酸吗?
学与问
2、已知还原性的强弱顺序为:S2->SO32-(SO2)>I->Fe2+,
则可选用哪种还原剂?
常见 氧化剂 O2 H2O2 KMnO4(H+)
Cl2 NaClO FeCl3 浓硫酸
常见 还原剂 金属单质 H2 CO
Na2S KI FeCl2
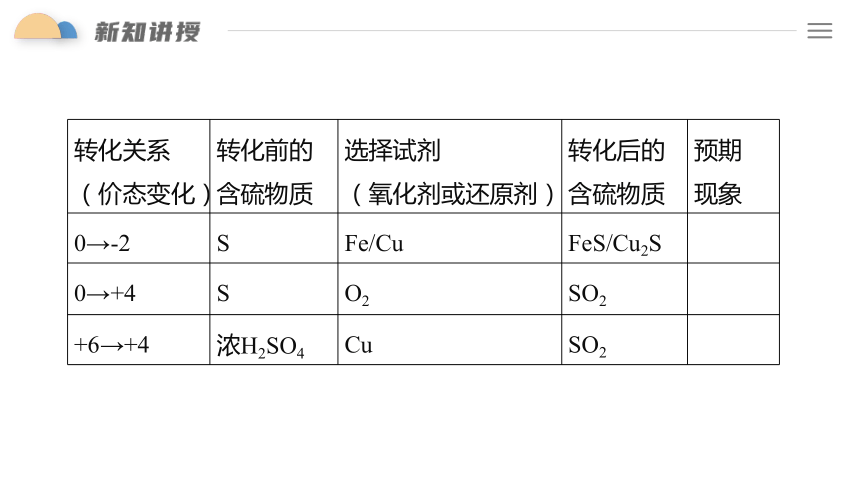
转化关系 (价态变化) 转化前的 含硫物质 选择试剂 (氧化剂或还原剂) 转化后的 含硫物质 预期
现象
0→-2 S Fe/Cu FeS/Cu2S
0→+4 S O2 SO2
+6→+4 浓H2SO4 Cu SO2
预期转化 选择试剂 实验操作和现象 实验结论
亚硫酸钠 稀硫酸 硫化钠 向亚硫酸钠溶液中加入稀硫酸,再加入硫化钠溶液,生成 色沉淀 反应生成
黄
硫
+4 0
Na2SO3 S
转化关系 (价态变化) 转化前的 含硫物质 选择试剂 (氧化剂或还原剂) 转化后的 含硫物质 预期
现象
+4→0 Na2SO3 SO2水溶液 还原剂 S 黄色沉淀
+4→+6 氧化剂 H2SO4
-2→0 Na2S 氧化剂 S 黄色沉淀
预期转化 选择试剂 实验操作和现象 实验结论
SO2水溶液 氯水 氯化钡溶液 向SO2水溶液中加入氯水,再加入氯化钡溶液,观察到 生成 色沉淀 反应生成
+4 +6
白
硫酸
SO2 H2SO4
1.同价态硫(+4价)化合物之间的相互转化关系如图。
写出图中序号所示反应的化学方程式。
① ;
② ;
③ 。
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
SO2+2NaOH===Na2SO3+H2O
相同价态硫的转化是通过酸、碱反应实现的
写出②、③、④反应的化学方程式:
②___________________________;
③________________________________;
④__________________________。
H2SO3+2NaOH == Na2SO3+2H2O
Na2SO3+H2SO4 ==Na2SO4+H2O+SO2↑
SO2+Na2SO3+H2O ==2NaHSO3
2.当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,可用下图表示
写出③④⑤的化学方程式(选考)
③____________________;
④_______________;
⑤_______________________。
SO2+2H2S===3S+2H2O
写出①②⑤的化学方程式(选考)
①________________________________;
②_____________________________________;
⑤_______________________。
2Na2S+O2+2H2O===4NaOH+2S↓
2Na2SO3+O2===2Na2SO4
不同价态硫的转化是通过氧化还原反应实现的
当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降
2SO2+O2 2SO3
小结规律:邻位转化规律
2H2S + O2(少量) 2S+2H2O
点燃
2H2S + 3O2(过量) 2SO2+2H2O
点燃
小结规律:越位转化规律
H2S+ H2SO4 S↓ +SO2 ↑ +2H2O
S + 2H2SO4 3SO2↑+ 2H2O
小结规律:归中转化规律
SO2
物质类别
化
合
价
单质
氧化物
盐
含氧酸
-2
+4
SO3
氢化物
硫元素的价类图
0
H2S
S
H2SO3
H2SO4
SO32-
SO42-
FeS
NaOH
Cl2、H2O2、O2
Cu、C、HI、H2S
Cl2、H2O2、O2
O2、浓硫酸
H2S
H2
KMnO4、HNO3、Fe3+
H2O
△
Cl2、O2、SO2、Fe3+、 HNO3 、 KMnO4
O2
NaOH
稀硫酸
+6
Fe
酸碱转化
氧化还原转化
H2O
△
1.硫在自然界的循环过程如图所示,下列说法不正确的是( )
A.石油和煤等化石燃料中含有硫元素
B.大气中的二氧化硫只来源于火山喷发
C.地壳中的硫元素常以硫化物和硫酸盐
的形式存在
D.动植物遗体被微生物分解后,可产生SO 和SO2
B
2.已知X为一种常见酸的浓溶液, 能使蔗糖粉末变黑。A与X反应转化关系如右图,其中反应条件及部分产物均已略去。
则下列有关说法正确的是 ( )
A.X使蔗糖变黑,主要体现X的强氧化性
B.若A为铁,足量A与X在室温下可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
D
3.关于硫及含硫化合物的说法中,正确的是( )
A.硫的化学性质比较活泼,自然界中不能以游离态存在
B.自然界中的硫酸钡以重晶石的形式存在,硫酸钙常以石膏(2CaSO4·H2O )的形式存在
C.食品中添加适量 可以起到漂白、防腐等作用
D.在加热条件下,铜和浓硫酸反应生成了蓝色的硫酸铜溶液和能使品红褪色的SO2气体
D
4.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是
A. 该过程中可得到化工产品
B. 该工艺流程是除去煤燃烧时产生的
C. 该过程中化合价发生改变的元素为和
D. 图中涉及的反应之一为
C
5.硫黄在空气中燃烧生成气体甲;将甲溶于水得溶液乙;向溶液乙中滴加溴水时溴水褪色,乙变为丙;在丙中加入硫化钠又生成气体丁;把丁通入溶液乙中得沉淀戊。物质甲、乙、丙、丁、戊中均含有硫元素,它们依次是( )
A.SO3 、H2SO4 、 H2SO3 、H2S 、S
B. SO2 、 H2SO3 、 H2SO4 、 H2S 、S
C. SO2 、 H2SO3 、 H2SO4 、 H2S 、 SO3
D. SO2 、 H2SO3 、 H2S 、 H2SO4 、 Na2S2O3
B
6.下图1为硫元素的价类二维图:根据图像信息判断下列说法正确的是( )
A. 从硫元素化合价变化的角度分析,图1中既有氧化性又有还原性的化合物有4种
B. 将X与Y混合,可生成淡黄色固体,该反应中氧化产物与还原产物的物质的量之比为1:1
C. 上述八种物质中,符合如图2示转化关系(一定条件下),则A为X,B为S,C为Y
D. 有同学预测足量Z的浓溶液与Cu反应后得到蓝色溶液,但是实验结果得到白色固体,现欲得到蓝色溶液,可向所得混合物中加蒸馏水并不断搅拌
C
7.化学中常用类比的方法可预测许多物质的性质。如根据推测:但类比是相对的,如根据,推测是错误的,应该是。下列各组类比中正确的是( )
A. 钠与水反应生成和,推测:所有金属与水反应都生成碱和
B. 由,推测:
C. 铝和硫直接化合能得到,推测:铁和硫直接化合也能得到
D. 由,推测:
D
8.亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是( )
A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
D
9.下图是一种综合处理SO2废气的工艺流程。下列说法正确的是( )
A.操作Ⅱ发生反应的离子方程式为:2Fe2++4H++O2=2Fe3++2H2O
B.溶液b中阳离子只有Fe2+
C.溶液a转化为溶液b的反应中,SO2被氧化
D.加入FeO可以使溶液c转化为溶液a
C
10.硫元素的几种化合物及其单质存在下列转化关系(反应条件省略)。
下列判断不正确的是( )
A.反应①中氧化剂与还原剂物质的量之比为1∶1
B.反应②表明SO2具有酸性氧化物的性质
C.反应③的原子利用率是100%
D.反应④中稀H2SO4作氧化剂
D
Na2SO3+S=Na2S2O3
Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
不同价态含硫物质的转化
第五章 化工生产中的重要非金属元素
1.通过对酸雨形成过程中含硫物质的存在及转化分析,巩固从化合价角度认识物质转化的思路,初步形成转化意识
2.通过设计脱除SO2的反应路径,将转化思路分解、细化,明确转化角度。通过对转化思路的梳理,完善转化思维模型。
3.通过分析实际工业生产中SO2的去除路径,提升基于思维模型分析、解决实际问题的能力。
火山喷口附近或地壳的岩层里
化合态:主要以硫化物和硫酸盐的形式存在
①硫化物形式 黄铁矿:FeS2;黄铜矿:CuFeS2。
②硫酸盐形式 芒硝:Na2SO4·10H2O 石膏:CaSO4·2H2O。
③存在于某些蛋白质中。
一、自然界中硫的存在和转化
SO2
SO3
H2SO3
H2SO4
+O2
+O2
+H2O
+H2O
S
酸雨形成过程中含硫物质的转化示意图
单质或
氧化物
酸
盐
+O2
-2
0
+4
+6
化合价
物质类别
酸雨形成过程——低价态的硫被氧化为高价态硫的过程
二、防治酸雨,设计转化路径
防治酸雨,就要将燃煤烟气中的SO2气体转化为其他对环境无污染或污染较小的含硫物质。那么, 可将SO2转化为哪些含硫物质?
SO32-
SO42-
H2S
S2-
物质转化思路:价态分析→转化目标→试剂选择
+ 碱等
+氧化剂
+还原剂
去除SO2的转化路径
SO2
SO3
H2SO3
H2SO4
+O2
+O2
+H2O
+H2O
S
单质或
氧化物
酸
盐
+O2
-2
0
+4
+6
化合价
物质类别
不同价态硫元素间转化的思维模型
Na2S
实验序号 转化目标 (价态变化) 转化前的含硫物质 选择试剂 转化后的含硫物质 预期现象
1 +4 → +6 SO2
2 +4 → +6 SO2
3 +4 → 0 SO2
4 +4 → +4 SO2
H2O2
生成淡黄色固体
反应后滴入BaCl2,产生白色沉淀,加入盐酸后沉淀溶解
反应后滴入稀盐酸,再滴入BaCl2,产生白色沉淀。
酸性KMnO4
SO42-
高锰酸钾溶液褪色
NaOH
S
SO42-
SO32-
Na2S
利用以下试剂,设计实验方案,验证SO2去除过程中发生了上述含硫物质的转化,并填写表格
试剂:SO2、酸性KMnO4溶液、H2O2溶液、Na2S溶液、稀盐酸、BaCl2溶液、NaOH溶液
1、氧化剂能选择浓硫酸吗?
学与问
2、已知还原性的强弱顺序为:S2->SO32-(SO2)>I->Fe2+,
则可选用哪种还原剂?
常见 氧化剂 O2 H2O2 KMnO4(H+)
Cl2 NaClO FeCl3 浓硫酸
常见 还原剂 金属单质 H2 CO
Na2S KI FeCl2
转化关系 (价态变化) 转化前的 含硫物质 选择试剂 (氧化剂或还原剂) 转化后的 含硫物质 预期
现象
0→-2 S Fe/Cu FeS/Cu2S
0→+4 S O2 SO2
+6→+4 浓H2SO4 Cu SO2
预期转化 选择试剂 实验操作和现象 实验结论
亚硫酸钠 稀硫酸 硫化钠 向亚硫酸钠溶液中加入稀硫酸,再加入硫化钠溶液,生成 色沉淀 反应生成
黄
硫
+4 0
Na2SO3 S
转化关系 (价态变化) 转化前的 含硫物质 选择试剂 (氧化剂或还原剂) 转化后的 含硫物质 预期
现象
+4→0 Na2SO3 SO2水溶液 还原剂 S 黄色沉淀
+4→+6 氧化剂 H2SO4
-2→0 Na2S 氧化剂 S 黄色沉淀
预期转化 选择试剂 实验操作和现象 实验结论
SO2水溶液 氯水 氯化钡溶液 向SO2水溶液中加入氯水,再加入氯化钡溶液,观察到 生成 色沉淀 反应生成
+4 +6
白
硫酸
SO2 H2SO4
1.同价态硫(+4价)化合物之间的相互转化关系如图。
写出图中序号所示反应的化学方程式。
① ;
② ;
③ 。
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
SO2+2NaOH===Na2SO3+H2O
相同价态硫的转化是通过酸、碱反应实现的
写出②、③、④反应的化学方程式:
②___________________________;
③________________________________;
④__________________________。
H2SO3+2NaOH == Na2SO3+2H2O
Na2SO3+H2SO4 ==Na2SO4+H2O+SO2↑
SO2+Na2SO3+H2O ==2NaHSO3
2.当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,可用下图表示
写出③④⑤的化学方程式(选考)
③____________________;
④_______________;
⑤_______________________。
SO2+2H2S===3S+2H2O
写出①②⑤的化学方程式(选考)
①________________________________;
②_____________________________________;
⑤_______________________。
2Na2S+O2+2H2O===4NaOH+2S↓
2Na2SO3+O2===2Na2SO4
不同价态硫的转化是通过氧化还原反应实现的
当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降
2SO2+O2 2SO3
小结规律:邻位转化规律
2H2S + O2(少量) 2S+2H2O
点燃
2H2S + 3O2(过量) 2SO2+2H2O
点燃
小结规律:越位转化规律
H2S+ H2SO4 S↓ +SO2 ↑ +2H2O
S + 2H2SO4 3SO2↑+ 2H2O
小结规律:归中转化规律
SO2
物质类别
化
合
价
单质
氧化物
盐
含氧酸
-2
+4
SO3
氢化物
硫元素的价类图
0
H2S
S
H2SO3
H2SO4
SO32-
SO42-
FeS
NaOH
Cl2、H2O2、O2
Cu、C、HI、H2S
Cl2、H2O2、O2
O2、浓硫酸
H2S
H2
KMnO4、HNO3、Fe3+
H2O
△
Cl2、O2、SO2、Fe3+、 HNO3 、 KMnO4
O2
NaOH
稀硫酸
+6
Fe
酸碱转化
氧化还原转化
H2O
△
1.硫在自然界的循环过程如图所示,下列说法不正确的是( )
A.石油和煤等化石燃料中含有硫元素
B.大气中的二氧化硫只来源于火山喷发
C.地壳中的硫元素常以硫化物和硫酸盐
的形式存在
D.动植物遗体被微生物分解后,可产生SO 和SO2
B
2.已知X为一种常见酸的浓溶液, 能使蔗糖粉末变黑。A与X反应转化关系如右图,其中反应条件及部分产物均已略去。
则下列有关说法正确的是 ( )
A.X使蔗糖变黑,主要体现X的强氧化性
B.若A为铁,足量A与X在室温下可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
D
3.关于硫及含硫化合物的说法中,正确的是( )
A.硫的化学性质比较活泼,自然界中不能以游离态存在
B.自然界中的硫酸钡以重晶石的形式存在,硫酸钙常以石膏(2CaSO4·H2O )的形式存在
C.食品中添加适量 可以起到漂白、防腐等作用
D.在加热条件下,铜和浓硫酸反应生成了蓝色的硫酸铜溶液和能使品红褪色的SO2气体
D
4.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是
A. 该过程中可得到化工产品
B. 该工艺流程是除去煤燃烧时产生的
C. 该过程中化合价发生改变的元素为和
D. 图中涉及的反应之一为
C
5.硫黄在空气中燃烧生成气体甲;将甲溶于水得溶液乙;向溶液乙中滴加溴水时溴水褪色,乙变为丙;在丙中加入硫化钠又生成气体丁;把丁通入溶液乙中得沉淀戊。物质甲、乙、丙、丁、戊中均含有硫元素,它们依次是( )
A.SO3 、H2SO4 、 H2SO3 、H2S 、S
B. SO2 、 H2SO3 、 H2SO4 、 H2S 、S
C. SO2 、 H2SO3 、 H2SO4 、 H2S 、 SO3
D. SO2 、 H2SO3 、 H2S 、 H2SO4 、 Na2S2O3
B
6.下图1为硫元素的价类二维图:根据图像信息判断下列说法正确的是( )
A. 从硫元素化合价变化的角度分析,图1中既有氧化性又有还原性的化合物有4种
B. 将X与Y混合,可生成淡黄色固体,该反应中氧化产物与还原产物的物质的量之比为1:1
C. 上述八种物质中,符合如图2示转化关系(一定条件下),则A为X,B为S,C为Y
D. 有同学预测足量Z的浓溶液与Cu反应后得到蓝色溶液,但是实验结果得到白色固体,现欲得到蓝色溶液,可向所得混合物中加蒸馏水并不断搅拌
C
7.化学中常用类比的方法可预测许多物质的性质。如根据推测:但类比是相对的,如根据,推测是错误的,应该是。下列各组类比中正确的是( )
A. 钠与水反应生成和,推测:所有金属与水反应都生成碱和
B. 由,推测:
C. 铝和硫直接化合能得到,推测:铁和硫直接化合也能得到
D. 由,推测:
D
8.亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是( )
A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
D
9.下图是一种综合处理SO2废气的工艺流程。下列说法正确的是( )
A.操作Ⅱ发生反应的离子方程式为:2Fe2++4H++O2=2Fe3++2H2O
B.溶液b中阳离子只有Fe2+
C.溶液a转化为溶液b的反应中,SO2被氧化
D.加入FeO可以使溶液c转化为溶液a
C
10.硫元素的几种化合物及其单质存在下列转化关系(反应条件省略)。
下列判断不正确的是( )
A.反应①中氧化剂与还原剂物质的量之比为1∶1
B.反应②表明SO2具有酸性氧化物的性质
C.反应③的原子利用率是100%
D.反应④中稀H2SO4作氧化剂
D
Na2SO3+S=Na2S2O3
Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
