8.2 课时2 酸的化学性质 课件(共23张PPT) 2024-2025学年化学沪教版九年级下册
文档属性
| 名称 | 8.2 课时2 酸的化学性质 课件(共23张PPT) 2024-2025学年化学沪教版九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-18 20:10:15 | ||
图片预览







文档简介
(共23张PPT)
课时2 酸的化学性质
1. 认识盐酸、稀硫酸的主要化学性质。
3. 了解常见的酸在生活、生产中的用途。
2. 认识金属活动性顺序,并能对常见金属能否与稀盐酸(或稀硫酸)发生置换反应进行判断。
常见的酸
酸:电离产生的阳离子全部是H+的化合物
盐酸 HCl
硫酸 H2SO4
硝酸 HNO3
磷酸 H3PO4
碳酸 H2CO3
醋酸 CH3COOH
名称角度
都称为某酸
组成角度
酸溶液里都含有H+
它们都有一些相似的化学性质
即通性
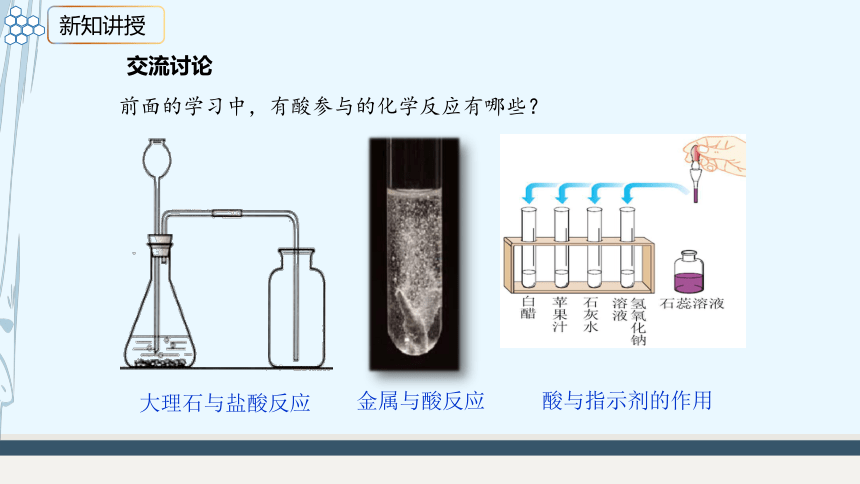
酸与指示剂的作用
金属与酸反应
大理石与盐酸反应
前面的学习中,有酸参与的化学反应有哪些?
交流讨论
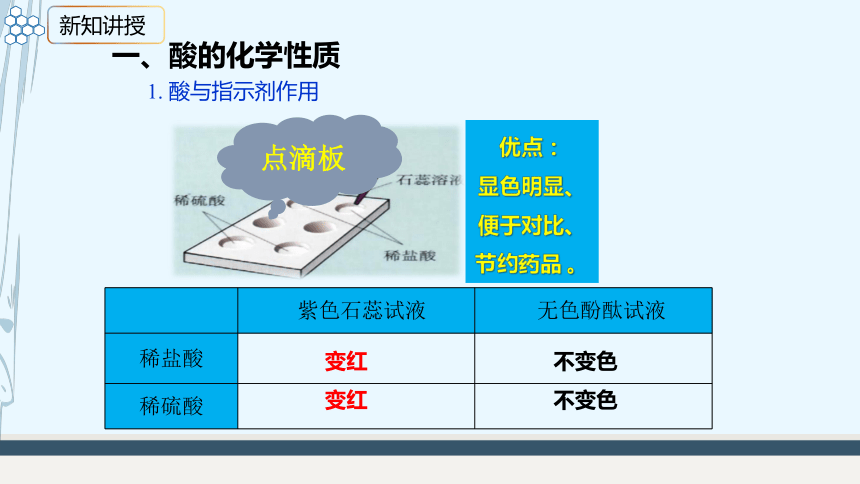
紫色石蕊试液 无色酚酞试液
稀盐酸
稀硫酸
变红
变红
不变色
不变色
1. 酸与指示剂作用
点滴板
优点:
显色明显、
便于对比、
节约药品 。
一、酸的化学性质
2. 酸与活泼金属反应
【实验】用稀硫酸和稀盐酸做如下实验,把实验现象填入表中,并讨论以下问题:
1.镁、铝、铜三种金属中,哪些能从酸溶液中置换出氢,哪些不能 写出有关的化学方程式。
2.描述、比较酸溶液与上述金属反应的实验现象,讨论可能的原因。
铜片
铜片
稀硫酸
稀硫酸
稀硫酸
实验操作 实验现象 反应的化学方程式
镁与稀盐酸 反应剧烈,产生大量气泡,放出热量,镁条逐渐溶解。 Mg+2HCl=Mg+↑
铝与稀盐酸 铝片表面产生大量气泡,铝片逐渐溶解 2Al+6HCl=2Al+3↑
铜与稀盐酸 不发生反应 无
盐
实验操作 实验现象 反应的化学方程式
镁与稀硫酸 反应剧烈,产生大量气泡,放出热量,镁条逐渐溶解。 Mg+S=MgS+↑
铝与稀硫酸 铝片表面产生大量气泡,铝片逐渐溶解 2Al+3S=Al+3↑
铜与稀硫酸 不发生反应 无
盐
上述各反应的生成物有何特点?
Mg +2 HCl = MgCl2 + H2↑
Zn +2HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
2Al +3H2SO4= Al2(SO4)3+ 3H2↑
2Al +6HCl = 2AlCl3 + 3H2↑
盐
酸+较活泼金属=盐+氢气
实验结论:
镁、铝、锌、铁等活动性较强的金属能与稀硫酸、稀盐酸发生置换反应,放出氢气,同时生成一类称为盐的化合物。
铜不能与稀硫酸、稀盐酸发生置换反应。
金属单质与酸溶液能否发生置换反应、反应的难易程度如何,与金属的活动性强弱有关。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金
1. 金属的位置越靠前,其活动性 。
2. 排在 的金属能与酸反应置换出 ,
的金属不能与酸发生置换反应。
3. 排在 的金属(不含K、Ca、Na)可以将其后面的金属从其盐溶液中置换出来。
越强
H前面
H2
H后面
前面
运用金属活动性顺序预测和解释化学反应
在金属活动性顺序表中,金属的位置越靠前,它的活动性就越强,排在氢前面的金属能与稀盐酸(或稀硫酸)发生置换反应,排在氢后面的金属不能与稀盐酸(或稀硫酸)发生置换反应。运用金属活动性顺序,可以预测金属与酸的化学反应,解释有关的实验现象。
观念构建
3. 酸与金属氧化物反应
【实验】向氧化铜中加入稀硫酸,向氧化铁中加入稀盐酸,观察实验现象并书写相应的化学方程式。
稀硫酸
氧化铜
稀盐酸
氧化铁
现象:
① 色的铁锈逐渐 ;
②溶液由 色逐渐变为 色。
反应方程式:
Fe2O3 + H2SO4
Fe2O3 + HCl
红棕
无
黄
6 = 2FeCl3 + 3H2O
3 = Fe2(SO4)3 + 3H2O
消失
(铁锈的主要成分Fe2O3)
溶液中含有Fe3+呈黄色
(1)酸与铁锈反应
① 色的氧化铜逐渐 ;
②溶液由 色逐渐变为 色。
CuO + H2SO4
CuO + HCl
黑
无
蓝
2 = CuCl2 + H2O
= CuSO4 + H2O
消失
溶液中含有Cu2+呈蓝色
(2)酸与氧化铜反应
现象:
反应方程式:
酸 + 金属氧化物 →
Fe2O3 + HCl
6 = 2FeCl3 + 3H2O
Fe2O3 + H2SO4
3 = Fe2(SO4)3 + 3H2O
CuO + HCl
CuO + H2SO4
2 = CuCl2 + H2O
= CuSO4 + H2O
盐
水
盐 + 水
1. 酸与指示剂作用
2. 酸 + 金属 → 盐 + H2
3. 酸 + 金属氧化物 → 盐 + H2O
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸在水溶液中都能解离出H+和酸根离子,
即在不同的酸溶液中都含有相同的H+,
所以酸有一些相似的性质。
为什么不同的酸有一些相似的化学性质?
交流讨论
胃液中含盐酸帮助消化
制药
金属除锈
1. 盐酸的用途
二、酸的用途
化肥
农药
金属除锈
精炼石油
2. 硫酸的用途
1.在给定条件下,下列物质间的转化能实现的是( )
A. B.
C. D.
C
2.相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的稀硫酸充分反应,生成氢气质量与反应时间关系见如图,分析图像判断,下面说法正确的是( )
A.金属锌反应速率最大
B.金属锌的活动性最强
C.金属镁生成氢气质量最多
D.金属铁消耗稀硫酸质量最多
C
3.现将等质量且形状相同的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量随反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2)。下列说法正确的是( )
A.相对原子质量:丙<乙<甲
B.金属活动性:乙<丙<甲
C.消耗硫酸的质量:甲<乙<丙
D.甲、乙、丙可能分别是锌、铁、镁
B
课时2 酸的化学性质
1. 认识盐酸、稀硫酸的主要化学性质。
3. 了解常见的酸在生活、生产中的用途。
2. 认识金属活动性顺序,并能对常见金属能否与稀盐酸(或稀硫酸)发生置换反应进行判断。
常见的酸
酸:电离产生的阳离子全部是H+的化合物
盐酸 HCl
硫酸 H2SO4
硝酸 HNO3
磷酸 H3PO4
碳酸 H2CO3
醋酸 CH3COOH
名称角度
都称为某酸
组成角度
酸溶液里都含有H+
它们都有一些相似的化学性质
即通性
酸与指示剂的作用
金属与酸反应
大理石与盐酸反应
前面的学习中,有酸参与的化学反应有哪些?
交流讨论
紫色石蕊试液 无色酚酞试液
稀盐酸
稀硫酸
变红
变红
不变色
不变色
1. 酸与指示剂作用
点滴板
优点:
显色明显、
便于对比、
节约药品 。
一、酸的化学性质
2. 酸与活泼金属反应
【实验】用稀硫酸和稀盐酸做如下实验,把实验现象填入表中,并讨论以下问题:
1.镁、铝、铜三种金属中,哪些能从酸溶液中置换出氢,哪些不能 写出有关的化学方程式。
2.描述、比较酸溶液与上述金属反应的实验现象,讨论可能的原因。
铜片
铜片
稀硫酸
稀硫酸
稀硫酸
实验操作 实验现象 反应的化学方程式
镁与稀盐酸 反应剧烈,产生大量气泡,放出热量,镁条逐渐溶解。 Mg+2HCl=Mg+↑
铝与稀盐酸 铝片表面产生大量气泡,铝片逐渐溶解 2Al+6HCl=2Al+3↑
铜与稀盐酸 不发生反应 无
盐
实验操作 实验现象 反应的化学方程式
镁与稀硫酸 反应剧烈,产生大量气泡,放出热量,镁条逐渐溶解。 Mg+S=MgS+↑
铝与稀硫酸 铝片表面产生大量气泡,铝片逐渐溶解 2Al+3S=Al+3↑
铜与稀硫酸 不发生反应 无
盐
上述各反应的生成物有何特点?
Mg +2 HCl = MgCl2 + H2↑
Zn +2HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
2Al +3H2SO4= Al2(SO4)3+ 3H2↑
2Al +6HCl = 2AlCl3 + 3H2↑
盐
酸+较活泼金属=盐+氢气
实验结论:
镁、铝、锌、铁等活动性较强的金属能与稀硫酸、稀盐酸发生置换反应,放出氢气,同时生成一类称为盐的化合物。
铜不能与稀硫酸、稀盐酸发生置换反应。
金属单质与酸溶液能否发生置换反应、反应的难易程度如何,与金属的活动性强弱有关。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金
1. 金属的位置越靠前,其活动性 。
2. 排在 的金属能与酸反应置换出 ,
的金属不能与酸发生置换反应。
3. 排在 的金属(不含K、Ca、Na)可以将其后面的金属从其盐溶液中置换出来。
越强
H前面
H2
H后面
前面
运用金属活动性顺序预测和解释化学反应
在金属活动性顺序表中,金属的位置越靠前,它的活动性就越强,排在氢前面的金属能与稀盐酸(或稀硫酸)发生置换反应,排在氢后面的金属不能与稀盐酸(或稀硫酸)发生置换反应。运用金属活动性顺序,可以预测金属与酸的化学反应,解释有关的实验现象。
观念构建
3. 酸与金属氧化物反应
【实验】向氧化铜中加入稀硫酸,向氧化铁中加入稀盐酸,观察实验现象并书写相应的化学方程式。
稀硫酸
氧化铜
稀盐酸
氧化铁
现象:
① 色的铁锈逐渐 ;
②溶液由 色逐渐变为 色。
反应方程式:
Fe2O3 + H2SO4
Fe2O3 + HCl
红棕
无
黄
6 = 2FeCl3 + 3H2O
3 = Fe2(SO4)3 + 3H2O
消失
(铁锈的主要成分Fe2O3)
溶液中含有Fe3+呈黄色
(1)酸与铁锈反应
① 色的氧化铜逐渐 ;
②溶液由 色逐渐变为 色。
CuO + H2SO4
CuO + HCl
黑
无
蓝
2 = CuCl2 + H2O
= CuSO4 + H2O
消失
溶液中含有Cu2+呈蓝色
(2)酸与氧化铜反应
现象:
反应方程式:
酸 + 金属氧化物 →
Fe2O3 + HCl
6 = 2FeCl3 + 3H2O
Fe2O3 + H2SO4
3 = Fe2(SO4)3 + 3H2O
CuO + HCl
CuO + H2SO4
2 = CuCl2 + H2O
= CuSO4 + H2O
盐
水
盐 + 水
1. 酸与指示剂作用
2. 酸 + 金属 → 盐 + H2
3. 酸 + 金属氧化物 → 盐 + H2O
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸在水溶液中都能解离出H+和酸根离子,
即在不同的酸溶液中都含有相同的H+,
所以酸有一些相似的性质。
为什么不同的酸有一些相似的化学性质?
交流讨论
胃液中含盐酸帮助消化
制药
金属除锈
1. 盐酸的用途
二、酸的用途
化肥
农药
金属除锈
精炼石油
2. 硫酸的用途
1.在给定条件下,下列物质间的转化能实现的是( )
A. B.
C. D.
C
2.相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的稀硫酸充分反应,生成氢气质量与反应时间关系见如图,分析图像判断,下面说法正确的是( )
A.金属锌反应速率最大
B.金属锌的活动性最强
C.金属镁生成氢气质量最多
D.金属铁消耗稀硫酸质量最多
C
3.现将等质量且形状相同的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量随反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2)。下列说法正确的是( )
A.相对原子质量:丙<乙<甲
B.金属活动性:乙<丙<甲
C.消耗硫酸的质量:甲<乙<丙
D.甲、乙、丙可能分别是锌、铁、镁
B
同课章节目录
