5.2 课时1 氮气与氮的固定(22页)
文档属性
| 名称 | 5.2 课时1 氮气与氮的固定(22页) |  | |
| 格式 | pptx | ||
| 文件大小 | 193.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-19 10:05:14 | ||
图片预览




文档简介
(共22张PPT)
氮气与氮的固定
第五章 化工生产中的重要非金属元素
1.从价类二维的角度认识元素化合物
2.通过分析氮的原子结构,推断含氮物质可能具有的化学特性,理解结构与性质的关系
3.通过对氮的固定的学习以及应用,诊断并发展学生对化学学科价值的认识
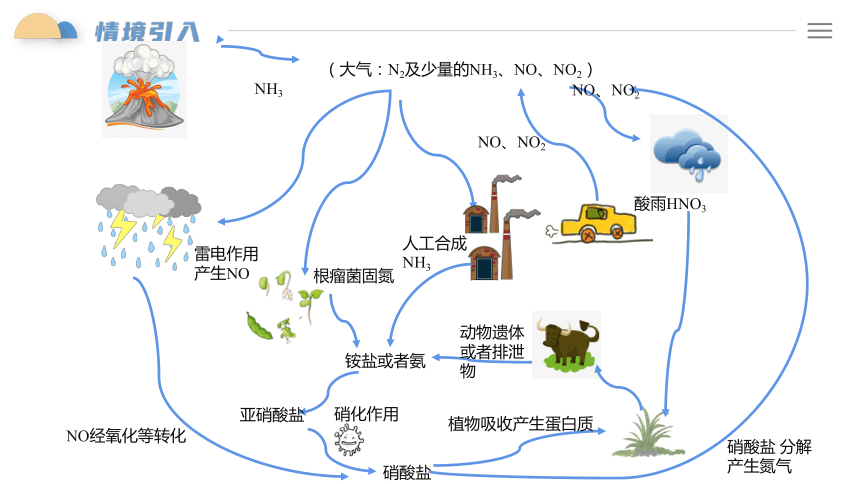
(大气:N2及少量的NH3、NO、NO2)
雷电作用
产生NO
NH3
根瘤菌固氮
人工合成NH3
酸雨HNO3
动物遗体或者排泄物
铵盐或者氨
硝酸盐
NO经氧化等转化
亚硝酸盐
植物吸收产生蛋白质
硝酸盐 分解产生氮气
硝化作用
NO、NO2
NO、NO2
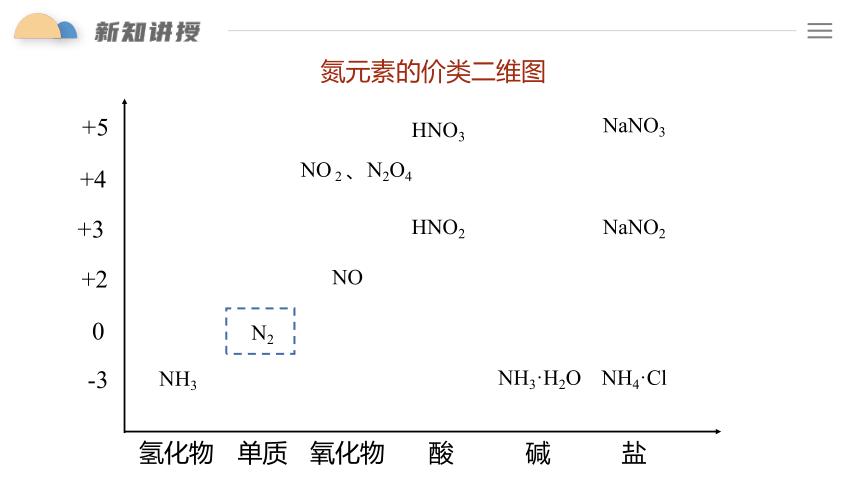
-3
0
+2
+4
+5
氢化物
单质
氧化物
酸
碱
盐
NH3
N2
NO 2 、N2O4
NO
HNO3
HNO2
NaNO3
NaNO2
+3
NH3·H2O
NH4·Cl
氮元素的价类二维图
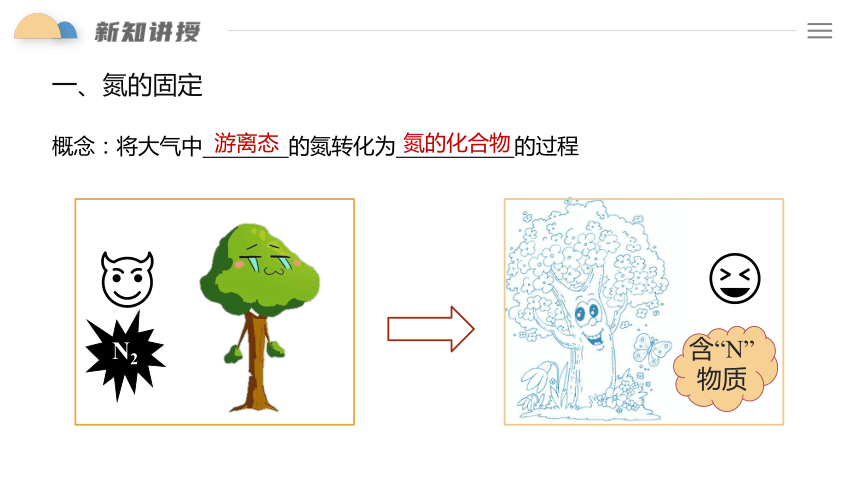
N2
含“N”物质
一、氮的固定
概念:将大气中 的氮转化为 的过程
游离态
氮的化合物
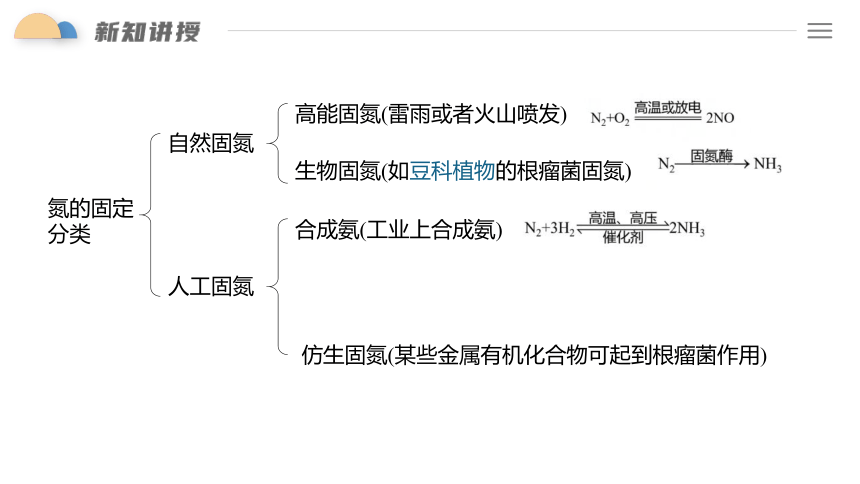
高能固氮
生物固氮
自然固氮
人工固氮
合成氨
仿生固氮
氮的固定
分类
自然固氮
高能固氮(雷雨或者火山喷发)
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌作用)
在我们空气中含量最多的就是氮气,
为何大多数农作物不能直接利用吸收氮气而需要施氮肥?
二、氮气
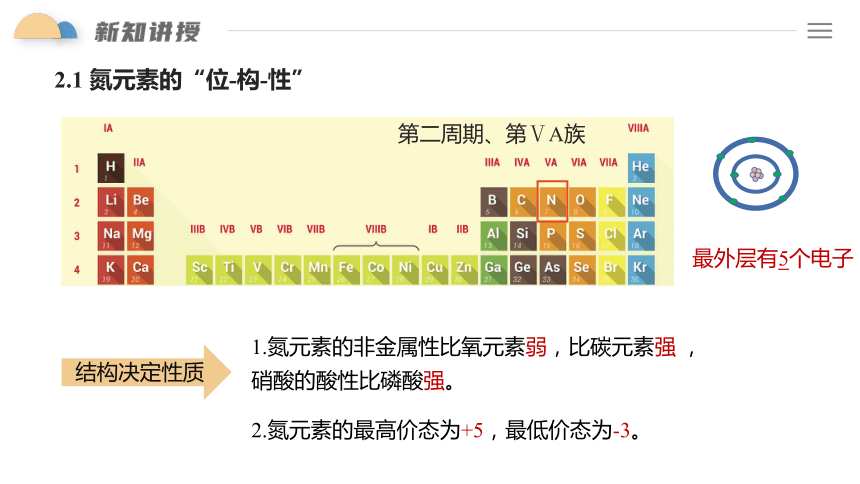
最外层有5个电子
1.氮元素的非金属性比氧元素弱,比碳元素强 ,硝酸的酸性比磷酸强。
2.氮元素的最高价态为+5,最低价态为-3。
结构决定性质
2.1 氮元素的“位-构-性”
第二周期、第ⅤA族
①游离态:主要以 的形式存在于空气中。
②化合态:部分存在于动植物体内的 中;
部分存在于土壤、海洋里的 中。
氮气分子
蛋白质
硝酸盐和铵盐
2.2氮元素在自然界中的存在形式
2.3 氮气的物理性质
颜色 状态 气味 密度 溶解性
_____ 气体 _____ 密度与空气接近 ___溶于水
无色
无味
难
(1)氮分子内两个氮原子间以 结合,断开该化学键
需要 的能量,所以氮气的化学性质很 ,通常情况
下 与其他物质发生化学反应。因此无法被大多数生物体直接吸收。
较多
氮氮三键
稳定
很难
电子式 结构式
①金属镁: ,
(Li、Mg、Ca)
②氢气: ,
氧化性
还原性
人工合成氨
2.4 氮气的化学性质
可逆反应
N2+3Mg===Mg3N2
点燃
N2+3H2====2NH3
催化剂
高温高压
N2+O2======2NO
放电
或高温
氮肥
尿素
碳酸氢铵
氯化铵
硝酸铵
CO(NH2)2
NH4Cl
NH4NO3
NH4HCO3
制备
应用
N2的结构
N2的性质
稳定 + 反应
氮的固定
氮的循环
N2 → 氮的化合物
N2 + 3H2
2NH3
高温、高压
催化剂
N2+3Mg===Mg3N2
点燃
N2+O2======2NO
放电
或高温
1.下列关于氮气的用途,叙述错误的是( )
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
C
2.下列关于氮气的叙述,错误的是( )
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
D
A.图中有3种固氮途径
B.固氮都是氧化还原反应
C.氮元素不以有机物形式参与循环
D.人类活动会影响氮循环
C
3.自然界中的氮循环如图所示。下列说法错误的是( )
4.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 由32 g O2和O3组成的混合气体中含有的原子总数为2.5NA
B.1 mol Fe与足量的S反应转移电子数为3NA
C.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2 ,均失去2NA个电子
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA
C
5.《中国诗词大会》不仅弘扬了,中华传统文化,还蕴含着许多化学知识。下列诗句的有关说法错误的是( )
A. 王安石诗句“雷蟠电掣云滔滔,夜半载雨输亭皋”。雷雨天实现了大气中氮的固定
B. 于谦诗句“凿开混沌得乌金,藏蓄阳和意最深”。“乌金”指的是石油
C. 赵孟螟诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。灿烂的烟花与某些金属元素的焰色反应有关
D. 刘禹锡诗句“千淘万漉虽辛苦,吹尽黄沙始到金”。金性质稳定,存在游离态,可用物理方法获得
B
6.下列关于氮气的说法错误的是
A. 氮气在通常情况下不燃烧,也不支持燃烧,不能供给呼吸
B. 液氮可用于医学和高科技领域,制造低温环境
C. 利用氮气的稳定性,工业上用来替代稀有气体作焊接金属的保护气
D. 在高温高压、催化剂条件下与氢气反应时,氮气作还原剂
D
氮气与氮的固定
第五章 化工生产中的重要非金属元素
1.从价类二维的角度认识元素化合物
2.通过分析氮的原子结构,推断含氮物质可能具有的化学特性,理解结构与性质的关系
3.通过对氮的固定的学习以及应用,诊断并发展学生对化学学科价值的认识
(大气:N2及少量的NH3、NO、NO2)
雷电作用
产生NO
NH3
根瘤菌固氮
人工合成NH3
酸雨HNO3
动物遗体或者排泄物
铵盐或者氨
硝酸盐
NO经氧化等转化
亚硝酸盐
植物吸收产生蛋白质
硝酸盐 分解产生氮气
硝化作用
NO、NO2
NO、NO2
-3
0
+2
+4
+5
氢化物
单质
氧化物
酸
碱
盐
NH3
N2
NO 2 、N2O4
NO
HNO3
HNO2
NaNO3
NaNO2
+3
NH3·H2O
NH4·Cl
氮元素的价类二维图
N2
含“N”物质
一、氮的固定
概念:将大气中 的氮转化为 的过程
游离态
氮的化合物
高能固氮
生物固氮
自然固氮
人工固氮
合成氨
仿生固氮
氮的固定
分类
自然固氮
高能固氮(雷雨或者火山喷发)
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌作用)
在我们空气中含量最多的就是氮气,
为何大多数农作物不能直接利用吸收氮气而需要施氮肥?
二、氮气
最外层有5个电子
1.氮元素的非金属性比氧元素弱,比碳元素强 ,硝酸的酸性比磷酸强。
2.氮元素的最高价态为+5,最低价态为-3。
结构决定性质
2.1 氮元素的“位-构-性”
第二周期、第ⅤA族
①游离态:主要以 的形式存在于空气中。
②化合态:部分存在于动植物体内的 中;
部分存在于土壤、海洋里的 中。
氮气分子
蛋白质
硝酸盐和铵盐
2.2氮元素在自然界中的存在形式
2.3 氮气的物理性质
颜色 状态 气味 密度 溶解性
_____ 气体 _____ 密度与空气接近 ___溶于水
无色
无味
难
(1)氮分子内两个氮原子间以 结合,断开该化学键
需要 的能量,所以氮气的化学性质很 ,通常情况
下 与其他物质发生化学反应。因此无法被大多数生物体直接吸收。
较多
氮氮三键
稳定
很难
电子式 结构式
①金属镁: ,
(Li、Mg、Ca)
②氢气: ,
氧化性
还原性
人工合成氨
2.4 氮气的化学性质
可逆反应
N2+3Mg===Mg3N2
点燃
N2+3H2====2NH3
催化剂
高温高压
N2+O2======2NO
放电
或高温
氮肥
尿素
碳酸氢铵
氯化铵
硝酸铵
CO(NH2)2
NH4Cl
NH4NO3
NH4HCO3
制备
应用
N2的结构
N2的性质
稳定 + 反应
氮的固定
氮的循环
N2 → 氮的化合物
N2 + 3H2
2NH3
高温、高压
催化剂
N2+3Mg===Mg3N2
点燃
N2+O2======2NO
放电
或高温
1.下列关于氮气的用途,叙述错误的是( )
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
C
2.下列关于氮气的叙述,错误的是( )
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
D
A.图中有3种固氮途径
B.固氮都是氧化还原反应
C.氮元素不以有机物形式参与循环
D.人类活动会影响氮循环
C
3.自然界中的氮循环如图所示。下列说法错误的是( )
4.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 由32 g O2和O3组成的混合气体中含有的原子总数为2.5NA
B.1 mol Fe与足量的S反应转移电子数为3NA
C.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2 ,均失去2NA个电子
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA
C
5.《中国诗词大会》不仅弘扬了,中华传统文化,还蕴含着许多化学知识。下列诗句的有关说法错误的是( )
A. 王安石诗句“雷蟠电掣云滔滔,夜半载雨输亭皋”。雷雨天实现了大气中氮的固定
B. 于谦诗句“凿开混沌得乌金,藏蓄阳和意最深”。“乌金”指的是石油
C. 赵孟螟诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。灿烂的烟花与某些金属元素的焰色反应有关
D. 刘禹锡诗句“千淘万漉虽辛苦,吹尽黄沙始到金”。金性质稳定,存在游离态,可用物理方法获得
B
6.下列关于氮气的说法错误的是
A. 氮气在通常情况下不燃烧,也不支持燃烧,不能供给呼吸
B. 液氮可用于医学和高科技领域,制造低温环境
C. 利用氮气的稳定性,工业上用来替代稀有气体作焊接金属的保护气
D. 在高温高压、催化剂条件下与氢气反应时,氮气作还原剂
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
