8.4 课时1 盐的组成和分类 课件(共18张PPT) 2024-2025学年化学沪教版九年级下册
文档属性
| 名称 | 8.4 课时1 盐的组成和分类 课件(共18张PPT) 2024-2025学年化学沪教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 36.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-19 14:25:17 | ||
图片预览





文档简介
(共18张PPT)
8.4 几种重要的盐
课时1 盐的组成和分类
1.认识盐的组成特点,能判断盐类物质。
2.了解某些盐溶液能够与金属发生置换反应。
3.能依据实验事实判断常见的复分解反应。
食盐是盐,盐就是食盐
错, 盐≠食盐
如亚硝酸钠是盐,有毒,是“工业用盐”,不是食盐
碳酸钙、碳酸钠、氯化钠等都是常见的盐。
如何将盐进行分类呢?
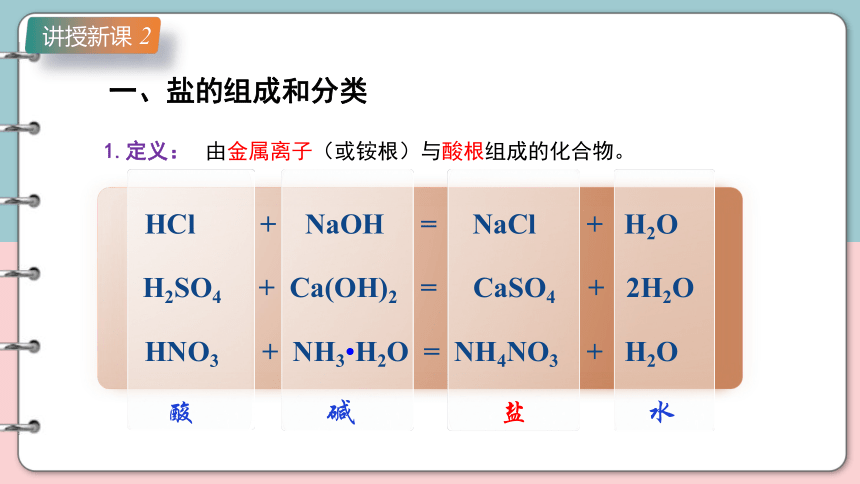
酸
碱
盐
水
HCl + NaOH = NaCl + H2O
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
HNO3 + NH3 H2O = NH4NO3 + H2O
1.定义:
由金属离子(或铵根)与酸根组成的化合物。
一、盐的组成和分类
请你试着写出下列几种盐的化学式。
硝酸钾
碳酸钠
碳酸钙
氯化钠
硫酸钾
氯化钙
硫酸铵
氯化铜
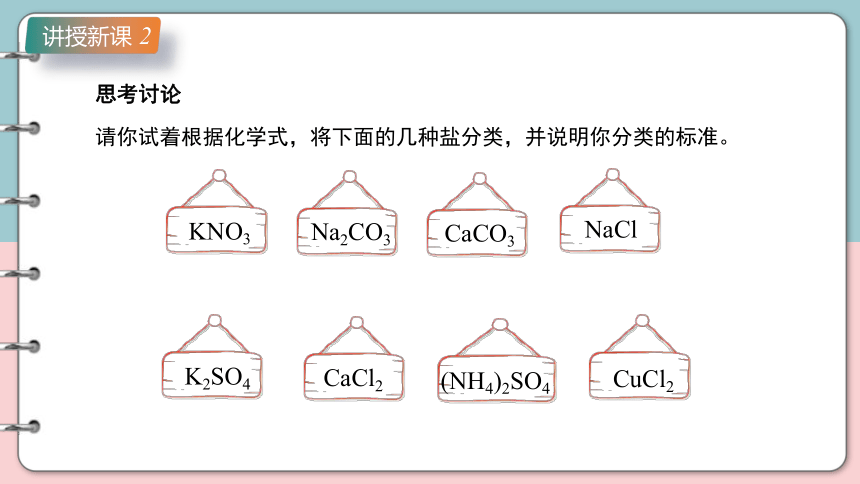
思考讨论
请你试着根据化学式,将下面的几种盐分类,并说明你分类的标准。
KNO3
Na2CO3
CaCO3
NaCl
K2SO4
CaCl2
(NH4)2SO4
CuCl2
思考讨论
根据组成盐的阳离子种类
根据组成盐的酸根种类
钾盐
钠盐
钙盐
铜盐
硝酸盐
盐酸盐
硫酸盐
碳酸盐
2.盐的分类
不同的盐在水中的溶解性不同,如氯化钠、氯化钾易溶于水,硫酸钙微溶于水,而碳酸钙则难溶于水。
3.盐的溶解性
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
NH4+ 溶、挥 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 不
Ag+ —— 溶 不 微 不
H2O
酸、碱、盐溶解性表(20℃)
四碱
四盐
Mg(OH)2
Al(OH)3
Fe(OH)3
Cu(OH)2
白色
白色
红褐色
蓝色
AgCl
BaSO4
BaCO3
CaCO3
不溶于酸
(不与酸反应)
4. 常见八大不溶物:
写出下列反应的化学方程式,并判断它们的反应类型。
(1)铁与硫酸铜溶液反应
(2)碳酸钠溶液、石灰石分别与足量稀盐酸反应,放出二氧化碳气体
(3)硫酸铜溶液与氢氧化钠溶液混合生成氢氧化铜沉淀
Fe + CuSO4 = FeSO4 + Cu
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
置换反应
复分解反应
复分解反应
交流讨论
1.盐 + 金属 → 新盐 + 新金属
置换反应
Cu +2AgNO3=== Cu(NO3)2+ 2Ag
Zn + CuSO4=== ZnSO4 + Cu
(1)盐必须溶于水;
(2)金属单质除K、Ca、Na外;
(3)金属的活动性比盐中金属活动性强。
反应条件
二、盐的化学性质
2. 盐 + 酸 → 新盐 + 新酸
反应条件
复分解反应
3. 盐 + 碱 → 新盐 + 新碱
生成物中有沉淀或气体或水
反应物均可溶、
生成物中有沉淀或气体或水
1. (生活情境)84消毒液的有效成分是次氯酸钠(NaClO),NaClO属于( D )
A. 氧化物 B. 酸
C. 碱 D. 盐
D
2. 下列物质中,全部是盐类的一组是( B )
A. 食盐、高锰酸钾、碳酸钙、干冰
B. 硫酸铜、碳酸钠、碳酸氢铵、碳酸钾
C. 碳酸钙、烧碱、碳酸钠、盐酸
D. 氯化钡、硫酸、熟石灰、过氧化氢
B
3. 将洁净的铜丝浸入含硝酸银和硝酸锌的混合溶液中,一段时间后取出,铜丝表面覆盖了一层物质,这层物质是( B )
A. 锌 B. 银
C. 银和锌 D. 铁和锌
B
盐的组成和分类
盐的组成和分类
定义:金属离子(或铵根)+酸根
盐的化学性质
分类:钠盐、钾盐、盐酸盐、硫酸盐等
盐的溶解性
盐 + 金属 → 新盐 + 新金属
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
8.4 几种重要的盐
课时1 盐的组成和分类
1.认识盐的组成特点,能判断盐类物质。
2.了解某些盐溶液能够与金属发生置换反应。
3.能依据实验事实判断常见的复分解反应。
食盐是盐,盐就是食盐
错, 盐≠食盐
如亚硝酸钠是盐,有毒,是“工业用盐”,不是食盐
碳酸钙、碳酸钠、氯化钠等都是常见的盐。
如何将盐进行分类呢?
酸
碱
盐
水
HCl + NaOH = NaCl + H2O
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
HNO3 + NH3 H2O = NH4NO3 + H2O
1.定义:
由金属离子(或铵根)与酸根组成的化合物。
一、盐的组成和分类
请你试着写出下列几种盐的化学式。
硝酸钾
碳酸钠
碳酸钙
氯化钠
硫酸钾
氯化钙
硫酸铵
氯化铜
思考讨论
请你试着根据化学式,将下面的几种盐分类,并说明你分类的标准。
KNO3
Na2CO3
CaCO3
NaCl
K2SO4
CaCl2
(NH4)2SO4
CuCl2
思考讨论
根据组成盐的阳离子种类
根据组成盐的酸根种类
钾盐
钠盐
钙盐
铜盐
硝酸盐
盐酸盐
硫酸盐
碳酸盐
2.盐的分类
不同的盐在水中的溶解性不同,如氯化钠、氯化钾易溶于水,硫酸钙微溶于水,而碳酸钙则难溶于水。
3.盐的溶解性
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
NH4+ 溶、挥 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 不
Ag+ —— 溶 不 微 不
H2O
酸、碱、盐溶解性表(20℃)
四碱
四盐
Mg(OH)2
Al(OH)3
Fe(OH)3
Cu(OH)2
白色
白色
红褐色
蓝色
AgCl
BaSO4
BaCO3
CaCO3
不溶于酸
(不与酸反应)
4. 常见八大不溶物:
写出下列反应的化学方程式,并判断它们的反应类型。
(1)铁与硫酸铜溶液反应
(2)碳酸钠溶液、石灰石分别与足量稀盐酸反应,放出二氧化碳气体
(3)硫酸铜溶液与氢氧化钠溶液混合生成氢氧化铜沉淀
Fe + CuSO4 = FeSO4 + Cu
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
置换反应
复分解反应
复分解反应
交流讨论
1.盐 + 金属 → 新盐 + 新金属
置换反应
Cu +2AgNO3=== Cu(NO3)2+ 2Ag
Zn + CuSO4=== ZnSO4 + Cu
(1)盐必须溶于水;
(2)金属单质除K、Ca、Na外;
(3)金属的活动性比盐中金属活动性强。
反应条件
二、盐的化学性质
2. 盐 + 酸 → 新盐 + 新酸
反应条件
复分解反应
3. 盐 + 碱 → 新盐 + 新碱
生成物中有沉淀或气体或水
反应物均可溶、
生成物中有沉淀或气体或水
1. (生活情境)84消毒液的有效成分是次氯酸钠(NaClO),NaClO属于( D )
A. 氧化物 B. 酸
C. 碱 D. 盐
D
2. 下列物质中,全部是盐类的一组是( B )
A. 食盐、高锰酸钾、碳酸钙、干冰
B. 硫酸铜、碳酸钠、碳酸氢铵、碳酸钾
C. 碳酸钙、烧碱、碳酸钠、盐酸
D. 氯化钡、硫酸、熟石灰、过氧化氢
B
3. 将洁净的铜丝浸入含硝酸银和硝酸锌的混合溶液中,一段时间后取出,铜丝表面覆盖了一层物质,这层物质是( B )
A. 锌 B. 银
C. 银和锌 D. 铁和锌
B
盐的组成和分类
盐的组成和分类
定义:金属离子(或铵根)+酸根
盐的化学性质
分类:钠盐、钾盐、盐酸盐、硫酸盐等
盐的溶解性
盐 + 金属 → 新盐 + 新金属
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
同课章节目录
