8.2 课时2 酸的化学性质 课件 (共24张PPT内嵌视频)2024-2025学年化学沪教版九年级下册
文档属性
| 名称 | 8.2 课时2 酸的化学性质 课件 (共24张PPT内嵌视频)2024-2025学年化学沪教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 79.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-20 17:24:23 | ||
图片预览







文档简介
(共24张PPT)
8.2.2 酸的化学性质
1. 认识盐酸、稀硫酸的主要化学性质。
3. 了解常见的酸在生活、生产中的用途。
2. 认识金属活动性顺序,并能对常见金属能否与稀盐酸(或稀硫酸)发生置换反应进行判断。
某些工厂电焊前,常用稀硫酸清洗金属器件,就是利用酸与金属氧化物反应。
你还知道酸与哪些物质能发生反应?请将你知道的与同学交流、讨论。
一、 常见酸的化学性质
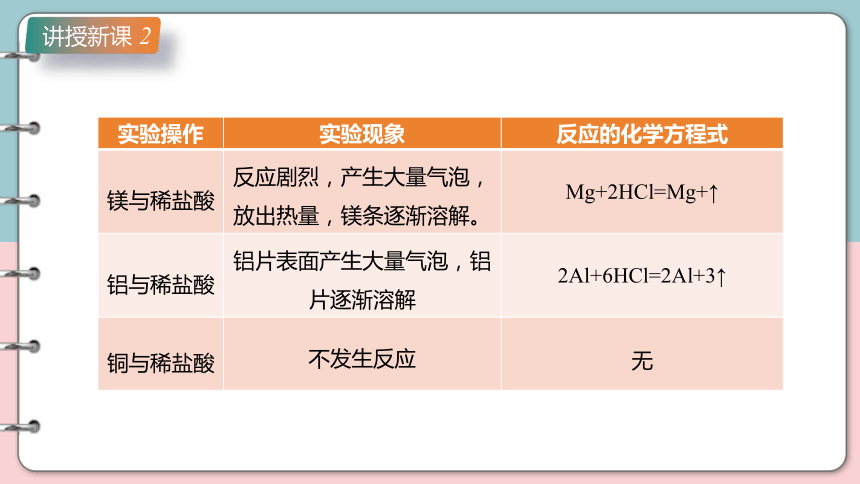
【实验】用稀硫酸和稀盐酸做如下实验,把实验现象填入表中,并讨论以下问题:
1.镁、铝、铜三种金属中,哪些能从酸溶液中置换出氢,哪些不能 写出有关的化学方程式。
2.描述、比较酸溶液与上述金属反应的实验现象,讨论可能的原因。
1.酸与金属反应
实验操作 实验现象 反应的化学方程式
镁与稀盐酸 反应剧烈,产生大量气泡,放出热量,镁条逐渐溶解。 Mg+2HCl=Mg+↑
铝与稀盐酸 铝片表面产生大量气泡,铝片逐渐溶解 2Al+6HCl=2Al+3↑
铜与稀盐酸 不发生反应 无
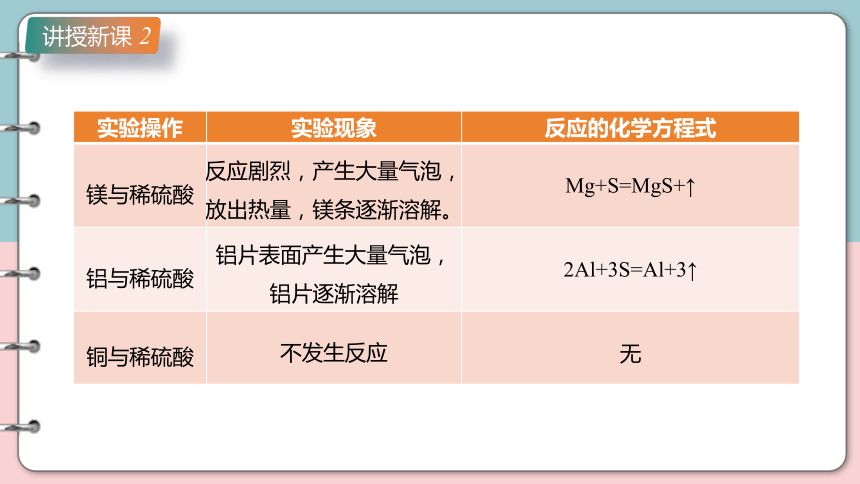
实验操作 实验现象 反应的化学方程式
镁与稀硫酸 反应剧烈,产生大量气泡,放出热量,镁条逐渐溶解。 Mg+S=MgS+↑
铝与稀硫酸 铝片表面产生大量气泡,铝片逐渐溶解 2Al+3S=Al+3↑
铜与稀硫酸 不发生反应 无
上述各反应的生成物有何特点?
酸+较活泼金属=盐+氢气
Mg +2 HCl = MgCl2 + H2↑
Zn +2HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
2Al +3H2SO4= Al2(SO4)3+ 3H2↑
2Al +6HCl = 2AlCl3 + 3H2↑
盐
金属单质与酸溶液能否发生置换反应、反应的难易程度如何,与金属的活动性强弱有关。
进一步研究表明,镁、铝、铜的金属活动性由强到弱的顺序如下:
Mg Al Cu
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Ag 银 Pt Au
通过更进一步的实验和研究,可以总结出常见金属活动性顺序:
◆ 金属越靠前,其活动性越强。
◆ 排在氢前面的金属(钾、钙、钠除外),能与稀盐酸、稀硫酸发生置换反应生成氢气,氢后的金属则不能。
◆排在前面的金属(钾、钙、钠除外)能与后面金属的盐溶液发生置换反应。
在金属活动性顺序表中,
金属(H前) +酸(除HNO3,浓H2SO4) 盐+H2
金属(排前面)+盐(可溶) 金属(排后面)+盐
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Ag 银 Pt Au
运用金属活动性顺序预测和解释化学反应
在金属活动性顺序表中,金属的位置越靠前,它的活动性就越强,排在氢前面的金属能与稀盐酸(或稀硫酸)发生置换反应,排在氢后面的金属不能与稀盐酸(或稀硫酸)发生置换反应。运用金属活动性顺序,可以预测金属与酸的化学反应,解释有关的实验现象。
观念构建
请同学们利用老师提供的试剂和工具,尝试着给铁钉除锈,你能找出多少种方法呢?
工具:砂纸
试剂:生锈的铁钉、稀盐酸、
稀硫酸、氯化钠溶液
仪器:试管、镊子、胶头滴管
讨论:①上面反应的生成物有什么共同之处?
2.酸与某些金属氧化物的反应
现 象 化学方程式
铁锈+盐酸
铁锈+硫酸
Fe2O3+6HCl = 2FeCl3 + 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁锈被溶解
溶液颜色变棕黄色
盐
水
溶液中含有Fe2+呈浅绿色
思考与交流
将稀盐酸或稀硫酸加入到黑色氧化铜中会反应吗?
若会反应请写出相应化学方程式推测实验现象。
CuO + HCl
2 = CuCl2 + H2O
CuO + H2SO4
= CuSO4 + H2O
① 色的氧化铜逐渐 ;
②溶液由 色逐渐变为 色。
现象:
黑
无
蓝
消失
溶液中含有Cu2+呈蓝色
工人师傅在焊接金属前为了保证焊接的牢固性,通常都要用盐酸浸泡金属以除去其表面的氧化物,但浸泡的时间不宜过长。你知道这是为什么吗?以铁为例,用化学方程式表示并描述现象。
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
Fe + 2HCl == FeCl2 + H2↑
铁锈逐渐消失,溶液由无色变为黄色
有气泡冒出
交流讨论
1.盐酸、硫酸、硝酸、碳酸都是酸它们在组成上的相同之处是什么
酸是指电离时生成的阳离子全部是氢离子的化合物。盐酸、硫酸、硝酸、碳酸的化学式分别为HCl、S、HN、C,从化学式可以看出,它们都是由氢离子和酸根离子构成;在溶液中,盐酸、硫酸、硝酸、碳酸都能电离出氢离子,所以具有相同的化学性质.
交流讨论
2.盐酸、硫酸在化学性质上有许多共同之处,请归纳它们的共同点并结合第7章有关溶液导电性的实验,对“酸的水溶液具有一些共同的化学性质”作出解释。
共同之处:①它们都能与酸碱指示剂反应;② 都能与活泼金属反应;③ 都能与金属氧化物反应。
对酸的水溶液具有共同化学性质的解释:在溶液导电性实验中可以发现,盐酸、硫酸的水溶液都能导电。这是因为它们在水溶液中都能电离出氢离子。例如与活泼金属反应时,是金属原子与氢离子反应,将氢离子还原为氢气;所以酸的水溶液具有一些共同的化学性质是因为它们都能电离出氢离子。
盐酸用于溶解矿石原料
硫酸和硝酸可用于制
造肥料、药物和炸药
醋酸在食品行业中常用作调味剂
二、 常见酸的用途
1、小李在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如右图所示的关系。图中A 、B 、C 、D 是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,则其中表示不正确的是( )
A、紫色 B、蓝色
C、红色 D、无色
A
2.下列化学方程式正确的是( )
A.Cu+2HCl=CuCl2+H2
B.2Fe+6HCl=2FeCl3+3H2
C.Zn+2HNO3=Zn(NO3)2+H2
D.Mg+H2SO4(稀)=MgSO4+H2
D
C
3.下列化学方程式正确的是( )
A.Cu+FeSO4=CuSO4+Fe B.Zn+Mg(NO3)2=Zn(NO3)2+Mg
C.Mg+CuSO4=MgSO4+Cu
D. Al+MgCl=AlCl3+Mg
4.有A,B,C三种金属,只有C不与盐酸反应,B可以从A的盐溶液中置换出A,它们的活动性由强到弱的排列顺序是_______________
B>A>C
5.用相同质量且浓度相同的稀盐酸分别跟足量的镁、铁、锌反应,反应情况用如图图线表示,纵坐标是氢气的质量,横坐标是反应时间,其中图线正确的是( )
B
6.将稀盐酸滴入下列盛有不同物质的试管中:
(1)不反应的是(填序号,下同)_______________;
(2)冒气泡的是_____________;
(3)有浅绿色溶液出现的是______________;
有蓝色溶液出现的是____________。
A
B、C
B
D
8.2.2 酸的化学性质
1. 认识盐酸、稀硫酸的主要化学性质。
3. 了解常见的酸在生活、生产中的用途。
2. 认识金属活动性顺序,并能对常见金属能否与稀盐酸(或稀硫酸)发生置换反应进行判断。
某些工厂电焊前,常用稀硫酸清洗金属器件,就是利用酸与金属氧化物反应。
你还知道酸与哪些物质能发生反应?请将你知道的与同学交流、讨论。
一、 常见酸的化学性质
【实验】用稀硫酸和稀盐酸做如下实验,把实验现象填入表中,并讨论以下问题:
1.镁、铝、铜三种金属中,哪些能从酸溶液中置换出氢,哪些不能 写出有关的化学方程式。
2.描述、比较酸溶液与上述金属反应的实验现象,讨论可能的原因。
1.酸与金属反应
实验操作 实验现象 反应的化学方程式
镁与稀盐酸 反应剧烈,产生大量气泡,放出热量,镁条逐渐溶解。 Mg+2HCl=Mg+↑
铝与稀盐酸 铝片表面产生大量气泡,铝片逐渐溶解 2Al+6HCl=2Al+3↑
铜与稀盐酸 不发生反应 无
实验操作 实验现象 反应的化学方程式
镁与稀硫酸 反应剧烈,产生大量气泡,放出热量,镁条逐渐溶解。 Mg+S=MgS+↑
铝与稀硫酸 铝片表面产生大量气泡,铝片逐渐溶解 2Al+3S=Al+3↑
铜与稀硫酸 不发生反应 无
上述各反应的生成物有何特点?
酸+较活泼金属=盐+氢气
Mg +2 HCl = MgCl2 + H2↑
Zn +2HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
2Al +3H2SO4= Al2(SO4)3+ 3H2↑
2Al +6HCl = 2AlCl3 + 3H2↑
盐
金属单质与酸溶液能否发生置换反应、反应的难易程度如何,与金属的活动性强弱有关。
进一步研究表明,镁、铝、铜的金属活动性由强到弱的顺序如下:
Mg Al Cu
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Ag 银 Pt Au
通过更进一步的实验和研究,可以总结出常见金属活动性顺序:
◆ 金属越靠前,其活动性越强。
◆ 排在氢前面的金属(钾、钙、钠除外),能与稀盐酸、稀硫酸发生置换反应生成氢气,氢后的金属则不能。
◆排在前面的金属(钾、钙、钠除外)能与后面金属的盐溶液发生置换反应。
在金属活动性顺序表中,
金属(H前) +酸(除HNO3,浓H2SO4) 盐+H2
金属(排前面)+盐(可溶) 金属(排后面)+盐
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Ag 银 Pt Au
运用金属活动性顺序预测和解释化学反应
在金属活动性顺序表中,金属的位置越靠前,它的活动性就越强,排在氢前面的金属能与稀盐酸(或稀硫酸)发生置换反应,排在氢后面的金属不能与稀盐酸(或稀硫酸)发生置换反应。运用金属活动性顺序,可以预测金属与酸的化学反应,解释有关的实验现象。
观念构建
请同学们利用老师提供的试剂和工具,尝试着给铁钉除锈,你能找出多少种方法呢?
工具:砂纸
试剂:生锈的铁钉、稀盐酸、
稀硫酸、氯化钠溶液
仪器:试管、镊子、胶头滴管
讨论:①上面反应的生成物有什么共同之处?
2.酸与某些金属氧化物的反应
现 象 化学方程式
铁锈+盐酸
铁锈+硫酸
Fe2O3+6HCl = 2FeCl3 + 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁锈被溶解
溶液颜色变棕黄色
盐
水
溶液中含有Fe2+呈浅绿色
思考与交流
将稀盐酸或稀硫酸加入到黑色氧化铜中会反应吗?
若会反应请写出相应化学方程式推测实验现象。
CuO + HCl
2 = CuCl2 + H2O
CuO + H2SO4
= CuSO4 + H2O
① 色的氧化铜逐渐 ;
②溶液由 色逐渐变为 色。
现象:
黑
无
蓝
消失
溶液中含有Cu2+呈蓝色
工人师傅在焊接金属前为了保证焊接的牢固性,通常都要用盐酸浸泡金属以除去其表面的氧化物,但浸泡的时间不宜过长。你知道这是为什么吗?以铁为例,用化学方程式表示并描述现象。
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
Fe + 2HCl == FeCl2 + H2↑
铁锈逐渐消失,溶液由无色变为黄色
有气泡冒出
交流讨论
1.盐酸、硫酸、硝酸、碳酸都是酸它们在组成上的相同之处是什么
酸是指电离时生成的阳离子全部是氢离子的化合物。盐酸、硫酸、硝酸、碳酸的化学式分别为HCl、S、HN、C,从化学式可以看出,它们都是由氢离子和酸根离子构成;在溶液中,盐酸、硫酸、硝酸、碳酸都能电离出氢离子,所以具有相同的化学性质.
交流讨论
2.盐酸、硫酸在化学性质上有许多共同之处,请归纳它们的共同点并结合第7章有关溶液导电性的实验,对“酸的水溶液具有一些共同的化学性质”作出解释。
共同之处:①它们都能与酸碱指示剂反应;② 都能与活泼金属反应;③ 都能与金属氧化物反应。
对酸的水溶液具有共同化学性质的解释:在溶液导电性实验中可以发现,盐酸、硫酸的水溶液都能导电。这是因为它们在水溶液中都能电离出氢离子。例如与活泼金属反应时,是金属原子与氢离子反应,将氢离子还原为氢气;所以酸的水溶液具有一些共同的化学性质是因为它们都能电离出氢离子。
盐酸用于溶解矿石原料
硫酸和硝酸可用于制
造肥料、药物和炸药
醋酸在食品行业中常用作调味剂
二、 常见酸的用途
1、小李在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如右图所示的关系。图中A 、B 、C 、D 是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,则其中表示不正确的是( )
A、紫色 B、蓝色
C、红色 D、无色
A
2.下列化学方程式正确的是( )
A.Cu+2HCl=CuCl2+H2
B.2Fe+6HCl=2FeCl3+3H2
C.Zn+2HNO3=Zn(NO3)2+H2
D.Mg+H2SO4(稀)=MgSO4+H2
D
C
3.下列化学方程式正确的是( )
A.Cu+FeSO4=CuSO4+Fe B.Zn+Mg(NO3)2=Zn(NO3)2+Mg
C.Mg+CuSO4=MgSO4+Cu
D. Al+MgCl=AlCl3+Mg
4.有A,B,C三种金属,只有C不与盐酸反应,B可以从A的盐溶液中置换出A,它们的活动性由强到弱的排列顺序是_______________
B>A>C
5.用相同质量且浓度相同的稀盐酸分别跟足量的镁、铁、锌反应,反应情况用如图图线表示,纵坐标是氢气的质量,横坐标是反应时间,其中图线正确的是( )
B
6.将稀盐酸滴入下列盛有不同物质的试管中:
(1)不反应的是(填序号,下同)_______________;
(2)冒气泡的是_____________;
(3)有浅绿色溶液出现的是______________;
有蓝色溶液出现的是____________。
A
B、C
B
D
同课章节目录
