8.3 酸和碱的反应 课件 (共28张PPT内嵌视频)2024-2025学年化学科粤版九年级下册
文档属性
| 名称 | 8.3 酸和碱的反应 课件 (共28张PPT内嵌视频)2024-2025学年化学科粤版九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 54.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-20 22:59:14 | ||
图片预览








文档简介
(共28张PPT)
01
认识酸和碱之间发生的中和反应。
02
知道什么是复分解反应。
03
知道中和反应在实际生活中的应用。
农业和工业上常用熟石灰来改良酸性土壤和处理酸性废水,你知道其中的原理吗?
通过前面的学习我们知道,酸和碱都有各自类似化学性质,你知道为什么吗?
【实验目的】知道酸、碱溶液能够导电
【实验操作】利用如图所示的装置,分别试验盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、蒸馏水和酒精的导电性。
一、酸和碱各自具有相似化学性质的原因
溶液 蒸馏水 乙醇 稀盐酸 稀硫酸 NaOH溶液 Ca(OH)2溶液
灯泡亮否
否
否
是
是
是
是
【结论】酸溶液、碱溶液能导电,而蒸馏水、乙醇不导电。
在盐酸、硫酸、氢氧化钠溶液和氢氧化钙溶液中存在带电的粒子。实际上,HCl在水中会解离出H+和Cl-,H2SO4在水中会解离出H+和SO42-;NaOH在水中会解离出Na+和OH-,Ca(OH)2在水中会解离出Ca2+和OH-。
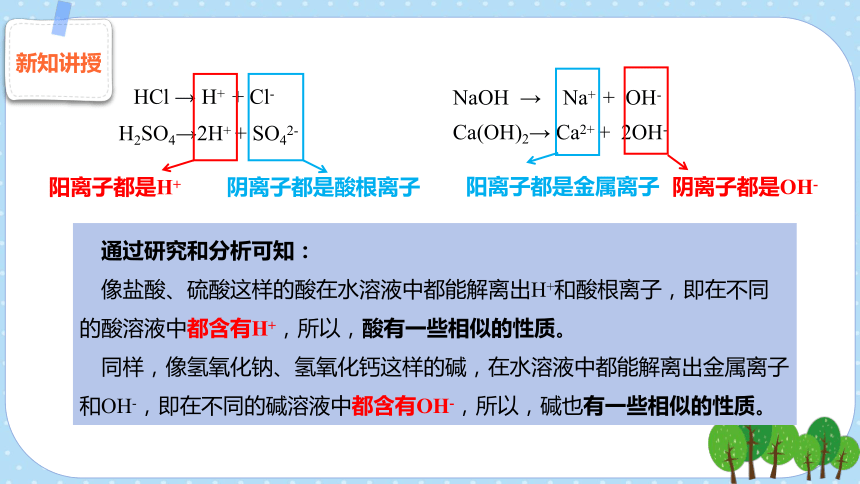
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
为什么酸溶液、碱溶液能导电?而蒸馏水、乙醇不导电?
通过研究和分析可知:
像盐酸、硫酸这样的酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有H+,所以,酸有一些相似的性质。
同样,像氢氧化钠、氢氧化钙这样的碱,在水溶液中都能解离出金属离子和OH-,即在不同的碱溶液中都含有OH-,所以,碱也有一些相似的性质。
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
阳离子都是H+
阴离子都是酸根离子
阳离子都是金属离子
阴离子都是OH-
1.酸类物质具有相似的化学性质,本质的原因是( )
A.能与指示剂作用 B.能与碱发生中和反应
C.溶于水时能解离出H+ D.都含有氢元素
C
2.下列物质不能导电的是( )
A.石墨 B.铜 C.酒精溶液 D.食盐水
C
若把酸溶液和碱溶液混合在一起,会发生什么反应呢?
【实验目的】认识酸和碱的中和反应
【实验8-14】
1.取少量稀氢氧化钠溶液于试管中,逐滴加入稀盐酸,观察到什么现象?
无明显现象
2.为观察到上述两种溶液发生反应的现象,应采取什么措施?重新设计实验。
二、中和反应
编号 操作步骤 实验现象
① 取少量NaOH溶液于试管中,滴1-2滴酚酞溶液
② 逐渐往NaOH溶液中滴稀盐酸、振荡
③ 向上述刚好褪色的溶液中再滴两滴NaOH溶液,振荡
④ 再次滴入微量稀盐酸,振荡
无色溶液变为红色
红色逐渐褪去
无色溶液又变为红色
红色又逐渐褪去
5mL稀氢氧化钠溶液
分析: (1)向氢氧化钠溶液中加入无色酚酞后溶液为什么变成红色?
(2)滴加稀盐酸后溶液变成了无色,可以说明说明?
氢氧化钠溶液显碱性,酚酞遇碱变红
溶液不显碱性,此时溶液中不含氢氧化钠
结论:氢氧化钠与盐酸能反应 NaOH + HCl = NaCl + H2O
酸和碱反应的实质:
盐酸与氢氧化钠溶液混合后,氢离子(H+)和氢氧根离子(OH-)结合成了水分子,即: 。
H+ +OH == H2O
(3)其它的酸和碱也能发生类似的反应,你能尝试着写出它们的化学方程式吗?
盐酸与氢氧化钙: ;
硫酸与氢氧化钾: ;
硫酸与氢氧化钠: ;
2HCl + Ca(OH)2== CaCl2 + 2H2O
H2SO4 + 2KOH == K2SO4 + 2H2O
H2SO4 + 2NaOH == Na2SO4 + 2H2O
酸与碱作用生成盐和水的反应称为中和反应。
1.中和反应:
2.中和反应的实质:
H+ +OH == H2O
3.中和反应的通式:
酸 + 碱 → 盐 + 水
中和反应也是酸和碱的性质之一
中和反应生成盐和水,所以生成盐和水的反应都是中和反应,这句话对吗?
不对。能生成盐和水的反应有:
①酸+金属氧化物=盐+水,如:2HCl+CuO=CuCl2+H2O
②酸+碱=盐+水,如:HCl+NaOH=NaCl+H2O
③碱+非金属氧化物=盐+水,如:NaOH+CO2=Na2CO3+H2O
5.下列反应属于中和反应的是( )
A.Zn+H2SO4=ZnSO4+H2↑ B.CO2+H2O=H2CO3
C.CuCl2+2NaOH=2NaCl+Cu(OH)2↓ D.HCl+KOH=KCl+H2O
4.对下面两个化学反应的说法错误的是( )
HCl+NaOH===NaCl+H2O 2NaOH+H2SO4===Na2SO4+2H2O
A.反应物都是一种酸和一种碱
B.氯化钠和硫酸钠都是由金属离子和酸根离子构成的,属于盐
C.都是中和反应
D.生成盐和水的反应一定是中和反应
D
D
项目 酸的主要化学性质 碱的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸和碱反应
与氧化物反应
与盐反应
与活泼金属反应
归纳一下吧:
尝试归纳出酸和碱的主要化学性质。
碱+非金属氧化物→盐+水
酸+金属氧化物→盐+水
使紫色石蕊试液变蓝色
使紫色石蕊试液变红色
无色酚酞试液不变色
使无色酚酞试液变红色
酸 + 碱 → 盐 + 水
酸+盐→新酸+新盐
碱+盐→新碱+新盐
酸+较活泼金属→盐+氢气
AgNO3 + HCl = AgCl↓+ HNO3
Fe2O3 + 6HCl = 2FeCl3 +3H2O
观察下列几个化学方程式:
2NaOH + CuCl2= 2NaCl + Cu(OH)2↓
你发现了什么规律?
HCl + NaOH = NaCl + H2O
上述反应中,两种化合物互相交换成分生成另外两种化合物,像这样的反应叫做复分解反应。
表示:
AB + CD →
AD + CB
①中和反应和复分解反应两者有什么关系?
中和反应属于复分解反应。
②我们已经学习过化合、分解、置换和复分解等各种基本反应类型。你能归纳出它们各自的特点,并准确判断某个具体化学反应属于什么基本反应类型吗?请举例说明。
比较内容 化合反应 分解反应 置换反应 复分解反应
特点
通式
多变一
一变多
单换单
双交换
A+B→AB
AB→A+B
A+BC→B+AC
AB+CD→AD+CB
6.有关复分解反应的说法一定正确的是( )
A.元素化合价改变 B.一定有气体或者沉淀生成
C.元素的存在形态不改变 D.中和反应不一定属于复分解反应
C
7.下列反应属于复分解反应的是( )
A.Na2O + H2O === 2NaOH
B.H2 + CuO === Cu + H2O
C.Cu(OH)2 === CuO + H2O
D.H2SO4 + Ca(OH)2 === CaSO4 + 2H2O
D
在氢氧化钠溶液中滴加稀盐酸时,溶液的PH如何变化?
我们利用pH传感器实时监测混合溶液在酸碱中和反应过程中的pH变化情况,并借助计算机以图像的形式呈现出来,即可直接得到酸碱中和反应过程中溶液的pH变化曲线。如向氢氧化钠溶液中滴加稀盐酸时溶液的PH变化为:
0 4 8 12 16 20 24 28 32 36 40 V/mL
1413121110
9 8 7
6 5 4
3 2 1
pH
.
.
.
.
.
.
.
.
.
.
。
A
C
B
你知道图像中的A点、B点和C点分别代表什么意思吗?
0 4 8 12 16 20 24 28 32 36 40 V/mL
1413121110
9 8 7
6 5 4
3 2 1
pH
.
.
.
.
.
.
.
.
.
.
。
A
C
B
A点表示:滴入盐酸较少,溶液中的NaOH有剩余,溶液呈 性, pH 7,溶液中的溶质是 。
碱
>
NaCl和NaOH
B点表示:盐酸与溶液中的NaOH恰好完全反应,此时溶液呈 性,pH 7,溶液中的溶质是 。
中
=
NaCl
c点表示:滴入盐酸过量,溶液中的HCl有剩余,溶液呈 性,pH 7,溶液中的溶质是 。
酸
<
NaCl和HCl
8.根据盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。请分析:
A
C
B
(1)该实验是将 滴入 中。
氢氧化钠溶液
盐酸
(2)A点时的溶液能使酚酞试液变 ,此时溶液中的溶质为 。
红
NaCl和HCl
(3)B点时的溶液呈 性,pH 7,溶液中的溶质是 。
中
=
NaCl
(4)C点时, 过量。
氢氧化钠
三、中和反应的应用
1.改良酸性或碱性土壤
在农业生产中,农作物生长对于土壤的酸碱性有一定的要求。根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,调节土壤的酸碱性,以利于农作物生长。
向酸性土壤中加入熟石灰
例如,近年来由于空气污染形成酸雨,导致一些地方的土壤酸性增强,不利于农作物生长,于是人们将适量的熟石灰加入土壤,以中和其酸性。
2.处理工业废水
工厂生产过程中的污水,需进行一系列的处理。例如,硫酸厂的污水中含有硫酸等物质,可以用熟石灰进行中和处理;印染厂的废水呈碱性,可加入硫酸进行中和。
处理工业废水
人的胃液里含有适量盐酸,可以帮助消化。但是如果饮食过量时,胃会分泌大量胃酸,造成胃部不适以致消化不良。在这种情况下,可以遵医嘱服用某些含有碱性物质的药物(如氢氧化铝),以中和过多的胃酸。
3.医药应用
化学方程式: ;
6HCl + 2Al(OH)3 == 2AlCl3 + 3H2O
4.调节溶液的酸碱性
在科学实验中,经常需要将溶液的pH控制在一定范围内。如果溶液的酸碱性太强或太弱,都可以用适当的碱或酸调节溶液的pH。
化学实验中产生的酸性或碱性废液能不能直接倒入下水道?该如何处理?
不能。酸性废液中应加入适量的碱性物质(如熟石灰)、碱性废液中应加入适量的酸性物质加以中和,再排放。
9.中和反应在生产和日常生活中有广泛的用途,下列应用与中和反应原理无关的是( )
A.氢氧化钠沾在皮肤上大量水冲洗后用硼酸处理
B.服用含Al(OH)3的药物治疗胃酸过多
C.用生石灰做干燥剂
D.用NaOH溶液洗涤石油产品中的残余硫酸
C
10.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质﹣﹣皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是( )
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
B
知识视窗
酸雨
部分非金属氧化物能跟水化合生成酸,例如:
SO2+H2O==H2SO3;SO3+H2O==H2SO4
(亚硫酸)
煤和石油燃烧后所产生的烟气中,含有二氧化硫和氮氧化物,排放到空气中被云层吸收,并经过化学作用形成酸雾,随雨水下降使成为显酸性的雨水,若其pH小于5.6,称为酸雨。
01
认识酸和碱之间发生的中和反应。
02
知道什么是复分解反应。
03
知道中和反应在实际生活中的应用。
农业和工业上常用熟石灰来改良酸性土壤和处理酸性废水,你知道其中的原理吗?
通过前面的学习我们知道,酸和碱都有各自类似化学性质,你知道为什么吗?
【实验目的】知道酸、碱溶液能够导电
【实验操作】利用如图所示的装置,分别试验盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、蒸馏水和酒精的导电性。
一、酸和碱各自具有相似化学性质的原因
溶液 蒸馏水 乙醇 稀盐酸 稀硫酸 NaOH溶液 Ca(OH)2溶液
灯泡亮否
否
否
是
是
是
是
【结论】酸溶液、碱溶液能导电,而蒸馏水、乙醇不导电。
在盐酸、硫酸、氢氧化钠溶液和氢氧化钙溶液中存在带电的粒子。实际上,HCl在水中会解离出H+和Cl-,H2SO4在水中会解离出H+和SO42-;NaOH在水中会解离出Na+和OH-,Ca(OH)2在水中会解离出Ca2+和OH-。
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
为什么酸溶液、碱溶液能导电?而蒸馏水、乙醇不导电?
通过研究和分析可知:
像盐酸、硫酸这样的酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有H+,所以,酸有一些相似的性质。
同样,像氢氧化钠、氢氧化钙这样的碱,在水溶液中都能解离出金属离子和OH-,即在不同的碱溶液中都含有OH-,所以,碱也有一些相似的性质。
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
阳离子都是H+
阴离子都是酸根离子
阳离子都是金属离子
阴离子都是OH-
1.酸类物质具有相似的化学性质,本质的原因是( )
A.能与指示剂作用 B.能与碱发生中和反应
C.溶于水时能解离出H+ D.都含有氢元素
C
2.下列物质不能导电的是( )
A.石墨 B.铜 C.酒精溶液 D.食盐水
C
若把酸溶液和碱溶液混合在一起,会发生什么反应呢?
【实验目的】认识酸和碱的中和反应
【实验8-14】
1.取少量稀氢氧化钠溶液于试管中,逐滴加入稀盐酸,观察到什么现象?
无明显现象
2.为观察到上述两种溶液发生反应的现象,应采取什么措施?重新设计实验。
二、中和反应
编号 操作步骤 实验现象
① 取少量NaOH溶液于试管中,滴1-2滴酚酞溶液
② 逐渐往NaOH溶液中滴稀盐酸、振荡
③ 向上述刚好褪色的溶液中再滴两滴NaOH溶液,振荡
④ 再次滴入微量稀盐酸,振荡
无色溶液变为红色
红色逐渐褪去
无色溶液又变为红色
红色又逐渐褪去
5mL稀氢氧化钠溶液
分析: (1)向氢氧化钠溶液中加入无色酚酞后溶液为什么变成红色?
(2)滴加稀盐酸后溶液变成了无色,可以说明说明?
氢氧化钠溶液显碱性,酚酞遇碱变红
溶液不显碱性,此时溶液中不含氢氧化钠
结论:氢氧化钠与盐酸能反应 NaOH + HCl = NaCl + H2O
酸和碱反应的实质:
盐酸与氢氧化钠溶液混合后,氢离子(H+)和氢氧根离子(OH-)结合成了水分子,即: 。
H+ +OH == H2O
(3)其它的酸和碱也能发生类似的反应,你能尝试着写出它们的化学方程式吗?
盐酸与氢氧化钙: ;
硫酸与氢氧化钾: ;
硫酸与氢氧化钠: ;
2HCl + Ca(OH)2== CaCl2 + 2H2O
H2SO4 + 2KOH == K2SO4 + 2H2O
H2SO4 + 2NaOH == Na2SO4 + 2H2O
酸与碱作用生成盐和水的反应称为中和反应。
1.中和反应:
2.中和反应的实质:
H+ +OH == H2O
3.中和反应的通式:
酸 + 碱 → 盐 + 水
中和反应也是酸和碱的性质之一
中和反应生成盐和水,所以生成盐和水的反应都是中和反应,这句话对吗?
不对。能生成盐和水的反应有:
①酸+金属氧化物=盐+水,如:2HCl+CuO=CuCl2+H2O
②酸+碱=盐+水,如:HCl+NaOH=NaCl+H2O
③碱+非金属氧化物=盐+水,如:NaOH+CO2=Na2CO3+H2O
5.下列反应属于中和反应的是( )
A.Zn+H2SO4=ZnSO4+H2↑ B.CO2+H2O=H2CO3
C.CuCl2+2NaOH=2NaCl+Cu(OH)2↓ D.HCl+KOH=KCl+H2O
4.对下面两个化学反应的说法错误的是( )
HCl+NaOH===NaCl+H2O 2NaOH+H2SO4===Na2SO4+2H2O
A.反应物都是一种酸和一种碱
B.氯化钠和硫酸钠都是由金属离子和酸根离子构成的,属于盐
C.都是中和反应
D.生成盐和水的反应一定是中和反应
D
D
项目 酸的主要化学性质 碱的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸和碱反应
与氧化物反应
与盐反应
与活泼金属反应
归纳一下吧:
尝试归纳出酸和碱的主要化学性质。
碱+非金属氧化物→盐+水
酸+金属氧化物→盐+水
使紫色石蕊试液变蓝色
使紫色石蕊试液变红色
无色酚酞试液不变色
使无色酚酞试液变红色
酸 + 碱 → 盐 + 水
酸+盐→新酸+新盐
碱+盐→新碱+新盐
酸+较活泼金属→盐+氢气
AgNO3 + HCl = AgCl↓+ HNO3
Fe2O3 + 6HCl = 2FeCl3 +3H2O
观察下列几个化学方程式:
2NaOH + CuCl2= 2NaCl + Cu(OH)2↓
你发现了什么规律?
HCl + NaOH = NaCl + H2O
上述反应中,两种化合物互相交换成分生成另外两种化合物,像这样的反应叫做复分解反应。
表示:
AB + CD →
AD + CB
①中和反应和复分解反应两者有什么关系?
中和反应属于复分解反应。
②我们已经学习过化合、分解、置换和复分解等各种基本反应类型。你能归纳出它们各自的特点,并准确判断某个具体化学反应属于什么基本反应类型吗?请举例说明。
比较内容 化合反应 分解反应 置换反应 复分解反应
特点
通式
多变一
一变多
单换单
双交换
A+B→AB
AB→A+B
A+BC→B+AC
AB+CD→AD+CB
6.有关复分解反应的说法一定正确的是( )
A.元素化合价改变 B.一定有气体或者沉淀生成
C.元素的存在形态不改变 D.中和反应不一定属于复分解反应
C
7.下列反应属于复分解反应的是( )
A.Na2O + H2O === 2NaOH
B.H2 + CuO === Cu + H2O
C.Cu(OH)2 === CuO + H2O
D.H2SO4 + Ca(OH)2 === CaSO4 + 2H2O
D
在氢氧化钠溶液中滴加稀盐酸时,溶液的PH如何变化?
我们利用pH传感器实时监测混合溶液在酸碱中和反应过程中的pH变化情况,并借助计算机以图像的形式呈现出来,即可直接得到酸碱中和反应过程中溶液的pH变化曲线。如向氢氧化钠溶液中滴加稀盐酸时溶液的PH变化为:
0 4 8 12 16 20 24 28 32 36 40 V/mL
1413121110
9 8 7
6 5 4
3 2 1
pH
.
.
.
.
.
.
.
.
.
.
。
A
C
B
你知道图像中的A点、B点和C点分别代表什么意思吗?
0 4 8 12 16 20 24 28 32 36 40 V/mL
1413121110
9 8 7
6 5 4
3 2 1
pH
.
.
.
.
.
.
.
.
.
.
。
A
C
B
A点表示:滴入盐酸较少,溶液中的NaOH有剩余,溶液呈 性, pH 7,溶液中的溶质是 。
碱
>
NaCl和NaOH
B点表示:盐酸与溶液中的NaOH恰好完全反应,此时溶液呈 性,pH 7,溶液中的溶质是 。
中
=
NaCl
c点表示:滴入盐酸过量,溶液中的HCl有剩余,溶液呈 性,pH 7,溶液中的溶质是 。
酸
<
NaCl和HCl
8.根据盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。请分析:
A
C
B
(1)该实验是将 滴入 中。
氢氧化钠溶液
盐酸
(2)A点时的溶液能使酚酞试液变 ,此时溶液中的溶质为 。
红
NaCl和HCl
(3)B点时的溶液呈 性,pH 7,溶液中的溶质是 。
中
=
NaCl
(4)C点时, 过量。
氢氧化钠
三、中和反应的应用
1.改良酸性或碱性土壤
在农业生产中,农作物生长对于土壤的酸碱性有一定的要求。根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,调节土壤的酸碱性,以利于农作物生长。
向酸性土壤中加入熟石灰
例如,近年来由于空气污染形成酸雨,导致一些地方的土壤酸性增强,不利于农作物生长,于是人们将适量的熟石灰加入土壤,以中和其酸性。
2.处理工业废水
工厂生产过程中的污水,需进行一系列的处理。例如,硫酸厂的污水中含有硫酸等物质,可以用熟石灰进行中和处理;印染厂的废水呈碱性,可加入硫酸进行中和。
处理工业废水
人的胃液里含有适量盐酸,可以帮助消化。但是如果饮食过量时,胃会分泌大量胃酸,造成胃部不适以致消化不良。在这种情况下,可以遵医嘱服用某些含有碱性物质的药物(如氢氧化铝),以中和过多的胃酸。
3.医药应用
化学方程式: ;
6HCl + 2Al(OH)3 == 2AlCl3 + 3H2O
4.调节溶液的酸碱性
在科学实验中,经常需要将溶液的pH控制在一定范围内。如果溶液的酸碱性太强或太弱,都可以用适当的碱或酸调节溶液的pH。
化学实验中产生的酸性或碱性废液能不能直接倒入下水道?该如何处理?
不能。酸性废液中应加入适量的碱性物质(如熟石灰)、碱性废液中应加入适量的酸性物质加以中和,再排放。
9.中和反应在生产和日常生活中有广泛的用途,下列应用与中和反应原理无关的是( )
A.氢氧化钠沾在皮肤上大量水冲洗后用硼酸处理
B.服用含Al(OH)3的药物治疗胃酸过多
C.用生石灰做干燥剂
D.用NaOH溶液洗涤石油产品中的残余硫酸
C
10.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质﹣﹣皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是( )
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
B
知识视窗
酸雨
部分非金属氧化物能跟水化合生成酸,例如:
SO2+H2O==H2SO3;SO3+H2O==H2SO4
(亚硫酸)
煤和石油燃烧后所产生的烟气中,含有二氧化硫和氮氧化物,排放到空气中被云层吸收,并经过化学作用形成酸雾,随雨水下降使成为显酸性的雨水,若其pH小于5.6,称为酸雨。
