浙江省杭州市2024-2025学年第一学期期末学业水平测试高一化学试题卷(PDF版,含答案)
文档属性
| 名称 | 浙江省杭州市2024-2025学年第一学期期末学业水平测试高一化学试题卷(PDF版,含答案) | 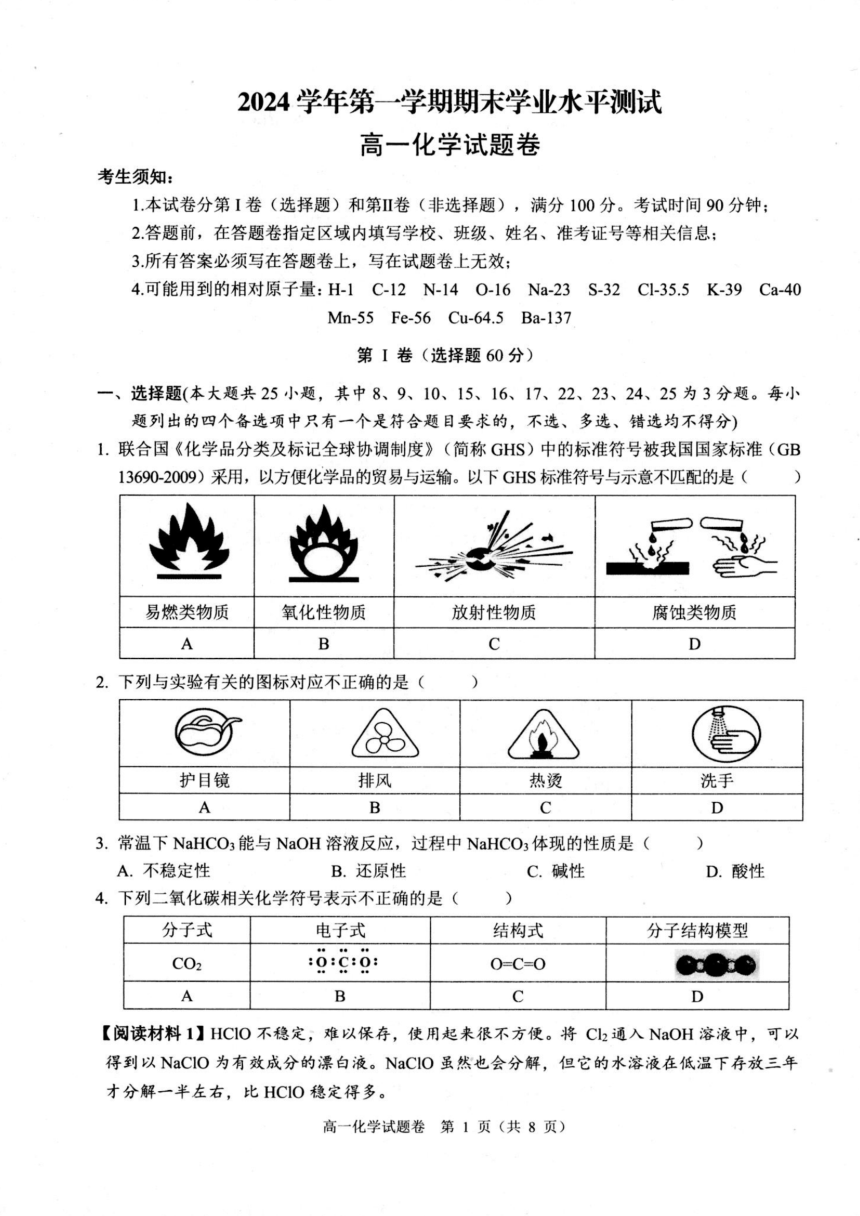 | |
| 格式 | |||
| 文件大小 | 10.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-18 18:38:12 | ||
图片预览




文档简介
2024学年第一学期期末学业水平测试
高一化学试题卷
考生须知:
1.本试卷分第I卷(选择题)和第II卷(非选择题),满分100分。考试时间90分钟;
2.答题前,在答题卷指定区域内填写学校、班级、姓名、准考证号等相关信息;
3.所有答案必须写在答题卷上,写在试题卷上无效;
4.可能用到的相对原子量:H-1 C-12 N-14 0-16 Na-23 S-32 Cl-35.5 K-39 Ca-40
Mn-55 Fe-56 Cu-64.5 Ba-137
第I卷(选择题60分)
一、选择题(本大题共25小题,其中8、9、10、15、16、17、22、23、24、25为3分题。每小
题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.联合国《化学品分类及标记全球协调制度》(简称GHS)中的标准符号被我国国家标准(GB
13690-2009)采用,以方便化学品的贸易与运输。以下GHS标准符号与示意不匹配的是()
易燃类物质 氧化性物质 放射性物质 腐蚀类物质
A B C D
2.下列与实验有关的图标对应不正确的是( )
护目镜 排风 热烫 洗手
A B C D
3.常温下NaHCO 能与NaOH溶液反应,过程中NaHCO 体现的性质是( )
A.不稳定性 B.还原性 C.碱性 D.酸性
4.下列二氧化碳相关化学符号表示不正确的是( )
分子式 电子式 结构式 分子结构模型
CO : :C:0: O=C=O
A B C D
【阅读材料1】HCIO不稳定,难以保存,使用起来很不方便。将Cl 通入 NaOH溶液中,可以
得到以NaClO为有效成分的漂白液。NaClO虽然也会分解,但它的水溶液在低温下存放三年
才分解一半左右,比HCIO稳定得多。
高一化学试题卷 第1页(共8页)
请回答5-10题:
5.下列关于氯元素的说法不正确的是( )
A.氯元素在自然界中主要以游离态存在 B.氯气是一种有刺激性的有毒气体
C.液氯中含有大量的氯气分子 D.液氯一般用钢瓶储存
6.等物质的量浓度的下列稀溶液中,ClO-离子浓度最大的是( )
A.NaClO B.HCIO C. Ca(CIO) D.氯水
7.饱和氯水溶液中存在多种微粒,微粒间作用力不包括( )
A.分子间作用力 B.非极性键 C.极性键 D.离子键
8.下列关于氯水溶液中微粒的结构与性质,说法不正确的是()
A.HCIO分子中各原子均满足8电子稳定结构
B. HCIO分解的过程中,既体现氧化性又体现还原性
C.因氯水中存在一定量Cl 分子,则溶液呈淡黄绿色
D.增强氯水溶液的碱性,有利于提升溶液的稳定性
9.某温度下,将Cl 通入一定浓度NaOH溶液中,若反应得到NaCl、NaClO和NaCIO 的混合
溶液,经测定CIO与Clr的物质的量之比约为1:8,则Cl 与NaOH溶液反应时,被氧化的
氯原子和被还原的氯原子的个数比为()
A.5:7 B.3:10 C.1:1 D.7:5
10.光照过程中氯水的pH、氯水中氯离子的浓度、广口瓶中氧气的体积分数的变化,如下图所
示。下列说法正确的是( )
1000 24
2.0f
氯水的pH 1.5} 氧离子的浓度/(mgL 800+600+400 氧气的体积分数/% 22+20+
1.0 200+ 18
0 50100 150 0 50 100 150 0 50 100 150
时间/s 时间/s 时间/
A.溶液pH降低的原因是光照条件下HCIO电离产生了更多的H+
B.随着氯离子浓度不断增加,溶液漂白能力逐渐减弱
C.随着氧气的体积分数不断增加,溶液氧化性逐渐增强
D.综合图像分析氯水光照过程中反应的离子方程式为:H O+ClO=Cl+O ↑+2H+
【阅读材料2】纯碱是一种重要的化工原料,早期人们从草木灰中提取碳酸钾,后来又从盐碱
地和盐湖等天然资源中获取碳酸钠,但天然碱的产量和纯度,远不能满足化工生产和人们日常
生活的需求。Na CO 的工业制法,历史上经历了3个阶段:
I.路布兰法(N.Leblanc):主要原料包括食盐、硫酸、石灰石和煤粉。
IⅡ.索尔维法(E.Solvay):以食盐、石灰石和氨为原料。简化工艺流程如下图所示。
煅烧
石灰石 CO Na CO
NaHCO 晶体
氨气 过滤
饱和食盐水 氨盐水 碳化 NaHCO 悬浊液
滤液(NH CI、NaHCO 、NaC等)
高一化学试题卷 第2页(共8页)
ⅢI.侯氏联碱法:该法最大的特点是滤去NaHCO 晶体后的母液含有大量NH Cl的NaHCO ,
向其中加入食盐使母液中的NH Cl结晶出来作为氮肥,并将最后留下含有NaCl的母液循
环使用,从而把食盐的利用率从原来的70 高到98
请回答11-17题:
11.齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳
高温分解形成的灰)混合加水所得液体来洗涤丝帛。下列说法错误的是()
A.草木灰的主要成分碳酸钾可用作钾肥
B.“蜃”的主要成分属于难溶性的盐
C.“灰”和“蜃”混合加水所得溶液中含有KOH
D.“蜃”加水混合后会发生化合反应
12.路布兰制碱法。其化学反应过程如下:
①固体食盐与硫酸反应生成硫酸钠和氯化氢:2NaClS)+H SO 高温Na SO +2HCl(g
②硫酸钠、石灰石和煤粉煅烧生成纯碱和硫化钙:
Na SO +2C+CaCo;高温2Na CO +CaS+2CO
③硫化钙、二氧化碳和水发应生成碳酸钙和硫化氢:CaS+CO +H O=CaCO +H S
④硫化氢被氧化生成硫酸,硫酸可以循环使用:H S+2O =H SO
下列有关说法正确的是( )
A.反应①用饱和食盐水与硫酸反应有利于制备HCl气体
B.反应②中氧化剂与还原剂的物质的量之比为2:1
C.反应③生成的H S在常温下是气体,属于非电解质
D.反应④用H O 替代O 生成相同质量的H SO ,理论上转移电子数不变
13.利用下图所示装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。下列有关装置和仪器的
表述不正确的是()
浓氨水
碱石灰 a
稀盐酸 非 不是
浪天 b 氧化钙
大理石 饱和NaCl溶液
A B C D
A.装置a的作用是防止外界水蒸气进入C装置
B.装置B的作用是除去CO 中混有的HCl气体
C.装置C中仪器b的作用是控制气体的流速和防止倒吸
D.装置D中止水夹K 先打开一段时间,再打开K
14.如题13所示模拟索尔维法制备碳酸氢钠。下列有关说法正确的是()
A.装置A中盛装稀盐酸的仪器为分液漏斗。
B.装置B用饱和Na CO 溶液,除杂效果更好
C.装置C中反应方程式为:2NaCl+CO +2NH +H O=Na CO J+2NH Cl
D.装置D中氧化钙可以由苛性钠或浓硫酸替代
高一化学试题卷 第3页(共8页)
15.我国科学家侯德榜以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,对
世界制碱工业做出了卓越贡献,工艺流程如下左图所示;右图为NH Cl和NaCl溶解度随
温度变化情况。
饱和食盐水 溶解度/g
副产品CO 循环! 80
NH NH.c
合成氨厂 沉淀池
产品 60
煅烧炉 Na CO
循环I 40
NH, NpCI母液
加入食盐细粉副产品 20
冷却至10℃以下、过滤 NH CI
5070
侯氏制碱法示意图 01030 90 T0o温度/℃
下列相关说法不正确的是( )
A.煅烧炉中主要发生反应:2NaHCO;Na CO +CO ↑+H O
B.经过沉淀池获取的母液中几乎不含有NaHCO
C.循环I的主要物质是CO
D.母液加入食盐细粉后选择低温结晶有利于副产品NH Cl的获取
16.制碱原材料饱和食盐水的纯度对产品纯度有很大的影响。从海水中得到的粗盐往往含有可
溶性杂质(主要有Na SO4、MgCl 、CaCl )和不溶性杂质(泥沙)等,必须进行分离和提
纯后才能用于制碱,粗盐提纯的部分流程如图所示,下列说法正确的是()
过量
过量NaOH 过量 沉淀
粗盐-溶解 溶液a溶液 溶液b 操作1 适量
滤液溶液c操作烘王精盐
A.操作I、Ⅱ均需要用到的玻璃仪器有烧杯和玻璃棒
B.a为含Ba2+的可溶性盐或碱,溶液b为含CO3的可溶性盐,且a与b顺序不能调换
C.室温下,加入适量c的过程中只发生了反应H*+OH=H O
D.沉淀的成分为:BaSO 、Mg(OH) 、CaCO 、BaCO 、泥沙等
17.现加热10.00g的碳酸钠和碳酸氢钠的混合固体使碳酸氢钠完全分解,固体质量变为9.69g,
则原混合固体中碳酸钠的质量分数为()
A.16.8% B.93.8% C.83.2% D.91.6%
【阅读材料3】有关铁及其化合物的价类二维关系,如下图所示:
价态个
+6 Feo
+3
+2 FexO
Fe3+ FerOH)
Fe2+ Fe(OH)
Fe
类别
单质 氧化物 盐 氢氧化物
回答18-25题:
18.下列物质转化不能一步实现的是( )
A.Fe→FeCl B.Fe→FeCl C.Fe→Fe O D.Fe→Fe(OH)
高一化学试题卷 第4页(共8页)
19.下列说法不正确的是( )
A.氯化铁溶液有酸性,可用于刻蚀电路板
B.铁粉具有还原性,可用作食品抗氧化剂
C.氢氧化铝具有弱碱性,可用于抗酸药物
D.钠钾合金熔点低且熔沸点差距大,可用作核反应堆的传热介质
20.杜甫诗句中“朱门酒肉臭,路有冻死骨”这里的“朱门”是指涂有( )的门
A. FeCl B.Fe O C. Fe(OH) D.Fe O
21.把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和 Fe3+的物质的量浓度恰
好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A.2:3 B.2:5 C.1:1 D.5:2
22.有铁的氧化物样品,用300mL 5mol-L1的盐酸恰好使其完全溶解,所得溶液还能吸收标准
状况下氯气3.36L,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是()
A. Fe O B.Fe O C.FesO D.Fe O
23.下列离子方程式中,不正确的是()
A.铁与稀盐酸反应:Fe+2H+=Fe2++H ↑
B.氧化亚铁与稀盐酸反应:FeO+2H+=Fe2++H O
C.氯化铁溶液与铜反应:2Fe3++Cu=2Fe2++Cu2+
D.向氯化亚铁溶液中滴加双氧水:Fe2++H O +2H+=Fe3++2H O
24.探究性学习小组利用如图所示方案制备 Fe(OH) 沉淀。下列说法不正确的是( )
NaOH NaOH稀硫酸 ae
溶液 溶液
向 NaOH
0 溶液 A B
苯 稀硫酸- 过量FeSO FeSOFeSO
溶液 溶液
NaOH
溶液 铁粉 水 铁粉- 溶液
① ② ③ ④
A.①装置中可能发生反应:4Fe2++8OH-+O +2H O=4Fe(OH)
B.②装置中苯的作用是隔绝空气中的氧气
C.③装置中长滴管的作用是防止滴入NaOH溶液时将空气中氧气带入 FeSO 溶液
D.④装置开始反应时应打开止水夹a,一段时间后再关闭止水夹a
25.高铁酸钾(K FeO )是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转
化为Fe(OH) 胶体,制备高铁酸钾流程如图所示。下列叙述正确的是( )
铁屑 Cl NaCIO NaOH
反应I 反应Ⅱ rkro品体
尾气 NaCI
A.红热的铁屑与干燥的氯气发生反应I时,铁屑过量会生成FeCl 和FeCl 的混合物
B.在水溶液中,发生反应Ⅱ的离子方程式为:3CIO+2Fe3+5H O=2FeO2+3Cl+10H+
C.根据制备流程可知,高铁酸盐在水中的溶解度:Na FeOD.高铁酸盐具有强氧化性可用于杀菌消毒,同时产生Fe(OH) 胶体具备絮凝净化功能
高一化学试题卷 第5页(共8页)
Ⅱ卷
二、非选择题(本大题共5小题,共40分)
26.(10分)符号表征是自然科学学习的重要方式,根据下图(NaCl固体在水中的溶解和形成
水合离子示意图)请用化学符号回答相关问题:
将NaCl固体加入水中 水分子与NaCI固体作用 NaCI圆体溶解并形成水合离子
(1)用电子式表示NaCl的形成过程:▲_
(2)氯化钠在水溶液中的电离方程式:▲_
(3)CH的结构示意图:▲
(4)请用符号表示水合钠离子:▲
(5)氯化钠是氯碱工业的重要原料,以氧化还原为模型思考氯化钠溶液通电后生成NaOH
溶液、H 和Cl 的过程,并用方程式表示反应过程:▲
27.(8分)右图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知B、C、
D是非金属单质,且在常温常压下都是气体,D常用于自来水的杀菌、消毒;化合物G的
焰色试验呈黄色,化合物F通常状况下成气态。请回答下列问题
A B
E
B △ CO G
C 光照 F
D
(1)D的组成元素在周期表中的位置:▲;物质C的结构式为:▲。
(2)写出E与CO 反应的化学方程式:▲
(3)标准状况下112mL CO 气体通入1L0.01mol/LG溶液反应,其离子方程式为:▲
(4)物质B在一定条件下与物质F发生置换反应,其化学方程式为:▲
28.(14分)某种胃药的有效成分为碳酸钙,室温测定其中碳酸钙含量的操作如下(假设该药
片中的其他成分不与盐酸或氢氧化钠反应):
高一化学试题卷 第6页(共8页)
①配制0.10mol/L稀盐酸和0.10mol/LNaOH溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸
请回答下列问题。
(1)正确的操作顺序是▲(填序号)
(2)研碎药品所选择的仪器是▲
A B C D
(3)测定过程中发生反应的离子方程式为▲;▲
(4)该测定实验共进行了4次。实验室现有50mL、100mL、250mL3种规格的容量瓶,则
配制盐酸应选用的容量瓶的规格为▲
(5)利用浓盐酸配制0.10mol/L稀盐酸的过程中,下列操作会引起浓度偏高的是▲_
A.用量筒量取浓盐酸时俯视刻度线
B.烧杯和玻璃棒的洗涤液未完全注入容量瓶中
C.定容时俯视容量瓶上的刻度线
D.定容时,添加蒸馏水超过刻度线后,用胶头滴管吸出多余的溶液
(6)某同学4次测定所消耗的NaOH溶液的体积如下:
测定次数 第1次 第2次 第3次 第4次
V[NaOH(aq)]mL 13.00 12.95 13.05 13.00
根据该同学的实验数据计算这种药片中碳酸钙的质量分数为▲
【阅读材料4】探究性学习小组发现过氧化氢溶液产品外包装有如下注意事项:
1.外用消毒剂,不得口服,置于儿童不易触及处;
2.本品对金属有腐蚀作用,慎用。
3.避免与碱性及还原性物质混合。
4.对本品主要有效成分过敏者禁用。
5.本品用于空气消毒时,应在无人条件下进行
高一化学试题卷 第7页(共8页)
请回答29-30题
29.(4分)回答与H O 性质相关的问题
(1)通过材料阅读可以获取过氧化氢可能具有的性质是▲
A.不稳定性 B.氧化性 C.还原性 D.酸性
(2)H O 的性质探究:向酸化的CuSO 溶液中加入H O 溶液,很快有大量气体逸出,同
时放热,一段时间后,蓝色溶液变为红色浑浊(Cu O)液,继续加入H O 溶液,红
色浑浊液又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法不正确
的是▲
A.Cu2+是H O 分解反应的催化剂
B. H O 既表现氧化性又表现还原性
C.Cu2+将H O 还原为O
D.红色浑浊变为蓝色溶液可表示为:Cu O+H O +4H+=2Cu2++3H O
30.(4分)H O 的性质与浓度密切相关,实验室常用酸性高锰酸钾测定过氧化氢的浓度。测定
之前,先用0.1000 mol/L Na C O 溶液准确标定新制高锰酸钾溶液的浓度,然后再用高锰
酸钾溶液测定H O 的浓度。
已知:①20.00mL未知浓度的高锰酸钾溶液恰好消耗了25.00mL0.1000 mol/L Na C O 溶液。
②20.00mL某浓度H O 溶液标定过程中消耗高锰酸钾溶液体积为16.00mL
③常见消毒对象使用H O 溶液浓度如下表所示:
消毒对象 纺织品 餐具 器械 空气
使用浓度(质量分数) 0.25 .5% 0.5 .0% 1.0% 1.2 .8%
④稀H O 溶液密度可近似为1g·cm3
⑤Na C O 溶液与酸性高锰酸钾溶液反应离子方程式:
5C O2-+2MnO +16H+=10CO ↑+2Mn2++8H O
(1)请写出酸性高锰酸钾氧化过氧化氢的离子方程式:▲(酸性条件下高锰酸钾对应
的还原产物为Mn2+)
(2)上述过氧化氢溶液可以直接使用的消毒对象为:▲
高一化学试题卷 第8页(共8页)
2024学年第一学期期末学业水平测试
高一化学参考答案
选择题部分(9-10、13-17、22、24-25为3分题)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C C D B A C D A B B B D A A B
16 17 18 19 20 21 22 23 24 25
D D D A B A D D C D
26(10分)
Na+.cl:→Na+[C:]
(1)
(2)NaCl=Na++Cl或NaCl+(m+n)H O=[Na(H O)m]*+[CI(H O).]
+17288
(3)
(4)[Na(H O)s]+或[Na(H O)。J
(5)2NaCl+2H o通2NaOH+ H ↑+Clzt或2CI+2H O通电20H+H ↑+Cl↑(条件写“电解”
或“通电”均给分)
27(8分)
(1)3周期VIIA族(1分)(周期数用阿拉伯数字或汉字均可以,族序数规范表达);
H-H(1分)
(2)2Na O +2CO =2Na CO +O
(3)CO +Na CO +H O=2NaHCO
(4)O +4HCI定条件2Cl +2H O
28(14分)
(1)①②④③或②①④③
(2)B
(3)CaCO +2H+=Ca2++CO ↑+H O;H++OH=H O
(4)250mL
(5)C
(6)60%
29(4分)
(1)BD
(2)C
30(4分)
(1)2MnO4+5H O +6H*=2Mn2++5O ↑+8H O
(2)纺织品
高一化学试题卷
考生须知:
1.本试卷分第I卷(选择题)和第II卷(非选择题),满分100分。考试时间90分钟;
2.答题前,在答题卷指定区域内填写学校、班级、姓名、准考证号等相关信息;
3.所有答案必须写在答题卷上,写在试题卷上无效;
4.可能用到的相对原子量:H-1 C-12 N-14 0-16 Na-23 S-32 Cl-35.5 K-39 Ca-40
Mn-55 Fe-56 Cu-64.5 Ba-137
第I卷(选择题60分)
一、选择题(本大题共25小题,其中8、9、10、15、16、17、22、23、24、25为3分题。每小
题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.联合国《化学品分类及标记全球协调制度》(简称GHS)中的标准符号被我国国家标准(GB
13690-2009)采用,以方便化学品的贸易与运输。以下GHS标准符号与示意不匹配的是()
易燃类物质 氧化性物质 放射性物质 腐蚀类物质
A B C D
2.下列与实验有关的图标对应不正确的是( )
护目镜 排风 热烫 洗手
A B C D
3.常温下NaHCO 能与NaOH溶液反应,过程中NaHCO 体现的性质是( )
A.不稳定性 B.还原性 C.碱性 D.酸性
4.下列二氧化碳相关化学符号表示不正确的是( )
分子式 电子式 结构式 分子结构模型
CO : :C:0: O=C=O
A B C D
【阅读材料1】HCIO不稳定,难以保存,使用起来很不方便。将Cl 通入 NaOH溶液中,可以
得到以NaClO为有效成分的漂白液。NaClO虽然也会分解,但它的水溶液在低温下存放三年
才分解一半左右,比HCIO稳定得多。
高一化学试题卷 第1页(共8页)
请回答5-10题:
5.下列关于氯元素的说法不正确的是( )
A.氯元素在自然界中主要以游离态存在 B.氯气是一种有刺激性的有毒气体
C.液氯中含有大量的氯气分子 D.液氯一般用钢瓶储存
6.等物质的量浓度的下列稀溶液中,ClO-离子浓度最大的是( )
A.NaClO B.HCIO C. Ca(CIO) D.氯水
7.饱和氯水溶液中存在多种微粒,微粒间作用力不包括( )
A.分子间作用力 B.非极性键 C.极性键 D.离子键
8.下列关于氯水溶液中微粒的结构与性质,说法不正确的是()
A.HCIO分子中各原子均满足8电子稳定结构
B. HCIO分解的过程中,既体现氧化性又体现还原性
C.因氯水中存在一定量Cl 分子,则溶液呈淡黄绿色
D.增强氯水溶液的碱性,有利于提升溶液的稳定性
9.某温度下,将Cl 通入一定浓度NaOH溶液中,若反应得到NaCl、NaClO和NaCIO 的混合
溶液,经测定CIO与Clr的物质的量之比约为1:8,则Cl 与NaOH溶液反应时,被氧化的
氯原子和被还原的氯原子的个数比为()
A.5:7 B.3:10 C.1:1 D.7:5
10.光照过程中氯水的pH、氯水中氯离子的浓度、广口瓶中氧气的体积分数的变化,如下图所
示。下列说法正确的是( )
1000 24
2.0f
氯水的pH 1.5} 氧离子的浓度/(mgL 800+600+400 氧气的体积分数/% 22+20+
1.0 200+ 18
0 50100 150 0 50 100 150 0 50 100 150
时间/s 时间/s 时间/
A.溶液pH降低的原因是光照条件下HCIO电离产生了更多的H+
B.随着氯离子浓度不断增加,溶液漂白能力逐渐减弱
C.随着氧气的体积分数不断增加,溶液氧化性逐渐增强
D.综合图像分析氯水光照过程中反应的离子方程式为:H O+ClO=Cl+O ↑+2H+
【阅读材料2】纯碱是一种重要的化工原料,早期人们从草木灰中提取碳酸钾,后来又从盐碱
地和盐湖等天然资源中获取碳酸钠,但天然碱的产量和纯度,远不能满足化工生产和人们日常
生活的需求。Na CO 的工业制法,历史上经历了3个阶段:
I.路布兰法(N.Leblanc):主要原料包括食盐、硫酸、石灰石和煤粉。
IⅡ.索尔维法(E.Solvay):以食盐、石灰石和氨为原料。简化工艺流程如下图所示。
煅烧
石灰石 CO Na CO
NaHCO 晶体
氨气 过滤
饱和食盐水 氨盐水 碳化 NaHCO 悬浊液
滤液(NH CI、NaHCO 、NaC等)
高一化学试题卷 第2页(共8页)
ⅢI.侯氏联碱法:该法最大的特点是滤去NaHCO 晶体后的母液含有大量NH Cl的NaHCO ,
向其中加入食盐使母液中的NH Cl结晶出来作为氮肥,并将最后留下含有NaCl的母液循
环使用,从而把食盐的利用率从原来的70 高到98
请回答11-17题:
11.齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳
高温分解形成的灰)混合加水所得液体来洗涤丝帛。下列说法错误的是()
A.草木灰的主要成分碳酸钾可用作钾肥
B.“蜃”的主要成分属于难溶性的盐
C.“灰”和“蜃”混合加水所得溶液中含有KOH
D.“蜃”加水混合后会发生化合反应
12.路布兰制碱法。其化学反应过程如下:
①固体食盐与硫酸反应生成硫酸钠和氯化氢:2NaClS)+H SO 高温Na SO +2HCl(g
②硫酸钠、石灰石和煤粉煅烧生成纯碱和硫化钙:
Na SO +2C+CaCo;高温2Na CO +CaS+2CO
③硫化钙、二氧化碳和水发应生成碳酸钙和硫化氢:CaS+CO +H O=CaCO +H S
④硫化氢被氧化生成硫酸,硫酸可以循环使用:H S+2O =H SO
下列有关说法正确的是( )
A.反应①用饱和食盐水与硫酸反应有利于制备HCl气体
B.反应②中氧化剂与还原剂的物质的量之比为2:1
C.反应③生成的H S在常温下是气体,属于非电解质
D.反应④用H O 替代O 生成相同质量的H SO ,理论上转移电子数不变
13.利用下图所示装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。下列有关装置和仪器的
表述不正确的是()
浓氨水
碱石灰 a
稀盐酸 非 不是
浪天 b 氧化钙
大理石 饱和NaCl溶液
A B C D
A.装置a的作用是防止外界水蒸气进入C装置
B.装置B的作用是除去CO 中混有的HCl气体
C.装置C中仪器b的作用是控制气体的流速和防止倒吸
D.装置D中止水夹K 先打开一段时间,再打开K
14.如题13所示模拟索尔维法制备碳酸氢钠。下列有关说法正确的是()
A.装置A中盛装稀盐酸的仪器为分液漏斗。
B.装置B用饱和Na CO 溶液,除杂效果更好
C.装置C中反应方程式为:2NaCl+CO +2NH +H O=Na CO J+2NH Cl
D.装置D中氧化钙可以由苛性钠或浓硫酸替代
高一化学试题卷 第3页(共8页)
15.我国科学家侯德榜以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,对
世界制碱工业做出了卓越贡献,工艺流程如下左图所示;右图为NH Cl和NaCl溶解度随
温度变化情况。
饱和食盐水 溶解度/g
副产品CO 循环! 80
NH NH.c
合成氨厂 沉淀池
产品 60
煅烧炉 Na CO
循环I 40
NH, NpCI母液
加入食盐细粉副产品 20
冷却至10℃以下、过滤 NH CI
5070
侯氏制碱法示意图 01030 90 T0o温度/℃
下列相关说法不正确的是( )
A.煅烧炉中主要发生反应:2NaHCO;Na CO +CO ↑+H O
B.经过沉淀池获取的母液中几乎不含有NaHCO
C.循环I的主要物质是CO
D.母液加入食盐细粉后选择低温结晶有利于副产品NH Cl的获取
16.制碱原材料饱和食盐水的纯度对产品纯度有很大的影响。从海水中得到的粗盐往往含有可
溶性杂质(主要有Na SO4、MgCl 、CaCl )和不溶性杂质(泥沙)等,必须进行分离和提
纯后才能用于制碱,粗盐提纯的部分流程如图所示,下列说法正确的是()
过量
过量NaOH 过量 沉淀
粗盐-溶解 溶液a溶液 溶液b 操作1 适量
滤液溶液c操作烘王精盐
A.操作I、Ⅱ均需要用到的玻璃仪器有烧杯和玻璃棒
B.a为含Ba2+的可溶性盐或碱,溶液b为含CO3的可溶性盐,且a与b顺序不能调换
C.室温下,加入适量c的过程中只发生了反应H*+OH=H O
D.沉淀的成分为:BaSO 、Mg(OH) 、CaCO 、BaCO 、泥沙等
17.现加热10.00g的碳酸钠和碳酸氢钠的混合固体使碳酸氢钠完全分解,固体质量变为9.69g,
则原混合固体中碳酸钠的质量分数为()
A.16.8% B.93.8% C.83.2% D.91.6%
【阅读材料3】有关铁及其化合物的价类二维关系,如下图所示:
价态个
+6 Feo
+3
+2 FexO
Fe3+ FerOH)
Fe2+ Fe(OH)
Fe
类别
单质 氧化物 盐 氢氧化物
回答18-25题:
18.下列物质转化不能一步实现的是( )
A.Fe→FeCl B.Fe→FeCl C.Fe→Fe O D.Fe→Fe(OH)
高一化学试题卷 第4页(共8页)
19.下列说法不正确的是( )
A.氯化铁溶液有酸性,可用于刻蚀电路板
B.铁粉具有还原性,可用作食品抗氧化剂
C.氢氧化铝具有弱碱性,可用于抗酸药物
D.钠钾合金熔点低且熔沸点差距大,可用作核反应堆的传热介质
20.杜甫诗句中“朱门酒肉臭,路有冻死骨”这里的“朱门”是指涂有( )的门
A. FeCl B.Fe O C. Fe(OH) D.Fe O
21.把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和 Fe3+的物质的量浓度恰
好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A.2:3 B.2:5 C.1:1 D.5:2
22.有铁的氧化物样品,用300mL 5mol-L1的盐酸恰好使其完全溶解,所得溶液还能吸收标准
状况下氯气3.36L,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是()
A. Fe O B.Fe O C.FesO D.Fe O
23.下列离子方程式中,不正确的是()
A.铁与稀盐酸反应:Fe+2H+=Fe2++H ↑
B.氧化亚铁与稀盐酸反应:FeO+2H+=Fe2++H O
C.氯化铁溶液与铜反应:2Fe3++Cu=2Fe2++Cu2+
D.向氯化亚铁溶液中滴加双氧水:Fe2++H O +2H+=Fe3++2H O
24.探究性学习小组利用如图所示方案制备 Fe(OH) 沉淀。下列说法不正确的是( )
NaOH NaOH稀硫酸 ae
溶液 溶液
向 NaOH
0 溶液 A B
苯 稀硫酸- 过量FeSO FeSOFeSO
溶液 溶液
NaOH
溶液 铁粉 水 铁粉- 溶液
① ② ③ ④
A.①装置中可能发生反应:4Fe2++8OH-+O +2H O=4Fe(OH)
B.②装置中苯的作用是隔绝空气中的氧气
C.③装置中长滴管的作用是防止滴入NaOH溶液时将空气中氧气带入 FeSO 溶液
D.④装置开始反应时应打开止水夹a,一段时间后再关闭止水夹a
25.高铁酸钾(K FeO )是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转
化为Fe(OH) 胶体,制备高铁酸钾流程如图所示。下列叙述正确的是( )
铁屑 Cl NaCIO NaOH
反应I 反应Ⅱ rkro品体
尾气 NaCI
A.红热的铁屑与干燥的氯气发生反应I时,铁屑过量会生成FeCl 和FeCl 的混合物
B.在水溶液中,发生反应Ⅱ的离子方程式为:3CIO+2Fe3+5H O=2FeO2+3Cl+10H+
C.根据制备流程可知,高铁酸盐在水中的溶解度:Na FeO
高一化学试题卷 第5页(共8页)
Ⅱ卷
二、非选择题(本大题共5小题,共40分)
26.(10分)符号表征是自然科学学习的重要方式,根据下图(NaCl固体在水中的溶解和形成
水合离子示意图)请用化学符号回答相关问题:
将NaCl固体加入水中 水分子与NaCI固体作用 NaCI圆体溶解并形成水合离子
(1)用电子式表示NaCl的形成过程:▲_
(2)氯化钠在水溶液中的电离方程式:▲_
(3)CH的结构示意图:▲
(4)请用符号表示水合钠离子:▲
(5)氯化钠是氯碱工业的重要原料,以氧化还原为模型思考氯化钠溶液通电后生成NaOH
溶液、H 和Cl 的过程,并用方程式表示反应过程:▲
27.(8分)右图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知B、C、
D是非金属单质,且在常温常压下都是气体,D常用于自来水的杀菌、消毒;化合物G的
焰色试验呈黄色,化合物F通常状况下成气态。请回答下列问题
A B
E
B △ CO G
C 光照 F
D
(1)D的组成元素在周期表中的位置:▲;物质C的结构式为:▲。
(2)写出E与CO 反应的化学方程式:▲
(3)标准状况下112mL CO 气体通入1L0.01mol/LG溶液反应,其离子方程式为:▲
(4)物质B在一定条件下与物质F发生置换反应,其化学方程式为:▲
28.(14分)某种胃药的有效成分为碳酸钙,室温测定其中碳酸钙含量的操作如下(假设该药
片中的其他成分不与盐酸或氢氧化钠反应):
高一化学试题卷 第6页(共8页)
①配制0.10mol/L稀盐酸和0.10mol/LNaOH溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸
请回答下列问题。
(1)正确的操作顺序是▲(填序号)
(2)研碎药品所选择的仪器是▲
A B C D
(3)测定过程中发生反应的离子方程式为▲;▲
(4)该测定实验共进行了4次。实验室现有50mL、100mL、250mL3种规格的容量瓶,则
配制盐酸应选用的容量瓶的规格为▲
(5)利用浓盐酸配制0.10mol/L稀盐酸的过程中,下列操作会引起浓度偏高的是▲_
A.用量筒量取浓盐酸时俯视刻度线
B.烧杯和玻璃棒的洗涤液未完全注入容量瓶中
C.定容时俯视容量瓶上的刻度线
D.定容时,添加蒸馏水超过刻度线后,用胶头滴管吸出多余的溶液
(6)某同学4次测定所消耗的NaOH溶液的体积如下:
测定次数 第1次 第2次 第3次 第4次
V[NaOH(aq)]mL 13.00 12.95 13.05 13.00
根据该同学的实验数据计算这种药片中碳酸钙的质量分数为▲
【阅读材料4】探究性学习小组发现过氧化氢溶液产品外包装有如下注意事项:
1.外用消毒剂,不得口服,置于儿童不易触及处;
2.本品对金属有腐蚀作用,慎用。
3.避免与碱性及还原性物质混合。
4.对本品主要有效成分过敏者禁用。
5.本品用于空气消毒时,应在无人条件下进行
高一化学试题卷 第7页(共8页)
请回答29-30题
29.(4分)回答与H O 性质相关的问题
(1)通过材料阅读可以获取过氧化氢可能具有的性质是▲
A.不稳定性 B.氧化性 C.还原性 D.酸性
(2)H O 的性质探究:向酸化的CuSO 溶液中加入H O 溶液,很快有大量气体逸出,同
时放热,一段时间后,蓝色溶液变为红色浑浊(Cu O)液,继续加入H O 溶液,红
色浑浊液又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法不正确
的是▲
A.Cu2+是H O 分解反应的催化剂
B. H O 既表现氧化性又表现还原性
C.Cu2+将H O 还原为O
D.红色浑浊变为蓝色溶液可表示为:Cu O+H O +4H+=2Cu2++3H O
30.(4分)H O 的性质与浓度密切相关,实验室常用酸性高锰酸钾测定过氧化氢的浓度。测定
之前,先用0.1000 mol/L Na C O 溶液准确标定新制高锰酸钾溶液的浓度,然后再用高锰
酸钾溶液测定H O 的浓度。
已知:①20.00mL未知浓度的高锰酸钾溶液恰好消耗了25.00mL0.1000 mol/L Na C O 溶液。
②20.00mL某浓度H O 溶液标定过程中消耗高锰酸钾溶液体积为16.00mL
③常见消毒对象使用H O 溶液浓度如下表所示:
消毒对象 纺织品 餐具 器械 空气
使用浓度(质量分数) 0.25 .5% 0.5 .0% 1.0% 1.2 .8%
④稀H O 溶液密度可近似为1g·cm3
⑤Na C O 溶液与酸性高锰酸钾溶液反应离子方程式:
5C O2-+2MnO +16H+=10CO ↑+2Mn2++8H O
(1)请写出酸性高锰酸钾氧化过氧化氢的离子方程式:▲(酸性条件下高锰酸钾对应
的还原产物为Mn2+)
(2)上述过氧化氢溶液可以直接使用的消毒对象为:▲
高一化学试题卷 第8页(共8页)
2024学年第一学期期末学业水平测试
高一化学参考答案
选择题部分(9-10、13-17、22、24-25为3分题)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C C D B A C D A B B B D A A B
16 17 18 19 20 21 22 23 24 25
D D D A B A D D C D
26(10分)
Na+.cl:→Na+[C:]
(1)
(2)NaCl=Na++Cl或NaCl+(m+n)H O=[Na(H O)m]*+[CI(H O).]
+17288
(3)
(4)[Na(H O)s]+或[Na(H O)。J
(5)2NaCl+2H o通2NaOH+ H ↑+Clzt或2CI+2H O通电20H+H ↑+Cl↑(条件写“电解”
或“通电”均给分)
27(8分)
(1)3周期VIIA族(1分)(周期数用阿拉伯数字或汉字均可以,族序数规范表达);
H-H(1分)
(2)2Na O +2CO =2Na CO +O
(3)CO +Na CO +H O=2NaHCO
(4)O +4HCI定条件2Cl +2H O
28(14分)
(1)①②④③或②①④③
(2)B
(3)CaCO +2H+=Ca2++CO ↑+H O;H++OH=H O
(4)250mL
(5)C
(6)60%
29(4分)
(1)BD
(2)C
30(4分)
(1)2MnO4+5H O +6H*=2Mn2++5O ↑+8H O
(2)纺织品
同课章节目录
