2025中考科学备考集训42:常见的化学反应(含解析)
文档属性
| 名称 | 2025中考科学备考集训42:常见的化学反应(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 350.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-01-18 22:12:07 | ||
图片预览




文档简介
2025中考科学备考集训42:常见的化学反应
一.选择题(共15小题)
1.温州轻轨工程正在建设中,工程技术人员利用铝热剂燃烧释放大量的热来焊接铁轨。点燃铝热剂反应的化学方程式为:2Al+Fe2O3Al2O3+2Fe.该反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
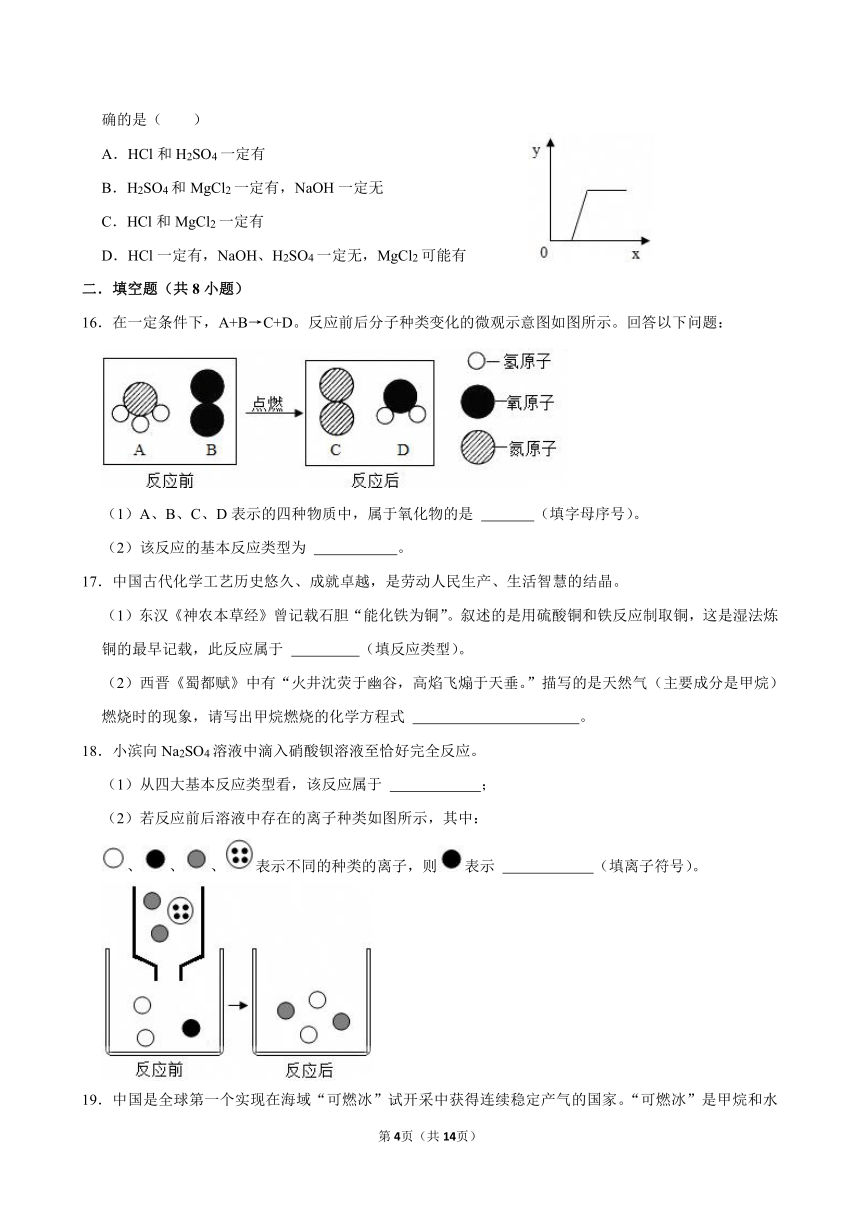
2.如图所示的化学反应基本类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3.芯片是“智能家电”的核心部件,它是以高纯度单质硅为材料制成的。制取高纯硅的化学方程式为:①SiO2+2CSi(粗)+2CO↑ ②Si(粗)+2Cl2SiCl4 ③SiCl4+2H2Si(纯)+4HCl。下列说法正确的是( )
A.反应①中,CO是还原剂
B.反应①②③都属于置换反应
C.反应②③的目的是将粗硅提纯
D.反应①②③不需要隔绝空气进行
4.在MgMgSO4Mg(OH)2MgO的各步转化中,反应所属的基本反应类型不包括( )
A.化合反应 B.复分解反应
C.置换反应 D.分解反应
5.下列属于复分解反应类型的是( )
A.Mg+2HCl=MgCl2+H2↑
B.Cu(OH)2+H2SO4=CuSO4+2H2O
C.3Fe+2O2Fe3O4
D.2KMnO4K2MnO4+MnO2+O2↑
6.如图是一款变色眼镜,在使用期限内眼镜质量保持不变。它的镜片内含有溴化银(AgBr)和氧化铜(CuO)。在室外强光照射下,溴化银转化成单质溴(Br2)和银(Ag),镜片颜色变暗棕色;在室内光线较暗处,单质溴和银在氧化铜催化下重新生成溴化银,镜片颜色又变浅。在使用期限内小金佩戴该眼镜后( )
A.从室内走到室外,镜片中物质发生化合反应
B.从室外走进室内,银元素的化合价降低
C.室内生成溴化银的质量一定大于室外分解溴化银的质量
D.无论环境明暗如何变化,氧化铜的质量始终不变
7.下列与Na2O+H2O=2NaOH属于同一基本反应类型的是( )
A.Fe+SFeS
B.Zn+2HCl=ZnCl2+H2↑
C.NaOH+HCl=NaCl+H2O
D.CaCO3CaO+CO2↑
8.工业用盐中含有的亚硝酸钠(NaNO2)是一种有毒物质,利用 NH4Cl溶液可使NaNO2转化为无毒物质。该反应分两步进行:①NaNO2+NH4Cl═NaCl+NH4NO2②NH4NO2═N2↑+2H2O
下列叙述不正确的是( )
A.NH4NO2由三种元素组成
B.反应①为复分解反应,反应②为分解反应
C.利用 NH4Cl 处理NaNO2最终转化为NaCl、N2和H2O
D.上述反应所涉及的物质中,氮元素的化合价有四种
9.芯片是电脑“智能家电”的核心部件,它是以高纯度的单质硅(Si)为材料制成的。硅及其氧化物能发生如下反应:
①Si+O2SiO2 ②Si+2NaOH+X═Na2SiO3+2H2↑
③SiO2+2CSi+2CO↑ ④SiO2+Na2CO3Na2SiO3+CO2↑
下列说法错误的是( )
A.④属于复分解反应
B.Na2SiO3中Si的化合价为+4价
C.②中X的化学式为H2O
D.Si和SiO2在一定条件下可以相互转化
10.2022年春晚的舞蹈诗剧《只此青绿》还原了北宋名画《千里江山图)。画中用到的矿物颜料有石绿。石绿主要成分是CuCO3 Cu(OH)2,CuCO3 Cu(OH)2受热易分解生成三种氧化物(石绿中其它成分不参与化学反应)。下列说法不正确的是( )
A.石绿加热分解能得到一种黑色固体
B.石绿溶于水可配成绿色溶液
C.石绿能与稀硫酸发生复分解反应
D.《千里江山图》应低温、干燥保存
11.下列关于各反应类型,说法不正确的是( )
A.氧化反应都要放出热量
B.反应物只有一种的反应一定是分解反应
C.有的化合反应也是氧化反应
D.物质与氧气的反应一定属于氧化反应
12.复分解反应不能生成的物质是( )
①单质 ②氧化物 ③酸 ④碱 ⑤盐
A.①② B.②④ C.③⑤ D.①
13.“绿色化学”是21世纪化学发展的主导方向,要求从根本上杜绝污染.它包括“原料绿色化”、“化学反应绿色化”、“产品绿色化”等内容.其中“化学反应绿色化”要求原料物质中的所有原子完全被利用,全部转入期望的产物中.下列符合“化学反应绿色化”要求的是( )
A.制取氢气:Zn+H2SO4=ZnSO4+H2↑
B.制取氧气:2KMnO4? K2MnO4+MnO2+O2↑
C.制取碳酸氢铵:CO2+H2O+NH3=NH4HCO3
D.制取氨气:(NH4)2SO4+Ca(OH)2?═CaSO4+2NH3↑+2H2O
14.推理是一种重要的学习方法。下列推理中正确的是( )
A.物质与氧气发生的反应都是氧化反应,则氧化反应一定要有氧气参加
B.单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质
C.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
D.碱性溶液能使酚酞试液变红,则能使酚酞试液变红的溶液一定呈碱性
15.某溶液溶质可能是NaOH、HCl、H2SO4、MgCl2的一种或几种。向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量(Y)与加入Ba(OH)2溶液质量(X)的关系如图所示,下列有关溶质组成的说法正确的是( )
A.HCl和H2SO4一定有
B.H2SO4和MgCl2一定有,NaOH一定无
C.HCl和MgCl2一定有
D.HCl一定有,NaOH、H2SO4一定无,MgCl2可能有
二.填空题(共8小题)
16.在一定条件下,A+B→C+D。反应前后分子种类变化的微观示意图如图所示。回答以下问题:
(1)A、B、C、D表示的四种物质中,属于氧化物的是 (填字母序号)。
(2)该反应的基本反应类型为 。
17.中国古代化学工艺历史悠久、成就卓越,是劳动人民生产、生活智慧的结晶。
(1)东汉《神农本草经》曾记载石胆“能化铁为铜”。叙述的是用硫酸铜和铁反应制取铜,这是湿法炼铜的最早记载,此反应属于 (填反应类型)。
(2)西晋《蜀都赋》中有“火井沈荧于幽谷,高焰飞煽于天垂。”描写的是天然气(主要成分是甲烷)燃烧时的现象,请写出甲烷燃烧的化学方程式 。
18.小滨向Na2SO4溶液中滴入硝酸钡溶液至恰好完全反应。
(1)从四大基本反应类型看,该反应属于 ;
(2)若反应前后溶液中存在的离子种类如图所示,其中:
、、、表示不同的种类的离子,则表示 (填离子符号)。
19.中国是全球第一个实现在海域“可燃冰”试开采中获得连续稳定产气的国家。“可燃冰”是甲烷和水在低温、高压条件下形成的水合物(CH4 nH2O)。
(1)在常温常压下,“可燃冰”会发生反应:CH4 nH2O=CH4+nH2O,该反应属于 。(填基本反应类型);
(2)甲烷可制成合成气(CO、H2),再制成甲醇(CH3OH),代替日益供应紧张的燃油。由合成气制甲醇的反应方程式为:CO+2H2CH3OH,由甲烷制成合成气有两种方法:
①CH4+H2OCO+3H2
②2CH4+O22CO+4H2
从原料配比角度比较方法①和②,更适宜用于合成甲醇的方法是 (填序号)。
20.HCl气体通入水中可得盐酸溶液,室温下,将HCl气体通入盛有NaOH溶液的试管中,直至溶液的pH=7。请回答下列问题:
(1)该反应的实质是 。
(2)HCl气体通入NaOH溶液前后,试管中溶液的离子种类如图所示,其中能使无色酚酞试液变红的是 (选填“①”“②”或“③”),③表示 离子。
21.对知识的比较和归纳是学习科学的重要方法之一.现有以下3个反应的化学方程式:
①CuSO4+Fe=Cu+FeSO4②CuO+H2Cu+H2O③SiO2+2CSi+2CO↑
(1)比较反应物和生成物的特点,可归纳出这3个反应的基本反应类型都属于 .
(2)上述3个反应都属于氧化还原反应,其中反应②中H2属于 (选填“氧化剂或还原剂”)
22.在反应前后有元素化合价发生变化的化学反应都属于氧化﹣还原反应.如图是化学兴趣小组通过自主学习构建的四种基本反应类型与氧化﹣还原反应的关系图.根据此图我能回答下列问题:
(1)①代表的基本反应类型是 ;
(2)任意写出一个不属于四种基本反应类型,但属于氧化﹣还原反应的化学方程式 .
23.如图为“领取奖杯游戏”的物质阶梯。当阶梯上相邻的物质之间能发生反应,方可向上攀登。例如,攀登阶梯甲能领取奖杯。
(1)甲阶梯上有5种物质,相邻间物质能发生复分解反应的个数是 。
(2)为除去Na2SO4、MgCl2、CaCl2,并得到中性的食盐溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量的NaOH 溶液,④加适量的稀 HCl,⑤加过量的BaCl2溶液,能达到目的的顺序是 。
(3)搭建阶梯乙,请你从O2、Al、Al2O3、HCl、NaOH 中选择4种物质放到台阶上,从高到低依次排列,排在倒数第二个台阶上的物质名称是: (从上往下的顺序)。
(4)用pH 试纸测定溶液酸碱度的操作是 。
三.实验探究题(共3小题)
24.酸和碱反应是放热反应吗?三位同学为探究此问题行了下列实验:
(1)甲同学取10mL10%的NaOH溶液于试管中,逐滴加入10%的稀硫酸,随着稀硫酸的加入,烧杯中溶液温度与加入硫酸体积之间的变化关系如甲图所示。从A到B点的过程中,试管中溶液的pH值逐渐 (选填“增大”或“减小”)。
(2)乙同学按乙图装置进行实验,其中利用了饱和石灰水的性质是 。
(3)丙同学按丙图实验,可以根据 现象也能证明酸碱反应是放热的。
25.某校科学兴趣小组的同学利用稀盐酸、碳酸钠、Ca(OH)2溶液三种物质探究“复分解反应发生的条件”,做了如图①②③的实验。请回答有关问题:
(1)试管①中可观察到的现象是 。
(2)通过试管①和②两组实验,可以初步得出复分解反应发生的条件是 。
(3)为了证明试管③中发生了复分解反应,还需要在 溶液中加入酚酞才便于观察。
(4)兴趣小组的同学将试管①反应后的物质过滤,取滤液少量置于试管中,加入CaCl2溶液,有白色沉淀产生,则滤液中溶质的成分为 。
26.为探索物质在化学变化前后的质量关系,科学家做了大量实验。
探究1:1663年,英国化学家波义耳将金属锡放在密闭容器里煅烧后立即打开容器盖进行称量,结果发现反应后的固体质量增加了,得出的结论是物质的总质量增加了。
探究2:1756年,俄国化学家罗蒙诺索夫重做了波义耳的实验。
①先用天平称取质量为m1的金属锡粉;
②将锡粉放在密闭容器里进行完全燃烧,生成了白色固体SnO2,称量容器的总质量为m2;
③打开容器,听到了空气进入容器发出的“丝丝的声响”。取出SnO2称量质量为m3;
④冷却后,把SnO2放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4;
结合上述科学探究完成下列问题:
(1)锡的燃烧反应方程式为:Sn+O2SnO2,其属于基本反应类型中的 。
(2)产物SnO2中锡元素的化合价为 。
(3)罗蒙诺索夫分析数据后,提出了“参加化学反应的物质的总质量,等于反应后产物的总质量”的观点。则支持该观点的证据是白色固体SnO2的质量m3= 。(注:用探究2中的相关表示质量的字母来表述)
2025中考科学备考集训42:常见的化学反应
参考答案与试题解析
题号 1 2 3 4 5 6 7 8 9 10 11
答案 C C C A B D A D A B B
题号 12 13 14 15
答案 D C D C
一.选择题(共15小题)
1.【解答】解:点燃铝热剂反应的化学方程式为:2Al+Fe2O3Al2O3+2Fe,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应。
故选:C。
2.【解答】解:该反应由一种单质生成了另一种单质,属于基本类型中的置换反应。
故选:C。
3.【解答】解:A、反应①中,碳夺取了二氧化硅中的氧,具有还原性,是该反应的还原剂,CO是产物,故A错误;
B、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,反应①③都是一种单质与一种化合物反应,生成另一种单质和另一种化合物,都属于置换反应,反应②属于化合反应,故B错误。
C、通过反应①得到的是粗硅,通过反应②③得到了纯净的硅,所以②③的目的是将粗硅提纯,故C正确;
D、反应①中的碳会与氧气反应,需要隔绝空气进行,故D错误。
故选:C。
4.【解答】解:镁和硫酸反应生成MgSO4和氢气,属于置换反应;MgSO4和NaOH反应生成Mg(OH)2和Na2SO4,属于复分解反应;Mg(OH)2在加热的条件下生成MgO,属于分解反应;因此在各步转化中,没有化合反应,
故选:A。
5.【解答】解:A、Mg+2HCl=MgCl2+H2↑,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项错误。
B、Cu(OH)2+H2SO4=CuSO4+2H2O,该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,故选项正确。
C、3Fe+2O2Fe3O4,该反应符合“多变一”的形式,符合化合反应的特征,属于化合反应,故选项错误。
D、2KMnO4K2MnO4+MnO2+O2↑,该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应,故选项错误。
故选:B。
6.【解答】解:A、从室内走到室外,在室外强光照射下,溴化银转化成单质溴(Br2)和银(Ag),该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应,故选项说法错误。
B、从室外走进室内,在室内光线较暗处,单质溴和银在氧化铜催化下重新生成溴化银,银元素的化合价由0价变为+1价,故选项说法错误。
C、由质量守恒定律,反应前后银元素的质量不变,室内生成溴化银的质量等于室外分解溴化银的质量,故选项说法错误。
D、由题意,在室内光线较暗处,单质溴和银在氧化铜催化下重新生成溴化银,反应前后催化剂的质量不变,无论环境明暗如何变化,氧化铜的质量始终不变,故选项说法正确。
故选:D。
7.【解答】解:Na2O+H2O═2NaOH是由两种物质生成一种新物质的化合反应。
A、该反应为两种物质反应生成一种物质,属于化合反应,正确;
B、该反应为一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应,错误;
C、该反应为由两种化合物互相交换成分,生成另外两种化合物,属于复分解反应,错误;
D、该反应为一种物质分解成两种其他物质,属于分解反应,错误。
故选:A。
8.【解答】解:A、NH4NO2是由氮、氢、氧三种元素组成,故A正确;
B、NaNO2+NH4Cl═NaCl+NH4NO2是两种化合物相互交换成分生成另外的两种化合物,属于复分解反应,而NH4NO2═N2↑+2H2O是属于一变多的分解反应,故B正确;
C、根据反应①②可知NH4Cl 处理NaNO2最终转化为NaCl、N2和H2O,故C正确;
D、NaNO2中氮元素的化合价为+3价,NH4NO2中氮元素的化合价分别为﹣3价、+3价,NH4Cl中氮元素的化合价为﹣3价,而N2中氮元素的化合价为0价,所以上述反应所涉及的物质中,氮元素的化合价有三种,故D错误。
故选:D。
9.【解答】解:A、④中不是两种化合物相互交换成分生成另外两种新的化合物,不属于复分解反应,该选项不正确。
B、Na2SiO3中钠元素化合价是+1,氧元素化合价是﹣2,根据化合物中元素化合价代数和为零可知,Si的化合价为+4价,该选项正确。
C、Si+2NaOH+X═Na2SiO3+2H2↑中,反应前后硅原子都是1个,钠原子都是2个,反应后氧原子是3个,反应前应该是3个,其中1个包含在未知物质中,反应后氢原子是4个,反应前应该是4个其中2个包含在未知物质中,X的化学式为H2O,该选项正确。
D、Si和SiO2在一定条件下可以相互转化,该选项正确。
故选:A。
10.【解答】解:石绿主要成分是CuCO3 Cu(OH)2,受热易分解生成氧化铜、水和二氧化碳三种氧化物。
A、石绿加热分解生成氧化铜,氧化铜为黑色固体,故A正确;
B、石绿难溶于水,不可配成绿色溶液,故B不正确;
C、石绿主要成分是CuCO3 Cu(OH)2,能与稀硫酸发生复分解反应,故C正确;
D、石绿受热易分解,《千里江山图》应低温、干燥保存,故D正确;
故选:B。
11.【解答】解:A、氧化反应都要放出热量,故选项说法正确。
B、反应物只有一种的反应不一定是分解反应,如氧气→臭氧,故选项说法错误。
C、有的化合反应也是氧化反应,如碳+氧气二氧化碳,故选项说法正确。
D、物质与氧气的反应一定属于氧化反应,故选项说法正确。
故选:B。
12.【解答】解:复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,可能生成酸碱盐,也可能生成氧化物,如酸碱发生复分解反应生成盐和水,水是氧化物;复分解反应不能生成的物质是单质。
故选:D。
13.【解答】解:根据化学反应绿色化”就是要求原料物质中的所有原子完全被利用,全部转入期望的产物中。
A、反应后有两种产物,并没有达到原料物质中的所有原子完全利用,全部转入期望产物,故A错误;
B、反应后有三种产物,并没有达到原料物质中的所有原子完全利用,全部转入期望产物,故B错误;
C、反应后只有一种产物,原料物质完全被利用,故C正确;
D、反应后有三种产物,并没有达到原料物质中的所有原子完全利用,全部转入期望产物,故D错误;
故选:C。
14.【解答】解:A、物质与氧气发生的反应都是氧化反应,但氧化反应不一定要有氧气参加,如氢气和氧化铜反应生成铜和水,氢气发生了氧化反应,故选项推理错误。
B、单质是由同种元素组成的纯净物,单质是由一种元素组成的物质,但由一种元素组成的物质不一定是单质,也可能是混合物,如氧气和臭氧的混合物、金刚石和石墨的混合物等,故选项推理错误。
C、中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故选项推理错误。
D、碱性溶液能使酚酞试液变红,则能使酚酞试液变红的溶液一定呈碱性,故选项推理正确。
故选:D。
15.【解答】解:向该溶液中滴加Ba(OH)2溶液,不能立即产生沉淀,说明溶液中不含有硫酸,一段时间后产生沉淀,是因为氢氧化钡先和盐酸反应,后和氯化镁反应,因此溶液中含有盐酸、氯化镁,溶液中含有盐酸,则不含有氢氧化钠,是因为盐酸和氢氧化钠不能共存,因此HCl和MgCl2一定有。
故选:C。
二.填空题(共8小题)
16.【解答】解:由微观反应示意图可知,该反应是由氨气和氧气在点燃的条件下反应生成氮气和水,化学方程式为4NH3+3O22N2+6H2O。
(1)氧化物是由两种元素组成,且其中一种元素是氧元素的化合物,所以水属于氧化物;故填:D;
(2)该反应是由一种单质与一种化合物反应生成另一种单质与另一种化合物,所以该反应属于置换反应;故填:置换反应。
17.【解答】解:(1)硫酸铜和铁反应生成铜和硫酸亚铁,属于置换反应;故答案为:置换;
(2)甲烷和氧气在点燃的条件下生成二氧化碳和水,配平即可;故答案为:CH4+2O2 CO2+2H2O。
18.【解答】解:(1)从四大基本反应类型看,硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,该反应属于复分解反应。
(2)硫酸根离子和钡离子结合生成硫酸钡沉淀,反应后硫酸根离子和钡离子消失,、、、表示不同的种类的离子,则表示SO42﹣。
故答案为:(1)复分解反应。
(2)SO42﹣。
19.【解答】解:(1)由化学方程式可知,该反应是由一种物质生成两种新物质,属于分解反应;故答案为:分解反应;
(2)合成甲醇需要一氧化碳和氢气的分子个数比为1:2,反应②生成的一氧化碳和氢气的分子个数比为1:2,故从原料配比角度比较方法①和②,更适宜用于合成甲醇的方法是②,故答案为:②。
20.【解答】解:(1)盐酸与氢氧化钠反应的微观实质是 氢离子和氢氧根离子结合成水分子。
(2)HCl气体通入NaOH溶液,氯化氢气体溶于水形成盐酸,盐酸和氢氧化钠反应生成氯化钠和水,反应的实质是氢离子和氢氧根离子结合生成水分子,由试管中溶液的离子种类图,反应前溶液中有钠离子和氢氧根离子,氢氧根离子能使无色酚酞试液变红,氢氧根离子与氢离子结合成水分子,反应后消失,R所以表示的是氢氧根离子,故填②;是反应后增加的离子,是Cl﹣。
故答案为:
(1)氢离子和氢氧根离子结合成水分子;
(2)②;Cl﹣。
21.【解答】解:(1)比较反应物和生成物的特点,可归纳出这3个反应都是一种单质和一种化合物反应生成了另一种单质和另一种化合物,基本反应类型都属置换反应。
(2)上述3个反应都属于氧化还原反应,其中反应②中H2夺取了氧化铜钟的氧,属于还原剂。
故答案为:(1)置换反应;
(2)还原剂。
22.【解答】解:(1)分析①所处的位置可知它是属于氧化还原反应中的一种基本反应类型,因为氧化还原反应在反应前后有元素化合价发生变化,所以考虑基本反应类型中的置换反应,因为置换反应有单质参与和单质生成,所以一定有化合价变化,所以①代表的基本反应类型是置换反应,则②应该是复分解反应;
(2)不属于四种基本反应类型,但属于氧化还原反应的反应一定是有单质生成或参与,但不会是置换反应;如有机物的燃烧等反应;
答案:
(1)置换反应;
(2)CH4+2O2CO2+2H2O(或CO+CuO Cu+CO2)
23.【解答】解:(1)镁和硫酸反应生成硫酸镁和氢气,属于置换反应;硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,属于复分解反应;碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应;二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,不属于反应基本类型,所以相邻间物质能发生复分解反应的个数是2;
(2)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,能达到目的的顺序是③⑤①②④或⑤③①②④;
(3)二氧化碳和氢氧化钠反应生成碳酸钠和水,氢氧化钠和盐酸反应生成氯化钠和水,盐酸和铝反应生成氯化铝和氢气,铝和氧气反应生成氧化铝,所以从左到右依次是氢氧化钠、盐酸、铝、氧气,从高到低依次排列,排在倒数第二个台阶上的物质名称是:铝;
(4)用pH 试纸测定溶液酸碱度的操作是:用玻璃棒蘸取少量待测液滴在试纸上,再与标准比色卡对比读数。
故答案为:(1)2;
(2)③⑤①②④或⑤③①②④;
(3)铝;
(4)用玻璃棒蘸取少量待测液滴在试纸上,再与标准比色卡对比读数。
三.实验探究题(共3小题)
24.【解答】解:(1)当加入稀硫酸时,硫酸与氢氧化钠反应,溶液碱性逐渐变弱,pH减小;
(2)氢氧化钙的溶解度随温度的升高而降低,饱和石灰水变浑浊,说明氢氧化钠与盐酸反应能放出热量;
(3)反应若放出热量,则会使烧瓶中的气体受热而膨胀,所以若观察到烧杯内的导管口有气泡产生,则说明中和反应放热。
故答案为:
(1)减小;
(2)饱和石灰水变浑浊,说明氢氧化钠与盐酸反应能放出热;
(3)烧杯内的导管口有气泡产生。
25.【解答】解:(1)碳酸钠溶液滴加到稀盐酸中,反应生成氯化钠和二氧化碳和水,因此试管①中可观察到的现象是有无色气体产生;
(2)试管①中,碳酸钠溶液滴加到稀盐酸中,反应生成氯化钠和二氧化碳和水,试管②中,氢氧化钙与碳酸钠反应得到碳酸钙白色沉淀和氢氧化钠,通过试管①和②两组实验,可以初步得出复分解反应发生的条件是生成物中有沉淀或气体或水生成,反应即可发生;
(3)酚酞遇碱变红,遇酸不变色;为了证明试管③中发生了复分解反应,还需要在氢氧化钙溶液中加入酚酞才便于观察;
(4)碳酸钠与氯化钙反应得到碳酸钙白色沉淀,而氯化钠与氯化钙不反应;兴趣小组的同学将试管①反应后的物质过滤,取滤液少量置于试管中,加入CaCl2溶液,有白色沉淀产生,则滤液中溶质的成分为碳酸钠和氯化钠的混合物。
故答案为:
(1)无色气体产生;
(2)生成物中有沉淀或气体或水生成,反应即可发生;
(3)氢氧化钙;
(4)碳酸钠和氯化钠。
26.【解答】解:(1)锡的燃烧反应方程式为:Sn+O2SnO2,其属于基本反应类型中的化合反应。
故答案为:化合反应。
(2)产物SnO2中氧元素化合价是﹣2,根据化合物中元素化合价代数和为零可知,锡元素的化合价为+4。
故答案为:+4。
(3)罗蒙诺索夫分析数据后,提出了“参加化学反应的物质的总质量,等于反应后产物的总质量”的观点。则支持该观点的证据是白色固体SnO2的质量m3=m4﹣m2(反应的氧气质量)+m1。
故答案为:m4﹣m2+m1。
第1页(共1页)
一.选择题(共15小题)
1.温州轻轨工程正在建设中,工程技术人员利用铝热剂燃烧释放大量的热来焊接铁轨。点燃铝热剂反应的化学方程式为:2Al+Fe2O3Al2O3+2Fe.该反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
2.如图所示的化学反应基本类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3.芯片是“智能家电”的核心部件,它是以高纯度单质硅为材料制成的。制取高纯硅的化学方程式为:①SiO2+2CSi(粗)+2CO↑ ②Si(粗)+2Cl2SiCl4 ③SiCl4+2H2Si(纯)+4HCl。下列说法正确的是( )
A.反应①中,CO是还原剂
B.反应①②③都属于置换反应
C.反应②③的目的是将粗硅提纯
D.反应①②③不需要隔绝空气进行
4.在MgMgSO4Mg(OH)2MgO的各步转化中,反应所属的基本反应类型不包括( )
A.化合反应 B.复分解反应
C.置换反应 D.分解反应
5.下列属于复分解反应类型的是( )
A.Mg+2HCl=MgCl2+H2↑
B.Cu(OH)2+H2SO4=CuSO4+2H2O
C.3Fe+2O2Fe3O4
D.2KMnO4K2MnO4+MnO2+O2↑
6.如图是一款变色眼镜,在使用期限内眼镜质量保持不变。它的镜片内含有溴化银(AgBr)和氧化铜(CuO)。在室外强光照射下,溴化银转化成单质溴(Br2)和银(Ag),镜片颜色变暗棕色;在室内光线较暗处,单质溴和银在氧化铜催化下重新生成溴化银,镜片颜色又变浅。在使用期限内小金佩戴该眼镜后( )
A.从室内走到室外,镜片中物质发生化合反应
B.从室外走进室内,银元素的化合价降低
C.室内生成溴化银的质量一定大于室外分解溴化银的质量
D.无论环境明暗如何变化,氧化铜的质量始终不变
7.下列与Na2O+H2O=2NaOH属于同一基本反应类型的是( )
A.Fe+SFeS
B.Zn+2HCl=ZnCl2+H2↑
C.NaOH+HCl=NaCl+H2O
D.CaCO3CaO+CO2↑
8.工业用盐中含有的亚硝酸钠(NaNO2)是一种有毒物质,利用 NH4Cl溶液可使NaNO2转化为无毒物质。该反应分两步进行:①NaNO2+NH4Cl═NaCl+NH4NO2②NH4NO2═N2↑+2H2O
下列叙述不正确的是( )
A.NH4NO2由三种元素组成
B.反应①为复分解反应,反应②为分解反应
C.利用 NH4Cl 处理NaNO2最终转化为NaCl、N2和H2O
D.上述反应所涉及的物质中,氮元素的化合价有四种
9.芯片是电脑“智能家电”的核心部件,它是以高纯度的单质硅(Si)为材料制成的。硅及其氧化物能发生如下反应:
①Si+O2SiO2 ②Si+2NaOH+X═Na2SiO3+2H2↑
③SiO2+2CSi+2CO↑ ④SiO2+Na2CO3Na2SiO3+CO2↑
下列说法错误的是( )
A.④属于复分解反应
B.Na2SiO3中Si的化合价为+4价
C.②中X的化学式为H2O
D.Si和SiO2在一定条件下可以相互转化
10.2022年春晚的舞蹈诗剧《只此青绿》还原了北宋名画《千里江山图)。画中用到的矿物颜料有石绿。石绿主要成分是CuCO3 Cu(OH)2,CuCO3 Cu(OH)2受热易分解生成三种氧化物(石绿中其它成分不参与化学反应)。下列说法不正确的是( )
A.石绿加热分解能得到一种黑色固体
B.石绿溶于水可配成绿色溶液
C.石绿能与稀硫酸发生复分解反应
D.《千里江山图》应低温、干燥保存
11.下列关于各反应类型,说法不正确的是( )
A.氧化反应都要放出热量
B.反应物只有一种的反应一定是分解反应
C.有的化合反应也是氧化反应
D.物质与氧气的反应一定属于氧化反应
12.复分解反应不能生成的物质是( )
①单质 ②氧化物 ③酸 ④碱 ⑤盐
A.①② B.②④ C.③⑤ D.①
13.“绿色化学”是21世纪化学发展的主导方向,要求从根本上杜绝污染.它包括“原料绿色化”、“化学反应绿色化”、“产品绿色化”等内容.其中“化学反应绿色化”要求原料物质中的所有原子完全被利用,全部转入期望的产物中.下列符合“化学反应绿色化”要求的是( )
A.制取氢气:Zn+H2SO4=ZnSO4+H2↑
B.制取氧气:2KMnO4? K2MnO4+MnO2+O2↑
C.制取碳酸氢铵:CO2+H2O+NH3=NH4HCO3
D.制取氨气:(NH4)2SO4+Ca(OH)2?═CaSO4+2NH3↑+2H2O
14.推理是一种重要的学习方法。下列推理中正确的是( )
A.物质与氧气发生的反应都是氧化反应,则氧化反应一定要有氧气参加
B.单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质
C.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
D.碱性溶液能使酚酞试液变红,则能使酚酞试液变红的溶液一定呈碱性
15.某溶液溶质可能是NaOH、HCl、H2SO4、MgCl2的一种或几种。向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量(Y)与加入Ba(OH)2溶液质量(X)的关系如图所示,下列有关溶质组成的说法正确的是( )
A.HCl和H2SO4一定有
B.H2SO4和MgCl2一定有,NaOH一定无
C.HCl和MgCl2一定有
D.HCl一定有,NaOH、H2SO4一定无,MgCl2可能有
二.填空题(共8小题)
16.在一定条件下,A+B→C+D。反应前后分子种类变化的微观示意图如图所示。回答以下问题:
(1)A、B、C、D表示的四种物质中,属于氧化物的是 (填字母序号)。
(2)该反应的基本反应类型为 。
17.中国古代化学工艺历史悠久、成就卓越,是劳动人民生产、生活智慧的结晶。
(1)东汉《神农本草经》曾记载石胆“能化铁为铜”。叙述的是用硫酸铜和铁反应制取铜,这是湿法炼铜的最早记载,此反应属于 (填反应类型)。
(2)西晋《蜀都赋》中有“火井沈荧于幽谷,高焰飞煽于天垂。”描写的是天然气(主要成分是甲烷)燃烧时的现象,请写出甲烷燃烧的化学方程式 。
18.小滨向Na2SO4溶液中滴入硝酸钡溶液至恰好完全反应。
(1)从四大基本反应类型看,该反应属于 ;
(2)若反应前后溶液中存在的离子种类如图所示,其中:
、、、表示不同的种类的离子,则表示 (填离子符号)。
19.中国是全球第一个实现在海域“可燃冰”试开采中获得连续稳定产气的国家。“可燃冰”是甲烷和水在低温、高压条件下形成的水合物(CH4 nH2O)。
(1)在常温常压下,“可燃冰”会发生反应:CH4 nH2O=CH4+nH2O,该反应属于 。(填基本反应类型);
(2)甲烷可制成合成气(CO、H2),再制成甲醇(CH3OH),代替日益供应紧张的燃油。由合成气制甲醇的反应方程式为:CO+2H2CH3OH,由甲烷制成合成气有两种方法:
①CH4+H2OCO+3H2
②2CH4+O22CO+4H2
从原料配比角度比较方法①和②,更适宜用于合成甲醇的方法是 (填序号)。
20.HCl气体通入水中可得盐酸溶液,室温下,将HCl气体通入盛有NaOH溶液的试管中,直至溶液的pH=7。请回答下列问题:
(1)该反应的实质是 。
(2)HCl气体通入NaOH溶液前后,试管中溶液的离子种类如图所示,其中能使无色酚酞试液变红的是 (选填“①”“②”或“③”),③表示 离子。
21.对知识的比较和归纳是学习科学的重要方法之一.现有以下3个反应的化学方程式:
①CuSO4+Fe=Cu+FeSO4②CuO+H2Cu+H2O③SiO2+2CSi+2CO↑
(1)比较反应物和生成物的特点,可归纳出这3个反应的基本反应类型都属于 .
(2)上述3个反应都属于氧化还原反应,其中反应②中H2属于 (选填“氧化剂或还原剂”)
22.在反应前后有元素化合价发生变化的化学反应都属于氧化﹣还原反应.如图是化学兴趣小组通过自主学习构建的四种基本反应类型与氧化﹣还原反应的关系图.根据此图我能回答下列问题:
(1)①代表的基本反应类型是 ;
(2)任意写出一个不属于四种基本反应类型,但属于氧化﹣还原反应的化学方程式 .
23.如图为“领取奖杯游戏”的物质阶梯。当阶梯上相邻的物质之间能发生反应,方可向上攀登。例如,攀登阶梯甲能领取奖杯。
(1)甲阶梯上有5种物质,相邻间物质能发生复分解反应的个数是 。
(2)为除去Na2SO4、MgCl2、CaCl2,并得到中性的食盐溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量的NaOH 溶液,④加适量的稀 HCl,⑤加过量的BaCl2溶液,能达到目的的顺序是 。
(3)搭建阶梯乙,请你从O2、Al、Al2O3、HCl、NaOH 中选择4种物质放到台阶上,从高到低依次排列,排在倒数第二个台阶上的物质名称是: (从上往下的顺序)。
(4)用pH 试纸测定溶液酸碱度的操作是 。
三.实验探究题(共3小题)
24.酸和碱反应是放热反应吗?三位同学为探究此问题行了下列实验:
(1)甲同学取10mL10%的NaOH溶液于试管中,逐滴加入10%的稀硫酸,随着稀硫酸的加入,烧杯中溶液温度与加入硫酸体积之间的变化关系如甲图所示。从A到B点的过程中,试管中溶液的pH值逐渐 (选填“增大”或“减小”)。
(2)乙同学按乙图装置进行实验,其中利用了饱和石灰水的性质是 。
(3)丙同学按丙图实验,可以根据 现象也能证明酸碱反应是放热的。
25.某校科学兴趣小组的同学利用稀盐酸、碳酸钠、Ca(OH)2溶液三种物质探究“复分解反应发生的条件”,做了如图①②③的实验。请回答有关问题:
(1)试管①中可观察到的现象是 。
(2)通过试管①和②两组实验,可以初步得出复分解反应发生的条件是 。
(3)为了证明试管③中发生了复分解反应,还需要在 溶液中加入酚酞才便于观察。
(4)兴趣小组的同学将试管①反应后的物质过滤,取滤液少量置于试管中,加入CaCl2溶液,有白色沉淀产生,则滤液中溶质的成分为 。
26.为探索物质在化学变化前后的质量关系,科学家做了大量实验。
探究1:1663年,英国化学家波义耳将金属锡放在密闭容器里煅烧后立即打开容器盖进行称量,结果发现反应后的固体质量增加了,得出的结论是物质的总质量增加了。
探究2:1756年,俄国化学家罗蒙诺索夫重做了波义耳的实验。
①先用天平称取质量为m1的金属锡粉;
②将锡粉放在密闭容器里进行完全燃烧,生成了白色固体SnO2,称量容器的总质量为m2;
③打开容器,听到了空气进入容器发出的“丝丝的声响”。取出SnO2称量质量为m3;
④冷却后,把SnO2放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4;
结合上述科学探究完成下列问题:
(1)锡的燃烧反应方程式为:Sn+O2SnO2,其属于基本反应类型中的 。
(2)产物SnO2中锡元素的化合价为 。
(3)罗蒙诺索夫分析数据后,提出了“参加化学反应的物质的总质量,等于反应后产物的总质量”的观点。则支持该观点的证据是白色固体SnO2的质量m3= 。(注:用探究2中的相关表示质量的字母来表述)
2025中考科学备考集训42:常见的化学反应
参考答案与试题解析
题号 1 2 3 4 5 6 7 8 9 10 11
答案 C C C A B D A D A B B
题号 12 13 14 15
答案 D C D C
一.选择题(共15小题)
1.【解答】解:点燃铝热剂反应的化学方程式为:2Al+Fe2O3Al2O3+2Fe,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应。
故选:C。
2.【解答】解:该反应由一种单质生成了另一种单质,属于基本类型中的置换反应。
故选:C。
3.【解答】解:A、反应①中,碳夺取了二氧化硅中的氧,具有还原性,是该反应的还原剂,CO是产物,故A错误;
B、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,反应①③都是一种单质与一种化合物反应,生成另一种单质和另一种化合物,都属于置换反应,反应②属于化合反应,故B错误。
C、通过反应①得到的是粗硅,通过反应②③得到了纯净的硅,所以②③的目的是将粗硅提纯,故C正确;
D、反应①中的碳会与氧气反应,需要隔绝空气进行,故D错误。
故选:C。
4.【解答】解:镁和硫酸反应生成MgSO4和氢气,属于置换反应;MgSO4和NaOH反应生成Mg(OH)2和Na2SO4,属于复分解反应;Mg(OH)2在加热的条件下生成MgO,属于分解反应;因此在各步转化中,没有化合反应,
故选:A。
5.【解答】解:A、Mg+2HCl=MgCl2+H2↑,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项错误。
B、Cu(OH)2+H2SO4=CuSO4+2H2O,该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,故选项正确。
C、3Fe+2O2Fe3O4,该反应符合“多变一”的形式,符合化合反应的特征,属于化合反应,故选项错误。
D、2KMnO4K2MnO4+MnO2+O2↑,该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应,故选项错误。
故选:B。
6.【解答】解:A、从室内走到室外,在室外强光照射下,溴化银转化成单质溴(Br2)和银(Ag),该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应,故选项说法错误。
B、从室外走进室内,在室内光线较暗处,单质溴和银在氧化铜催化下重新生成溴化银,银元素的化合价由0价变为+1价,故选项说法错误。
C、由质量守恒定律,反应前后银元素的质量不变,室内生成溴化银的质量等于室外分解溴化银的质量,故选项说法错误。
D、由题意,在室内光线较暗处,单质溴和银在氧化铜催化下重新生成溴化银,反应前后催化剂的质量不变,无论环境明暗如何变化,氧化铜的质量始终不变,故选项说法正确。
故选:D。
7.【解答】解:Na2O+H2O═2NaOH是由两种物质生成一种新物质的化合反应。
A、该反应为两种物质反应生成一种物质,属于化合反应,正确;
B、该反应为一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应,错误;
C、该反应为由两种化合物互相交换成分,生成另外两种化合物,属于复分解反应,错误;
D、该反应为一种物质分解成两种其他物质,属于分解反应,错误。
故选:A。
8.【解答】解:A、NH4NO2是由氮、氢、氧三种元素组成,故A正确;
B、NaNO2+NH4Cl═NaCl+NH4NO2是两种化合物相互交换成分生成另外的两种化合物,属于复分解反应,而NH4NO2═N2↑+2H2O是属于一变多的分解反应,故B正确;
C、根据反应①②可知NH4Cl 处理NaNO2最终转化为NaCl、N2和H2O,故C正确;
D、NaNO2中氮元素的化合价为+3价,NH4NO2中氮元素的化合价分别为﹣3价、+3价,NH4Cl中氮元素的化合价为﹣3价,而N2中氮元素的化合价为0价,所以上述反应所涉及的物质中,氮元素的化合价有三种,故D错误。
故选:D。
9.【解答】解:A、④中不是两种化合物相互交换成分生成另外两种新的化合物,不属于复分解反应,该选项不正确。
B、Na2SiO3中钠元素化合价是+1,氧元素化合价是﹣2,根据化合物中元素化合价代数和为零可知,Si的化合价为+4价,该选项正确。
C、Si+2NaOH+X═Na2SiO3+2H2↑中,反应前后硅原子都是1个,钠原子都是2个,反应后氧原子是3个,反应前应该是3个,其中1个包含在未知物质中,反应后氢原子是4个,反应前应该是4个其中2个包含在未知物质中,X的化学式为H2O,该选项正确。
D、Si和SiO2在一定条件下可以相互转化,该选项正确。
故选:A。
10.【解答】解:石绿主要成分是CuCO3 Cu(OH)2,受热易分解生成氧化铜、水和二氧化碳三种氧化物。
A、石绿加热分解生成氧化铜,氧化铜为黑色固体,故A正确;
B、石绿难溶于水,不可配成绿色溶液,故B不正确;
C、石绿主要成分是CuCO3 Cu(OH)2,能与稀硫酸发生复分解反应,故C正确;
D、石绿受热易分解,《千里江山图》应低温、干燥保存,故D正确;
故选:B。
11.【解答】解:A、氧化反应都要放出热量,故选项说法正确。
B、反应物只有一种的反应不一定是分解反应,如氧气→臭氧,故选项说法错误。
C、有的化合反应也是氧化反应,如碳+氧气二氧化碳,故选项说法正确。
D、物质与氧气的反应一定属于氧化反应,故选项说法正确。
故选:B。
12.【解答】解:复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,可能生成酸碱盐,也可能生成氧化物,如酸碱发生复分解反应生成盐和水,水是氧化物;复分解反应不能生成的物质是单质。
故选:D。
13.【解答】解:根据化学反应绿色化”就是要求原料物质中的所有原子完全被利用,全部转入期望的产物中。
A、反应后有两种产物,并没有达到原料物质中的所有原子完全利用,全部转入期望产物,故A错误;
B、反应后有三种产物,并没有达到原料物质中的所有原子完全利用,全部转入期望产物,故B错误;
C、反应后只有一种产物,原料物质完全被利用,故C正确;
D、反应后有三种产物,并没有达到原料物质中的所有原子完全利用,全部转入期望产物,故D错误;
故选:C。
14.【解答】解:A、物质与氧气发生的反应都是氧化反应,但氧化反应不一定要有氧气参加,如氢气和氧化铜反应生成铜和水,氢气发生了氧化反应,故选项推理错误。
B、单质是由同种元素组成的纯净物,单质是由一种元素组成的物质,但由一种元素组成的物质不一定是单质,也可能是混合物,如氧气和臭氧的混合物、金刚石和石墨的混合物等,故选项推理错误。
C、中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故选项推理错误。
D、碱性溶液能使酚酞试液变红,则能使酚酞试液变红的溶液一定呈碱性,故选项推理正确。
故选:D。
15.【解答】解:向该溶液中滴加Ba(OH)2溶液,不能立即产生沉淀,说明溶液中不含有硫酸,一段时间后产生沉淀,是因为氢氧化钡先和盐酸反应,后和氯化镁反应,因此溶液中含有盐酸、氯化镁,溶液中含有盐酸,则不含有氢氧化钠,是因为盐酸和氢氧化钠不能共存,因此HCl和MgCl2一定有。
故选:C。
二.填空题(共8小题)
16.【解答】解:由微观反应示意图可知,该反应是由氨气和氧气在点燃的条件下反应生成氮气和水,化学方程式为4NH3+3O22N2+6H2O。
(1)氧化物是由两种元素组成,且其中一种元素是氧元素的化合物,所以水属于氧化物;故填:D;
(2)该反应是由一种单质与一种化合物反应生成另一种单质与另一种化合物,所以该反应属于置换反应;故填:置换反应。
17.【解答】解:(1)硫酸铜和铁反应生成铜和硫酸亚铁,属于置换反应;故答案为:置换;
(2)甲烷和氧气在点燃的条件下生成二氧化碳和水,配平即可;故答案为:CH4+2O2 CO2+2H2O。
18.【解答】解:(1)从四大基本反应类型看,硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,该反应属于复分解反应。
(2)硫酸根离子和钡离子结合生成硫酸钡沉淀,反应后硫酸根离子和钡离子消失,、、、表示不同的种类的离子,则表示SO42﹣。
故答案为:(1)复分解反应。
(2)SO42﹣。
19.【解答】解:(1)由化学方程式可知,该反应是由一种物质生成两种新物质,属于分解反应;故答案为:分解反应;
(2)合成甲醇需要一氧化碳和氢气的分子个数比为1:2,反应②生成的一氧化碳和氢气的分子个数比为1:2,故从原料配比角度比较方法①和②,更适宜用于合成甲醇的方法是②,故答案为:②。
20.【解答】解:(1)盐酸与氢氧化钠反应的微观实质是 氢离子和氢氧根离子结合成水分子。
(2)HCl气体通入NaOH溶液,氯化氢气体溶于水形成盐酸,盐酸和氢氧化钠反应生成氯化钠和水,反应的实质是氢离子和氢氧根离子结合生成水分子,由试管中溶液的离子种类图,反应前溶液中有钠离子和氢氧根离子,氢氧根离子能使无色酚酞试液变红,氢氧根离子与氢离子结合成水分子,反应后消失,R所以表示的是氢氧根离子,故填②;是反应后增加的离子,是Cl﹣。
故答案为:
(1)氢离子和氢氧根离子结合成水分子;
(2)②;Cl﹣。
21.【解答】解:(1)比较反应物和生成物的特点,可归纳出这3个反应都是一种单质和一种化合物反应生成了另一种单质和另一种化合物,基本反应类型都属置换反应。
(2)上述3个反应都属于氧化还原反应,其中反应②中H2夺取了氧化铜钟的氧,属于还原剂。
故答案为:(1)置换反应;
(2)还原剂。
22.【解答】解:(1)分析①所处的位置可知它是属于氧化还原反应中的一种基本反应类型,因为氧化还原反应在反应前后有元素化合价发生变化,所以考虑基本反应类型中的置换反应,因为置换反应有单质参与和单质生成,所以一定有化合价变化,所以①代表的基本反应类型是置换反应,则②应该是复分解反应;
(2)不属于四种基本反应类型,但属于氧化还原反应的反应一定是有单质生成或参与,但不会是置换反应;如有机物的燃烧等反应;
答案:
(1)置换反应;
(2)CH4+2O2CO2+2H2O(或CO+CuO Cu+CO2)
23.【解答】解:(1)镁和硫酸反应生成硫酸镁和氢气,属于置换反应;硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,属于复分解反应;碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应;二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,不属于反应基本类型,所以相邻间物质能发生复分解反应的个数是2;
(2)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,能达到目的的顺序是③⑤①②④或⑤③①②④;
(3)二氧化碳和氢氧化钠反应生成碳酸钠和水,氢氧化钠和盐酸反应生成氯化钠和水,盐酸和铝反应生成氯化铝和氢气,铝和氧气反应生成氧化铝,所以从左到右依次是氢氧化钠、盐酸、铝、氧气,从高到低依次排列,排在倒数第二个台阶上的物质名称是:铝;
(4)用pH 试纸测定溶液酸碱度的操作是:用玻璃棒蘸取少量待测液滴在试纸上,再与标准比色卡对比读数。
故答案为:(1)2;
(2)③⑤①②④或⑤③①②④;
(3)铝;
(4)用玻璃棒蘸取少量待测液滴在试纸上,再与标准比色卡对比读数。
三.实验探究题(共3小题)
24.【解答】解:(1)当加入稀硫酸时,硫酸与氢氧化钠反应,溶液碱性逐渐变弱,pH减小;
(2)氢氧化钙的溶解度随温度的升高而降低,饱和石灰水变浑浊,说明氢氧化钠与盐酸反应能放出热量;
(3)反应若放出热量,则会使烧瓶中的气体受热而膨胀,所以若观察到烧杯内的导管口有气泡产生,则说明中和反应放热。
故答案为:
(1)减小;
(2)饱和石灰水变浑浊,说明氢氧化钠与盐酸反应能放出热;
(3)烧杯内的导管口有气泡产生。
25.【解答】解:(1)碳酸钠溶液滴加到稀盐酸中,反应生成氯化钠和二氧化碳和水,因此试管①中可观察到的现象是有无色气体产生;
(2)试管①中,碳酸钠溶液滴加到稀盐酸中,反应生成氯化钠和二氧化碳和水,试管②中,氢氧化钙与碳酸钠反应得到碳酸钙白色沉淀和氢氧化钠,通过试管①和②两组实验,可以初步得出复分解反应发生的条件是生成物中有沉淀或气体或水生成,反应即可发生;
(3)酚酞遇碱变红,遇酸不变色;为了证明试管③中发生了复分解反应,还需要在氢氧化钙溶液中加入酚酞才便于观察;
(4)碳酸钠与氯化钙反应得到碳酸钙白色沉淀,而氯化钠与氯化钙不反应;兴趣小组的同学将试管①反应后的物质过滤,取滤液少量置于试管中,加入CaCl2溶液,有白色沉淀产生,则滤液中溶质的成分为碳酸钠和氯化钠的混合物。
故答案为:
(1)无色气体产生;
(2)生成物中有沉淀或气体或水生成,反应即可发生;
(3)氢氧化钙;
(4)碳酸钠和氯化钠。
26.【解答】解:(1)锡的燃烧反应方程式为:Sn+O2SnO2,其属于基本反应类型中的化合反应。
故答案为:化合反应。
(2)产物SnO2中氧元素化合价是﹣2,根据化合物中元素化合价代数和为零可知,锡元素的化合价为+4。
故答案为:+4。
(3)罗蒙诺索夫分析数据后,提出了“参加化学反应的物质的总质量,等于反应后产物的总质量”的观点。则支持该观点的证据是白色固体SnO2的质量m3=m4﹣m2(反应的氧气质量)+m1。
故答案为:m4﹣m2+m1。
第1页(共1页)
同课章节目录
