安徽省示范高中培优联盟2024-2025学年高二上学期12月冬季联赛化学试题(含答案)
文档属性
| 名称 | 安徽省示范高中培优联盟2024-2025学年高二上学期12月冬季联赛化学试题(含答案) |  | |
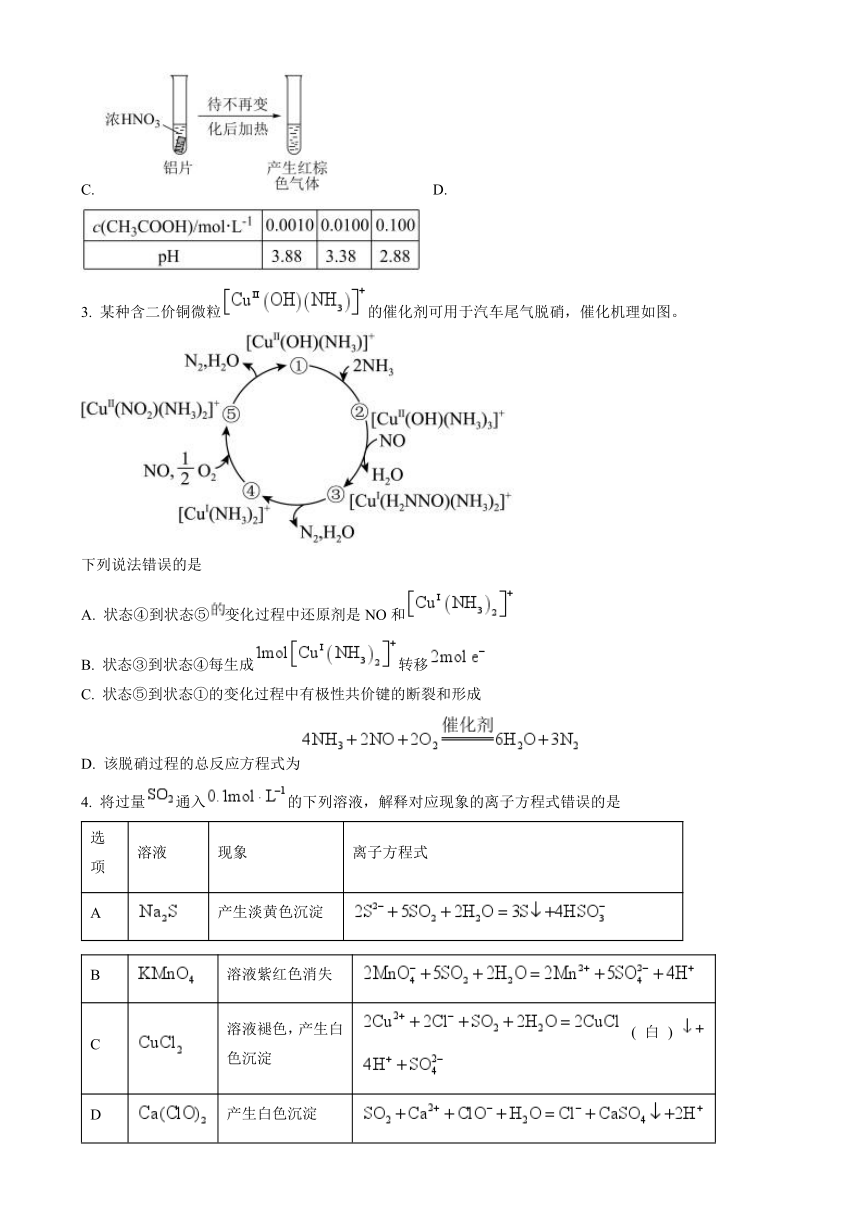
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-19 09:47:24 | ||
图片预览




文档简介
安徽省示范高中培优联盟2024年冬季联赛(高二)
化学
本试卷分选择题和非选择题两部分,选择题第1至第6页,非选择题第7至第10页。全卷满分100分,考试时间75分钟。
考生注意事项:
1.答题前,务必在试题卷、答题卡规定的地方填写自己的姓名、座位号,并认真核对答题卡上所粘贴的条形码中姓名、座位号与本人姓名、座位号是否一致。
2.答选择题时,每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
3.答非选择题时,必须使用0.5毫米的黑色墨水签字笔在答题卡上书写,要求字体工整、笔迹清晰。作图题可先用铅笔在答题卡规定的位置绘出,确认后再用0.5毫米的黑色墨水签字笔描清楚。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上答题无效。
4.考试结束,务必将试题卷和答题卡一并上交。
可能用到的相对原子质量:H-1 N-14 O-16 Mg-24 S-32 Cl-35.5 Cu-64 Ba-137
一、选择题(本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。)
1. 文物见证历史,化学创造文明。安徽出土的下列文物中其主要成分不能与其他三项归为一类的是
选项 A B C D
文物图示
选项 肥西兽面纹铜斝 南陵青铜龙耳尊 含山玉版 寿县铸客大鼎
A. A B. B C. C D. D
2. 下列事实不能用平衡移动原理解释的是
A. B.
C. D.
3. 某种含二价铜微粒的催化剂可用于汽车尾气脱硝,催化机理如图。
下列说法错误的是
A. 状态④到状态⑤变化过程中还原剂是NO和
B. 状态③到状态④每生成转移
C. 状态⑤到状态①的变化过程中有极性共价键的断裂和形成
D. 该脱硝过程的总反应方程式为
4. 将过量通入的下列溶液,解释对应现象的离子方程式错误的是
选项 溶液 现象 离子方程式
A 产生淡黄色沉淀
B 溶液紫红色消失
C 溶液褪色,产生白色沉淀 (白)
D 产生白色沉淀
A. A B. B C. C D. D
5. 氨是一种重要的化工产品和化工原料,下图为合成氨以及氨氧化制硝酸的流程示意图。
下列说法错误的是
A. R比较容易与反应
B. 氧化炉中发生的反应为:
C. 向吸收塔中通入R气体,有利于提高硝酸的产率
D. 工业生产中了盛装大量浓硝酸,可选择铁作为罐体材料
6. 和存在平衡: 。下列分析正确的是
A. 1mol平衡混合气体含有2mol N原子
B. 断裂中的共价键所需能量大于断裂中的共价键所需能量
C. 恒温时,缩小容积,的转化率增大,是平衡正向移动导致的
D. 恒容时,水浴加热,气体颜色变浅,是平衡正向移动导致的
7. 用如图装置(夹持装置略)进行实验,由b中现象能证明a中产物生成的是
a中反应 b中检测试剂及现象
A 浓与C生成 澄清石灰水变浑浊
B 浓HCl与生成 溶液产生白色沉淀
C 分解生成 淀粉—KI溶液变蓝
D 浓NaOH和溶液生成 酚酞溶液变红
A. A B. B C. C D. D
8. “碳达峰、碳中和”是我国社会发展重大战略之一。氧化制备可减少的排放并实现资源利用,发生如下两个反应:
I.
Ⅱ.
向容积为10L的密闭容器中投入和,不同温度下,测得5min时(反应均未平衡)的相关数据见下表,下列说法错误的是
温度(℃) 400 500 600
乙烷转化率(%) 2.0 9.0 17.8
乙烯选择性(%) 92.0 800 61.8
注:
A. 反应活化能:I>Ⅱ
B. 时,5min时的转化率为:
C. 时,反应T的平均速率为:
D. 其他条件不变,增大投料比[]投料,平衡后乙烷的转化率下降
9. 我国古籍记载了硫酸的制备方法——“炼石胆()取精华法”。借助现代仪器分析,该制备过程中分解的TG曲线(热重)如下图所示。
下列说法错误的是
A. 发生反应:
B. c点固体的成分主要是:CuO
C. ,固体分解的产物中可能含有:、、
D. 时,CuO的稳定性小于
10. 同位素在科研中具有重要的用途。氘代氨()可用于研究某些反应机理。下列两种方法均可得到:①与反应;②与的水解反应。
下列说法错误的是
A. 的空间结构为V形
B. 与的化学性质基本相同
C. 方法①得到的产品纯度比方法②的高
D. 方法②的化学方程式是
11. 常温下水溶液体系中存在反应:。已知初始浓度,溶液中所有含碳微粒的物质的量分数()与pH变化关系如图所示(忽略溶液体积变化)。下列说法错误的是
A. P点:
B. 的电离平衡常数:
C. 点:
D. 时:
12. 钴及其化合物在工业、电子、电讯等领域都有着广阔的应用前景。一种从炼锌产生的废渣(主要含钴、锌、铅、铁、锰的+2价氧化物或单质)中提取钴的工艺如下:
已知:溶液中相关离子开始沉淀和沉淀完全()时的pH:
开始沉淀的pH 1.5 6.9 — 7.4 6.2
沉淀完全的pH 2.8 8.4 1.1 9.4 8.2
下列说法错误的是
A. 滤渣2的主要成份是
B. “沉锰”步骤中,生成产生的物质的量为0.4mol
C. 氧化沉钴的离子方程式:
D. 滤液中
13. 工业上以为原料生产。现有含的、溶液,含的、溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。
已知:
下列说法错误的是
A. 曲线①代表含的溶液的变化曲线
B. p点
C. 反应的平衡常数
D. 对含且和初始浓度均为的混合溶液,时发生沉淀转化
14. 某同学进行如下实验:
序号 实验① 实验② 实验③ 实验④ 实验⑤
方案
现象 出现白色沉淀 无明显现象 出现白色沉淀 产生气泡,高锰酸钾溶液不褪色 出现白色沉淀
已知:是一种白色难溶于水的固体
下列说法不合理的是
A. 实验①生成白色沉淀的反应属于复分解反应
B. 实验②、③可证明显弱酸性
C. 实验⑤的白色沉淀经检验为,说明溶解度
D. 可用、检验长期放置的中是否含有
二、非选择题(本大题共4小题,共58分。)
15. 是一种重要的工业原料,可采用不同的方法制备。我国目前氨的生产能力居世界首位。
(1)早期以氯化铵和熟石灰制备,反应的化学方程式为:_______。
(2)根据下图所示的能量转换关系,、合成的热化学方程式为:_______。
(3)在和的条件下,以铁触媒为催化剂由和合成氨。
①该反应放热,但仍选择较高温度。其原因是:_______。
②对和的反应进行研究:在容积可变的密闭容器中,充入和进行反应。在不同压强下(、、),反应达到平衡时,测得的体积分数()随温度的变化如图所示。解释A点的容器容积大于B点的容器容积的原因:_______。
(4)某种分解制备氨,转化关系如图,其中b、d代表或MgO中的一种。
①b的化学式为:_______。
②该转化过程中会生成副产物,结合化学方程式解释通入水蒸气可减少的产生原因:_______。
(5)和为原料直接合成能耗高,科研人员利用氯化镁循环法(MCC)合成氨。
选用试剂a完成转化。
①选用进行转化。将置于中能释放出。
②选用固体进行转化。依据MCC法合成氨的过程(如图),写出MCC法合成氨的总反应方程式:_______。
③测量的转化率:取固体、的混合物,混匀,充分反应。生成的与的恰好完全反应。的转化率为:_______。
16. 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应I化学反应方程式:_______
(2)反应Ⅱ:
①该反应能自发进行的条件是:_______。(填字母)
A.低温 B.高温
②一定压强下,与的投料比[]对平衡体系中转化率影响如下:
时,解释平衡转化率随投料比增大而降低的可能原因:_______。
(3)可以作为水溶液中歧化反应的催化剂。可能的催化过程如下:
i.
ii._______。(用离子方程式表示)
(4)探究i、ii反应速率与歧化反应速率的关系,实验如下:分别将饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:易溶解在KI溶液中)
序号 A B C D
试剂组成
实验现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较A快 无明显现象 溶液由棕褐色很快裡色,变成黄色,出现浑浊较A快
①D是A的对比实验,则_______。
②比较A、B、C,可得出的结论是:_______。
③实验表明,的歧化反应速率,结合i、ii反应速率解释原因:_______。
17. 铅酸蓄电池电压稳定、使用方便、安全可靠、价格低廉,因此在生产、生活中使用广泛。
(1)铅酸蓄电池的构造如图所示。
已知:铅酸蓄电池放电时发生反应:
①放电时,Pb为_______极。
②正极的电极反应式:_______。
(2)以废旧铅酸电池中的含铅废料(主要含、以及少量PbO和Pb)为原料制备PbO,实现铅的再生利用,流程示意图如下。
已知:、
①“脱硫”过程中需不断搅拌,其目的是:_______。
②溶浸过程中,转化为的化学反应有:和_______。
③足量分别和等物质的量的、混合进行脱硫,测定相同时间内脱硫率随反应温度的变化如下图。
i.图中曲线_______(填“a”或“b”)表示的脱硫曲线。
ii.曲线a对应的脱硫率在时最大,可能的原因是:_______。
iii.结合平衡常数解释选择曲线a对应物质脱硫的原因是:_______。
iv.相同温度时曲线b的脱硫率低于曲线a的脱硫率,结合与、反应的离子方程式解释原因:_______。
v.用实现的再生和的循环利用,设计方案:取溶液B,_______。
18. 某实验小组以BaS溶液为原料制备,并测定产品中的含量。设计实验方案如下:
可选用试剂:NaCl晶体、BaS溶液、浓、稀、溶液、蒸馏水
Ⅰ.的制备
按如图所示装置进行实验,得到溶液,经一系列步骤获得产品
Ⅱ.的含量测定
①称取产品m g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入过量的热溶液(杂质不参与反应);
③沉淀完全后,水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为n g。
回答下列问题:
(1)仪器a的名称是:_______,仪器b的作用是:_______。
(2)Ⅰ中发生的主要化学反应方程式是:______,该反应利用了试剂c的酸性和______性。
(3)Ⅲ中发生反应的离子方程式主要是:_______。
(4)下图为配制溶液部分过程,操作X应重复次,目的是:_______,定容后还需要的操作为:_______。
(5)沉淀完全后,检验沉淀用蒸馏水洗涤干净的方法是:_______。
(6)产品中的质量分数是:_______。
安徽省示范高中培优联盟2024年冬季联赛(高二)
化学
一、选择题(本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。)
1.
【答案】C
2.
【答案】C
3.
【答案】D
4.
【答案】D
5.
【答案】B
6.
【答案】C
7.
【答案】D
8.
【答案】A
9.
【答案】B
10.
【答案】C
11.
【答案】C
12.
【答案】D
13.
【答案】B
14.
【答案】D
二、非选择题(本大题共4小题,共58分。)
15.
【答案】(1)
(2)
(3) ①. 温度高,化学反应速率加快(催化剂在该温度下活性高) ②. 该反应放热,且正反应的气体分子数减少,B点的温度大于A点的温度,为使两点的的体积分数相同,需增大压强,故B点的容积小于A点的容积。(或:该反应为气体分子数减小的放热反应,图中B点温度高于A点,且A,B两点的的体积分数相等,由图分析知,故压强对容器体积的影响比温度的影响大,所以)
(4) ①. ②.
(5) ①. ②. (或)
16.
【答案】(1)
(2) ①. A ②. 一定压强下,相比于浓度增加,浓度的减小对平衡的影响更大,不利于的转化
(3)
(4) ①. 0.0002 ②. 是歧化反应的催化剂,单独存在不具有催化作用,但可以加快歧化反应速率 ③. 反应ii比i快,D中由反应ii产生的使反应加快
17.
【答案】(1) ①. 负 ②.
(2) ①. 增大反应物接触面积,提高反应速率。(或使不覆盖于表面阻止反应) ②. ③. a ④. 温度小于时,随温度增加,脱硫速率加快,单位时间内脱硫率增大;温度大于时,随温度增加,碳酸铵分解,溶液中降低,脱硫速率减小,单位时间内脱硫率减小 ⑤. ,反应完全 ⑥. 用脱硫时发生反应:,用脱硫时发生反应:,未完全转化为沉淀 ⑦. 加入,过滤,向滤液中通入分解产生的
18.
【答案】(1) ①. 分液漏斗 ②. 防倒吸
(2) ①. (浓)(或(浓)) ②. 难挥发
(3)
(4) ①. 将玻璃棒和烧杯中的残留硫酸全部转移到容量瓶中(或减少硫酸损失) ②. 盖好瓶塞,反复上下颠倒容量瓶,将溶液混合均匀
(5)取最后一次洗涤液,加入酸化的溶液无现象
(6)(或)
化学
本试卷分选择题和非选择题两部分,选择题第1至第6页,非选择题第7至第10页。全卷满分100分,考试时间75分钟。
考生注意事项:
1.答题前,务必在试题卷、答题卡规定的地方填写自己的姓名、座位号,并认真核对答题卡上所粘贴的条形码中姓名、座位号与本人姓名、座位号是否一致。
2.答选择题时,每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
3.答非选择题时,必须使用0.5毫米的黑色墨水签字笔在答题卡上书写,要求字体工整、笔迹清晰。作图题可先用铅笔在答题卡规定的位置绘出,确认后再用0.5毫米的黑色墨水签字笔描清楚。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上答题无效。
4.考试结束,务必将试题卷和答题卡一并上交。
可能用到的相对原子质量:H-1 N-14 O-16 Mg-24 S-32 Cl-35.5 Cu-64 Ba-137
一、选择题(本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。)
1. 文物见证历史,化学创造文明。安徽出土的下列文物中其主要成分不能与其他三项归为一类的是
选项 A B C D
文物图示
选项 肥西兽面纹铜斝 南陵青铜龙耳尊 含山玉版 寿县铸客大鼎
A. A B. B C. C D. D
2. 下列事实不能用平衡移动原理解释的是
A. B.
C. D.
3. 某种含二价铜微粒的催化剂可用于汽车尾气脱硝,催化机理如图。
下列说法错误的是
A. 状态④到状态⑤变化过程中还原剂是NO和
B. 状态③到状态④每生成转移
C. 状态⑤到状态①的变化过程中有极性共价键的断裂和形成
D. 该脱硝过程的总反应方程式为
4. 将过量通入的下列溶液,解释对应现象的离子方程式错误的是
选项 溶液 现象 离子方程式
A 产生淡黄色沉淀
B 溶液紫红色消失
C 溶液褪色,产生白色沉淀 (白)
D 产生白色沉淀
A. A B. B C. C D. D
5. 氨是一种重要的化工产品和化工原料,下图为合成氨以及氨氧化制硝酸的流程示意图。
下列说法错误的是
A. R比较容易与反应
B. 氧化炉中发生的反应为:
C. 向吸收塔中通入R气体,有利于提高硝酸的产率
D. 工业生产中了盛装大量浓硝酸,可选择铁作为罐体材料
6. 和存在平衡: 。下列分析正确的是
A. 1mol平衡混合气体含有2mol N原子
B. 断裂中的共价键所需能量大于断裂中的共价键所需能量
C. 恒温时,缩小容积,的转化率增大,是平衡正向移动导致的
D. 恒容时,水浴加热,气体颜色变浅,是平衡正向移动导致的
7. 用如图装置(夹持装置略)进行实验,由b中现象能证明a中产物生成的是
a中反应 b中检测试剂及现象
A 浓与C生成 澄清石灰水变浑浊
B 浓HCl与生成 溶液产生白色沉淀
C 分解生成 淀粉—KI溶液变蓝
D 浓NaOH和溶液生成 酚酞溶液变红
A. A B. B C. C D. D
8. “碳达峰、碳中和”是我国社会发展重大战略之一。氧化制备可减少的排放并实现资源利用,发生如下两个反应:
I.
Ⅱ.
向容积为10L的密闭容器中投入和,不同温度下,测得5min时(反应均未平衡)的相关数据见下表,下列说法错误的是
温度(℃) 400 500 600
乙烷转化率(%) 2.0 9.0 17.8
乙烯选择性(%) 92.0 800 61.8
注:
A. 反应活化能:I>Ⅱ
B. 时,5min时的转化率为:
C. 时,反应T的平均速率为:
D. 其他条件不变,增大投料比[]投料,平衡后乙烷的转化率下降
9. 我国古籍记载了硫酸的制备方法——“炼石胆()取精华法”。借助现代仪器分析,该制备过程中分解的TG曲线(热重)如下图所示。
下列说法错误的是
A. 发生反应:
B. c点固体的成分主要是:CuO
C. ,固体分解的产物中可能含有:、、
D. 时,CuO的稳定性小于
10. 同位素在科研中具有重要的用途。氘代氨()可用于研究某些反应机理。下列两种方法均可得到:①与反应;②与的水解反应。
下列说法错误的是
A. 的空间结构为V形
B. 与的化学性质基本相同
C. 方法①得到的产品纯度比方法②的高
D. 方法②的化学方程式是
11. 常温下水溶液体系中存在反应:。已知初始浓度,溶液中所有含碳微粒的物质的量分数()与pH变化关系如图所示(忽略溶液体积变化)。下列说法错误的是
A. P点:
B. 的电离平衡常数:
C. 点:
D. 时:
12. 钴及其化合物在工业、电子、电讯等领域都有着广阔的应用前景。一种从炼锌产生的废渣(主要含钴、锌、铅、铁、锰的+2价氧化物或单质)中提取钴的工艺如下:
已知:溶液中相关离子开始沉淀和沉淀完全()时的pH:
开始沉淀的pH 1.5 6.9 — 7.4 6.2
沉淀完全的pH 2.8 8.4 1.1 9.4 8.2
下列说法错误的是
A. 滤渣2的主要成份是
B. “沉锰”步骤中,生成产生的物质的量为0.4mol
C. 氧化沉钴的离子方程式:
D. 滤液中
13. 工业上以为原料生产。现有含的、溶液,含的、溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。
已知:
下列说法错误的是
A. 曲线①代表含的溶液的变化曲线
B. p点
C. 反应的平衡常数
D. 对含且和初始浓度均为的混合溶液,时发生沉淀转化
14. 某同学进行如下实验:
序号 实验① 实验② 实验③ 实验④ 实验⑤
方案
现象 出现白色沉淀 无明显现象 出现白色沉淀 产生气泡,高锰酸钾溶液不褪色 出现白色沉淀
已知:是一种白色难溶于水的固体
下列说法不合理的是
A. 实验①生成白色沉淀的反应属于复分解反应
B. 实验②、③可证明显弱酸性
C. 实验⑤的白色沉淀经检验为,说明溶解度
D. 可用、检验长期放置的中是否含有
二、非选择题(本大题共4小题,共58分。)
15. 是一种重要的工业原料,可采用不同的方法制备。我国目前氨的生产能力居世界首位。
(1)早期以氯化铵和熟石灰制备,反应的化学方程式为:_______。
(2)根据下图所示的能量转换关系,、合成的热化学方程式为:_______。
(3)在和的条件下,以铁触媒为催化剂由和合成氨。
①该反应放热,但仍选择较高温度。其原因是:_______。
②对和的反应进行研究:在容积可变的密闭容器中,充入和进行反应。在不同压强下(、、),反应达到平衡时,测得的体积分数()随温度的变化如图所示。解释A点的容器容积大于B点的容器容积的原因:_______。
(4)某种分解制备氨,转化关系如图,其中b、d代表或MgO中的一种。
①b的化学式为:_______。
②该转化过程中会生成副产物,结合化学方程式解释通入水蒸气可减少的产生原因:_______。
(5)和为原料直接合成能耗高,科研人员利用氯化镁循环法(MCC)合成氨。
选用试剂a完成转化。
①选用进行转化。将置于中能释放出。
②选用固体进行转化。依据MCC法合成氨的过程(如图),写出MCC法合成氨的总反应方程式:_______。
③测量的转化率:取固体、的混合物,混匀,充分反应。生成的与的恰好完全反应。的转化率为:_______。
16. 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应I化学反应方程式:_______
(2)反应Ⅱ:
①该反应能自发进行的条件是:_______。(填字母)
A.低温 B.高温
②一定压强下,与的投料比[]对平衡体系中转化率影响如下:
时,解释平衡转化率随投料比增大而降低的可能原因:_______。
(3)可以作为水溶液中歧化反应的催化剂。可能的催化过程如下:
i.
ii._______。(用离子方程式表示)
(4)探究i、ii反应速率与歧化反应速率的关系,实验如下:分别将饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:易溶解在KI溶液中)
序号 A B C D
试剂组成
实验现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较A快 无明显现象 溶液由棕褐色很快裡色,变成黄色,出现浑浊较A快
①D是A的对比实验,则_______。
②比较A、B、C,可得出的结论是:_______。
③实验表明,的歧化反应速率,结合i、ii反应速率解释原因:_______。
17. 铅酸蓄电池电压稳定、使用方便、安全可靠、价格低廉,因此在生产、生活中使用广泛。
(1)铅酸蓄电池的构造如图所示。
已知:铅酸蓄电池放电时发生反应:
①放电时,Pb为_______极。
②正极的电极反应式:_______。
(2)以废旧铅酸电池中的含铅废料(主要含、以及少量PbO和Pb)为原料制备PbO,实现铅的再生利用,流程示意图如下。
已知:、
①“脱硫”过程中需不断搅拌,其目的是:_______。
②溶浸过程中,转化为的化学反应有:和_______。
③足量分别和等物质的量的、混合进行脱硫,测定相同时间内脱硫率随反应温度的变化如下图。
i.图中曲线_______(填“a”或“b”)表示的脱硫曲线。
ii.曲线a对应的脱硫率在时最大,可能的原因是:_______。
iii.结合平衡常数解释选择曲线a对应物质脱硫的原因是:_______。
iv.相同温度时曲线b的脱硫率低于曲线a的脱硫率,结合与、反应的离子方程式解释原因:_______。
v.用实现的再生和的循环利用,设计方案:取溶液B,_______。
18. 某实验小组以BaS溶液为原料制备,并测定产品中的含量。设计实验方案如下:
可选用试剂:NaCl晶体、BaS溶液、浓、稀、溶液、蒸馏水
Ⅰ.的制备
按如图所示装置进行实验,得到溶液,经一系列步骤获得产品
Ⅱ.的含量测定
①称取产品m g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入过量的热溶液(杂质不参与反应);
③沉淀完全后,水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为n g。
回答下列问题:
(1)仪器a的名称是:_______,仪器b的作用是:_______。
(2)Ⅰ中发生的主要化学反应方程式是:______,该反应利用了试剂c的酸性和______性。
(3)Ⅲ中发生反应的离子方程式主要是:_______。
(4)下图为配制溶液部分过程,操作X应重复次,目的是:_______,定容后还需要的操作为:_______。
(5)沉淀完全后,检验沉淀用蒸馏水洗涤干净的方法是:_______。
(6)产品中的质量分数是:_______。
安徽省示范高中培优联盟2024年冬季联赛(高二)
化学
一、选择题(本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。)
1.
【答案】C
2.
【答案】C
3.
【答案】D
4.
【答案】D
5.
【答案】B
6.
【答案】C
7.
【答案】D
8.
【答案】A
9.
【答案】B
10.
【答案】C
11.
【答案】C
12.
【答案】D
13.
【答案】B
14.
【答案】D
二、非选择题(本大题共4小题,共58分。)
15.
【答案】(1)
(2)
(3) ①. 温度高,化学反应速率加快(催化剂在该温度下活性高) ②. 该反应放热,且正反应的气体分子数减少,B点的温度大于A点的温度,为使两点的的体积分数相同,需增大压强,故B点的容积小于A点的容积。(或:该反应为气体分子数减小的放热反应,图中B点温度高于A点,且A,B两点的的体积分数相等,由图分析知,故压强对容器体积的影响比温度的影响大,所以)
(4) ①. ②.
(5) ①. ②. (或)
16.
【答案】(1)
(2) ①. A ②. 一定压强下,相比于浓度增加,浓度的减小对平衡的影响更大,不利于的转化
(3)
(4) ①. 0.0002 ②. 是歧化反应的催化剂,单独存在不具有催化作用,但可以加快歧化反应速率 ③. 反应ii比i快,D中由反应ii产生的使反应加快
17.
【答案】(1) ①. 负 ②.
(2) ①. 增大反应物接触面积,提高反应速率。(或使不覆盖于表面阻止反应) ②. ③. a ④. 温度小于时,随温度增加,脱硫速率加快,单位时间内脱硫率增大;温度大于时,随温度增加,碳酸铵分解,溶液中降低,脱硫速率减小,单位时间内脱硫率减小 ⑤. ,反应完全 ⑥. 用脱硫时发生反应:,用脱硫时发生反应:,未完全转化为沉淀 ⑦. 加入,过滤,向滤液中通入分解产生的
18.
【答案】(1) ①. 分液漏斗 ②. 防倒吸
(2) ①. (浓)(或(浓)) ②. 难挥发
(3)
(4) ①. 将玻璃棒和烧杯中的残留硫酸全部转移到容量瓶中(或减少硫酸损失) ②. 盖好瓶塞,反复上下颠倒容量瓶,将溶液混合均匀
(5)取最后一次洗涤液,加入酸化的溶液无现象
(6)(或)
同课章节目录
