2.3 建构原子模型 同步练习(第2课时,含解析)
文档属性
| 名称 | 2.3 建构原子模型 同步练习(第2课时,含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 139.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-01-19 20:53:19 | ||
图片预览



文档简介
2.3建构原子模型(第二课时)
一、选择题
1.2023年10月3日,我国科学家发现战略性关键金属新矿物——铌包头矿。铌包头矿富含铌等元素。铌原子的核电荷数为41,相对原子质量为93,则该原子核内的质子数为( )
A.41 B.42 C.93 D.134
2.如图天平右盘中一个“▲”为一个C﹣12原子质量的1/12,据图推测A原子的相对原子质量是( )
A.9 B.9克 C.12 D.12克
3.下列说法正确的是( )
①分子是保持物质性质的一种微粒; ②原子是不能再分的一种微粒;③镁原子与镁离子的化学性质不同; ④构成氯化钠的氯化钠离子在不断运动
A.①② B.②③ C.①②④ D.③
4.金属铯(Cs)制造真空件器、光电管等的重要材料。已知铯原子的相对原子质量为133,其质子数为55,则铯原子的核外电子为( )
A.55 B.78 C.133 D.188
5.2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子
A.含有2个质子
B.核电荷数为1
C.相对原子质量为4
D.质子数和中子数相等
6.一个碳-12原子的质量为m,一个甲原子的质量为n,则甲原子的相对原子质量为( )
A. B. C. D.
7.下列有关分子、原子和离子的说法正确的是( )
A.分子的质量一定都比原子大
B.带电的微粒都称为离子
C.分子、原子、离子都可以直接构成物质
D.原子是实心球体,是最小的微粒,不能再分
8.某微粒核外有18个电子,核内有16个质子和16个中子,该微粒是( )
A.原子 B.分子 C.阳离子 D.阴离子
9.如图为氯化钠形成的微观模型图。关于氯化钠的形成,下列表述正确的是( )
A.氯化钠由钠原子和氯原子构成
B.钠原子失去电子变成阳离子
C.钠原子失去电子、氯原子得到电子后相互吸引,构成氯化钠分子
D.有些氯化钠带正电,有些氯化钠带负电,聚合在一起构成电中性的氯化钠
10.2017年5月,中国科学院等相关部门正式定名了4种元素,其中2种元素的信息如表。据此能得出的推论是( )
原子序数 中文名称 符号 相对原子质量
113 鉨 Nh 284
115 镆 Mc 288
A.鉨原子的中子数113
B.镆原子的核电荷数为288
C.镆原子比鉨原子核外多2个电子
D.镆原子比鉨原子质量大4g
二、填空题
11.已知氧原子的相对原子质量为16,银原子的相对原子质量为108,若银原子的实际质量为m克,则氧原子的实际质量可以表示为 。
12.氧的原子核带8个单位正电荷,核外有_________个电子。氧的原子量为16,这种氧的原子核中有__ _个质子和___ __个中子。
13.在①分子、②原子、③原子核、④质子、⑤中子、⑥电子等粒子中,找出符合下列条件的,把相应的序号填在横线上。
(1)在同一原子中数目一定相等的粒子是 ;
(2)不显电性的粒子是 ;
(3)上述粒子中质量最小的粒子是 ;
(4)带正电荷的是 ;
(5)化学变化中一定发生变化的微粒 。
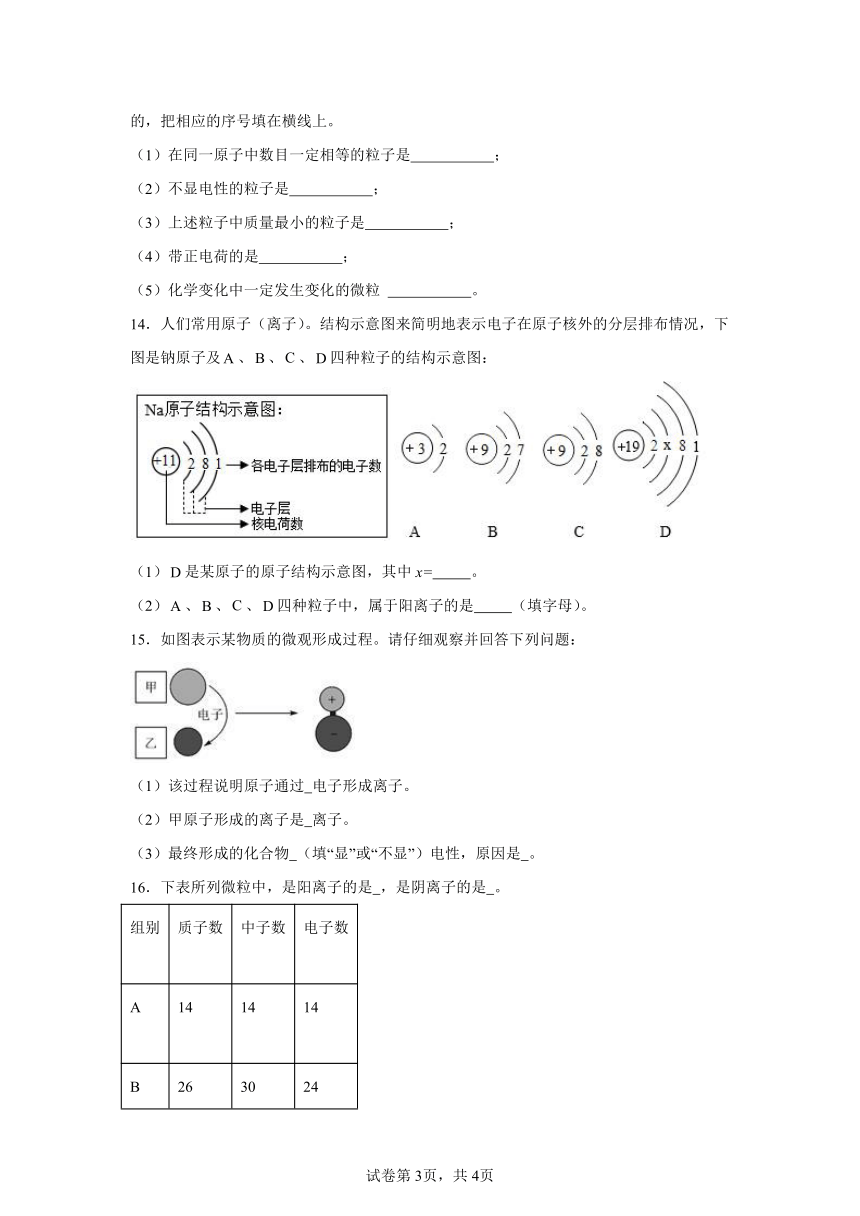
14.人们常用原子(离子)。结构示意图来简明地表示电子在原子核外的分层排布情况,下图是钠原子及、、、四种粒子的结构示意图:
(1)是某原子的原子结构示意图,其中x= 。
(2)、、、四种粒子中,属于阳离子的是 (填字母)。
15.如图表示某物质的微观形成过程。请仔细观察并回答下列问题:
(1)该过程说明原子通过 电子形成离子。
(2)甲原子形成的离子是 离子。
(3)最终形成的化合物 (填“显”或“不显”)电性,原因是 。
16.下表所列微粒中,是阳离子的是 ,是阴离子的是 。
组别 质子数 中子数 电子数
A 14 14 14
B 26 30 24
C 26 30 26
D 8 8 10
17.完成下表的填写
粒子名称 质子数 电子数 粒子所带电荷
氯原子 17 不带电
氯离子 17 18
钠原子 11
钠离子 11 带1个单位正电荷
试卷第1页,共3页
试卷第1页,共3页
《2.3建构原子模型(第二课时)》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 A A D A B A C D B C
1.A
【详解】原子中,原子序数=质子数=核外电子数=核电荷数,铌原子的核电荷数为41,质子数为41.
故选A。
2.A
【详解】原子的相对原子质量=,天平右盘中“▲”为一个C-12原子质量的,则A原子的质量是一个C-12原子质量的的9倍,相对原子质量单位是“1”,不是“g”,常省略不写,一个C-12原子质量的相对原子质量为1,则A原子的相对原子质量是9。
故选A。
3.D
【详解】①由分子构成的物质,分子是保持其化学性质的最小微粒,分子是保持物质化学性质的一种微粒,故①错误;
②原子是能再分的一种微粒,可分为原子核和电子,原子是化学变化中的最小微粒,故②错误;
③镁原子与镁离子的最外层电子数不同,因而化学性质不同,故③正确;
④构成氯化钠的钠离子和氯离子在不断运动,故④错误。说法正确的是③。
故选D。
4.A
【详解】因为原子中:核电荷数 =核内质子数= 核外电子数,由题意铯原子核内质子数为 55,故其核外电子数为 55。
故选A。
5.B
【详解】A、根据质子数=核外电子数,可知氚原子含有1个质子,故错误。
B、核电荷数=质子数,据图可知氚原子含有1个质子,因此核电荷数为1,故正确。
C、相对原子质量≈质子数+中子数,据图可知氚原子含有1个质子、2个中子,因此相对原子质量=3,故错误。
D、据图可知氚原子含有1个质子、2个中子,因此质子数和中子数不相等,故错误。
故选B。
6.A
【详解】根据公式:某原子的相对原子质量=。可得:甲原子的相对原子质量=。故选A。
7.C
【详解】A、分子的质量比组成它的原子的质量大,但不是所有分子都比原子大,如铁原子大于氢分子,错误;
B、带电的微粒不一定是离子,如质子,错误;
C、分子、原子、离子都可以直接构成物质,如水由水分子构成,铁由铁原子构成,氯化钠由钠离子和氯离子构成,正确;
D、原子不是实心球体,原子核外有很大空间,且原子可分为原子核和核外电子,错误。
故选C。
8.D
【详解】在原子中,质子带正电,核外电子带负电,某微粒核外有18个电子,16个质子,质子数<核外电子数,所以该微粒带负电,为阴离子。
故选D。
9.B
【详解】A、因氯化钠是阴阳离子通过静电作用形成的化合物,其构成微粒为离子,氯化钠是由钠离子和氯离子构成的物质,故说法错误;
B、由形成过程图可知,钠原子失去1个电子变为阳离子,故说法正确;
C、1个钠离子带一个单位的正电荷,1个氯离子带一个单位的负电荷,则钠离子与氯离子之间相互吸引,构成电中性的氯化钠,故说法错误;
D、1个钠离子带一个单位的正电荷,1个氯离子带一个单位的负电荷,则钠离子与氯离子之间相互吸引,构成电中性的氯化钠,故说法错误。
故选B。
10.C
【详解】A、鉨原子的质子数是113,中子数为284-113=171,选项错误。
B、镆原子的核电荷数为115,相对原子质量是288,选项错误。
C、原子中,核外电子=质子数,镆原子比鉨原子核外多2个电子,这是因为115﹣113=2,选项正确。
D、镆原子比鉨原子相对原子质量大4,质量不是大4g,选项错误。
故选C。
【点睛】原子中,质子数+中子数=相对原子质量。
11.
【详解】已知氧原子的相对原子质量为16,银原子的相对原子质量为108,若银原子的实际质量为m,设氧原子的实际质量是x,根据相对原子质量之比等于原子的实际质量成之比,则, x=。
12.8 8 8
【详解】核内质子数等于核电荷数等于核外电子数,所以氧的原子核带8个单位正电荷,核外有8个电子;由于相对原子质量=质子数+中子数,所以氧的原子核中有8个质子,中子数是:16-8=8.
故答案为8;8;8.
13. ④⑥ ①②⑤ ⑥ ③④ ①
【详解】(1)因为原子不带电,所以在同一原子中数目相等的是质子、电子,故填④⑥。
(2)不显电性的是分子、原子、中子,故填①②⑤。
(3)原子中,电子的质量几乎忽略不计,质量最小的是电子,故填⑥。
(4)带正电荷的是原子核和质子,故填③④。
(5)化学变化的本质是分子分成原子,原子组合成新的分子,所以化学变化中一定改变的是分子,故填①。
14. 8 A
【分析】(1)根据在原子中质子数等于电子数分析x的值;
(2)根据在阳离子中质子数大于电子数分析。
【详解】(1)在原子中质子数等于电子数,所以x=19﹣2﹣8﹣1=8;
(2)质子数>电子数,带正电,是阳离子。在A中,质子数=3>电子数=2,A属于阳离子。
15. 得失 阳 不显 两种离子所带电荷数相同,电性相反
【详解】(1)该过程说明原子通过得失电子形成离子,故填:得失。
(2)甲原子形成的离子带正电,为阳离子,故填:阳。
(3)最终形成的化合物不显电性,原因是两种离子所带电荷数相同,电性相反。
故填:不显;两种离子所带电荷数相同,电性相反。
16.B D
【详解】根据表格提供的数据可以看出,B的质子数大于电子数,属于阳离子,D的质子数小于电子数,属于阴离子。
故填:B;D。
17. 17 带1个单位负电荷 11 不带电 10
【详解】原子中:核电荷数=质子数=核外电子数;
阳离子:核电荷数=质子数>核外电子数;
阴离子:核电荷数=质子数<核外电子数;
故答案为
粒子名称 质子数 电子数 粒子所带电荷
氯原子 17 17 不带电
氯离子 17 18 带1个单位负电荷
钠原子 11 11 不带电
钠离子 11 10 带1个单位正电荷
答案第1页,共2页
答案第1页,共2页
一、选择题
1.2023年10月3日,我国科学家发现战略性关键金属新矿物——铌包头矿。铌包头矿富含铌等元素。铌原子的核电荷数为41,相对原子质量为93,则该原子核内的质子数为( )
A.41 B.42 C.93 D.134
2.如图天平右盘中一个“▲”为一个C﹣12原子质量的1/12,据图推测A原子的相对原子质量是( )
A.9 B.9克 C.12 D.12克
3.下列说法正确的是( )
①分子是保持物质性质的一种微粒; ②原子是不能再分的一种微粒;③镁原子与镁离子的化学性质不同; ④构成氯化钠的氯化钠离子在不断运动
A.①② B.②③ C.①②④ D.③
4.金属铯(Cs)制造真空件器、光电管等的重要材料。已知铯原子的相对原子质量为133,其质子数为55,则铯原子的核外电子为( )
A.55 B.78 C.133 D.188
5.2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子
A.含有2个质子
B.核电荷数为1
C.相对原子质量为4
D.质子数和中子数相等
6.一个碳-12原子的质量为m,一个甲原子的质量为n,则甲原子的相对原子质量为( )
A. B. C. D.
7.下列有关分子、原子和离子的说法正确的是( )
A.分子的质量一定都比原子大
B.带电的微粒都称为离子
C.分子、原子、离子都可以直接构成物质
D.原子是实心球体,是最小的微粒,不能再分
8.某微粒核外有18个电子,核内有16个质子和16个中子,该微粒是( )
A.原子 B.分子 C.阳离子 D.阴离子
9.如图为氯化钠形成的微观模型图。关于氯化钠的形成,下列表述正确的是( )
A.氯化钠由钠原子和氯原子构成
B.钠原子失去电子变成阳离子
C.钠原子失去电子、氯原子得到电子后相互吸引,构成氯化钠分子
D.有些氯化钠带正电,有些氯化钠带负电,聚合在一起构成电中性的氯化钠
10.2017年5月,中国科学院等相关部门正式定名了4种元素,其中2种元素的信息如表。据此能得出的推论是( )
原子序数 中文名称 符号 相对原子质量
113 鉨 Nh 284
115 镆 Mc 288
A.鉨原子的中子数113
B.镆原子的核电荷数为288
C.镆原子比鉨原子核外多2个电子
D.镆原子比鉨原子质量大4g
二、填空题
11.已知氧原子的相对原子质量为16,银原子的相对原子质量为108,若银原子的实际质量为m克,则氧原子的实际质量可以表示为 。
12.氧的原子核带8个单位正电荷,核外有_________个电子。氧的原子量为16,这种氧的原子核中有__ _个质子和___ __个中子。
13.在①分子、②原子、③原子核、④质子、⑤中子、⑥电子等粒子中,找出符合下列条件的,把相应的序号填在横线上。
(1)在同一原子中数目一定相等的粒子是 ;
(2)不显电性的粒子是 ;
(3)上述粒子中质量最小的粒子是 ;
(4)带正电荷的是 ;
(5)化学变化中一定发生变化的微粒 。
14.人们常用原子(离子)。结构示意图来简明地表示电子在原子核外的分层排布情况,下图是钠原子及、、、四种粒子的结构示意图:
(1)是某原子的原子结构示意图,其中x= 。
(2)、、、四种粒子中,属于阳离子的是 (填字母)。
15.如图表示某物质的微观形成过程。请仔细观察并回答下列问题:
(1)该过程说明原子通过 电子形成离子。
(2)甲原子形成的离子是 离子。
(3)最终形成的化合物 (填“显”或“不显”)电性,原因是 。
16.下表所列微粒中,是阳离子的是 ,是阴离子的是 。
组别 质子数 中子数 电子数
A 14 14 14
B 26 30 24
C 26 30 26
D 8 8 10
17.完成下表的填写
粒子名称 质子数 电子数 粒子所带电荷
氯原子 17 不带电
氯离子 17 18
钠原子 11
钠离子 11 带1个单位正电荷
试卷第1页,共3页
试卷第1页,共3页
《2.3建构原子模型(第二课时)》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 A A D A B A C D B C
1.A
【详解】原子中,原子序数=质子数=核外电子数=核电荷数,铌原子的核电荷数为41,质子数为41.
故选A。
2.A
【详解】原子的相对原子质量=,天平右盘中“▲”为一个C-12原子质量的,则A原子的质量是一个C-12原子质量的的9倍,相对原子质量单位是“1”,不是“g”,常省略不写,一个C-12原子质量的相对原子质量为1,则A原子的相对原子质量是9。
故选A。
3.D
【详解】①由分子构成的物质,分子是保持其化学性质的最小微粒,分子是保持物质化学性质的一种微粒,故①错误;
②原子是能再分的一种微粒,可分为原子核和电子,原子是化学变化中的最小微粒,故②错误;
③镁原子与镁离子的最外层电子数不同,因而化学性质不同,故③正确;
④构成氯化钠的钠离子和氯离子在不断运动,故④错误。说法正确的是③。
故选D。
4.A
【详解】因为原子中:核电荷数 =核内质子数= 核外电子数,由题意铯原子核内质子数为 55,故其核外电子数为 55。
故选A。
5.B
【详解】A、根据质子数=核外电子数,可知氚原子含有1个质子,故错误。
B、核电荷数=质子数,据图可知氚原子含有1个质子,因此核电荷数为1,故正确。
C、相对原子质量≈质子数+中子数,据图可知氚原子含有1个质子、2个中子,因此相对原子质量=3,故错误。
D、据图可知氚原子含有1个质子、2个中子,因此质子数和中子数不相等,故错误。
故选B。
6.A
【详解】根据公式:某原子的相对原子质量=。可得:甲原子的相对原子质量=。故选A。
7.C
【详解】A、分子的质量比组成它的原子的质量大,但不是所有分子都比原子大,如铁原子大于氢分子,错误;
B、带电的微粒不一定是离子,如质子,错误;
C、分子、原子、离子都可以直接构成物质,如水由水分子构成,铁由铁原子构成,氯化钠由钠离子和氯离子构成,正确;
D、原子不是实心球体,原子核外有很大空间,且原子可分为原子核和核外电子,错误。
故选C。
8.D
【详解】在原子中,质子带正电,核外电子带负电,某微粒核外有18个电子,16个质子,质子数<核外电子数,所以该微粒带负电,为阴离子。
故选D。
9.B
【详解】A、因氯化钠是阴阳离子通过静电作用形成的化合物,其构成微粒为离子,氯化钠是由钠离子和氯离子构成的物质,故说法错误;
B、由形成过程图可知,钠原子失去1个电子变为阳离子,故说法正确;
C、1个钠离子带一个单位的正电荷,1个氯离子带一个单位的负电荷,则钠离子与氯离子之间相互吸引,构成电中性的氯化钠,故说法错误;
D、1个钠离子带一个单位的正电荷,1个氯离子带一个单位的负电荷,则钠离子与氯离子之间相互吸引,构成电中性的氯化钠,故说法错误。
故选B。
10.C
【详解】A、鉨原子的质子数是113,中子数为284-113=171,选项错误。
B、镆原子的核电荷数为115,相对原子质量是288,选项错误。
C、原子中,核外电子=质子数,镆原子比鉨原子核外多2个电子,这是因为115﹣113=2,选项正确。
D、镆原子比鉨原子相对原子质量大4,质量不是大4g,选项错误。
故选C。
【点睛】原子中,质子数+中子数=相对原子质量。
11.
【详解】已知氧原子的相对原子质量为16,银原子的相对原子质量为108,若银原子的实际质量为m,设氧原子的实际质量是x,根据相对原子质量之比等于原子的实际质量成之比,则, x=。
12.8 8 8
【详解】核内质子数等于核电荷数等于核外电子数,所以氧的原子核带8个单位正电荷,核外有8个电子;由于相对原子质量=质子数+中子数,所以氧的原子核中有8个质子,中子数是:16-8=8.
故答案为8;8;8.
13. ④⑥ ①②⑤ ⑥ ③④ ①
【详解】(1)因为原子不带电,所以在同一原子中数目相等的是质子、电子,故填④⑥。
(2)不显电性的是分子、原子、中子,故填①②⑤。
(3)原子中,电子的质量几乎忽略不计,质量最小的是电子,故填⑥。
(4)带正电荷的是原子核和质子,故填③④。
(5)化学变化的本质是分子分成原子,原子组合成新的分子,所以化学变化中一定改变的是分子,故填①。
14. 8 A
【分析】(1)根据在原子中质子数等于电子数分析x的值;
(2)根据在阳离子中质子数大于电子数分析。
【详解】(1)在原子中质子数等于电子数,所以x=19﹣2﹣8﹣1=8;
(2)质子数>电子数,带正电,是阳离子。在A中,质子数=3>电子数=2,A属于阳离子。
15. 得失 阳 不显 两种离子所带电荷数相同,电性相反
【详解】(1)该过程说明原子通过得失电子形成离子,故填:得失。
(2)甲原子形成的离子带正电,为阳离子,故填:阳。
(3)最终形成的化合物不显电性,原因是两种离子所带电荷数相同,电性相反。
故填:不显;两种离子所带电荷数相同,电性相反。
16.B D
【详解】根据表格提供的数据可以看出,B的质子数大于电子数,属于阳离子,D的质子数小于电子数,属于阴离子。
故填:B;D。
17. 17 带1个单位负电荷 11 不带电 10
【详解】原子中:核电荷数=质子数=核外电子数;
阳离子:核电荷数=质子数>核外电子数;
阴离子:核电荷数=质子数<核外电子数;
故答案为
粒子名称 质子数 电子数 粒子所带电荷
氯原子 17 17 不带电
氯离子 17 18 带1个单位负电荷
钠原子 11 11 不带电
钠离子 11 10 带1个单位正电荷
答案第1页,共2页
答案第1页,共2页
同课章节目录
