2.4 探究物质组成的奥秘 同步练习(第1课时,含解析)
文档属性
| 名称 | 2.4 探究物质组成的奥秘 同步练习(第1课时,含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 76.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-01-19 20:55:03 | ||
图片预览


文档简介
2.4探究物质组成的奥秘(第一课时)
一、选择题
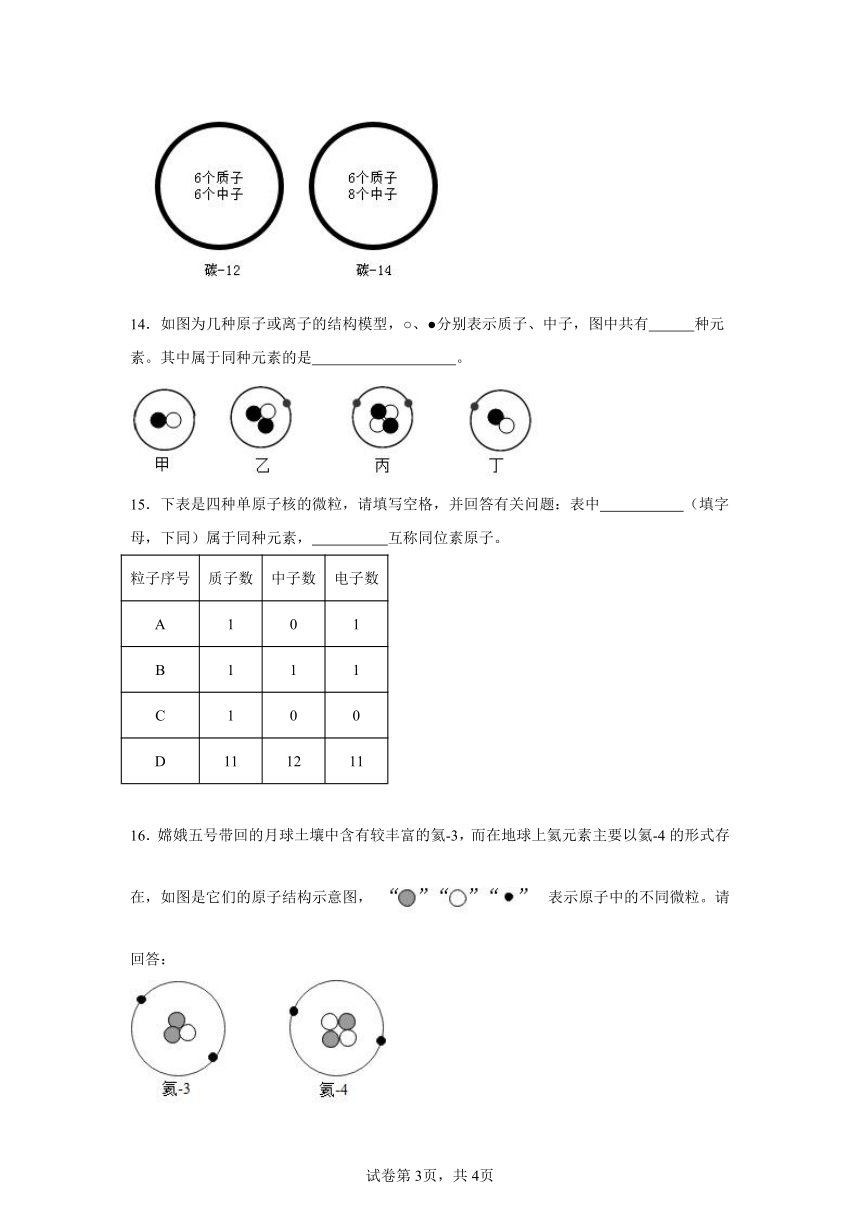
1.青少年正处于身体的迅速生长发育时期,需要适量补充钙、锌等。这里的“钙”“锌”指的是( )
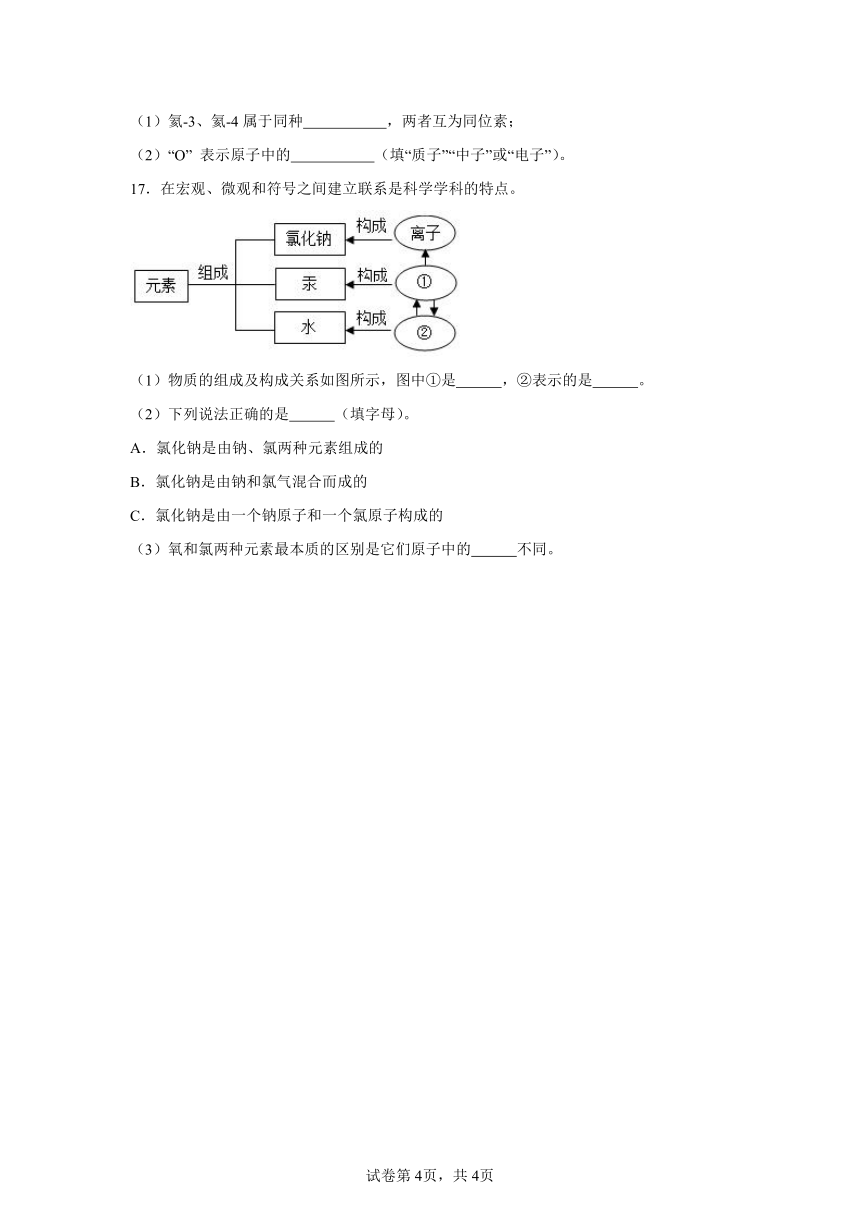
A.单质 B.元素 C.离子 D.原子
2.2024年2月22日央视报道,江西发现新矿物“铈钼易解石”命名获得国际矿物学协会——新矿物命名及分类委员会批准通过。。“铈”、“钼”最本质的区别是( )
A.最外层电子数不同 B.质子数不同
C.中子数不同 D.相对原子质量不同
3.良渚古城遗址被列入世界遗产名录。考古学家通过对有关遗址出土文物中的碳原子含量测定,推测其年代距今年。碳原子与碳原子不同的是( )
A.质子数 B.核电荷数 C.电子数 D.中子数
4.核废水中含有大量的氚,一旦进入人体可能会对人造成辐射损害。氕原子和氚原子结构如图所示,下列说法正确的是( )
氕原子 氚原子
A.氕原子与氚原子相对原子质量相同
B.氕原子与氚原子的核外电子数不同
C.氕原子与氚原子的质子数相同
D.氕原子与氚原子的中子数相同
5.生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。碳-14原子在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子、8个中子 B.氮原子核,含7个质子、7个中子
C.氮原子核,含7个质子、6个中子 D.氧原子核,含7个质子、8个中子
6.有3种不同的原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子。下列说法正确的是( )
A.甲和乙的核电荷数不同 B.甲和乙互为同位素原子
C.乙和丙核外电子数相等 D.乙和丙互为同位素原子
7.2020年 12月 17日,嫦娥五号返回器携带月壤样品回到地球。月壤中蕴含He-3, 它被认为是解决未来能源问题的重要物质之一、地球上的氦元素主要以 He-4 形式存在,He-4 原子核内有2个质子和2个中子,下列说法正确的是( )
A.He-3 原子核中有2个中子 B.He-3 原子核外有3 个电子
C.He-3和He-4是同位素原子 D.He-3 和He-4的原子质量相同
8.一种原子的核内有8个质子和8个中子,另一种原子的核内有8个质子和10个中子,则下列说法中不正确的是( )
A.它们具有相同的核电荷数 B.它们的质量相同
C.它们同属于一种元素 D.它们具有相同的核外电子数
9.氕(H)、氘(H)、氚(H)是氢的三种同位素原子。下列说法正确的是( )
A.氕、氘、氚是三种不同的元素 B.三种原子的质量相等
C.三种原子的核外电子数不同 D.氕原子中的中子数为0
10.下列说法中正确的是( )
A.若两种微粒的电子数相同,它们一定属于同种元素
B.若两种微粒的质子数相同,它们一定属于同种元素
C.若两种微粒属于同种元素,它们的原子核内的质子数一定相同
D.若两种微粒属于同种元素,它们的原子核外的电子数一定相同
二、填空题
11.把具有相同 (即质子数)的同一类原子总称为 。
12.将下列微粒名称(分子、原子、离子、质子、中子、电子)分别填入下列空格中。①上述粒子中质量最小的是 ;②带电的原子或原子团叫 ;③ 是化学变化中的最小微粒。④氕、氘、氚三种原子的_____相同; 不相同,互为同位素;
13.考古学上常听过碳-14 原子测定文物年代,如图所示,碳-14 原子和碳-12 原子同属于碳的 原子,因为它们在原子结构上 相同、 不同。
14.如图为几种原子或离子的结构模型,○、●分别表示质子、中子,图中共有 种元素。其中属于同种元素的是 。
15.下表是四种单原子核的微粒,请填写空格,并回答有关问题:表中 (填字母,下同)属于同种元素, 互称同位素原子。
粒子序号 质子数 中子数 电子数
A 1 0 1
B 1 1 1
C 1 0 0
D 11 12 11
16.嫦娥五号带回的月球土壤中含有较丰富的氦-3,而在地球上氦元素主要以氦-4的形式存在,如图是它们的原子结构示意图,表示原子中的不同微粒。请回答:
(1)氦-3、氦-4属于同种 ,两者互为同位素;
(2)“O” 表示原子中的 (填“质子”“中子”或“电子”)。
17.在宏观、微观和符号之间建立联系是科学学科的特点。
(1)物质的组成及构成关系如图所示,图中①是 ,②表示的是 。
(2)下列说法正确的是 (填字母)。
A.氯化钠是由钠、氯两种元素组成的
B.氯化钠是由钠和氯气混合而成的
C.氯化钠是由一个钠原子和一个氯原子构成的
(3)氧和氯两种元素最本质的区别是它们原子中的 不同。
试卷第1页,共3页
试卷第1页,共3页
《2.4探究物质组成的奥秘(第一课时)》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B B D C B B C B D C
1.B
【详解】这里的“钙”、“锌”指的是不是以单质、分子、原子、离子等形式存在,这里所指的“钙、锌”是强调存在的元素,与具体形态无关。故选B。
2.B
【分析】元素是具有相同质子数(即核电荷数)的一类原子的总称,决定元素种类的是质子数。
【详解】A、决定元素种类的是质子数,不是最外层电子数,故A错误;
B、决定元素种类的是质子数,故B正确 ;
C、决定元素种类的是质子数,不是中子数,故C错误;
D、决定元素种类的是质子数,不是相对原子质量,故D错误。
故选B。
3.D
【详解】A、碳-14原子与碳-12原子均是碳元素形成的原子,它们的质子数相同,故选项错误;
B、原子中核电荷数=核内质子数,碳-14原子与碳-12原子的质子数相同,则核电荷数相同,故选项错误;
C、原子中核电荷数=核内质子数=核外电子数,碳-14原子与碳-12原子的质子数相同,则电子数相同,故选项错误;
D、相对原子质量=质子数+中子数,碳-14原子与碳-12原子的质子数相同,但它们的相对原子质量不同,则它们的中子数一定不同,故选项正确。
故选D。
4.C
【详解】根据题图可知:氕和氚的质子数相同,氕的原子核内没有中子,氚的原子核内有两个中子,它们的核外电子数相同,相对原子质量不同,属于同一种元素。故选C。
5.B
【详解】由于碳-14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核,所以该原子核内的质子数成为7,因此该原子核成为氮原子的原子核,其核内质子数是7中子数也是7。
故选B。
6.B
【详解】A、在原子中质子数等于核电荷数,由甲和乙质子数相等可知甲和乙的核电荷数相同,故说法错误;
B、质子数相同中子数不同的原子互为同位素原子,由题中甲和乙的质子数相同、中子数不同,所以甲和乙互为同位素,故说法正确;
C、在原子中质子数等于核外电子数,由题中乙和丙质子数不同,所以二者的核外电子数不同,故说法错误;
D、质子数相同中子数不同的原子互为同位素原子,由题中乙和丙的质子数不同,所以乙和丙不是互为同位素,故说法错误。
故选B。
7.C
【详解】A、元素是具有相同质子数的一类原子的总称;所以He-3,He-4的原子核中均含有2个质子,He-4原子核内有2个质子和2个中子,则He-3原子核内中子数为3-2=1,错误;
B、原子中,质子数=核外电子数,He-3原子核内有2个质子,核外有2个电子,错误;
C、He-3和He-4是同种元素的两种原子,是同位素原子,正确;
D、原子质量主要集中在原子核,因He-3和He-4的原子的质子数相同,中子数不同,He-3和He-4的原子质量不同,错误。
故选C。
8.B
【详解】A、在原子中,质子数=核电荷数,两种原子的质子数相同,因此它们具有相同的核电荷数,说法正确,不符合题意;
B、原子的质量大小取决于质子和中子数的和的大小,两种原子的质子数相同,中子数不相同,它们的质量不相同,说法错误,符合题意;
C、元素的种类取决于质子数,两种原子的质子数相同,因此它们同属于一种元素,说法正确,不符合题意;
D、在原子中,质子数=核外电子数,两种原子的质子数相同,因此它们具有相同的核外电子数,说法正确,不符合题意。
故选B。
9.D
【详解】A、氕、氘、氚三种原子的质子数都是1,属于同种元素,错误;
B、相对原子质量=质子数+中子数,它们的质子数相同,中子数不同,相对原子质量不同,错误;
C、由于氕、氘、氚三种原子的质子数都为1,原子中,质子数=核外电子数,氕、氘、氚三种原子的核外电子数都为1,错误;
D、中子数=相对原子质量-质子数,氕的中子数=1-1=0,正确。
故选D。
10.C
【详解】A、若两种微粒的核外电子数相同,这两种微粒不一定属于同种元素,如铝离子和镁离子,核外的电子数都是10个,它们属于不同元素,故选项A不符合题意;
B、两种粒子的质子数相同,但这两种粒子不一定属于同种元素,如氢分子和氦原子,它们的质子数均为2个,它们属于不同种元素,故选项B不符合题意;
C、质子数决定元素的种类,若两种微粒属于同种元素,这两种微粒的质子数一定相等,故选项C符合题意;
D、若两种微粒属于同种元素,这两种微粒的核外电子数不一定相等,如氧原子与氧离子属于同种元素,但氧原子核外电子数为8个,氧离子核外电子数为10个,故选项D不符合题意。
故选C。
11. 核电荷数 元素
【详解】化学上把具有相同的核电荷数(或质子数)的同一类原子总称为元素,故填核电荷数,元素。
12.
【详解】①电子的质量很小,可以忽略,所以相对原子质量约为质子数和中子数之和,故答案为电子;
②离子是带电的原子或原子团;故答案为离子;
③原子是化学变化中的最小微粒;故答案为原子;
④同位素是指具有相同核电荷但不同原子质量的原子称为同位素,则同位素的不同原子质子数相同。氕、氘、氚三种原子的质子数相同,中子数不相同,互为同位素;故答案为质子、中子。
13. 同位素 质子数 中子数
【详解】碳-14 原子和碳-12 原子的质子数相同,故同属于碳的同位素原子,它们在原子结构上质子数相同,中子数不同。
14. 2 甲、乙、丁
【详解】由图可知,四个微粒的结构模型中,其中的质子数有的是1,还有的是2,即四个微粒属于2种元素,故填2;
由图可知,微粒甲、乙、丁的质子数均为1,即三个微粒的质子数相同,属于同一种元素,故填甲、乙、丁。
15. ABC AB/BA
【详解】元素指的是质子数相同的一类原子的总称,质子数决定了元素的种类,A、B、C的质子数都是1,为同种元素;
根据具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;ABC的质子数都是1,但C的电子数为0,C不属于原子,是离子,AB的质子数相同,中子数不同,故互称同位素原子的是AB;
16. 元素 中子
【详解】(1)氦-3、氦-4属于同种元素,由于具有相同的质子数和不同中子数,所以两者互为同位素。
(2)氦-3、氦-4具有相同的质子数和不同中子数,根据图片可知,二者原子核都含有2个●,则 ●为质子,而○为中子。
17. 原子 分子 A 质子数或核电荷数
【详解】(1)金属汞由汞原子构成,且原子得到或失去电子后形成离子,所以图中①是原子,故填原子;
水由水分子构成,且分子由原子构成,所以图中②表示的是分子,故填分子。
(2)A 氯化钠是由钠、氯两种元素组成的,选项正确;
B 钠和氯气混合形成混合物,而氯化钠属于纯净物,选项错误;
C 氯化钠是由钠离子和氯离子构成的,选项错误,故填A。
(3)元素是具有相同质子数或核电荷数的一类原子的总称,氧和氯是两种不同的元素,所以两种元素最本质的区别是它们原子中的质子数或核电荷数不同,故填质子数或核电荷数。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.青少年正处于身体的迅速生长发育时期,需要适量补充钙、锌等。这里的“钙”“锌”指的是( )
A.单质 B.元素 C.离子 D.原子
2.2024年2月22日央视报道,江西发现新矿物“铈钼易解石”命名获得国际矿物学协会——新矿物命名及分类委员会批准通过。。“铈”、“钼”最本质的区别是( )
A.最外层电子数不同 B.质子数不同
C.中子数不同 D.相对原子质量不同
3.良渚古城遗址被列入世界遗产名录。考古学家通过对有关遗址出土文物中的碳原子含量测定,推测其年代距今年。碳原子与碳原子不同的是( )
A.质子数 B.核电荷数 C.电子数 D.中子数
4.核废水中含有大量的氚,一旦进入人体可能会对人造成辐射损害。氕原子和氚原子结构如图所示,下列说法正确的是( )
氕原子 氚原子
A.氕原子与氚原子相对原子质量相同
B.氕原子与氚原子的核外电子数不同
C.氕原子与氚原子的质子数相同
D.氕原子与氚原子的中子数相同
5.生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。碳-14原子在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子、8个中子 B.氮原子核,含7个质子、7个中子
C.氮原子核,含7个质子、6个中子 D.氧原子核,含7个质子、8个中子
6.有3种不同的原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子。下列说法正确的是( )
A.甲和乙的核电荷数不同 B.甲和乙互为同位素原子
C.乙和丙核外电子数相等 D.乙和丙互为同位素原子
7.2020年 12月 17日,嫦娥五号返回器携带月壤样品回到地球。月壤中蕴含He-3, 它被认为是解决未来能源问题的重要物质之一、地球上的氦元素主要以 He-4 形式存在,He-4 原子核内有2个质子和2个中子,下列说法正确的是( )
A.He-3 原子核中有2个中子 B.He-3 原子核外有3 个电子
C.He-3和He-4是同位素原子 D.He-3 和He-4的原子质量相同
8.一种原子的核内有8个质子和8个中子,另一种原子的核内有8个质子和10个中子,则下列说法中不正确的是( )
A.它们具有相同的核电荷数 B.它们的质量相同
C.它们同属于一种元素 D.它们具有相同的核外电子数
9.氕(H)、氘(H)、氚(H)是氢的三种同位素原子。下列说法正确的是( )
A.氕、氘、氚是三种不同的元素 B.三种原子的质量相等
C.三种原子的核外电子数不同 D.氕原子中的中子数为0
10.下列说法中正确的是( )
A.若两种微粒的电子数相同,它们一定属于同种元素
B.若两种微粒的质子数相同,它们一定属于同种元素
C.若两种微粒属于同种元素,它们的原子核内的质子数一定相同
D.若两种微粒属于同种元素,它们的原子核外的电子数一定相同
二、填空题
11.把具有相同 (即质子数)的同一类原子总称为 。
12.将下列微粒名称(分子、原子、离子、质子、中子、电子)分别填入下列空格中。①上述粒子中质量最小的是 ;②带电的原子或原子团叫 ;③ 是化学变化中的最小微粒。④氕、氘、氚三种原子的_____相同; 不相同,互为同位素;
13.考古学上常听过碳-14 原子测定文物年代,如图所示,碳-14 原子和碳-12 原子同属于碳的 原子,因为它们在原子结构上 相同、 不同。
14.如图为几种原子或离子的结构模型,○、●分别表示质子、中子,图中共有 种元素。其中属于同种元素的是 。
15.下表是四种单原子核的微粒,请填写空格,并回答有关问题:表中 (填字母,下同)属于同种元素, 互称同位素原子。
粒子序号 质子数 中子数 电子数
A 1 0 1
B 1 1 1
C 1 0 0
D 11 12 11
16.嫦娥五号带回的月球土壤中含有较丰富的氦-3,而在地球上氦元素主要以氦-4的形式存在,如图是它们的原子结构示意图,表示原子中的不同微粒。请回答:
(1)氦-3、氦-4属于同种 ,两者互为同位素;
(2)“O” 表示原子中的 (填“质子”“中子”或“电子”)。
17.在宏观、微观和符号之间建立联系是科学学科的特点。
(1)物质的组成及构成关系如图所示,图中①是 ,②表示的是 。
(2)下列说法正确的是 (填字母)。
A.氯化钠是由钠、氯两种元素组成的
B.氯化钠是由钠和氯气混合而成的
C.氯化钠是由一个钠原子和一个氯原子构成的
(3)氧和氯两种元素最本质的区别是它们原子中的 不同。
试卷第1页,共3页
试卷第1页,共3页
《2.4探究物质组成的奥秘(第一课时)》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B B D C B B C B D C
1.B
【详解】这里的“钙”、“锌”指的是不是以单质、分子、原子、离子等形式存在,这里所指的“钙、锌”是强调存在的元素,与具体形态无关。故选B。
2.B
【分析】元素是具有相同质子数(即核电荷数)的一类原子的总称,决定元素种类的是质子数。
【详解】A、决定元素种类的是质子数,不是最外层电子数,故A错误;
B、决定元素种类的是质子数,故B正确 ;
C、决定元素种类的是质子数,不是中子数,故C错误;
D、决定元素种类的是质子数,不是相对原子质量,故D错误。
故选B。
3.D
【详解】A、碳-14原子与碳-12原子均是碳元素形成的原子,它们的质子数相同,故选项错误;
B、原子中核电荷数=核内质子数,碳-14原子与碳-12原子的质子数相同,则核电荷数相同,故选项错误;
C、原子中核电荷数=核内质子数=核外电子数,碳-14原子与碳-12原子的质子数相同,则电子数相同,故选项错误;
D、相对原子质量=质子数+中子数,碳-14原子与碳-12原子的质子数相同,但它们的相对原子质量不同,则它们的中子数一定不同,故选项正确。
故选D。
4.C
【详解】根据题图可知:氕和氚的质子数相同,氕的原子核内没有中子,氚的原子核内有两个中子,它们的核外电子数相同,相对原子质量不同,属于同一种元素。故选C。
5.B
【详解】由于碳-14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核,所以该原子核内的质子数成为7,因此该原子核成为氮原子的原子核,其核内质子数是7中子数也是7。
故选B。
6.B
【详解】A、在原子中质子数等于核电荷数,由甲和乙质子数相等可知甲和乙的核电荷数相同,故说法错误;
B、质子数相同中子数不同的原子互为同位素原子,由题中甲和乙的质子数相同、中子数不同,所以甲和乙互为同位素,故说法正确;
C、在原子中质子数等于核外电子数,由题中乙和丙质子数不同,所以二者的核外电子数不同,故说法错误;
D、质子数相同中子数不同的原子互为同位素原子,由题中乙和丙的质子数不同,所以乙和丙不是互为同位素,故说法错误。
故选B。
7.C
【详解】A、元素是具有相同质子数的一类原子的总称;所以He-3,He-4的原子核中均含有2个质子,He-4原子核内有2个质子和2个中子,则He-3原子核内中子数为3-2=1,错误;
B、原子中,质子数=核外电子数,He-3原子核内有2个质子,核外有2个电子,错误;
C、He-3和He-4是同种元素的两种原子,是同位素原子,正确;
D、原子质量主要集中在原子核,因He-3和He-4的原子的质子数相同,中子数不同,He-3和He-4的原子质量不同,错误。
故选C。
8.B
【详解】A、在原子中,质子数=核电荷数,两种原子的质子数相同,因此它们具有相同的核电荷数,说法正确,不符合题意;
B、原子的质量大小取决于质子和中子数的和的大小,两种原子的质子数相同,中子数不相同,它们的质量不相同,说法错误,符合题意;
C、元素的种类取决于质子数,两种原子的质子数相同,因此它们同属于一种元素,说法正确,不符合题意;
D、在原子中,质子数=核外电子数,两种原子的质子数相同,因此它们具有相同的核外电子数,说法正确,不符合题意。
故选B。
9.D
【详解】A、氕、氘、氚三种原子的质子数都是1,属于同种元素,错误;
B、相对原子质量=质子数+中子数,它们的质子数相同,中子数不同,相对原子质量不同,错误;
C、由于氕、氘、氚三种原子的质子数都为1,原子中,质子数=核外电子数,氕、氘、氚三种原子的核外电子数都为1,错误;
D、中子数=相对原子质量-质子数,氕的中子数=1-1=0,正确。
故选D。
10.C
【详解】A、若两种微粒的核外电子数相同,这两种微粒不一定属于同种元素,如铝离子和镁离子,核外的电子数都是10个,它们属于不同元素,故选项A不符合题意;
B、两种粒子的质子数相同,但这两种粒子不一定属于同种元素,如氢分子和氦原子,它们的质子数均为2个,它们属于不同种元素,故选项B不符合题意;
C、质子数决定元素的种类,若两种微粒属于同种元素,这两种微粒的质子数一定相等,故选项C符合题意;
D、若两种微粒属于同种元素,这两种微粒的核外电子数不一定相等,如氧原子与氧离子属于同种元素,但氧原子核外电子数为8个,氧离子核外电子数为10个,故选项D不符合题意。
故选C。
11. 核电荷数 元素
【详解】化学上把具有相同的核电荷数(或质子数)的同一类原子总称为元素,故填核电荷数,元素。
12.
【详解】①电子的质量很小,可以忽略,所以相对原子质量约为质子数和中子数之和,故答案为电子;
②离子是带电的原子或原子团;故答案为离子;
③原子是化学变化中的最小微粒;故答案为原子;
④同位素是指具有相同核电荷但不同原子质量的原子称为同位素,则同位素的不同原子质子数相同。氕、氘、氚三种原子的质子数相同,中子数不相同,互为同位素;故答案为质子、中子。
13. 同位素 质子数 中子数
【详解】碳-14 原子和碳-12 原子的质子数相同,故同属于碳的同位素原子,它们在原子结构上质子数相同,中子数不同。
14. 2 甲、乙、丁
【详解】由图可知,四个微粒的结构模型中,其中的质子数有的是1,还有的是2,即四个微粒属于2种元素,故填2;
由图可知,微粒甲、乙、丁的质子数均为1,即三个微粒的质子数相同,属于同一种元素,故填甲、乙、丁。
15. ABC AB/BA
【详解】元素指的是质子数相同的一类原子的总称,质子数决定了元素的种类,A、B、C的质子数都是1,为同种元素;
根据具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;ABC的质子数都是1,但C的电子数为0,C不属于原子,是离子,AB的质子数相同,中子数不同,故互称同位素原子的是AB;
16. 元素 中子
【详解】(1)氦-3、氦-4属于同种元素,由于具有相同的质子数和不同中子数,所以两者互为同位素。
(2)氦-3、氦-4具有相同的质子数和不同中子数,根据图片可知,二者原子核都含有2个●,则 ●为质子,而○为中子。
17. 原子 分子 A 质子数或核电荷数
【详解】(1)金属汞由汞原子构成,且原子得到或失去电子后形成离子,所以图中①是原子,故填原子;
水由水分子构成,且分子由原子构成,所以图中②表示的是分子,故填分子。
(2)A 氯化钠是由钠、氯两种元素组成的,选项正确;
B 钠和氯气混合形成混合物,而氯化钠属于纯净物,选项错误;
C 氯化钠是由钠离子和氯离子构成的,选项错误,故填A。
(3)元素是具有相同质子数或核电荷数的一类原子的总称,氧和氯是两种不同的元素,所以两种元素最本质的区别是它们原子中的质子数或核电荷数不同,故填质子数或核电荷数。
答案第1页,共2页
答案第1页,共2页
同课章节目录
