2.2 第2课时 化学反应能量转化的重要应用——化学电池 课件(共59张PPT)
文档属性
| 名称 | 2.2 第2课时 化学反应能量转化的重要应用——化学电池 课件(共59张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-20 01:58:07 | ||
图片预览











文档简介
(共59张PPT)
0
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第2课时 化学反应能量转化的重要应用——化学电池
核心素养 学业要求
体会化学电池对提高生活质量的重要意义,体会化学科学对社会发展的贡献,强化绿色化学观念和可持续发展意识。 1.了解原电池的构成和工作原理。
2.知道构成原电池的条件。
3.了解化学能与电能的相互转化以及化学反应的其他应用。
4.了解常见的化学电池。
学生自主学习
01
课时作业
03
目录
CONTENTS
课堂互动探究
02
学生自主学习
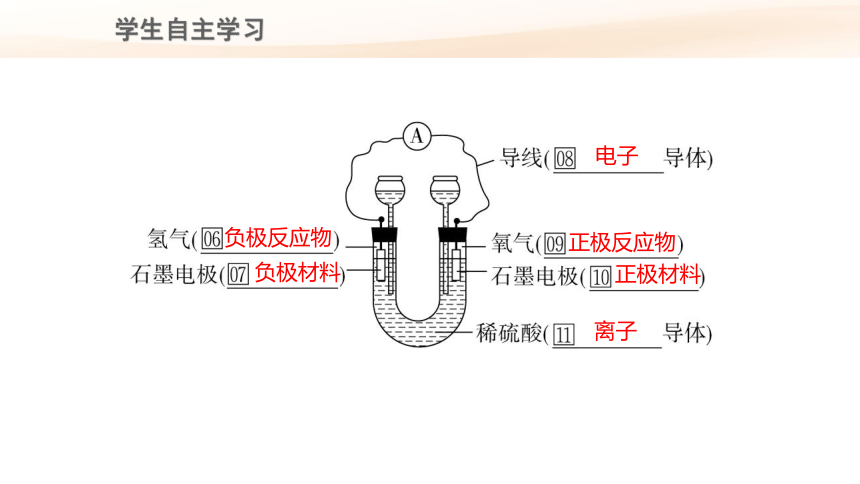
1.原电池
一种利用______________将_________直接转化成_______的装置。
2.认识氢氧燃料电池
在氢氧燃料电池中,氧化反应与还原反应分别在_______________进行。其中氢气分子中的氢原子在左侧石墨电极上______电子,氢气作为电池的___________;氧气分子中氧原子在右侧石墨电极上_______电子,氧气作为电池的____________。
氧化还原反应
化学能
电能
两个不同的区域
失去
负极反应物
得到
正极反应物
负极反应物
负极材料
电子
正极反应物
正极材料
离子
3.原电池的基本工作原理
_________和_________分别在不同的区域发生氧化反应和还原反应,并通过能导电的物质形成___________产生______。其中,还原剂在______上______电子,是_______反应物;氧化剂在_______上_______电子,是_______反应物;电极材料通常是能够_______的固体。此外,还要有能够传导电荷的_________作为离子导体;而导线则作为_______导体,起到传导电子形成___________的作用。
还原剂
氧化剂
闭合回路
电流
负极
失去
负极
正极
得到
正极
导电
电解质
电子
闭合回路
设计思路及依据 实验现象及电极反应式
氧化还原反应:Zn+2H+===Zn2++H2↑ 现象:铜片上有大量的无色_____产生并逸出,锌片不断_____,电流表指针发生偏转。电极反应式:负极:________________正极:_________________
确定负极 选择负极反应物:_____
选择负极材料:_____
确定正极 选择正极反应物:______________
选择正极材料:______________
形成闭合回路 选择离子导体:______________
选择电子导体:_______
4.设计原电池
Zn
Zn
盐酸、稀硫酸等
铜、石墨等
盐酸、稀硫酸等
导线
气泡
溶解
Zn-2e-===Zn2+
2H++2e-===H2↑
5.常见电池
(1)干电池(属于__________):如______电池。
(2)充电电池(又称__________):如___________、_____________(手机用)。
(3)燃料电池:具有________________,__________________等优点。
一次电池
锌锰
二次电池
铅蓄电池
锂离子电池
能量转换效率高
能长时间提供电能
1.判断正误,正确的打“√”,错误的打“×”。
(1)原电池是电能转化为化学能的装置。( )
(2)将铜片和锌片用导线连接插入任何溶液中,电流表指针都会偏转。( )
(3)原电池工作时,在负极上发生氧化反应,正极上发生还原反应。( )
(4)所有的化学反应都可以设计成原电池。( )
(5)原电池中,一定是还原剂做负极材料。( )
(6)在原电池中,还原剂做负极反应物,一定和离子导体发生反应。( )
(7)原电池在工作时,电子可以通过电解质溶液形成电流。( )
√
×
×
×
×
×
×
2.下列有关原电池的说法中正确的是( )
A.在外电路中电子由正极流向负极
B.在原电池中负极发生还原反应
C.原电池工作时,阳离子向正极方向移动
D.原电池中正极一定是不活泼金属
解析 A项,电子应由负极流向正极;B项,原电池中负极发生氧化反应;D项,原电池中正极可以为导电的非金属,如碳,故选C。
3.如图所示,将镁棒和铜棒插入橙子中,用导线将其接入电流表后电流表指针发生偏转,该电池中( )
A.镁棒是负极 B.铜棒是负极
C.镁棒被还原 D.铜棒被氧化
4.一种氢能的制取、贮存及利用如图所示,图示中能量转化方式不涉及( )
A.电能→化学能
B.光能→化学能
C.化学能→电能
D.电能→机械能
解析 由图示可以看出,在能量转化方式上有光能催化分解H2O,是光能→化学能,H2燃料电池车中,是化学能转化为电能,电能转化为机械能,整个过程,无电能到化学能转化,故选A。
解析 原电池的两极反应必须是氧化剂和还原剂分别在正极和负极上得失电子,故化学反应必须为自发的氧化还原反应,无电子转移的非氧化还原反应不能设计为原电池,故选D。
课堂互动探究
探究一 原电池的工作原理
1.原电池的构成条件
(1)能自发发生的氧化还原反应。
(2)电极:两个导体做电极。一般为两种活动性不同的金属,其中较活泼的金属做负极,发生氧化反应,较不活泼的金属做正极,发生还原反应;或金属与能导电的非金属(如石墨)做电极,其中金属做负极,非金属(如石墨)做正极。
(3)具有电解质溶液且构成闭合回路:两电极用导线相连放入电解质溶液中形成闭合回路。
2.原电池的工作原理(以Cu Zn 稀H2SO4原电池为例)
实验装置
实验现象 铜片上有大量的无色气体生成并逸出,锌片不断溶解,灯泡变亮
实验结论 导线中有电流通过,通过化学反应,化学能转化为电能
原理分析
电池总反应:Zn+2H+===Zn2++H2↑当把用导线连接的铜片与锌片一同插入稀硫酸中时:①锌原子失去电子被氧化为Zn2+进入溶液;②电子由锌片通过导线流向铜片;③溶液中的H+从铜片上获得电子被还原为氢气而逸出;④电子在导线上做定向移动,形成电流
②负极本身不反应时,常见书写方法为:
氢氧(酸性)燃料电池,负极反应式为H2-2e-===2H+。
氢氧(碱性)燃料电池,负极反应式为H2-2e-+2OH-===2H2O。
(2)正极反应式的书写
①首先根据化合价变化或氧化性强弱判断得电子的微粒;
②其次确定该微粒得电子后变成哪种形式。
如氢氧(酸性)燃料电池,正极反应式为O2+4H++4e-===2H2O。
氢氧(碱性)燃料电池,正极反应式为O2+2H2O+4e-===4OH-。
1.下列各装置能构成原电池的是( )
M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
2.如图所示装置中,观察到电流表指针偏转(指针顺着电流
方向偏转),M变粗,N变细,由此判断下表中所列M、N、P三种
物质,其中可以成立的是( )
解析 该原电池中M变粗,N变细,说明发生原电池反应时
N溶解,N做负极,溶液中有金属析出附着在M上,M做正极。
A、B两项中,电解质溶液分别为稀硫酸和稀盐酸,原电池工作
时,不会有金属析出,不符合题意;C项,正极反应为Ag++
e-===Ag,符合题意;而D项,锌比铁活泼,故M做负极,变细,不符合题意。
原电池的判定
(1)先分析有无外接电源,无外接电源的可能为原电池。
(2)根据原电池的形成条件——四看
看电极——两极为导体,且存在活动性差异;
看溶液——两极插入电解质溶液中;
看回路——形成闭合回路;
看本质——有自发的氧化还原反应发生。
探究二 原电池的应用
原电池的应用
(1)加快氧化还原反应速率
如实验室用Zn和稀硫酸(或稀盐酸)反应制备H2,常用粗锌。原因是粗锌中的杂质和锌、稀硫酸形成原电池,加快了锌的腐蚀,使产生H2的速率加快。
(2)比较金属的活动性强弱
原电池中,一般活动性强的金属做负极,活动性弱的金属做正极。如有两种金属A和B,用导线连接后插入稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性:A>B。
(3)金属的防护
轮船外壳上镶嵌锌块,在海水中形成原电池,锌做负极失去电子,保护铁不被腐蚀。
(4)设计原电池
设计原电池要依据原电池的构成条件来进行。
①一个自发的氧化还原反应。
②两个导电的电极。
③电解质溶液及导线构成闭合回路。
例如以Cu+2FeCl3===2FeCl2+CuCl2设计原电池
设计思路 实例
以自发进行的氧化还原反应为基础 Cu+2FeCl3===2FeCl2+CuCl2
把氧化还原反应分解为氧化反应和还原反应两个半反应,从而确定电极反应 负极反应(氧化反应):Cu-2e-===Cu2+正极反应(还原反应):2Fe3++2e-===2Fe2+
以电极反应为原理,根据原电池的工作原理确定电极材料和电解质溶液 负极:Cu正极:石墨电解质溶液:FeCl3溶液
原电池的装置简图
解析 只有自发的氧化还原反应才可能设计成原电池,D项中的反应不是氧化还原反应,不能设计为原电池。
4.选择适宜的材料和试剂,请利用反应“Cu+2Ag+===2Ag+Cu2+”设计一个化学电池。
回答下列问题:
(1)负极材料:______;正极材料:___________;电解质溶液:___________。
(2)写出电极反应式
正极:_____________________;
负极:_____________________。
(3)原电池中电子从________极流出,电解质溶液中阴离子流向_____(填“正”或“负”)极。
铜
银(或碳棒)
AgNO3溶液
2Ag++2e-===2Ag
Cu-2e-===Cu2+
铜(负)
负
本课小结
原电池是把化学能转化为电能的装置。其工作原理是:
课时作业
一、选择题(每小题只有1个选项符合题意)
1.下列烧杯中盛放的都是稀硫酸,不能形成原电池的是( )
选项 A B C D
两极材料 Mg、Mg Zn、Fe 金刚石、Cu Zn、Cu
电解质溶液 稀H2SO4 乙醇 浓H2SO4 稀盐酸
2.由下列各组材料和电解质溶液能组成原电池的是( )
3.下列有关原电池的说法中不正确的是( )
A.在内电路中,电子由正极流向负极
B.原电池的正、负极材料不一定都参与反应
C.原电池工作时,正极上发生还原反应
D.原电池工作时,可能会伴随着热量变化
解析 原电池中,内电路不存在电子流动,A错误。
解析 铜锌原电池中,Cu做正极,溶液中的氢离子在正极上得电子生成氢气,所以铜片表面有气泡生成,但溶液中的阴离子向负极移动,故A错误。
5.如图所示进行实验,下列说法不正确的是( )
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B.甲、乙装置中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D.装置乙中负极的电极反应式:Zn-2e-===Zn2+
解析 装置甲发生反应Zn+2H+===H2↑+Zn2+,锌片上有气泡产生,装置乙属于原电池装置,铜为正极,发生反应2H++2e-===H2↑,铜片上有气泡产生,A正确;装置甲中没有发生化学能到电能的转化,B错误;装置乙是一个原电池装置,锌、铜之间用导线连接电流计,可观察到指针偏转,C正确;装置乙中,Zn为负极,电极反应式为Zn-2e-===Zn2+,D正确。
6.图甲是铜锌原电池示意图。图乙中x轴表示原电池工作时流入正极的电子的物质的量,则y轴可以表示( )
7.如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
解析 根据题图知该装置是原电池,外电路中电子从X电极流
向Y电极,电流的流向与此相反,即Y→外电路→X,故A错误;两
电极分别为Fe和碳棒,则Y为碳棒,X为Fe,故B错误;X是负极,
负极上发生氧化反应,Y是正极,正极上发生还原反应,故C错误;
原电池中较活泼的金属做负极,较不活泼的金属或导电的非金属做
正极,该原电池中X是负极,Y是正极,所以若两电极都是金属,则它们的活动性顺序为X>Y,故D正确。
8.下列有关氢燃料电池的说法不正确的是( )
A.通入氢气的电极发生氧化反应
B.碱性电解液中阳离子向通入氢气的方向移动
C.正极的电极反应式为O2+2H2O+4e-===4OH-
D.放电过程中碱性电解液的OH-的物质的量不变
解析 该燃料电池为原电池,通入氢气的一极为电池
的负极,发生氧化反应,A正确;原电池中,阳离子向正
极移动,即向通入氧气的方向移动,B错误;通入氧气的
一极为原电池的正极,电解质为碱性电解液,电极反应式
为O2+2H2O+4e-===4OH-,C正确;由图可知,氢氧燃料电池放电过程中,总反应为氢气和氧气反应生成水,则碱性电解液中OH-的物质的量不变,D正确。
9.已知X、Y、Z都是金属,若把X浸入Z的硝酸盐溶液中,X的表面有Z析出;若X、Y和盐酸形成原电池,Y为电池的负极。则X、Y、Z的金属活动性顺序为( )
A.Y>X>Z B.X>Z>Y
C.X>Y>Z D.Y>Z>X
解析 把X浸入Z的硝酸盐溶液中,X的表面有Z析出,说明金属X可以把金属Z从其盐溶液中置换出来,所以金属活动性:X>Z;X和Y组成原电池时,Y为电池的负极,所以金属活动性:Y>X,则X、Y、Z三种金属的活动性顺序为Y>X>Z,A正确。
10.在铜-锌-稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片消耗了32.5 g ②锌片质量增加了32.5 g ③铜片上生成1 g氢气
④铜片上生成1 mol氢气
A.①③ B.①④
C.②③ D.②④
解析 在Cu Zn 稀H2SO4原电池中Zn做负极,Cu做正极,发生的总反应为Zn+H2SO4===ZnSO4+H2↑,设当导线中有1 mol电子通过时,理论上负极锌片消耗x g,铜片上析出氢气y g。
Zn+H2SO4===ZnSO4+H2↑ 转移电子
65 g 2 g 2 mol
x g y g 1 mol
解得:x=32.5,y=1。
即锌片消耗了32.5 g,铜片上生成1 g氢气,说法正确的是①③。
解析 根据反应方程式,放电时,Zn元素化合价由0价升高为+2价,H元素化合价由+1价降低为0价,所以Zn片做负极,电极反应式为Zn-2e-===Zn2+,碳棒做正极,H2在碳棒上生成,电流由正极经外电路流向负极,应是由碳棒流向锌片。
12.利用CH4和O2的反应,在KOH溶液中用铂作电极可以构成原电池。下列说法正确的是( )
①每消耗1 mol CH4可以向外电路提供8 mol e-
②在负极上O2获得电子,电极反应式为O2+2H2O+4e-===4OH-
③外电路电子由负极流向正极,内电路电子由正极流向负极
④电池放电过程中,溶液的pH不断降低
⑤负极发生氧化反应,正极发生还原反应
⑥负极附近会出现淡蓝色火焰
A.①④⑤ B.①③④ C.②③⑥ D.②⑤⑥
二、非选择题
13.某化学研究性学习小组针对原电池的形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 实验装置 实验现象
1 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象
2 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转
3 铜棒表面的现象是____________;电流计指针__________
有气体生成
发生偏转
①通过实验2和3,可得出原电池的形成条件是________________________。
②通过实验1和3,可得出原电池的形成条件是______________。
③若将3装置中稀硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池的形成条件是_____________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式。
Zn棒:__________________。
Cu棒:__________________。
(3)实验3的电流是从_____棒流出的(填“Zn”或“Cu”),反应过程中若有0.4 mol电子发生了转移,则Zn电极质量减轻_____g。
有活动性不同的两个电极
形成闭合回路
有电解质溶液
Zn-2e-===Zn2+
2H++2e-===H2↑
Cu
13
解析 (3)实验3中锌棒做负极,铜棒做正极,则电流是从Cu棒流出的,反应过程中若有0.4 mol电子发生转移,根据Zn-2e-===Zn2+可知消耗0.2 mol Zn,则Zn电极质量减轻0.2 mol×65 g·mol-1=13.0 g。
14.化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学方程式正确且能设计成原电池的是______(填序号,下同)。
A.KOH+HCl===KCl+H2O
B.Cu+Fe3+===Fe2++Cu2+
C.Na2O+H2O===2NaOH
D.Fe+H2SO4===FeSO4+H2↑
D
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是______。
A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比Ⅰ慢
A
(3)电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+ PbO2+2H2SO4===2PbSO4+2H2O。
①写出放电时正极的电极反应式:____________________________________;
②铅蓄电池放电时,负极质量将________(填“增大”“减小”或“不变”)。当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为________。
增大
2 mol
解析 (2)图Ⅰ中发生的是锌与稀H2SO4的反应,图Ⅱ形成铜-锌原电池。图Ⅰ主要将化学能转化为热能,而图Ⅱ主要将化学能转化为电能,则图Ⅰ中温度计的示数高于图Ⅱ的示数,但均高于室温,故A正确,B错误;图Ⅱ中铜为正极,铜棒的表面有气泡产生,故C错误;利用原电池反应可以使金属与酸的反应速率加快,图Ⅱ中产生气体的速率比Ⅰ快,故D错误。
0
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第2课时 化学反应能量转化的重要应用——化学电池
核心素养 学业要求
体会化学电池对提高生活质量的重要意义,体会化学科学对社会发展的贡献,强化绿色化学观念和可持续发展意识。 1.了解原电池的构成和工作原理。
2.知道构成原电池的条件。
3.了解化学能与电能的相互转化以及化学反应的其他应用。
4.了解常见的化学电池。
学生自主学习
01
课时作业
03
目录
CONTENTS
课堂互动探究
02
学生自主学习
1.原电池
一种利用______________将_________直接转化成_______的装置。
2.认识氢氧燃料电池
在氢氧燃料电池中,氧化反应与还原反应分别在_______________进行。其中氢气分子中的氢原子在左侧石墨电极上______电子,氢气作为电池的___________;氧气分子中氧原子在右侧石墨电极上_______电子,氧气作为电池的____________。
氧化还原反应
化学能
电能
两个不同的区域
失去
负极反应物
得到
正极反应物
负极反应物
负极材料
电子
正极反应物
正极材料
离子
3.原电池的基本工作原理
_________和_________分别在不同的区域发生氧化反应和还原反应,并通过能导电的物质形成___________产生______。其中,还原剂在______上______电子,是_______反应物;氧化剂在_______上_______电子,是_______反应物;电极材料通常是能够_______的固体。此外,还要有能够传导电荷的_________作为离子导体;而导线则作为_______导体,起到传导电子形成___________的作用。
还原剂
氧化剂
闭合回路
电流
负极
失去
负极
正极
得到
正极
导电
电解质
电子
闭合回路
设计思路及依据 实验现象及电极反应式
氧化还原反应:Zn+2H+===Zn2++H2↑ 现象:铜片上有大量的无色_____产生并逸出,锌片不断_____,电流表指针发生偏转。电极反应式:负极:________________正极:_________________
确定负极 选择负极反应物:_____
选择负极材料:_____
确定正极 选择正极反应物:______________
选择正极材料:______________
形成闭合回路 选择离子导体:______________
选择电子导体:_______
4.设计原电池
Zn
Zn
盐酸、稀硫酸等
铜、石墨等
盐酸、稀硫酸等
导线
气泡
溶解
Zn-2e-===Zn2+
2H++2e-===H2↑
5.常见电池
(1)干电池(属于__________):如______电池。
(2)充电电池(又称__________):如___________、_____________(手机用)。
(3)燃料电池:具有________________,__________________等优点。
一次电池
锌锰
二次电池
铅蓄电池
锂离子电池
能量转换效率高
能长时间提供电能
1.判断正误,正确的打“√”,错误的打“×”。
(1)原电池是电能转化为化学能的装置。( )
(2)将铜片和锌片用导线连接插入任何溶液中,电流表指针都会偏转。( )
(3)原电池工作时,在负极上发生氧化反应,正极上发生还原反应。( )
(4)所有的化学反应都可以设计成原电池。( )
(5)原电池中,一定是还原剂做负极材料。( )
(6)在原电池中,还原剂做负极反应物,一定和离子导体发生反应。( )
(7)原电池在工作时,电子可以通过电解质溶液形成电流。( )
√
×
×
×
×
×
×
2.下列有关原电池的说法中正确的是( )
A.在外电路中电子由正极流向负极
B.在原电池中负极发生还原反应
C.原电池工作时,阳离子向正极方向移动
D.原电池中正极一定是不活泼金属
解析 A项,电子应由负极流向正极;B项,原电池中负极发生氧化反应;D项,原电池中正极可以为导电的非金属,如碳,故选C。
3.如图所示,将镁棒和铜棒插入橙子中,用导线将其接入电流表后电流表指针发生偏转,该电池中( )
A.镁棒是负极 B.铜棒是负极
C.镁棒被还原 D.铜棒被氧化
4.一种氢能的制取、贮存及利用如图所示,图示中能量转化方式不涉及( )
A.电能→化学能
B.光能→化学能
C.化学能→电能
D.电能→机械能
解析 由图示可以看出,在能量转化方式上有光能催化分解H2O,是光能→化学能,H2燃料电池车中,是化学能转化为电能,电能转化为机械能,整个过程,无电能到化学能转化,故选A。
解析 原电池的两极反应必须是氧化剂和还原剂分别在正极和负极上得失电子,故化学反应必须为自发的氧化还原反应,无电子转移的非氧化还原反应不能设计为原电池,故选D。
课堂互动探究
探究一 原电池的工作原理
1.原电池的构成条件
(1)能自发发生的氧化还原反应。
(2)电极:两个导体做电极。一般为两种活动性不同的金属,其中较活泼的金属做负极,发生氧化反应,较不活泼的金属做正极,发生还原反应;或金属与能导电的非金属(如石墨)做电极,其中金属做负极,非金属(如石墨)做正极。
(3)具有电解质溶液且构成闭合回路:两电极用导线相连放入电解质溶液中形成闭合回路。
2.原电池的工作原理(以Cu Zn 稀H2SO4原电池为例)
实验装置
实验现象 铜片上有大量的无色气体生成并逸出,锌片不断溶解,灯泡变亮
实验结论 导线中有电流通过,通过化学反应,化学能转化为电能
原理分析
电池总反应:Zn+2H+===Zn2++H2↑当把用导线连接的铜片与锌片一同插入稀硫酸中时:①锌原子失去电子被氧化为Zn2+进入溶液;②电子由锌片通过导线流向铜片;③溶液中的H+从铜片上获得电子被还原为氢气而逸出;④电子在导线上做定向移动,形成电流
②负极本身不反应时,常见书写方法为:
氢氧(酸性)燃料电池,负极反应式为H2-2e-===2H+。
氢氧(碱性)燃料电池,负极反应式为H2-2e-+2OH-===2H2O。
(2)正极反应式的书写
①首先根据化合价变化或氧化性强弱判断得电子的微粒;
②其次确定该微粒得电子后变成哪种形式。
如氢氧(酸性)燃料电池,正极反应式为O2+4H++4e-===2H2O。
氢氧(碱性)燃料电池,正极反应式为O2+2H2O+4e-===4OH-。
1.下列各装置能构成原电池的是( )
M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
2.如图所示装置中,观察到电流表指针偏转(指针顺着电流
方向偏转),M变粗,N变细,由此判断下表中所列M、N、P三种
物质,其中可以成立的是( )
解析 该原电池中M变粗,N变细,说明发生原电池反应时
N溶解,N做负极,溶液中有金属析出附着在M上,M做正极。
A、B两项中,电解质溶液分别为稀硫酸和稀盐酸,原电池工作
时,不会有金属析出,不符合题意;C项,正极反应为Ag++
e-===Ag,符合题意;而D项,锌比铁活泼,故M做负极,变细,不符合题意。
原电池的判定
(1)先分析有无外接电源,无外接电源的可能为原电池。
(2)根据原电池的形成条件——四看
看电极——两极为导体,且存在活动性差异;
看溶液——两极插入电解质溶液中;
看回路——形成闭合回路;
看本质——有自发的氧化还原反应发生。
探究二 原电池的应用
原电池的应用
(1)加快氧化还原反应速率
如实验室用Zn和稀硫酸(或稀盐酸)反应制备H2,常用粗锌。原因是粗锌中的杂质和锌、稀硫酸形成原电池,加快了锌的腐蚀,使产生H2的速率加快。
(2)比较金属的活动性强弱
原电池中,一般活动性强的金属做负极,活动性弱的金属做正极。如有两种金属A和B,用导线连接后插入稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性:A>B。
(3)金属的防护
轮船外壳上镶嵌锌块,在海水中形成原电池,锌做负极失去电子,保护铁不被腐蚀。
(4)设计原电池
设计原电池要依据原电池的构成条件来进行。
①一个自发的氧化还原反应。
②两个导电的电极。
③电解质溶液及导线构成闭合回路。
例如以Cu+2FeCl3===2FeCl2+CuCl2设计原电池
设计思路 实例
以自发进行的氧化还原反应为基础 Cu+2FeCl3===2FeCl2+CuCl2
把氧化还原反应分解为氧化反应和还原反应两个半反应,从而确定电极反应 负极反应(氧化反应):Cu-2e-===Cu2+正极反应(还原反应):2Fe3++2e-===2Fe2+
以电极反应为原理,根据原电池的工作原理确定电极材料和电解质溶液 负极:Cu正极:石墨电解质溶液:FeCl3溶液
原电池的装置简图
解析 只有自发的氧化还原反应才可能设计成原电池,D项中的反应不是氧化还原反应,不能设计为原电池。
4.选择适宜的材料和试剂,请利用反应“Cu+2Ag+===2Ag+Cu2+”设计一个化学电池。
回答下列问题:
(1)负极材料:______;正极材料:___________;电解质溶液:___________。
(2)写出电极反应式
正极:_____________________;
负极:_____________________。
(3)原电池中电子从________极流出,电解质溶液中阴离子流向_____(填“正”或“负”)极。
铜
银(或碳棒)
AgNO3溶液
2Ag++2e-===2Ag
Cu-2e-===Cu2+
铜(负)
负
本课小结
原电池是把化学能转化为电能的装置。其工作原理是:
课时作业
一、选择题(每小题只有1个选项符合题意)
1.下列烧杯中盛放的都是稀硫酸,不能形成原电池的是( )
选项 A B C D
两极材料 Mg、Mg Zn、Fe 金刚石、Cu Zn、Cu
电解质溶液 稀H2SO4 乙醇 浓H2SO4 稀盐酸
2.由下列各组材料和电解质溶液能组成原电池的是( )
3.下列有关原电池的说法中不正确的是( )
A.在内电路中,电子由正极流向负极
B.原电池的正、负极材料不一定都参与反应
C.原电池工作时,正极上发生还原反应
D.原电池工作时,可能会伴随着热量变化
解析 原电池中,内电路不存在电子流动,A错误。
解析 铜锌原电池中,Cu做正极,溶液中的氢离子在正极上得电子生成氢气,所以铜片表面有气泡生成,但溶液中的阴离子向负极移动,故A错误。
5.如图所示进行实验,下列说法不正确的是( )
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B.甲、乙装置中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D.装置乙中负极的电极反应式:Zn-2e-===Zn2+
解析 装置甲发生反应Zn+2H+===H2↑+Zn2+,锌片上有气泡产生,装置乙属于原电池装置,铜为正极,发生反应2H++2e-===H2↑,铜片上有气泡产生,A正确;装置甲中没有发生化学能到电能的转化,B错误;装置乙是一个原电池装置,锌、铜之间用导线连接电流计,可观察到指针偏转,C正确;装置乙中,Zn为负极,电极反应式为Zn-2e-===Zn2+,D正确。
6.图甲是铜锌原电池示意图。图乙中x轴表示原电池工作时流入正极的电子的物质的量,则y轴可以表示( )
7.如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
解析 根据题图知该装置是原电池,外电路中电子从X电极流
向Y电极,电流的流向与此相反,即Y→外电路→X,故A错误;两
电极分别为Fe和碳棒,则Y为碳棒,X为Fe,故B错误;X是负极,
负极上发生氧化反应,Y是正极,正极上发生还原反应,故C错误;
原电池中较活泼的金属做负极,较不活泼的金属或导电的非金属做
正极,该原电池中X是负极,Y是正极,所以若两电极都是金属,则它们的活动性顺序为X>Y,故D正确。
8.下列有关氢燃料电池的说法不正确的是( )
A.通入氢气的电极发生氧化反应
B.碱性电解液中阳离子向通入氢气的方向移动
C.正极的电极反应式为O2+2H2O+4e-===4OH-
D.放电过程中碱性电解液的OH-的物质的量不变
解析 该燃料电池为原电池,通入氢气的一极为电池
的负极,发生氧化反应,A正确;原电池中,阳离子向正
极移动,即向通入氧气的方向移动,B错误;通入氧气的
一极为原电池的正极,电解质为碱性电解液,电极反应式
为O2+2H2O+4e-===4OH-,C正确;由图可知,氢氧燃料电池放电过程中,总反应为氢气和氧气反应生成水,则碱性电解液中OH-的物质的量不变,D正确。
9.已知X、Y、Z都是金属,若把X浸入Z的硝酸盐溶液中,X的表面有Z析出;若X、Y和盐酸形成原电池,Y为电池的负极。则X、Y、Z的金属活动性顺序为( )
A.Y>X>Z B.X>Z>Y
C.X>Y>Z D.Y>Z>X
解析 把X浸入Z的硝酸盐溶液中,X的表面有Z析出,说明金属X可以把金属Z从其盐溶液中置换出来,所以金属活动性:X>Z;X和Y组成原电池时,Y为电池的负极,所以金属活动性:Y>X,则X、Y、Z三种金属的活动性顺序为Y>X>Z,A正确。
10.在铜-锌-稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片消耗了32.5 g ②锌片质量增加了32.5 g ③铜片上生成1 g氢气
④铜片上生成1 mol氢气
A.①③ B.①④
C.②③ D.②④
解析 在Cu Zn 稀H2SO4原电池中Zn做负极,Cu做正极,发生的总反应为Zn+H2SO4===ZnSO4+H2↑,设当导线中有1 mol电子通过时,理论上负极锌片消耗x g,铜片上析出氢气y g。
Zn+H2SO4===ZnSO4+H2↑ 转移电子
65 g 2 g 2 mol
x g y g 1 mol
解得:x=32.5,y=1。
即锌片消耗了32.5 g,铜片上生成1 g氢气,说法正确的是①③。
解析 根据反应方程式,放电时,Zn元素化合价由0价升高为+2价,H元素化合价由+1价降低为0价,所以Zn片做负极,电极反应式为Zn-2e-===Zn2+,碳棒做正极,H2在碳棒上生成,电流由正极经外电路流向负极,应是由碳棒流向锌片。
12.利用CH4和O2的反应,在KOH溶液中用铂作电极可以构成原电池。下列说法正确的是( )
①每消耗1 mol CH4可以向外电路提供8 mol e-
②在负极上O2获得电子,电极反应式为O2+2H2O+4e-===4OH-
③外电路电子由负极流向正极,内电路电子由正极流向负极
④电池放电过程中,溶液的pH不断降低
⑤负极发生氧化反应,正极发生还原反应
⑥负极附近会出现淡蓝色火焰
A.①④⑤ B.①③④ C.②③⑥ D.②⑤⑥
二、非选择题
13.某化学研究性学习小组针对原电池的形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 实验装置 实验现象
1 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象
2 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转
3 铜棒表面的现象是____________;电流计指针__________
有气体生成
发生偏转
①通过实验2和3,可得出原电池的形成条件是________________________。
②通过实验1和3,可得出原电池的形成条件是______________。
③若将3装置中稀硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池的形成条件是_____________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式。
Zn棒:__________________。
Cu棒:__________________。
(3)实验3的电流是从_____棒流出的(填“Zn”或“Cu”),反应过程中若有0.4 mol电子发生了转移,则Zn电极质量减轻_____g。
有活动性不同的两个电极
形成闭合回路
有电解质溶液
Zn-2e-===Zn2+
2H++2e-===H2↑
Cu
13
解析 (3)实验3中锌棒做负极,铜棒做正极,则电流是从Cu棒流出的,反应过程中若有0.4 mol电子发生转移,根据Zn-2e-===Zn2+可知消耗0.2 mol Zn,则Zn电极质量减轻0.2 mol×65 g·mol-1=13.0 g。
14.化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学方程式正确且能设计成原电池的是______(填序号,下同)。
A.KOH+HCl===KCl+H2O
B.Cu+Fe3+===Fe2++Cu2+
C.Na2O+H2O===2NaOH
D.Fe+H2SO4===FeSO4+H2↑
D
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是______。
A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比Ⅰ慢
A
(3)电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+ PbO2+2H2SO4===2PbSO4+2H2O。
①写出放电时正极的电极反应式:____________________________________;
②铅蓄电池放电时,负极质量将________(填“增大”“减小”或“不变”)。当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为________。
增大
2 mol
解析 (2)图Ⅰ中发生的是锌与稀H2SO4的反应,图Ⅱ形成铜-锌原电池。图Ⅰ主要将化学能转化为热能,而图Ⅱ主要将化学能转化为电能,则图Ⅰ中温度计的示数高于图Ⅱ的示数,但均高于室温,故A正确,B错误;图Ⅱ中铜为正极,铜棒的表面有气泡产生,故C错误;利用原电池反应可以使金属与酸的反应速率加快,图Ⅱ中产生气体的速率比Ⅰ快,故D错误。
