2.3 第1课时 化学反应的快慢 课件 (共61张PPT)
文档属性
| 名称 | 2.3 第1课时 化学反应的快慢 课件 (共61张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-20 01:59:18 | ||
图片预览










文档简介
(共61张PPT)
0
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度
第1课时 化学反应的快慢
核心素养 学业要求
发展对化学变化的微观认识,认识化学反应是有一定速率的,初步形成实验探究化学反应规律的思路方法。 1.了解化学反应速率的概念及平均速率的表示方法,并能计算化学反应速率。
2.运用控制变量法设计实验探究温度、浓度、催化剂、接触面积对化学反应速率的影响。
学生自主学习
01
课时作业
03
目录
CONTENTS
课堂互动探究
02
学生自主学习
1.化学反应速率
(1)定义:描述化学反应_______的物理量。
(2)表示方法:用单位时间内_______________________________或_________ ________________来表示。
(3)对于在体积固定的容器中进行的化学反应aA+bB===cC+dD,以反应物B来表示,反应的化学反应速率为:v(B)=________。
(4)单位:____________或mol·L-1·min-1。
快慢
某反应物浓度的减少量(绝对值)
物浓度的增加量
某生成
mol·L-1·s-1
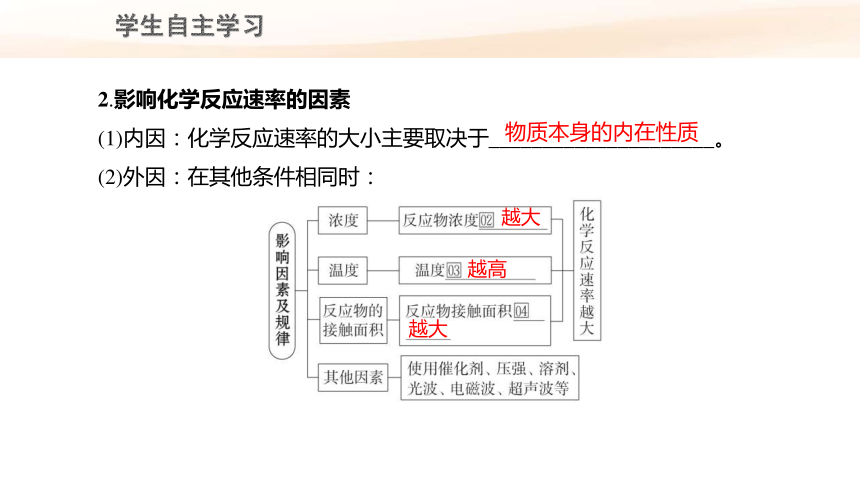
2.影响化学反应速率的因素
(1)内因:化学反应速率的大小主要取决于_____________________。
(2)外因:在其他条件相同时:
物质本身的内在性质
越大
越高
越大
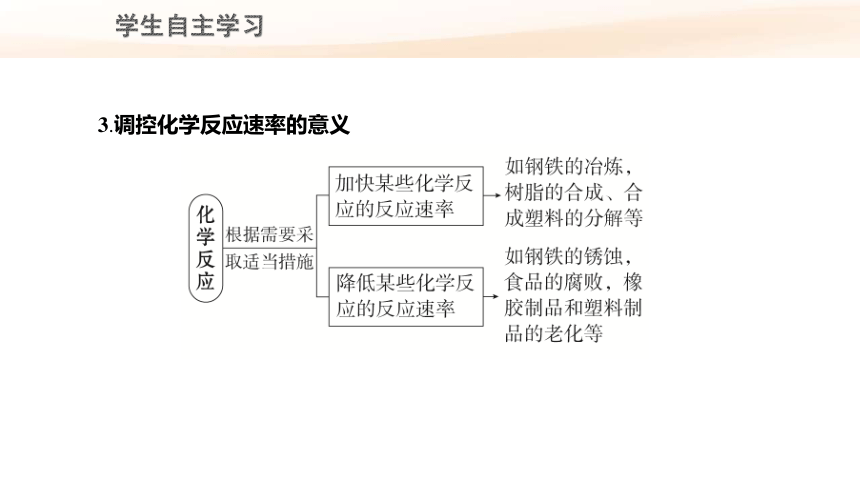
3.调控化学反应速率的意义
1.判断正误,正确的打“√”,错误的打“×”。
(1)可以用任何物质表示化学反应速率。( )
(2)反应速率的单位通常为mol·s-1或mol·min-1。( )
(3)反应速率越大,则反应现象越明显。( )
(4)对同一个化学反应,用不同物质表示的化学反应速率,其数值越大,则表示化学反应速率越快。( )
(5)无论是放热反应还是吸热反应,温度升高,反应速率一定加快。( )
(6)压强变化,则化学反应速率一定会变化。( )
(7)铁和硫酸反应时,硫酸浓度越大,产生的H2的速率越快。( )
×
×
×
×
√
×
×
2.下列对化学反应速率的理解正确的是( )
A.化学反应速率表示的是化学反应进行的快慢
B.同一化学反应用不同物质表示数值一定不同
C.化学反应速率可以用任何一种反应物或生成物来表示
D.化学反应速率可以是正值,也可以是负值
3.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指某一时刻,某种反应物的瞬时反应速率
B.化学反应速率为“0.8 mol·L-1·s-1”表示反应在1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行得快慢
D.对于任何化学反应来说,都是反应物的质量越大,反应越快
5.镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有( )
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温
A.①② B.②③
C.①③ D.②④
课堂互动探究
探究一 化学反应速率
2.对于一个具体的化学反应,反应物和生成物的物质的量的变化是按化学方程式中化学计量数之比进行的,所以化学反应中各物质的反应速率之比等于化学方程式中各物质的化学计量数之比。
对于反应aA+bB===cC+dD(A、B、C、D均不是固体或纯液体),v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d。
3.化学反应速率的理解
(1)对于有固体或纯液体参加的反应,由于固体或纯液体的浓度为一常数,所以不用固体或纯液体表示反应速率。
(2)Δt表示某一时间段,故化学反应速率是平均速率,而非瞬时速率。
(3)无论是用反应物还是用生成物表示化学反应速率,化学反应速率都取正值。
(4)表示化学反应速率时,必须指明具体的物质,因为同一化学反应用不同的物质表示反应速率,其数值可能不同。在同一时间内的同一个化学反应里,虽然用不同物质表示的化学反应速率不一定相同,但它们表示的意义相同,即一种物质的化学反应速率就代表了整个化学反应的反应速率。
2.对于反应A2(g)+3B2(g)===2C(g)+D(g),不同条件下,其化学反应速率最快的是( )
A.v(B2)=0.8 mol/(L·s) B.v(D)=0.6 mol/(L·s)
C.v(C)=0.6 mol/(L·s) D.v(A2)=0.8 mol/(L·min)
化学反应快慢的比较
(1)同一反应不同条件或者不同时段内的反应速率比较时,先换算成同一物质、相同单位的反应速率,数值大的反应速率快。
(2)对于反应aA+bB===cC,将v(A)∶v(B)的值与a∶b的值进行比较,若v(A)∶v(B)=a∶b,二者速率相等;若v(A)∶v(B)>a∶b,v(A)>v(B);v(A)∶v(B)探究二 影响化学反应速率的因素
1.根据变量控制方法探究影响化学反应速率的因素
编号 实验内容 实验现象 实验结论
Ⅰ 表面积大致相同的镁条产生气泡较快,铁片生成气泡较慢 物质性质决定化学反应速率
Ⅱ 质量相等的粉末状碳酸钙产生气泡较快,块状碳酸钙产生气泡较慢 接触面积越大,则反应速率越快
Ⅲ 加入3 mol·L-1盐酸的试管中放出大量气泡,加入0.5 mol·L-1盐酸的试管中缓慢放出气泡 反应物浓度越大,化学反应速率越快
Ⅳ 加入MnO2后的H2O2溶液产生大量气泡,未加MnO2的H2O2溶液生成气泡很缓慢 加入催化剂,反应速率加快
2.影响化学反应速率的因素
(1)内因
不同的化学反应,具有不同的化学反应速率,因此,反应物本身的性质是决定化学反应速率的主要因素。
(2)外因
①浓度
a.在一定条件下,增大反应物浓度能加快化学反应速率,减小反应物浓度能降低化学反应速率。
b.在一定温度下,固体或纯液体物质的浓度是一个常数,改变其用量,对化学反应速率无影响。
②温度
a.对任何化学反应都适用,且不受反应物状态的影响。
b.不论是吸热反应还是放热反应,升高温度都能增大化学反应速率,降低温度都能减小化学反应速率。
③压强
由于固体或液体的体积受压强的影响很小,所以压强只影响有气体参加的化学反应的反应速率。压强对化学反应速率的影响实质是通过改变浓度对化学反应速率的影响实现的。
a.恒温恒容时:
ⅰ.充入气体反应物(压强增大)―→浓度增大―→反应速率加快;
ⅱ.充入惰性气体―→总压强增大,各物质的浓度不变,反应速率不变(注:此处惰性气体指不参加反应的气体)。
b.恒温恒压时:充入惰性气体―→体积增大―→各反应物浓度减小―→反应速率减慢。
④催化剂
其他条件相同时,加入合适的催化剂,能够增大化学反应速率。
⑤反应物间的接触面积
其他条件相同时,反应物间的接触面积越大,化学反应速率越快。
⑥其他因素
溶剂、光波、电磁波、超声波等。
3.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小排列顺序正确的是( )
甲500 ℃,10 mol SO2和5 mol O2的反应
乙500 ℃,用V2O5做催化剂,10 mol SO2和5 mol O2的反应
丙450 ℃,8 mol SO2和5 mol O2的反应
丁500 ℃,8 mol SO2和5 mol O2的反应
A.甲、乙、丙、丁 B.乙、甲、丁、丙
C.乙、甲、丙、丁 D.丁、丙、乙、甲
解析 由温度可知,丙中反应速率最慢;温度相同时,乙中使用催化剂,则反应速率最快,甲与丁比较,甲中浓度大,反应速率快,则按正反应速率由大到小排列顺序应为乙、甲、丁、丙。
解析 ①对:升高温度,反应速率加快。②错:碳是固体,增加固体的量,反应速率不变。③对:恒温恒容下通入CO2,由于容器容积不变,所以二氧化碳的浓度增大,反应速率加快。④错:恒温恒压下充入不参加反应的N2,容器体积增大,参与反应的物质的浓度降低,反应速率减慢。⑤错:恒温恒容下充入N2,容器体积不变,参与反应的物质的浓度不变,反应速率不变。
本课小结
课时作业
一、选择题(每小题只有1个选项符合题意)
1.在2 L的密闭容器中发生反应:A(g)+2B(g)===3C(g),经过3 min后A的物质的量由10 mol变为7 mol,则下面表示的反应速率正确的是( )
A.vA=1 mol·L-1·min-1 B.vA=3 mol·L-1·min-1
C.vA=2 mol·L-1·min-1 D.vA=0.5 mol·L-1·min-1
2.对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
解析 同一个化学反应中各物质表示的反应速率之比等于其相应的化学计量数之比,则根据反应的化学方程式可知应该有v(W)∶v(X)∶v(Y)∶v(Z)=3∶2∶4∶3,故C正确。
3.下列表示的是化学反应A(g)+2B(g)===C(g)+D(g)在不同条件下的反应速率,其中最快的是( )
A.v(A)=0.3 mol·L-1·s-1 B.v(B)=0.5 mol·L-1·s-1
C.v(C)=0.25 mol·L-1·s-1 D.v(D) =0.2 mol·L-1·s-1
4.下列措施对加快反应速率明显有效的是( )
A.Na与水反应时增加水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4溶液与BaCl2溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
5.一定能使化学反应速率加快的措施是( )
①扩大容器容积 ②使用正催化剂 ③增大反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大压强
A.②③ B.②③④⑥
C.②③④⑤ D.②④
解析 ①对于有气体参加的反应,扩大容器容积,会使物质的浓度降低,反应速率减慢,但对无气体参加的反应没有影响;③若反应物是固体或纯液体物质,则增大反应物的物质的量,化学反应速率不变;⑤对于有气体参加的反应,缩小容器容积,会导致气体的浓度增大,化学反应速率加快,但对无气体参加的反应没有影响;⑥若反应无气体参加,则增大压强,化学反应速率不变。
6.CaCO3与稀盐酸反应(放热反应)生成CO2的物质的量与
反应时间的关系如图所示,下列结论不正确的是( )
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后减小
C.反应在第2 min到第4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍
解析 由题图可知,2~4 min时间内,生成的二氧化碳的物质的量比反应开始2 min内大,故2~4 min内平均反应速率比反应开始2 min内快,A错误。
7.下列有关化学反应速率的说法中正确的是( )
A.二氧化锰能加快所有化学反应的速率
B.用铁片和稀硫酸反应制取氢气时,适当增大硫酸浓度可以加快产生氢气的速率
C.100 mL 2 mol·L-1的盐酸与锌反应时,加入浓氯化钠溶液,生成氢气的反应速率变快
D.对于任何反应,增大压强都可加快反应速率
解析 MnO2作催化剂只能加快某些化学反应的速率,如加速H2O2的分解,并不能使所有化学反应速率都加快,故A错误;锌与盐酸反应:Zn+2H+===Zn2++H2↑,增加c(Cl-)对反应无影响,加入浓氯化钠溶液,c(H+)减小,生成氢气的反应速率变慢,故C错误;增大压强只对有气体参与的反应的反应速率有影响,对只有固体或液体参与的反应无影响,如HCl和NaOH反应,增大压强对反应速率无影响,故D错误。
8.已知:Na2S2O3+H2SO4===S↓+SO2↑+H2O+Na2SO4,通过析出硫的快慢可以判断反应速率的大小,请判断下列几种情况下,最先看到硫析出的是( )
选项 温度/℃ Na2S2O3溶液的体积和物质的量浓度 H2SO4溶液的体积和物质的量浓度
A 20 15 mL 0.1 mol·L-1 15 mL 0.1 mol·L-1
B 20 10 mL 0.2 mol·L-1 10 mL 0.2 mol·L-1
C 50 50 mL 0.1 mol·L-1 50 mL 0.1 mol·L-1
D 50 5 mL 0.5 mol·L-1 5 mL 0.5 mol·L-1
解析 温度越高,反应速率越快,则C、D项中的反应速率大于A、B项,又因D项中混合后反应物的浓度大于C项中混合后反应物的浓度,则D项中反应速率最快,最先看到硫析出。
9.常温下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量NaNO3固体;③加入少量CuSO4固体;④加入少量CH3COONa固体;⑤加热;⑥将稀硫酸换成98%硫酸。其中可增大单位时间内氢气收集量的措施有( )
A.①③④ B.①③⑤
C.②④⑤ D.②⑤⑥
解析 将铁块换为等质量的铁粉,加大反应物的接触面积,反应速率加快;加入少量NaNO3固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气;加入少量CuSO4固体,Fe和CuSO4反应生成Cu,Fe、Cu和H2SO4形成原电池,加快反应速率;加入少量CH3COONa固体,生成弱酸CH3COOH,氢离子浓度降低,反应速率减慢;升高温度,反应速率加快;将稀硫酸换成98%硫酸,常温下,铁块在浓硫酸中发生钝化。
10.在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折为标准状况)如下表:
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应到6 min时,c(H2O2)=0.30 mol/L
D.反应到6 min时,H2O2分解了50%
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
解析 保持容器容积不变,向其中加入1 mol I2(g),反应物浓度增大,反应速率加快,A错误;保持容器容积不变,向其中加入1 mol He,参加反应的物质的浓度不变,则反应速率不变,B错误;保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),因物质的量增大1倍,体积也增大1倍,则浓度不变,反应速率不变,C正确;保持容器内气体压强不变,向其中加入1 mol He,体积增大,参加反应的物质的浓度减小,则反应速率减慢,D错误。
物质 时间 X Y Z Q
起始(mol) 0.7 1
2 min时(mol) 0.8 2.7 0.8 2.7
3 min时(mol) 0.8
已知:2 min内v(Q)=0.075 mol·L-1·min-1,且v(Z)∶v(Y)=1∶2。请回答下列问题:
(1)2 min内Z的反应速率v(Z)=__________________。
(2)起始时n(Y)=________,n(Q)=________。
(3)化学方程式中m=_____,n=_____,p=_____,q=_____。
(4)对于该反应,能增大反应速率的措施是_______。
A.增大容器容积 B.移走部分Q
C.通入大量X D.升高温度
0.05 mol·L-1·min-1
2.3 mol
3.0 mol
1
4
2
3
CD
解析 (2)因为v(Z)∶v(Y)=1∶2,说明Z、Y的物质的量的变化量之比为1∶2,因为Z减少了0.2 mol,所以Y增加了0.4 mol,则Y的起始物质的量是2.7 mol-0.4 mol=2.3 mol。根据v(Q)=0.075 mol·L-1·min-1可知,Q物质的量的变化量是0.075 mol·L-1·min-1×2 L×2 min=0.3 mol,所以Q的起始量是0.3 mol+2.7 mol=3.0 mol。
(3)各物质的物质的量的变化量之比等于其化学计量数之比,所以m∶n∶p∶q=0.1 mol∶0.4 mol∶0.2 mol∶0.3 mol=1∶4∶2∶3,则m=1,n=4,p=2,q=3。
(4)增大容器的容积,各物质的物质的量浓度减小,反应速率减慢;移走部分Q,Q的物质的量浓度减小,反应速率减慢;通入大量X,X的物质的量浓度增大,反应速率加快;升高温度,反应速率加快。
14.某化学小组研究外界条件对反应速率的影响,进行如下实验:
【实验原理】
2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容】
实验 编号 室温下,试管中所加试剂及其用量/mL 室温下溶液颜色褪至无色所需时间/min
2.0 mol·L-1 H2C2O4溶液 H2O 0.2 mol·L-1 KMnO4溶液 3 mol·L-1 稀硫酸
1 3.0 2.0 3.0 2.0 4.0
2 2.0 3.0 3.0 2.0 5.2
3 1.0 4.0 3.0 2.0 6.4
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________ ________________________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=________________________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但乙同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。
其他条件相同时,增大
1.5×10-2 mol·L-1·min-1
H2C2O4浓度(或反应物浓度),反应速率增大
该小组同学根据如图所示信息提出了新的假设,并继续进行实验探究:
①该小组同学提出的假设是__________________________________________ ______________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
生成物中的MnSO4为该反应的催化剂(或Mn2+
对该反应有催化作用)
实验编号 室温下,试管中所加试剂及其用量/mL 再向试管中加入少量固体 室温下溶液颜色褪至无色所需时间/min
2.0 mol·L-1 H2C2O4溶液 H2O 0.2 mol·L-1 KMnO4溶液 3 mol·L-1稀硫酸
4 3.0 2.0 3.0 2.0 _______ t
③若该小组同学提出的假设成立,应观察到的现象是____________________ ___________________。
MnSO4
与实验1比较,溶液
褪色所需时间变短
实验 编号 室温下,试管中所加试剂及其用量/mL 室温下溶液颜色褪至无色所需时间/min
2.0 mol·L-1 H2C2O4溶液 H2O 0.2 mol·L-1 KMnO4溶液 3 mol·L-1 稀硫酸
1 3.0 2.0 3.0 2.0 4.0
2 2.0 3.0 3.0 2.0 5.2
3 1.0 4.0 3.0 2.0 6.4
(3)①由图乙可知反应开始一段时间后速率增大的比较快,说明生成物中的MnSO4或Mn2+可能为该反应的催化剂。②与实验1作对比,其他条件不变,加入硫酸锰,记录溶液褪为无色所需时间。③如果假设成立,即MnSO4或Mn2+对该反应有催化作用,实验4与实验1比较,反应速率变快,溶液褪色所需时间变短。
0
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度
第1课时 化学反应的快慢
核心素养 学业要求
发展对化学变化的微观认识,认识化学反应是有一定速率的,初步形成实验探究化学反应规律的思路方法。 1.了解化学反应速率的概念及平均速率的表示方法,并能计算化学反应速率。
2.运用控制变量法设计实验探究温度、浓度、催化剂、接触面积对化学反应速率的影响。
学生自主学习
01
课时作业
03
目录
CONTENTS
课堂互动探究
02
学生自主学习
1.化学反应速率
(1)定义:描述化学反应_______的物理量。
(2)表示方法:用单位时间内_______________________________或_________ ________________来表示。
(3)对于在体积固定的容器中进行的化学反应aA+bB===cC+dD,以反应物B来表示,反应的化学反应速率为:v(B)=________。
(4)单位:____________或mol·L-1·min-1。
快慢
某反应物浓度的减少量(绝对值)
物浓度的增加量
某生成
mol·L-1·s-1
2.影响化学反应速率的因素
(1)内因:化学反应速率的大小主要取决于_____________________。
(2)外因:在其他条件相同时:
物质本身的内在性质
越大
越高
越大
3.调控化学反应速率的意义
1.判断正误,正确的打“√”,错误的打“×”。
(1)可以用任何物质表示化学反应速率。( )
(2)反应速率的单位通常为mol·s-1或mol·min-1。( )
(3)反应速率越大,则反应现象越明显。( )
(4)对同一个化学反应,用不同物质表示的化学反应速率,其数值越大,则表示化学反应速率越快。( )
(5)无论是放热反应还是吸热反应,温度升高,反应速率一定加快。( )
(6)压强变化,则化学反应速率一定会变化。( )
(7)铁和硫酸反应时,硫酸浓度越大,产生的H2的速率越快。( )
×
×
×
×
√
×
×
2.下列对化学反应速率的理解正确的是( )
A.化学反应速率表示的是化学反应进行的快慢
B.同一化学反应用不同物质表示数值一定不同
C.化学反应速率可以用任何一种反应物或生成物来表示
D.化学反应速率可以是正值,也可以是负值
3.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指某一时刻,某种反应物的瞬时反应速率
B.化学反应速率为“0.8 mol·L-1·s-1”表示反应在1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行得快慢
D.对于任何化学反应来说,都是反应物的质量越大,反应越快
5.镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有( )
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温
A.①② B.②③
C.①③ D.②④
课堂互动探究
探究一 化学反应速率
2.对于一个具体的化学反应,反应物和生成物的物质的量的变化是按化学方程式中化学计量数之比进行的,所以化学反应中各物质的反应速率之比等于化学方程式中各物质的化学计量数之比。
对于反应aA+bB===cC+dD(A、B、C、D均不是固体或纯液体),v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d。
3.化学反应速率的理解
(1)对于有固体或纯液体参加的反应,由于固体或纯液体的浓度为一常数,所以不用固体或纯液体表示反应速率。
(2)Δt表示某一时间段,故化学反应速率是平均速率,而非瞬时速率。
(3)无论是用反应物还是用生成物表示化学反应速率,化学反应速率都取正值。
(4)表示化学反应速率时,必须指明具体的物质,因为同一化学反应用不同的物质表示反应速率,其数值可能不同。在同一时间内的同一个化学反应里,虽然用不同物质表示的化学反应速率不一定相同,但它们表示的意义相同,即一种物质的化学反应速率就代表了整个化学反应的反应速率。
2.对于反应A2(g)+3B2(g)===2C(g)+D(g),不同条件下,其化学反应速率最快的是( )
A.v(B2)=0.8 mol/(L·s) B.v(D)=0.6 mol/(L·s)
C.v(C)=0.6 mol/(L·s) D.v(A2)=0.8 mol/(L·min)
化学反应快慢的比较
(1)同一反应不同条件或者不同时段内的反应速率比较时,先换算成同一物质、相同单位的反应速率,数值大的反应速率快。
(2)对于反应aA+bB===cC,将v(A)∶v(B)的值与a∶b的值进行比较,若v(A)∶v(B)=a∶b,二者速率相等;若v(A)∶v(B)>a∶b,v(A)>v(B);v(A)∶v(B)
1.根据变量控制方法探究影响化学反应速率的因素
编号 实验内容 实验现象 实验结论
Ⅰ 表面积大致相同的镁条产生气泡较快,铁片生成气泡较慢 物质性质决定化学反应速率
Ⅱ 质量相等的粉末状碳酸钙产生气泡较快,块状碳酸钙产生气泡较慢 接触面积越大,则反应速率越快
Ⅲ 加入3 mol·L-1盐酸的试管中放出大量气泡,加入0.5 mol·L-1盐酸的试管中缓慢放出气泡 反应物浓度越大,化学反应速率越快
Ⅳ 加入MnO2后的H2O2溶液产生大量气泡,未加MnO2的H2O2溶液生成气泡很缓慢 加入催化剂,反应速率加快
2.影响化学反应速率的因素
(1)内因
不同的化学反应,具有不同的化学反应速率,因此,反应物本身的性质是决定化学反应速率的主要因素。
(2)外因
①浓度
a.在一定条件下,增大反应物浓度能加快化学反应速率,减小反应物浓度能降低化学反应速率。
b.在一定温度下,固体或纯液体物质的浓度是一个常数,改变其用量,对化学反应速率无影响。
②温度
a.对任何化学反应都适用,且不受反应物状态的影响。
b.不论是吸热反应还是放热反应,升高温度都能增大化学反应速率,降低温度都能减小化学反应速率。
③压强
由于固体或液体的体积受压强的影响很小,所以压强只影响有气体参加的化学反应的反应速率。压强对化学反应速率的影响实质是通过改变浓度对化学反应速率的影响实现的。
a.恒温恒容时:
ⅰ.充入气体反应物(压强增大)―→浓度增大―→反应速率加快;
ⅱ.充入惰性气体―→总压强增大,各物质的浓度不变,反应速率不变(注:此处惰性气体指不参加反应的气体)。
b.恒温恒压时:充入惰性气体―→体积增大―→各反应物浓度减小―→反应速率减慢。
④催化剂
其他条件相同时,加入合适的催化剂,能够增大化学反应速率。
⑤反应物间的接触面积
其他条件相同时,反应物间的接触面积越大,化学反应速率越快。
⑥其他因素
溶剂、光波、电磁波、超声波等。
3.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小排列顺序正确的是( )
甲500 ℃,10 mol SO2和5 mol O2的反应
乙500 ℃,用V2O5做催化剂,10 mol SO2和5 mol O2的反应
丙450 ℃,8 mol SO2和5 mol O2的反应
丁500 ℃,8 mol SO2和5 mol O2的反应
A.甲、乙、丙、丁 B.乙、甲、丁、丙
C.乙、甲、丙、丁 D.丁、丙、乙、甲
解析 由温度可知,丙中反应速率最慢;温度相同时,乙中使用催化剂,则反应速率最快,甲与丁比较,甲中浓度大,反应速率快,则按正反应速率由大到小排列顺序应为乙、甲、丁、丙。
解析 ①对:升高温度,反应速率加快。②错:碳是固体,增加固体的量,反应速率不变。③对:恒温恒容下通入CO2,由于容器容积不变,所以二氧化碳的浓度增大,反应速率加快。④错:恒温恒压下充入不参加反应的N2,容器体积增大,参与反应的物质的浓度降低,反应速率减慢。⑤错:恒温恒容下充入N2,容器体积不变,参与反应的物质的浓度不变,反应速率不变。
本课小结
课时作业
一、选择题(每小题只有1个选项符合题意)
1.在2 L的密闭容器中发生反应:A(g)+2B(g)===3C(g),经过3 min后A的物质的量由10 mol变为7 mol,则下面表示的反应速率正确的是( )
A.vA=1 mol·L-1·min-1 B.vA=3 mol·L-1·min-1
C.vA=2 mol·L-1·min-1 D.vA=0.5 mol·L-1·min-1
2.对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
解析 同一个化学反应中各物质表示的反应速率之比等于其相应的化学计量数之比,则根据反应的化学方程式可知应该有v(W)∶v(X)∶v(Y)∶v(Z)=3∶2∶4∶3,故C正确。
3.下列表示的是化学反应A(g)+2B(g)===C(g)+D(g)在不同条件下的反应速率,其中最快的是( )
A.v(A)=0.3 mol·L-1·s-1 B.v(B)=0.5 mol·L-1·s-1
C.v(C)=0.25 mol·L-1·s-1 D.v(D) =0.2 mol·L-1·s-1
4.下列措施对加快反应速率明显有效的是( )
A.Na与水反应时增加水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4溶液与BaCl2溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
5.一定能使化学反应速率加快的措施是( )
①扩大容器容积 ②使用正催化剂 ③增大反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大压强
A.②③ B.②③④⑥
C.②③④⑤ D.②④
解析 ①对于有气体参加的反应,扩大容器容积,会使物质的浓度降低,反应速率减慢,但对无气体参加的反应没有影响;③若反应物是固体或纯液体物质,则增大反应物的物质的量,化学反应速率不变;⑤对于有气体参加的反应,缩小容器容积,会导致气体的浓度增大,化学反应速率加快,但对无气体参加的反应没有影响;⑥若反应无气体参加,则增大压强,化学反应速率不变。
6.CaCO3与稀盐酸反应(放热反应)生成CO2的物质的量与
反应时间的关系如图所示,下列结论不正确的是( )
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后减小
C.反应在第2 min到第4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍
解析 由题图可知,2~4 min时间内,生成的二氧化碳的物质的量比反应开始2 min内大,故2~4 min内平均反应速率比反应开始2 min内快,A错误。
7.下列有关化学反应速率的说法中正确的是( )
A.二氧化锰能加快所有化学反应的速率
B.用铁片和稀硫酸反应制取氢气时,适当增大硫酸浓度可以加快产生氢气的速率
C.100 mL 2 mol·L-1的盐酸与锌反应时,加入浓氯化钠溶液,生成氢气的反应速率变快
D.对于任何反应,增大压强都可加快反应速率
解析 MnO2作催化剂只能加快某些化学反应的速率,如加速H2O2的分解,并不能使所有化学反应速率都加快,故A错误;锌与盐酸反应:Zn+2H+===Zn2++H2↑,增加c(Cl-)对反应无影响,加入浓氯化钠溶液,c(H+)减小,生成氢气的反应速率变慢,故C错误;增大压强只对有气体参与的反应的反应速率有影响,对只有固体或液体参与的反应无影响,如HCl和NaOH反应,增大压强对反应速率无影响,故D错误。
8.已知:Na2S2O3+H2SO4===S↓+SO2↑+H2O+Na2SO4,通过析出硫的快慢可以判断反应速率的大小,请判断下列几种情况下,最先看到硫析出的是( )
选项 温度/℃ Na2S2O3溶液的体积和物质的量浓度 H2SO4溶液的体积和物质的量浓度
A 20 15 mL 0.1 mol·L-1 15 mL 0.1 mol·L-1
B 20 10 mL 0.2 mol·L-1 10 mL 0.2 mol·L-1
C 50 50 mL 0.1 mol·L-1 50 mL 0.1 mol·L-1
D 50 5 mL 0.5 mol·L-1 5 mL 0.5 mol·L-1
解析 温度越高,反应速率越快,则C、D项中的反应速率大于A、B项,又因D项中混合后反应物的浓度大于C项中混合后反应物的浓度,则D项中反应速率最快,最先看到硫析出。
9.常温下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量NaNO3固体;③加入少量CuSO4固体;④加入少量CH3COONa固体;⑤加热;⑥将稀硫酸换成98%硫酸。其中可增大单位时间内氢气收集量的措施有( )
A.①③④ B.①③⑤
C.②④⑤ D.②⑤⑥
解析 将铁块换为等质量的铁粉,加大反应物的接触面积,反应速率加快;加入少量NaNO3固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气;加入少量CuSO4固体,Fe和CuSO4反应生成Cu,Fe、Cu和H2SO4形成原电池,加快反应速率;加入少量CH3COONa固体,生成弱酸CH3COOH,氢离子浓度降低,反应速率减慢;升高温度,反应速率加快;将稀硫酸换成98%硫酸,常温下,铁块在浓硫酸中发生钝化。
10.在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折为标准状况)如下表:
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应到6 min时,c(H2O2)=0.30 mol/L
D.反应到6 min时,H2O2分解了50%
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
解析 保持容器容积不变,向其中加入1 mol I2(g),反应物浓度增大,反应速率加快,A错误;保持容器容积不变,向其中加入1 mol He,参加反应的物质的浓度不变,则反应速率不变,B错误;保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),因物质的量增大1倍,体积也增大1倍,则浓度不变,反应速率不变,C正确;保持容器内气体压强不变,向其中加入1 mol He,体积增大,参加反应的物质的浓度减小,则反应速率减慢,D错误。
物质 时间 X Y Z Q
起始(mol) 0.7 1
2 min时(mol) 0.8 2.7 0.8 2.7
3 min时(mol) 0.8
已知:2 min内v(Q)=0.075 mol·L-1·min-1,且v(Z)∶v(Y)=1∶2。请回答下列问题:
(1)2 min内Z的反应速率v(Z)=__________________。
(2)起始时n(Y)=________,n(Q)=________。
(3)化学方程式中m=_____,n=_____,p=_____,q=_____。
(4)对于该反应,能增大反应速率的措施是_______。
A.增大容器容积 B.移走部分Q
C.通入大量X D.升高温度
0.05 mol·L-1·min-1
2.3 mol
3.0 mol
1
4
2
3
CD
解析 (2)因为v(Z)∶v(Y)=1∶2,说明Z、Y的物质的量的变化量之比为1∶2,因为Z减少了0.2 mol,所以Y增加了0.4 mol,则Y的起始物质的量是2.7 mol-0.4 mol=2.3 mol。根据v(Q)=0.075 mol·L-1·min-1可知,Q物质的量的变化量是0.075 mol·L-1·min-1×2 L×2 min=0.3 mol,所以Q的起始量是0.3 mol+2.7 mol=3.0 mol。
(3)各物质的物质的量的变化量之比等于其化学计量数之比,所以m∶n∶p∶q=0.1 mol∶0.4 mol∶0.2 mol∶0.3 mol=1∶4∶2∶3,则m=1,n=4,p=2,q=3。
(4)增大容器的容积,各物质的物质的量浓度减小,反应速率减慢;移走部分Q,Q的物质的量浓度减小,反应速率减慢;通入大量X,X的物质的量浓度增大,反应速率加快;升高温度,反应速率加快。
14.某化学小组研究外界条件对反应速率的影响,进行如下实验:
【实验原理】
2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容】
实验 编号 室温下,试管中所加试剂及其用量/mL 室温下溶液颜色褪至无色所需时间/min
2.0 mol·L-1 H2C2O4溶液 H2O 0.2 mol·L-1 KMnO4溶液 3 mol·L-1 稀硫酸
1 3.0 2.0 3.0 2.0 4.0
2 2.0 3.0 3.0 2.0 5.2
3 1.0 4.0 3.0 2.0 6.4
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________ ________________________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=________________________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但乙同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。
其他条件相同时,增大
1.5×10-2 mol·L-1·min-1
H2C2O4浓度(或反应物浓度),反应速率增大
该小组同学根据如图所示信息提出了新的假设,并继续进行实验探究:
①该小组同学提出的假设是__________________________________________ ______________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
生成物中的MnSO4为该反应的催化剂(或Mn2+
对该反应有催化作用)
实验编号 室温下,试管中所加试剂及其用量/mL 再向试管中加入少量固体 室温下溶液颜色褪至无色所需时间/min
2.0 mol·L-1 H2C2O4溶液 H2O 0.2 mol·L-1 KMnO4溶液 3 mol·L-1稀硫酸
4 3.0 2.0 3.0 2.0 _______ t
③若该小组同学提出的假设成立,应观察到的现象是____________________ ___________________。
MnSO4
与实验1比较,溶液
褪色所需时间变短
实验 编号 室温下,试管中所加试剂及其用量/mL 室温下溶液颜色褪至无色所需时间/min
2.0 mol·L-1 H2C2O4溶液 H2O 0.2 mol·L-1 KMnO4溶液 3 mol·L-1 稀硫酸
1 3.0 2.0 3.0 2.0 4.0
2 2.0 3.0 3.0 2.0 5.2
3 1.0 4.0 3.0 2.0 6.4
(3)①由图乙可知反应开始一段时间后速率增大的比较快,说明生成物中的MnSO4或Mn2+可能为该反应的催化剂。②与实验1作对比,其他条件不变,加入硫酸锰,记录溶液褪为无色所需时间。③如果假设成立,即MnSO4或Mn2+对该反应有催化作用,实验4与实验1比较,反应速率变快,溶液褪色所需时间变短。
